内淋巴囊肿瘤的诊治现状和进展
2022-05-29戴春富李非田
戴春富 李非田
(复旦大学附属眼耳鼻喉科医院耳鼻喉科 上海 200031)
1984年,Hassard等[1]在为一例临床诊断“梅尼埃病”的患者行内淋巴囊减压术时,发现其内淋巴囊存在易出血的新生物,经病理检查证实为内淋巴囊肿瘤(endolymphatic sac tumor, ELST),此为发现的首例ELST。这一疾病随后被越来越多的耳鼻咽喉科医师认识。1988年,Gaffey等[2]首次报道了9例位于内淋巴囊解剖区域的侵袭性肿瘤,并将其命名为“侵袭性中耳乳头状瘤”(aggressive papillary middle ear tumor)。1989年,Heffern[3]报道了20例疑似起源于内淋巴囊的“低级别腺瘤”(low-grade adenocarcinoma of probable endolymphatic sac origin)病例。2005年,世界卫生组织(WHO)正式将这类肿瘤命名为ELST[4]。我们团队在2021年根据肿瘤累及周围重要解剖结构的情况,提出ELST的临床分级系统和相应的手术策略[5]。
ELST可散发,也可作为冯希佩尔-林道综合征(von Hippel-Lindau syndrome, VHL综合征)的伴发疾病。VHL综合征是一种常染色体显性遗传病,由位于3p25~26的抑癌基因VHL突变导致。据报道[6],VHL综合征患者中ELST的发病率为11%~16%,其中30%为双侧发病。散发的ELST十分罕见,目前发表的文献多为小样本病例报道,尚未有其发病率的相关报道。ELST患者主诉多为听力下降、眩晕、耳鸣及面瘫等非特异性症状,易与其他疾病混淆。Roche等[7]报道,在诊断为前庭神经鞘瘤的患者中,最终有1/300病理证实为ELST。ELST具有特征性影像学表现,通过对其影像学特征的学习,术前诊断ELST并不困难。该肿瘤生长缓慢,关于其对放射化学治疗(简称放化疗)是否敏感尚未见报道。目前治疗ELST的主要方式为手术切除。根据肿瘤累及的解剖结构,我们最近提出了新的临床分级系统和相应的手术策略[5],对其术式的选择及预后具有指导意义。本文结合我们临床上收治ELST患者的经验,重点介绍其诊断、临床分级及术式选择、预后及发病机制的新进展。
1 ELST发生的分子机制
ELST的病因不明。目前关于ELST发生的分子机制研究多集中在基因层面。既往研究[8-10]主要检测ELST患者是否存在VHL基因突变,而很少关注其他基因或者表观遗传如DNA甲基化等改变。染色体3p25.3上VHL基因的胚系突变(germline mutation)及双侧等位基因的功能丧失与VHL综合征相关ELST的发病有关,而散发ELST的发病机制未有定论[11-12]。早期研究[8,10]发现,散发ELST患者只有50%(5/10)检测到VHL基因突变。近年来,关于ELST基因学检测病例数最多、最全面的报道来自Schweizer等[13]。其团队报道散发ELST的VHL基因突变率达82%(9/11);2例散发及1例VHL相关ELST样本检测到TERT启动子突变;除VHL基因及TERT启动子突变外,未检测到其他肿瘤相关基因突变。该报道还显示,60%(6/10)VHL相关ELST及91%(10/11)散发ELST的3号染色体杂合性丢失(loss of heterozygosity),杂合性丢失导致73%(8/11)的散发ELST双侧VHL等位基因失活(biallelic VHL inactivation)从而致病[13]。散发肿瘤与VHL相关肿瘤DNA甲基化图谱无明显差异,然而ELST与桥小脑角的其他肿瘤包括头颈部副神经节瘤、室管膜瘤、血管母细胞瘤等的DNA甲基化图谱相比差异显著[13]。综上所述,双侧VHL等位基因失活是散发及VHL相关ELST的重要发病机制,TERT启动子突变可能与预后相关,但需要大样本临床数据验证,部分散发病例发病机制不明,随着新测序技术的应用,将有可能揭开这部分病例背后的谜团。此外,内淋巴囊主要由线粒体丰富细胞(mitochondria-rich cell,MRC)及核糖体丰富细胞(ribosome-rich cell,RRC)组成,ELST起源于何种细胞,抑或起源于内淋巴管,均需进一步研究,单细胞测序技术有望提供ELST起源的证据[14]。
2 ELST的诊断
2.1 ELST的临床表现 ELST好发于成人,散发ELST的发病高峰在30~40岁,伴发于VHL综合征者的发病高峰在20~30岁[13,15]。患者最常见的症状依次为感音神经性听力下降、眩晕、耳鸣、面瘫,部分患者因后组脑神经受累或者肿瘤累及颅内,可出现声嘶、呛咳、头痛、复视等[16]。伴发于VHL综合征的患者同时伴有颅内、脊柱、视网膜血管母细胞瘤或肾脏肿瘤并出现相应症状[17]。图1是我们收治的1例VHL综合征患者的临床和颞骨磁共振成像(magnetic resonance imaging, MRI)资料。ELST患者听力下降多为感音神经性耳聋,呈渐进性,为耳蜗或听神经受累,亦或是合并内淋巴积水所致。值得注意的是,部分患者听力下降呈突发性,被认为由迷路出血引起内耳毛细胞变性导致[18]。我们早期收治的患者中,有3例在增强MRI上有迷路高信号表现而颞骨CT上内耳结构未被肿瘤累及,其中2例表现为突发性听力下降[5]。眩晕为前庭器官或前庭神经受累,也可能由并发的内淋巴积水所致。伴有反复发作性眩晕的患者易误诊为梅尼埃病,提示影像学检查在眩晕患者中的重要性[19-21]。体格检查可见鼓膜完整,累及中耳的ELST可见鼓膜后方淡红色肿物,应与鼓室体瘤和颈静脉球体瘤鉴别。我们的经验是,ELST所致的鼓膜后肿物较鼓室体瘤及颈静脉球体瘤色淡,后者血供更加丰富,常为樱桃红,且伴有搏动性耳鸣。当肿瘤累及面神经和颈静脉孔区时,应注意评估面神经及后组脑神经的功能。
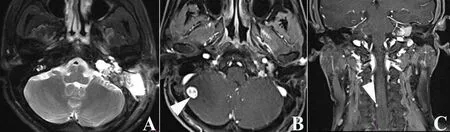
图1 VHL综合征患者的临床和颞骨MRI资料 患者男性,因左耳听力下降伴耳鸣5年,左侧面瘫1周就诊。A.MRI T2序列示左侧岩锥后缘不规则占位,累及内听道、颈静脉孔区;B.MRI增强示右侧小脑半球椭圆形结节(白色△),强化明显,周围伴大片脑组织水肿;C.MRI增强示下段颈髓可见一较小强化灶(白色△),考虑VHL综合征颅外表现。
2.2 ELST的影像学检查 ELST起源于内淋巴囊或内淋巴管,因此早期以岩锥后缘后半规管后方内淋巴囊部位为中心生长,逐渐侵蚀颞骨其他部位。关于ELST的生长速率尚未见报道。我们诊断的1例选择定期MRI随访的散发ELST患者,2018年和2022年增强MRI显示肿瘤大小无明显变化,提示该肿瘤生长缓慢。然而部分肿瘤有分泌含高蛋白液体功能,可使肿瘤体积迅速增加,压迫周围软组织[6]。ELST在颞骨高分辨率CT上的特征性表现为有骨质破坏的颞骨占位性病变,瘤内可有残留的骨片,早期肿瘤边缘呈现膨胀性骨质破坏产生周边钙化(peripheral rim of calcification)[22],如图2A所示。ELST在颞骨增强MRI T1和T2序列上的典型特征为肿瘤中心等信号、外周高信号或肿瘤内散在高信号灶,不均匀强化[23],如图2B~D所示。肿瘤外周高信号可能是蛋白含量高所致。部分患者在颞骨增强MRI上可出现迷路内高信号的表现,提示迷路出血的可能[24]。此外,由于肿瘤起源于内淋巴囊或内淋巴管,妨碍内淋巴液的吸收,一些患者行内耳钆造影检查可发现内淋巴积水的征象[25]。结合文献报道及笔者经验,对于疑似ELST患者均应进行颞骨高分辨率CT、增强MRI及内耳钆造影检查,累及乙状窦、颈静脉球、颈内动脉的患者还应同时行磁共振静脉成像(MRV)、磁共振动脉成像(MRA)检查以评估术中颈静脉球切除、颈内动脉损伤风险。由于ELST患者有合并VHL综合征的可能,因此对于疑似患者术前还应常规行基因检测、眼底及腹部超声检查或正电子发射计算机断层显像(PET-CT)以排除VHL综合征累及身体其他部位可能。
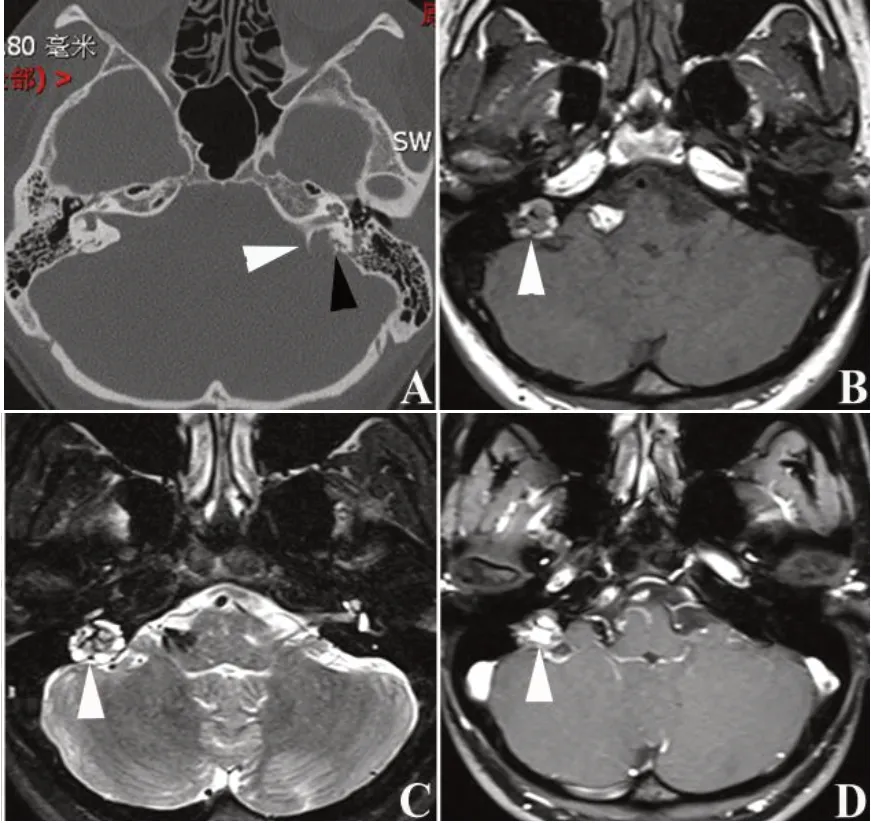
图2 ELST的影像学特征性表现 A.颞骨CT水平位示左侧迷路后占位,侵犯内听道,伴骨质破坏,可见肿瘤内骨质碎片(黑色△)及膨胀性破坏形成周边钙化(白色△);B.颞骨MRI T1序列示肿瘤外围一圈呈高信号,瘤内等信号(白色△);C.肿瘤在颞骨MRI T2序列也呈现外围高信号(白色△);D.颞骨增强MRI示肿瘤不均匀强化(白色△)。
3 ELST的临床分级
国际抗癌联盟(UICC)尚未推出ELST的临床分级。神经外科医师Bambakidis等[26]在2004年最早提出ELST的临床分级系统,该分级系统基于肿瘤侵犯颅内的部位、大小,将ELST分为4级。然而,随着耳科医师对ELST的认识及影像学检查的普及,有很多更早期的ELST被诊断,而该分级系统未能区分有保留残余听力机会的患者,不能有效指导耳神经颅底外科医师选择合适的手术方式。此外,Schipper等[27]在2006年根据肿瘤的影像学特点,将其收治的7例ELST分成了A、B、C三期,然而分期描述不够细致,且由于病例数少的缘故,其分期系统未包括有颅内侵犯的肿瘤,不够全面。根据临床经验及影像学上肿瘤累及的结构,我们团队提出了新的临床分级系统[5]:Ⅰ级,肿瘤位于岩骨后缘,局限于后半规管和后颅窝之间,和(或)侵犯面神经,但内耳及颈静脉孔未受累及;Ⅱ级,肿瘤向前侵犯半规管、耳蜗、内听道或中耳,但桥小脑角及颈静脉孔未受累及;Ⅲa级,肿瘤侵犯颈静脉孔、颈内动脉或斜坡;Ⅲb级,肿瘤侵犯颅内、海绵窦和(或)颈静脉孔。该分级系统囊括了从早期局限于颞骨岩部后缘至朝向颅内侵犯等不同生长阶段的ELST。图3~6分别显示各分级ELST患者的影像学资料。

图3 Ⅰ级ELST患者的资料 男性,44岁,以右侧耳鸣5个月就诊。A.颞骨CT水平位示肿瘤位于右侧后半规管及后颅窝之间(箭头);B.颞骨MRI T2序列示等高信号肿物,位于后半规管与后颅窝之间(箭头)。
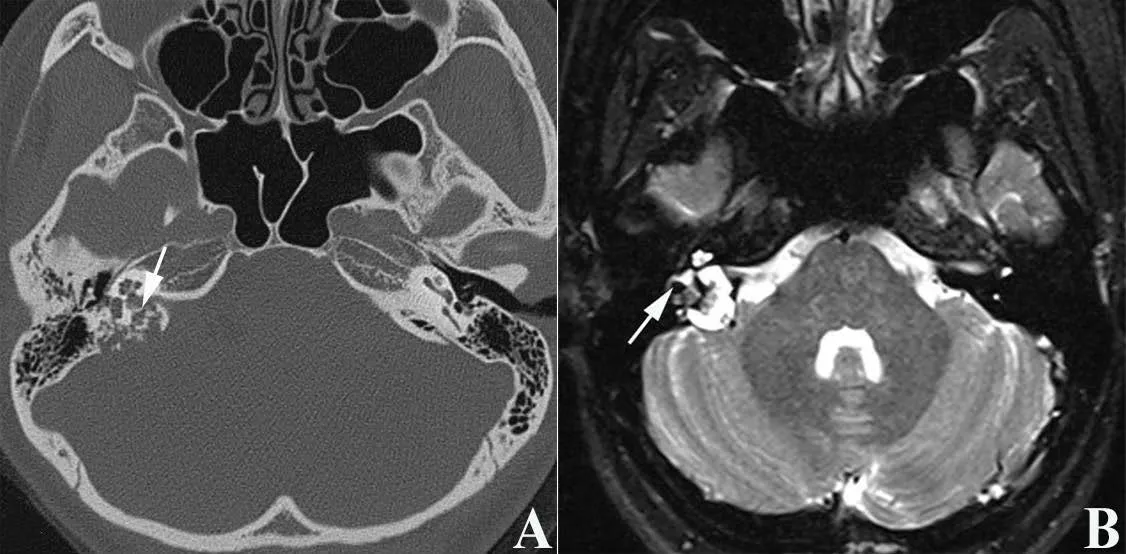
图4 Ⅱ级ELST患者的资料 女性,25岁,以右耳听力下降半年就诊,伴耳鸣。A.颞骨CT水平位示肿瘤向前侵及半规管、右侧内听道,瘤内散在骨片(箭头);B.颞骨MRI T2序列示肿瘤局限于颞骨内,主要朝前方生长累及迷路(箭头)。
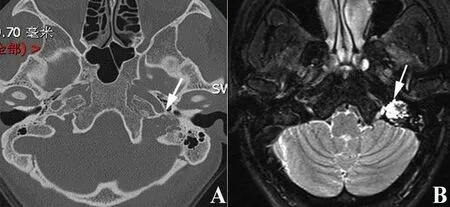
图5 Ⅲa级ELST患者的资料 女性,29岁,因左耳搏动性耳鸣伴听力下降2年就诊。A.颞骨CT水平位示左侧颈静脉孔区骨质破坏性占位,毗邻颈内动脉水平段(箭头);B.颞骨MRI T2序列示周围高信号肿物累及颈静脉孔(箭头)。

图6 Ⅲb级ELST患者的资料 女性,51岁,因右侧耳闷伴听力下降1年余就诊,伴耳鸣。A.颞骨CT水平位示肿瘤广泛破坏颞骨及后颅窝骨质;B.颞骨MRI T2序列示肿瘤往颅内生长(红色△)。
4 ELST的手术策略选择
ELST一旦诊断应尽早行手术切除。手术切除仍是ELST的首选治疗方式,全切除后肿瘤的局部复发率低,远期治愈率达90%[28]。手术原则为完全切除肿瘤并尽可能保护患者的听功能及面神经功能。Nevoux等[29]根据术中所见将ELST分为囊性和纤维性,并认为与纤维性相比,囊性与周围组织边界清,但术中出血较多。我们早期手术的15例ELST患者中,Ⅰ+Ⅱ级肿瘤中囊性2例、纤维性4例,影像学上的平均最大肿瘤直径为1.63 cm,术中平均失血量为116.7 mL;Ⅲ级肿瘤中囊性8例、纤维性1例,影像学上平均最大肿瘤直径为3.26 cm,术中平均失血量为693.8 mL,提示囊性肿瘤较纤维性肿瘤的侵袭性高且易出血,对Ⅲ级肿瘤患者应常规术前备血[5]。尽管ELST血供丰富,主要来自脑膜中动脉、茎乳动脉或颈内动脉鼓室支;然而其供血动脉较细小,栓塞材料难以发挥作用,术前血管栓塞效果欠佳,故术前栓塞较少使用[29-30]。如果术中发现肿瘤同中颅底脑膜关系密切,先将肿瘤同中颅底脑膜分离,即可将脑膜中动脉分支血管阻断,避免进一步出血。如肿瘤同面神经垂直段关系密切,此时先将肿瘤同垂直段面神经分离,可切断面神经深面茎乳动脉供血。Ⅲ级肿瘤一般出血明显,可使用Surgicel和脑棉交替压迫止血。
术式的选择应根据术前听力及肿瘤临床分级决定。Ⅰ级,肿瘤局限于迷路后区域,通常为轻至中度听力下降,为保留这类患者的残余听力,选择迷路后径路+岩骨后部切除术。Ⅱ级,肿瘤主要朝前侵犯但仍局限于颞骨内,此时迷路或内听道受累,因此患者听力呈重度下降,为完全切除肿瘤,通常选择经迷路径路颞骨次全切除术。Ⅲ级,肿瘤侵犯颞骨外结构,Ⅲa级累及颈静脉孔相关结构,推荐采用颞下窝径路切除肿瘤;Ⅲb级累及颅内,通常采用颞下窝入路结合乙状窦后入路或颅中窝入路。若肿瘤累及颈静脉球,出血风险大,术中我们可在通过闭塞乙状窦和结扎颈内静脉后,使用乙状窦隧道填塞岩下窦技术控制岩下窦出血,同时还能避免后组脑神经损伤,进而切除颈静脉球外侧壁及肿瘤。如肿瘤向外累及外耳道,同时颅内肿瘤直径>2 cm,此时可二期切除颅内肿瘤,避免脑脊液漏的发生。对于面神经未受累及的早期肿瘤患者,术中应注意避免损伤面神经及其骨管;对于面神经受累及的患者,应切除受累面神经,并同期行面神经-耳大神经吻合术或面神经-舌下神经吻合术。采用颞下窝径路时,为了更好地暴露肿瘤,可将面神经部分前移位或使用面神经骨桥技术。累及颅内的患者,可根据肿瘤大小,同期或分期切除颅内肿瘤。为预防术后脑脊液漏和颅内感染,术中可用人工脑膜、肌肉及脂肪修补脑脊液漏,用肌肉及骨蜡封闭咽鼓管,将蒂在后方的肌骨膜瓣同前方腮腺后缘缝合,并封闭外耳道。
5 ELST的放化疗
放化疗在ELST患者的应用缺乏大样本、长期随访研究,因此ELST患者是否从放化疗中受益尚存在争议。目前放疗通常作为术后复发患者或者首次手术时无法全切除患者的补救性治疗。有研究[31]报道外放射治疗(external beam radiation)控制复发肿瘤的有效率不高,仅为47.4%, 立体定向放射治疗(stereotactic radiosurgery)的有效率为77.8%。也有报道[32]调强放射治疗(intensity-modulated radiation therapy)及质子放疗(proton-beam therapy)对控制ELST次全切除术后的肿瘤生长有效,立体定向放疗及3D适形放疗(3D conformal radiotherapy)效果欠佳。伽马刀作为ELST患者的首次治疗、术后辅助治疗及转移灶的治疗均有报道,15~18 Gy是治疗ELST的最佳剂量,副作用最小且不影响治疗效果[33-34]。舒尼替尼和贝伐单抗等抑制血管生成的靶向药物在VHL综合征的应用为ELST的靶向治疗提供了可能方向。目前关于ELST靶向治疗的报道仅检索到1例。2020年Nelson等[35]报道了1例术后复发的散发ELST患者,给予帕唑帕尼后肿瘤显著缩小。帕唑帕尼是一种小分子酪氨酸激酶抑制剂,能够抑制参与血管生成的多种通路及效应分子,包括血小板源性生长因子家族(platelet-derived growth factor family,PDGF)、成纤维细胞生长因子(fibroblast growth factor,FGFs)、血小板生长因子-BB(PDGFBB)、Ephrin-B2及Notch等,最早被美国食品药品监督管理局(FDA)批准用于晚期肾癌的治疗,随后的临床实验将帕唑帕尼的适应证扩展到中枢神经系统的血管母细胞瘤等与VHL综合征相关的肿瘤[36-37]。这些研究展示了帕唑帕尼具有控制复发性ELST的生长,以及作为术前辅助治疗从而为术前评估难以全切除患者提供手术切除机会的前景。
6 ELST的预后及随访
目前尚无关于ELST的大样本生存分析报道。Ferreira等[38]报道1例ELST术后4年出现颅内转移灶;Cheng等[33]报道1例小脑蚓及脑干多发转移病例,颅内转移可能与肿瘤细胞播散(seed metastasis)有关,也可能是接诊医师未注意到该患者为VHL综合征颅内并发血管母细胞瘤而非肿瘤细胞播散。手术后肿瘤细胞脱落转移(drop metastasis)至脊柱有2例报道,但不能排除这2例患者患有VHL综合征,脊柱并发血管母细胞瘤[39-40]。Schweizer等[13]报道散发ELST及VHL综合征相关ELST的局部复发率无明显差异,且病理上呈现透明细胞表型的ELST易复发。我们团队报道的15例患者平均随访(35.1±20.5)个月,均未出现远处转移,局部复发3例,均为囊性,其中2例为Ⅲ级,1例为Ⅱ级,提示囊性肿瘤患者易复发,但这一观点需要纳入更多的临床病例以佐证。根据ELST有局部复发倾向的特点,我们建议术后3个月、6个月、1年定期随访并行增强MRI检查。随访过程中,患者若出现不明原因的腰背疼痛、马尾综合征及神经根痛等症状,应行脊柱影像学检查以排除脊柱转移的可能。局部复发及远处转移的ELST患者,经过评估手术风险小,能够达到病灶全切除者仍应首选手术切除,其次考虑放疗。
综上所述,首诊及复发ELST的治疗均以手术切除为主,术前常规行颞骨高分辨率CT、颞骨增强MRI检查来明确肿瘤范围、临床分级以选择手术方式,基因检测、腹部B超及眼底检查也应纳入术前常规检查以排除VHL综合征的可能。术后应密切随访,对于手术无法完全切除肿瘤者,应联合放疗科共同制订合适的放疗剂量和方案。ELST术后易复发,合并VHL综合征的患者易多器官累及,对于这类患者最根本的治疗将依赖于未来的靶向精准治疗。此外,ELST的起源、决定其是否有分泌功能的机制、肿瘤的免疫浸润情况以及是否有进行免疫治疗的可能,还有待研究。这些问题的解决将为ELST患者提供新的治疗手段,对复发患者尤其重要。
