从进化生物学角度谈为何中国目前需要动态清零而非与新冠病毒共存
2022-05-24苏枭何子文柳树群李海鹏
苏枭,何子文,柳树群,李海鹏
观 点
从进化生物学角度谈为何中国目前需要动态清零而非与新冠病毒共存
苏枭2,何子文3,柳树群4,李海鹏1
1. 中国科学院上海营养与健康研究所进化基因组学实验室,上海 200031 2. 中国科学院上海巴斯德研究所,上海 200031 3. 中山大学生命科学学院,广州 510275 4. 云南大学,云南生物资源保护与利用国家重点实验室,昆明 650091
自从2021年11月在南非发现了新冠病毒奥密克戎(Omicron)变异株以来,该变异株迅速取代德尔塔(Delta)变异株成为全球主要流行的变异株[1]。2022年3月初开始的上海疫情便是由奥密克戎变异株所引发。从2022年4月9日上海的流行病学调查数据来看,新冠病毒新增患者多为无症状感染者,和确诊病例的比例为24∶1 (https://wsjkw.sh.gov.cn/)。此外,最近发表于的研究结果表明,与德尔塔变异株相比,奥密克戎变异株所导致的重症率有所下降(2.6%1.9%),同时嗅觉丧失的比例也大幅下降(52.7%16.7%)[2]。针对奥密克戎变异株的流行病学和病例特征,一些学者质疑,上海封控付出如此巨大的社会和经济成本是否值得?也有学者发表文章,建议中国应立即逐步放弃动态清零政策而与病毒共存[3]。针对上述争议,本文将从进化生物学和群体遗传学的角度阐述,如果我国现阶段不采取动态清零的防疫策略而与病毒共存,会导致什么样的后果?
新冠病毒是一种正义单链RNA病毒(positive- sense single-stranded RNA virus),其基因组仅有不到3万个碱基[4,5],远小于人类基因组。病毒在侵入人体细胞后会利用宿主细胞的翻译机器产生病毒蛋白[6,7],同时使用病毒基因组编码的RNA依赖性RNA聚合酶复制基因组[8]。由于RNA依赖性RNA聚合酶相比于DNA聚合酶有更高的错误率和更低的纠错能力,且单链RNA比双链DNA对细胞环境诱变剂更为敏感,因此新冠病毒比DNA病毒具有更高的突变率。虽然一部分突变会因导致病毒功能缺陷(如复制和组装等)而被淘汰,但不可避免地,部分突变会通过增强病毒免疫逃逸能力或病毒与细胞受体结合能力等方式而获得更高的传播力(transmissibility),因而对病毒的进化具有重要作用。新冠病毒的基因组平均突变速率为每年在每个位点有9.69×10–4的可能性发生一次突变[9],这意味着在一条传播链上,平均每隔大约12.5天病毒基因组就会发生一次变化。
新冠肺炎疫情自2019年爆发以来,已经相继出现了阿尔法(Alpha)、德尔塔和奥密克戎3个主要的变异株(variant of concern)。或者说,大约每8个月会出现一个新的主要变异株(图1)。虽然与德尔塔变异株相比,奥密克戎变异株的重症率有所下降[2],但是其显著增强的传播力和免疫逃逸能力仍给全球疫情防控带来巨大挑战。依据美国疾病控制与预防中心的统计,即便美国拥有相对先进的医疗条件,在奥密克戎变异株大流行的3月1日到4月8日的时间段内,平均每天死于新冠肺炎的人数依然高达883人(https://covid.cdc.gov/)。因此在国内相对落后的医疗条件下,考虑到中国人口是美国人口的4倍,60岁以上人口中国是美国的3.94倍,如果完全放开新冠病毒的防控,奥密克戎变异株在中国导致的死亡人数可能会是非常惊人的。
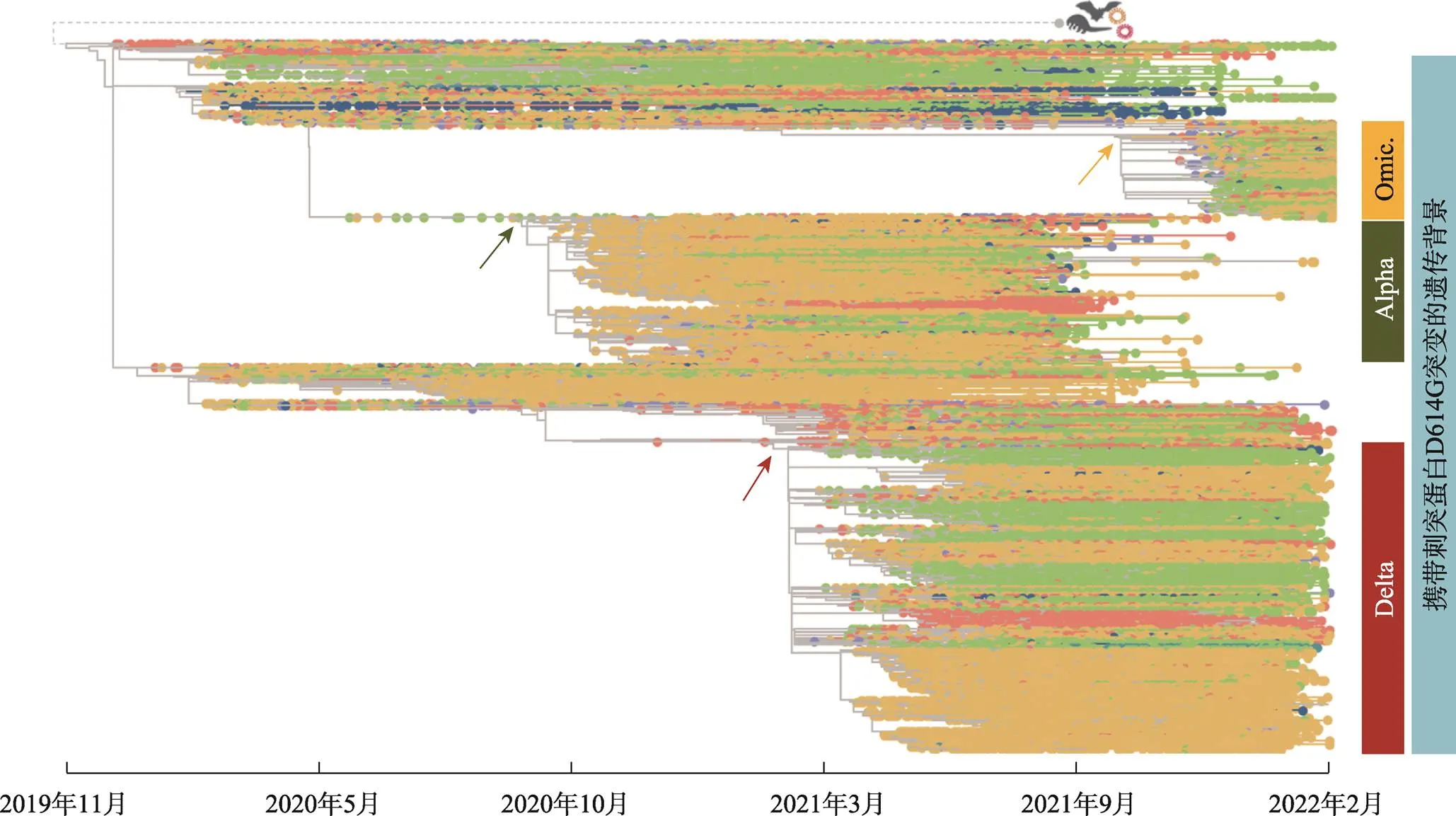
图1 新冠病毒进化和传播全景图显示阿尔法(Alpha)、德尔塔(Delta)和奥密克戎(Omicron) 3个主要变异株的产生、扩散和局部消亡
箭头分别指出了主要变异株产生的节点,表明其相互独立的起源。携带刺突蛋白D614G突变的遗传背景用浅蓝色表示,进化树上节点的不同颜色代表不同的大洲(非洲浅蓝色,亚洲珊瑚红,欧洲浅褐色,北美绿色,南美洲品蓝色,大洋洲暗青色)。新冠病毒进化树共包括3 465 961条高质量新冠病毒基因组和流行病学相关元数据的分析结果[9]。新冠病毒基因组浏览器的数据获取自国家基因组科学数据中心https://ngdc.cncb.ac.cn/ncov/apis/,分析和可视化软件下载自http://www.egps-software.net/egpscloud/eGPS_Desktop.html。
由于新冠病毒的突变率较高,病毒群体在较短时间内便可积累相当数量的突变,这意味着将来很可能出现新的变异株,并且难以预测新变异株在致病力(virulence)和病死率(case fatality rate)上的变化。具体而言,自然选择在病毒短期和长期的进化过程中均起到关键作用。在自然选择事件中,如果一个变异株因为比其他变异株传播得更快,则随着时间的演变,这一变异株的频率将会逐步增加[10,11]。因此自然选择的选择对象始终是病毒的传播力而非其致病力。病毒的传播力是由三方面因素共同决定的,即病毒自身因素(如潜伏期、病毒载量和致病力等)、环境因素(如湿度和温度)和人群因素(如防疫措施、生活方式、感染史、易感人群比例、疫苗接种率和疫苗有效性等),因而病毒的传播力与致病力并不一定存在负相关。如果病毒的传播力与致病力在进化过程中一定呈负相关,那么许多病毒,比如流感病毒,经过长期的进化就应丧失致病力。但事实并非如此。有关病毒致病力的演变已有一些进化模型例子[12~18]。例如,兔粘液瘤病毒(myxoma virus)曾被用来控制野兔()的群体数量,起初兔粘液瘤病毒的致病力快速降低,但随后持续缓慢回升,并且在澳洲和欧洲独立观察到的结果均一致[16]。因此,新冠病毒致病力会随着病毒演变而持续降低的说法缺乏理论依据。基于目前理论和数据分析的结果,我们认为随着时间的演变,新冠病毒致病力的变化很难预测。
从新冠病毒的进化和传播树上可以看出,阿尔法、德尔塔和奥密克戎变异株虽然都携带刺突蛋白质D614G突变,但均是独立起源的(图1),所以将来的主要变异株会如何演变仍是一个未知数。此外,新冠病毒基因组浏览器的分析结果表明,许多同样的突变在过去的两年间曾反复发生[9]。虽然有些位点突变率比较低,但是平均每个位点已经突变了22.1次(657 074/29 701)。基于此,我们认为倘若放任奥密克戎变异株在中国人群中持续传播,即使没有任何其余外来的病毒毒株,阿尔法、德尔塔和许多变异株的突变仍有很大概率在国内重新产生。特别是当被感染人群数量上升到一定程度的时候,一个个体可能会被两个或多个毒株(strains)所感染,这或许导致毒株之间的重组,因而未来变异株的致病力还是可能骤然提升至正常人体不可承受之重。
必须强调的是,虽然奥密克戎是目前全球范围最为流行的变异株,但阿尔法和德尔塔变异株并未消失(图1)。研究表明,新冠病毒可通过冷链扩散[19,20],同时非奥密克戎变异株向国内的输入也难以避免[21,22]。因此,一旦放任奥密克戎变异株在国内肆意传播,加之境外输入的其他变异株,这将会极大增加病毒重组的风险[23,24]。
新冠肺炎疫情爆发以来,新冠病毒之所以能够快速地适应性进化,是因为自然选择持续在无数的毒株中选择具有更高传播力的毒株。候选毒株的数目越庞大,则越容易选择到传播力更高的毒株,从而加速病毒的适应性进化。因此,根据群体遗传学理论,我们预期感染人数的增长会不可避免地加速病毒的适应性进化。考虑到中国庞大的人口基数,一旦放任新冠病毒的肆意传播,这将会迅速增加全球的感染人数,从而进一步加速新冠病毒的适应性进化,给全球抗疫造成更大的压力。如果在过去的两年间中国不采取严格防控措施,依据人口比例这一参数粗略估计,目前的全球感染人数或许将增加22.8%,病毒所产生的突变数量和其适应性进化速率也同样会增加22.8%。基于此,我们认为中国大陆在过去两年的动态清零政策大大减缓了新冠病毒的适应性进化,为全球抗疫做出了实质贡献。
那么国内是否应该放开限制,取消动态清零政策?何时取消?我们认为上述问题需要经过慎重的、多方面的科学研究之后,结合中国的实际情况才能回答。比如新冠病毒致病力的减弱是否存在极限?与疫苗的普及率有何关系?疫苗对人体的保护能力可以维持多长时间?奥密克戎以及将来新的主要变异株的感染是否会带来严重的后遗症?被新冠病毒感染之后是否能够有效保护人体不被再次感染?事实上,正如最近的综述文章[25]所指出的,人们对这些问题的研究才刚刚开始,尚需经过悉心研究才能给出答案。也有研究表明,即便已经实现了全球范围的大规模疫苗接种,当前所接种的疫苗因保护力和免疫周期可维持性等原因,也不一定能够实现有效的群体免疫;如果放弃严格管控措施,疫情将会长期持续存在[26]。针对目前的国际国内疫情形势我们建议,在及时开展相关科学研究的同时,需特别关注国外有关奥密克戎变异株能否起到类似于活病毒疫苗效果的研究报告,并持续监测分析国外新冠病毒各个变异株的传播和进化[9,27],直到有充分的证据表明,新冠病毒变种不再严重危害公众健康;或者待具有高效力(efficacy)的疫苗在国内(特别是老年人群中)大规模接种之后,再综合考虑是否调整现有的防疫政策。
总之,从进化生物学和群体遗传学的分析结果来看,未来可能出现的新冠病毒新变异株的致病力目前很难预测。即便某些低致病力变异株暂时或可起到类似于活病毒疫苗的效果,但由于其进化方向的不可预测性,未来产生具有强免疫逃逸能力和强致病性变异株的可能性仍然存在。考虑到目前未接种疫苗人群(如婴幼儿和老年人)的庞大绝对数量,我们建议中国在近期仍然需要维持动态清零政策而不宜实施与新冠病毒共存策略。同时,我们也呼吁,在具体执行动态清零政策的过程中,各地应加强制度设计并优化管理,采取更为灵活主动的应对措施,保障基本民生需求和经济的发展。
[1] Viana R, Moyo S, Amoako DG, Tegally H, Scheepers C, Althaus CL, Anyaneji UJ, Bester PA, Boni MF, Chand M, Choga WT, Colquhoun R, Davids M, Deforche K, Doolabh D, du PL, Engelbrecht S, Everatt J, Giandhari J, Giovanetti M, Hardie D, Hill V, Hsiao NY, Iranzadeh A, Ismail A, Joseph C, Joseph R, Koopile L, Kosakovsky Pond SL, Kraemer MUG, Kuate-Lere L, Laguda-Akingba O, Lesetedi-Mafoko O, Lessells R, Lockman S, Lucaci A, Maharaj A, Mahlangu B, Maponga T, Mahlakwane K, Makatini Z, Marais G, Maruapula D, Masupu K, Matshaba M, Mayaphi S, Mbhele N, Mbulawa MB, Mendes A, Mlisana K, Mnguni A, Mohale T, Moir M, Moruisi K, Mosepele M, Motsatsi G, Motswaledi MS, Mphoyakgosi T, Msomi N, Mwangi PN, Naidoo Y, Ntuli N, Nyaga M, Olubayo L, Pillay S, Radibe B, Ramphal Y, Ramphal U, San JE, Scott L, Shapiro R, Singh L, Smith-Lawrence P, Stevens W, Strydom A, Subramoney K, Tebeila N, Tshiabuila D, Tsui J, van Wyk S, Weaver S, Wibmer C, Wilkinson E, Wolter N, Zarebski AE, Zuze B, Goedhals D, Preiser W, Treurnicht F, Venter M, Williamson C, Pybus OG, Bhiman J, Glass A, Martin DP, Rambaut A, Gaseitsiwe S, von Gottberg A, de Oliveira T. Rapid epidemic expansion of the SARS-CoV-2 Omicron variant in southern Africa., 2022, 603(7902): 679–686.
[2] Menni C, Valdes AM, Polidori L, Antonelli M, Penamakuri S, Nogal A, Louca P, May A, Figueiredo JC, Hu C, Molteni E, Canas L, Österdahl MF, Modat M, Sudre CH, Fox B, Hammers A, Wolf J, Capdevila J, Chan AT, David SP, Steves CJ, Ourselin S, Spector TD. Symptom prevalence, duration, and risk of hospital admission in individuals infected with SARS-CoV-2 during periods of omicron and delta variant dominance: a prospective observational study from the ZOE COVID study., 2022, doi: 10.1016/s0140-6736(22)00327-0
[3] Chen JM, Chen YQ. China can prepare to end its zero-COVID policy., 2022, doi: 10.1038/s41591- 022-01794-3
[4] Wu F, Zhao S, Yu B, Chen YM, Wang W, Song ZG, Hu Y, Tao ZW, Tian JH, Pei YY, Yuan ML, Zhang YL, Dai FH, Liu Y, Wang QM, Zheng JJ, Xu L, Holmes EC, Zhang YZ. A new coronavirus associated with human respiratory disease in China., 2020, 579(7798): 265–269.
[5] Hu B, Guo H, Zhou P, Shi ZL. Characteristics of SARS- CoV-2 and COVID-19., 2021, 19(3): 141–154.
[6] Wan Y, Shang J, Graham R, Baric RS, Li F. Receptor recognition by the novel coronavirus from Wuhan: an analysis based on decade-long structural studies of SARS coronavirus., 2020, 94(7): e00127–20.
[7] Zhang ZB, Xia YL, Shen JX, Du WW, Fu YX, Liu SQ. Mechanistic origin of different binding affinities of SARS-CoV and SARS-CoV-2 spike RBDs to human ACE2., 2022, 11(8): 1274.
[8] Peng R, Wu LA, Wang Q, Qi J, Gao GF. Cell entry by SARS-CoV-2., 2021, 46(10): 848–860.
[9] Yu D, Yang X, Tang BX, Pan YH, Yang JN, Duan GY, Zhu JW, Hao ZQ, Mu HL, Dai L, Hu WJ, Zhang MC, Cui Y, Jin T, Li CP, Ma L, Language translation team, Su X, Zhang G, Zhao W, Li H. Coronavirus GenBrowser for monitoring the transmission and evolution of SARS- CoV-2., 2022, 23(2): bbab583.
[10] Hartl DL, Clark AG. Principles of Population GeneticsSinauer Associates, Inc., 1988.
[11] Lin K, Li H. Advances in detecting positive selection on genome.2009, 31(9): 896–902.
林拷, 李海鹏. DNA水平上检测正选择方法的研究进展. 遗传, 2009, 31(9): 896–902
[12] Anderson RM, May RM. Coevolution of hosts and parasites., 1982, 85(Pt 2): 411–426.
[13] Bull JJ. Virulence., 1994, 48(5): 1423–1437.
[14] Ebert D, Bull JJ. Challenging the trade-off model for the evolution of virulence: is virulence management feasible?, 2003, 11(1): 15–20.
[15] Read AF. The evolution of virulence., 1994, 2(3): 73–76.
[16] Geoghegan JL, Holmes EC. The phylogenomics of evolving virus virulence., 2018, 19(12): 756–769.
[17] Levin BR, Bull JJ. Short-sighted evolution and the virulence of pathogenic microorganisms., 1994, 2(3): 76–81.
[18] Read AF, Baigent SJ, Powers C, Kgosana LB, Blackwell L, Smith LP, Kennedy DA, Walkden-Brown SW, Nair VK. Imperfect vaccination can enhance the transmission of highly virulent pathogens., 2015, 13(7): e1002198.
[19] Ma HL, Wang ZG, Zhao X, Han J, Zhang Y, Wang H, Chen C, Wang J, Jiang FC, Lei J, Song JD, Jiang SF, Zhu SL, Liu HH, Wang DY, Meng Y, Mao NY, Wang YH, Zhu Z, Chen ZX, Wang BL, Song QQ, Du HJ, Yuan Q, Xia D, Xia ZQ, Liu PP, Wu YC, Feng ZJ, Gao RQ, Gao GF, Xu WB. Long distance transmission of SARS-CoV-2 from contaminated cold chain products to humans -- Qingdao City, Shandong Province, China, September 2020., 2021, 3(30): 637–644.
[20] Yu D, Zhu JW, Yang JN, Pan YH, Mu HL, Cao RF, Tang BX, Duan GY, Hao ZQ, Dai L, Zhao GP, Zhang YP, Zhao W, Zhang G, Li H. Global cold-chain related SARS-CoV-2 transmission., 2022, doi: 10.5281/zenodo.6379310.
[21] Liu PP, Yang MJ, Zhao X, Guo YY, Wang L, Zhang J, Lei WW, Han WF, Jiang FC, Liu WJ, Gao GF, Wu GZ. Cold-chain transportation in the frozen food industry may have caused a recurrence of COVID-19 cases in destination: successful isolation of SARS-CoV-2 virus from the imported frozen cod package surface., 2020, 2(4): 199–201.
[22] Pang XH, Ren LL, Wu SS, Ma WT, Yang J, Di L, Li J, Xiao Y, Kang L, Du SC, Du J, Wang J, Li G, Zhai SG, Chen LJ, Zhou WX, Lai SJ, Gao L, Pan Y, Wang QY, Li MK, Wang JB, Huang YY, Wang JW, COVID-19 Field Response Group, COVID-19 Laboratory Testing Group. Cold-chain food contamination as the possible origin of COVID-19 resurgence in Beijing., 2020, 7(12): 1861–1864.
[23] Bolze A, Basler T, White S, Rossi AD, Wyman D, Roychoudhury P, Greninger AL, Hayashibara K, Beatty M, Shah S, Stous S, Kil E, Dai H, Cassens T, Tsan K, Nguyen J, Ramirez J, Carter S, Cirulli ET, Barrett KS, Washington NL, Belda-Ferre P, Jacobs S, Sandoval E, Becker D, Lu JT, Isaksson M, Lee W, Luo SS. Evidence for SARS-CoV-2 Delta and Omicron co-infections and recombination., 2022, doi: 10.1101/2022.03.09.22272113.
[24] Lacek KA, Rambo-Martin BL, Batra D, Zheng XY, Sakaguchi H, Peacock T, Keller M, Wilson MM, Sheth M, Davis ML, Borroughs M, Gerhart J, Hassell N, Shepard SS, Cook PW, Lee J, Wentworth DE, Barnes JR, Kondor R, Paden CR. Identification of a novel SARS-CoV-2 Delta-Omicron recombinant virus in the United States., 2022, doi: 10.1101/2022.03.19.484981.
[25] Willyard C. What the Omicron wave is revealing about human immunity., 2022, 602(7895): 22–25.
[26] Zhao SL, Sha T, Wu CI, Xue YB, Chen H. Will the large- scale vaccination succeed in containing the COVID-19 pandemic and how soon?, 2021, 3: 304–316.
[27] Gong Z, Zhu JW, Li CP, Jiang S, Ma LN, Tang BX, Zou D, Chen ML, Sun YB, Song SH, Zhang Z, Xiao JF, Xue YB, Bao YM, Du ZL, Zhao WM. An online coronavirus analysis platform from the National Genomics Data Center., 2020, 41(6): 705–708.
2022-04-13;
2022-04-19;
2022-04-27
中国科学院B类战略性先导科技专项(编号:XDPB17)资助[Supported by the Strategic Priority Research Program of the Chinese Academy of Sciences (No. XDPB17)]
苏枭,博士,研究员,研究方向:呼吸道感染。E-mail: xsu@ips.ac.cn
何子文,博士,副教授,研究方向:进化生物学与生态基因组学。E-mail: heziwen@mail.sysu.edu.cn
柳树群,博士,教授,研究方向:计算生物学。E-mail: shuqunliu@gmail.com
苏枭,何子文和柳树群并列第一作者。
李海鹏,博士,研究员,研究方向:进化基因组学和群体基因组学。E-mail: lihaipeng@picb.ac.cn
10.16288/j.yczz.22-107
(责任编委: 施鹏)