利用谱系追踪方法探究Lgr5在胰腺组织及其类器官中的表达
2022-05-24闫炳儒艾显辉刘淼田丽红梁洋滕春波
闫炳儒,艾显辉,刘淼,田丽红,梁洋,滕春波
研究报告
利用谱系追踪方法探究Lgr5在胰腺组织及其类器官中的表达
闫炳儒1,艾显辉1,刘淼1,田丽红2,梁洋1,滕春波1
1. 东北林业大学生命科学学院,哈尔滨 150040 2. 东北林业大学野生动物保护与自然保护地学院,哈尔滨 150040
富含亮氨酸重复序列G蛋白偶联受体5 (leucine-rich repeat containing G protein-coupled receptor 5, Lgr5)在体内分布广泛,可以作为多种上皮组织(包括小肠、结肠、胃和毛囊)中干细胞的标记物。为了探究小鼠()胰腺发育过程中导管上皮细胞及体外培养的胰腺导管类器官中Lgr5的表达情况,本研究利用Lgr5-CreERT2+/–和Rosa26-mTmG杂交后的转基因小鼠,经Tamoxifen (他莫昔芬)诱导后,观察不同发育阶段胰腺组织切片的荧光表达情况,并通过三维培养建立成体小鼠胰腺导管类器官,观察诱导后类器官细胞中的荧光变化。结果显示:Tamoxifen诱导的正常成体转基因小鼠胰腺导管内未检测到表达Lgr5的细胞;通过对孕鼠及哺乳母鼠注射Tamoxifen,在胚胎发育15.5 d和新生小鼠胰腺中也未发现Lgr5阳性细胞;但是将4-hydroxy- Tamoxifen (4-羟基–他莫昔芬)添加到培养基中,在Lgr5-CreERT2+/–;Rosa26-mTmG转基因小鼠胰腺导管来源的类器官中检测到部分细胞表达Lgr5。本研究结果证实,在成体及胚胎胰腺组织中没有检测到Lgr5表达,但在体外培养的胰腺导管类器官细胞中检测到Lgr5表达。本研究为探索胰腺发育过程中干/祖细胞特异性表达基因奠定了基础。
胰腺;导管;Lgr5;类器官;谱系追踪
富含亮氨酸重复序列G蛋白偶联受体5 (leucine rich repeat containing G protein-coupled receptor 5, Lgr5),又名GPR49、HG38、FEX、GPR67和MGC117008,属于糖蛋白激素受体类,是Wnt激动剂R-spondins的受体,在体内广泛分布,已经证明其可以作为小肠、胃、肝脏等多个组织中成体干/祖细胞的标记物。利用Lgr5-CreERT2小鼠(),Barker等[1]成功标记了小肠中的干细胞。R-spondins信号在离体类器官形成过程中具有重要作用。已有研究发现,R-spondins通过激活Lgr5,促进肺、胃、肝、肠、乳腺等多种组织干/祖细胞形成类器官(organoid)[2,3]。
胰腺是人体重要的消化器官,与小肠、肝脏相同,均起源于内胚层形成的原始肠管[4,5]。胰腺由内、外分泌细胞组成,外分泌细胞产生的分泌酶进入消化道,内分泌细胞产生的激素进入血液[6]。目前,成体胰腺组织中是否有多能干/祖细胞及其亚细胞定位一直存在争议。Gu等[7]研究认为,成体胰腺中的β细胞主要通过自我复制产生,而不是来源于干细胞。也有研究发现,成人胰腺导管中存在干/祖细胞,能够介导胰腺再生[8]。近年来利用类器官培养技术,Huch等[9]获得胰腺导管类器官,但是在成体胰腺导管中没有检测到Lgr5阳性细胞,然而在胰腺结扎导管造成的胰腺损伤组织中的导管细胞有Lgr5表达。但是,小鼠早期发育过程中的胰腺祖细胞是否存在Lgr5表达目前仍不清楚。
为了探讨小鼠胰腺发育过程中导管上皮细胞及体外培养的胰腺导管类器官中Lgr5的表达情况,本研究利用谱系追踪方法,探究了Lgr5-CreERT2+/–;Rosa26-mTmG转基因小鼠在胰腺发育过程中上皮细胞Lgr5的表达情况,进一步分离转基因小鼠胰腺导管上皮细胞经培养获得小鼠胰腺导管类器官(mouse pancreatic duct organoid, mPDO),利用4-hydroxy-Tamoxifen诱导类器官中Cre酶对floxed (flanked)序列的切除,通过观察荧光变化鉴定是否存在Lgr5的表达。本研究为发掘胰腺发育过程中干/祖细胞特异性表达基因,及胰腺类器官的开发应用等奠定了基础。
1 材料与方法
1.1 实验动物
Lgr5-CreERT2+/–转基因小鼠购自赛业(苏州)生物科技有限公司,Rosa26-mTmG转基因小鼠为本实验室自有,饲养在东北林业大学生命科学学院SPF级实验动物室。动物实验经东北林业大学实验动物管理与伦理委员会审查,符合伦理原则。Lgr5-CreERT2+/–是具有Lgr5-Cre等位基因的小鼠,表达CreERT2蛋白。Lgr5-CreERT2+/–与Rosa26-mTmG转基因小鼠交配产生后代,经Tamoxifen诱导后Cre介导的重组将导致后代Lgr5表达细胞中floxed序列的缺失,该小鼠可用于谱系追踪,也可用于标记表达Lgr5的干/祖细胞。Rosa26-mTmG小鼠在Cre重组之前,在细胞/组织中广泛表达细胞膜定位的tdTomato (mT)红色荧光蛋白,发生Cre重组后,细胞膜定位的EGFP (mG)荧光表达取代了红色荧光。本研究使用基因型为Lgr5-CreERT2+/–和Rosa26-mTmG的成年小鼠,经过合笼繁殖出实验所需要的小鼠,最终所需的转基因小鼠基因型为Lgr5-CreERT2+/–; Rosa26-mTmG。
1.2 Lgr5-CreERT2+/–; Rosa26-mTmG转基因小鼠的构建
选择健康状况良好且处于发情期的Lgr5- CreERT2+/–雄鼠和Rosa26-mTmG雌鼠,雄∶雌为1∶2或1∶3比例合笼,小鼠过了断奶期分开独自笼养,直到小鼠性成熟。具体构建模式见图1。
1.3 小鼠总DNA提取及PCR鉴定
剪取小鼠尾尖(大约0.4~0.6 cm)迅速转移至研钵加入液氮研磨,直至样品变为白色粉末状。将研磨好的组织粉末移至经过预冷的1.5 mL EP管中,并加入180 μL Buffer GTL,20 μL Proteinase K,涡旋震荡使样品彻底混匀,56℃消化。根据DNA提取试剂盒(CW2298M,北京CWBIO公司)说明提取鼠尾DNA。
设计基因引物,基因引物由赛业(苏州)生物科技有限公司提供(各引物信息见表1)进行样品DNA的PCR检测。构建15 μL PCR扩增体系,包括7.5 μL PCR Master Mixture (2×,P222-AA,南京Vazyme公司)、1 μL上游引物和1 μL下游引物、1 μL DNA模板和4.5 μL ddH2O。采用如下程序进行PCR扩增反应:95℃预变性5 min;95℃变性30 s,67℃退火35 s,72℃延伸45 s,35个循环;最后再72℃延伸5 min。
1.4 Tamoxifen诱导
将Tamoxifen (CAS#10540-29-1,美国Sigma公司)以20 mg/mL的浓度配于玉米油中,37℃避光加热1 h后分装避光保存至4℃冰箱,以腹腔注射的方式,参照THE JACKSON LABORATORY建议剂量[10,11],每只小鼠按100 μL/d的剂量注射Tamoxifen,连续注射5 d。注射停止一周后收集小鼠组织样本进行切片。
在小鼠胚胎期8.5 d (Embryo 8.5 day,E8.5 d),发育的内胚层中假定的胰腺和肝脏开始发生分离。为了观察胰腺胚胎发育时期Lgr5的表达情况,取7~8周龄发情的Lgr5-CreERT2+/–与Rosa26-mTmG小鼠合笼,次日早上检测阴道栓,见栓鼠记E0.5 d,于胰腺祖细胞活跃期E9.5 d对孕鼠腹腔注射100 μL Tamoxifen注射液,每24 h注射一次,连续注射6 d,第7 d收集E15.5 d胎鼠胰腺组织及小肠组织冰冻切片进行观察。取7~8周龄健康的Lgr5-CreERT2+/–与Rosa26-mTmG小鼠合笼,新生小鼠出生当日记第0 d,出生后24 h给哺乳母鼠注射Tamoxifen,每只哺乳母鼠腹腔注射100 μL Tamoxifen注射液,每24 h注射一次,连续注射7 d,第8 d收集新生小鼠胰腺组织及小肠组织冰冻切片进行观察。
1.5 小鼠组织的冰冻切片
利用过量注射戊巴比妥钠(P11011,美国Merck公司)麻醉处死Lgr5-CreERT2+/–; Rosa26-mTmG小鼠,75%的消毒酒精浸润。从小鼠腹部剪开,取出小肠及胰腺组织。将取出的组织放入1×PBS清洗去掉血渍,然后在解剖显微镜下剔除多余的脂肪组织等。将上述处理干净的胰腺组织放于4%PFA溶液中固定20 min,用30%质量比的蔗糖脱水过夜。用冰冻切片包埋剂(OCT)将胰腺组织进行包埋。将包埋好的样品冰冻切片做好标记,–80℃冻存。

图1 Lgr5-CreERT2+/–; Rosa26-mTmG小鼠繁育模式图

表1 PCR引物
F:forward primer;R:reverse primer。
1.6 免疫染色
Lgr5-CreERT2+/–;Rosa26-mTmG成鼠、E15.5胎鼠及新生鼠的小肠、胰腺、胰腺导管组织和类器官冰冻切片于37℃杂交箱放置20~30 min进行烘片,1×PBS洗3遍,每次10 min,洗掉残留的OCT。4%PFA于37℃固定20 min,除去PFA。用0.3%TritonX 100在37℃孵育20 min。10%HSA (马血清)于37℃封闭50 min。I抗4℃孵育过夜,I抗包括Lgr5 (1∶100,bs-20746R,北京Bioss公司)和Insulin (1∶100,AF1159,上海碧云天生物技术有限公司)。II抗Alexa Fluor 488标记的驴抗兔IgG H&L (1∶100,bs-0295D- AF488,北京Bioss公司) 37℃孵育1 h,后面全程避光。经DAPI (1∶1000,33259,德国Biofroxx公司)染核5 min。防淬灭剂封片,4℃暗盒短暂保存。
1.7 小鼠胰腺导管类器官的培养
处死成体Lgr5-CreERT2+/–;Rosa26-mTmG转基因小鼠后,剥离胰腺的主导管,用于类器官的制备。将胰腺主导管置于15 mL离心管,2 mg/mL胶原酶IV于37℃消化15 min,分离导管周围残留的组织,剧烈摇晃离心管。将消化好的胰腺主导管重新置于含有无菌PBS的10 cm皿中。利用解剖镜剥离残留在导管周围的组织,PBS冲洗以保证去除多余组织。置于不同的无菌1.5 mL离心管中,用解剖剪刀将胰腺导管尽可能的剪碎,加入2 mg/mL胶原酶IV共1 mL,37℃消化20 min,用1 mL枪头反复吹打。将消化好的导管细胞于水平离心机300离心5 min。无菌PBS洗3遍,水平离心机300离心5 min。Matrigel基质胶(美国Corning公司)于前一天4℃放置过夜,使其充分溶解成液态,再用预冷的枪头吸取Matrigel,重悬消化好的导管细胞,滴于培养板中心,形成一个半球形的凝胶进行三维(three- dimensional, 3D)培养。将培养板于37℃放置10 min,使Matrigel凝固,加入小鼠类器官扩增培养基(mouse expansion medium, mEM),在37℃含有5%CO2的细胞培养箱培养,隔天需更换新鲜mEM培养基。mEM主要成分包括D/F12基础培养基、1%青霉素-链霉素、1%Glutamax (美国Hyclone公司)、2%B27 Supplementminus VA (美国Thermo公司)、100 ng/mL R-Spondin-1 (RSPO1,美国R&D公司)、50 ng/mL EGF、25 ng/mL Noggin、100 ng/mL FGF10 (美国Peprotech公司)、1 mmol/L N-acetylcysteine和10 mmol/L Nicotinamide (美国Sigma公司)。
诱导类器官表达Lgr5实验中使用含有500 nmol/L 4-hydroxy-Tamoxifen (CAS#68047-06-3,美国Sigma公司)的mEM培养mPDO 7~10 d左右,利用荧光显微镜观察类器官荧光变化。
1.8 类器官细胞冰冻切片的制备步骤
去除类器官培养过程中mEM培养液,加入常温PBS清洗。加入4%PFA,室温固定15 min。去除PFA后用勺子将含有类器官的Matrigel凝胶放入含有30%蔗糖(PBS配制)的50 mL离心管中,4℃过夜,直至凝胶沉到管底。从蔗糖溶液中取出凝胶,放入含有OCT化合物的模具中,OCT完全凝固后放于–80℃冰箱保存。利用恒温冷冻切片机切割制备好的类器官模具,制备约10 μm的细胞切片,可放于–80℃冰箱保存。
2 结果与分析
2.1 Lgr5-CreERT2+/–; Rosa26-mTmG转基因小鼠的获得与鉴定
本研究将Lgr5-CreERT2+/–小鼠与Rosa26-mTmG小鼠杂交,获得基因型为Lgr5-CreERT2+/–; Rosa26- mTmG目的转基因小鼠(图1)。通过该方法获得谱系追踪小鼠后,利用NCBI数据库查询基因序列并设计引物,引物由赛业生物公司提供(表1)。提取小鼠鼠尾DNA作为模板,进行PCR扩增,用2%琼脂糖凝胶鉴定小鼠基因型。PCR扩增结果显示,目的条带为174 bp,与吻合,该结果显示已经获得Lgr5-CreERT2+/–;Rosa26- mTmG转基因小鼠,可用于后续实验(图2)。
2.2 谱系追踪显示成鼠胰腺组织没有Lgr5表达
已有研究表明Lgr5可以用来标记小肠、胃和毛囊组织中的干细胞[12,13]。因此本研究利用Lgr5- CreERT2+/–; Rosa26-mTmG转基因小鼠观察成体胰腺组织中上皮细胞Lgr5的表达情况。将7~8周龄转基因鼠通过注射Tamoxifen激活体内Cre酶的活性,连续注射5 d,注射结束7 d后收集小肠及胰腺导管组织(图3A),其中小肠组织作为阳性对照。结果显示,小肠切片中观察到大量EGFP表达细胞(图3B),证明小鼠体内Lgr5启动的Cre酶具有有效的酶活性。将转基因小鼠的胰腺组织进行连续切片,导管中未检测到明显的EGFP表达(图3B)。以上结果暗示:在正常的成体小鼠中胰腺导管上皮中没有Lgr5表达。
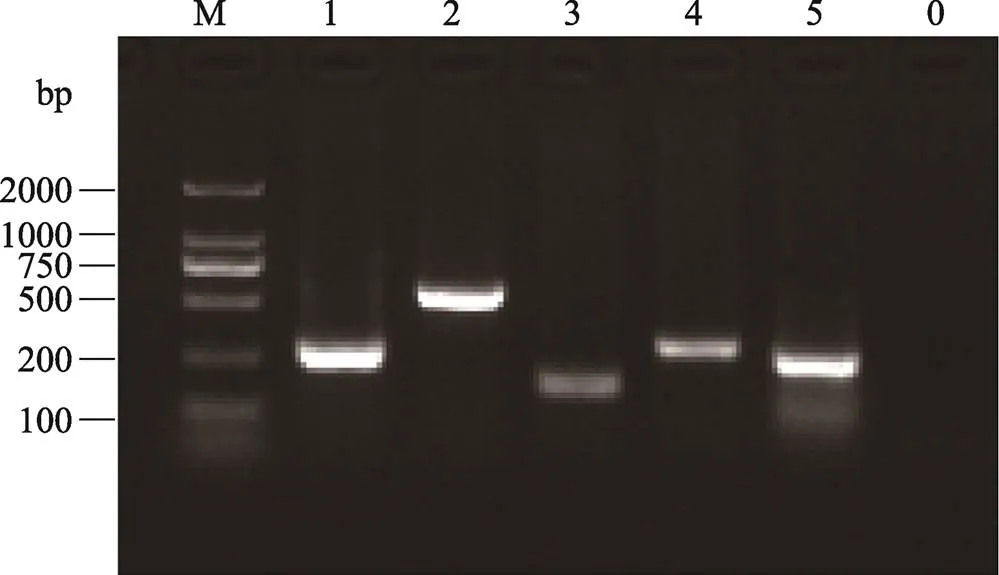
图2 Lgr5-CreERT2+/–; Rosa26-mTmG转基因小鼠PCR鉴定结果
M:DL2000 DNA marker;1:GAPDH,200 bp;2:CreERT2基因鉴定PCR产物,542 bp;3:Lgr5突变体基因鉴定PCR产物,174 bp;4:Lgr5野生型基因鉴定PCR产物,298 bp;5:mTmG纯合突变体基因鉴定PCR产物,250 bp;0:negative control。
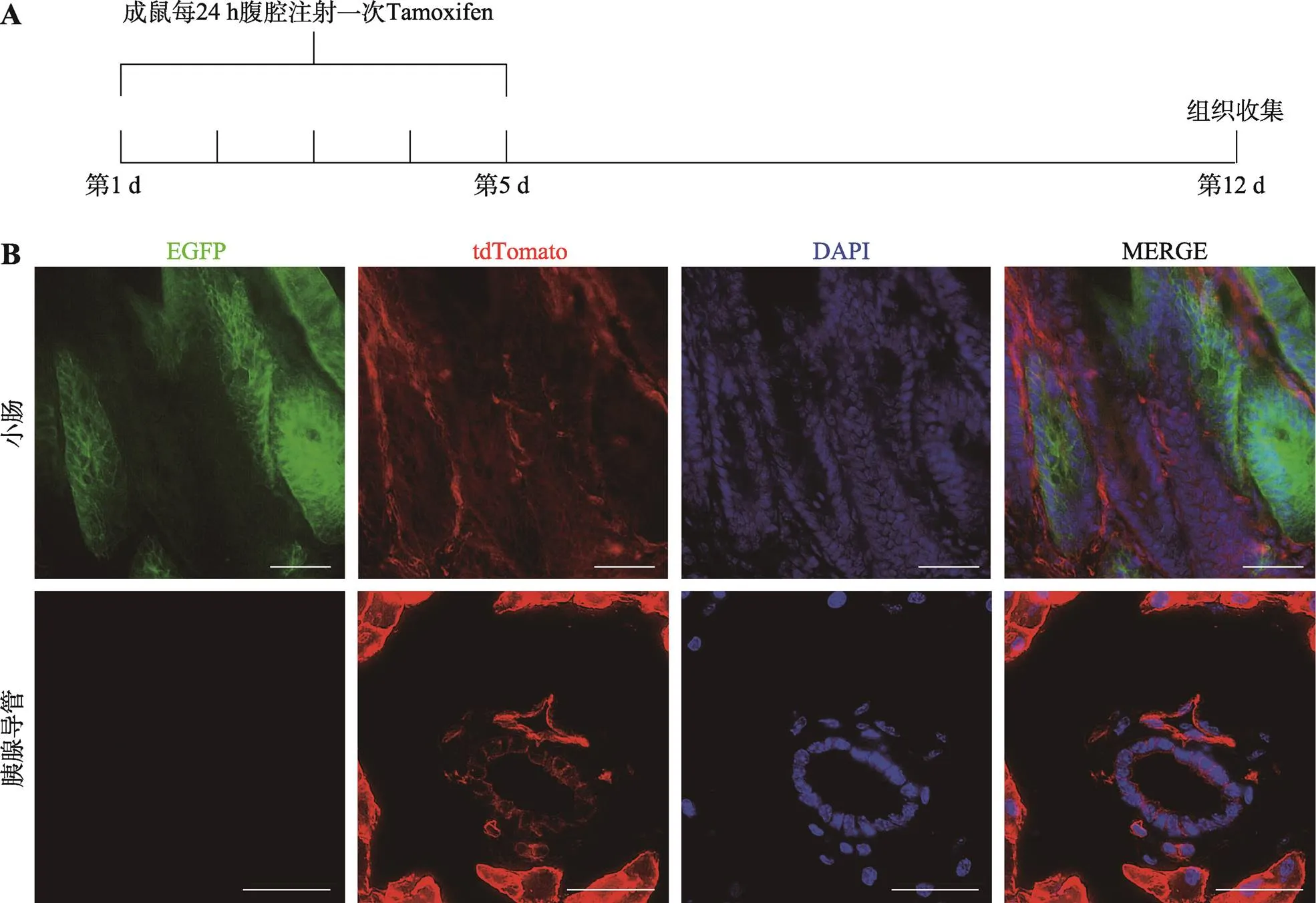
图3 Lgr5-CreERT2+/–; Rosa26-mTmG成鼠胰腺组织Lgr5表达分析
A:Tamoxifen给药模式图;B:荧光显微镜观察Lgr5-CreERT2+/–; Rosa26-mTmG小鼠小肠及胰腺导管切片。小肠切片显示有EGFP表达细胞,证明Tamoxifen诱导成功。EGFP标记Lgr5-CreERT2,显示为绿色;tdTomato标记细胞膜,显示为红色;DAPI染细胞核,显示为蓝色;比例尺:100 μm。
2.3 谱系追踪显示新生鼠及E15.5 d胎鼠胰腺组织没有Lgr5表达
成体小鼠的胰腺导管内未检测到Lgr5的表达,为进一步探究在增殖和分化活跃的胚胎期或出生后是否有Lgr5标记的祖细胞,本研究通过Tamoxifen诱导制备E15.5 d胎鼠及新生小鼠胰腺及胰腺导管切片(图4A,图5A),观察胰腺发育过程中Lgr5的表达情况,小肠上皮切片作为阳性对照。结果显示,制备的胎鼠及新生鼠的小肠中广泛表达Lgr5,而胰腺及胰腺导管中没有检测到EGFP的表达(图4B,图5B),暗示在小鼠胰腺胚胎和新生时期的胰腺组织中Lgr5也不表达。
2.4 Lgr5-CreERT2+/–; Rosa26-mTmG转基因小鼠胰腺导管类器官的培养
通过分离Lgr5-CreERT2+/–; Rosa26-mTmG小鼠原代胰腺导管细胞,经剪碎及胰酶消化,利用Matrigel进行3D培养,制备mPDO,其中mEM(小鼠类器官扩增培养基)参考Barker等[12]建立的小鼠类器官培养成份,通过加入小鼠EGF及RSPO1等类器官生长的必需因子,可以观察到mPDO增殖形成闭合结构,随后闭合结构不断扩增,最终形成较大的囊状类器官。扩大的囊状类器官经过吹打消化形成单细胞之后,按1∶3~1∶5比例传代培养,结果显示依旧可以保持正常增殖传代能力(图6)。
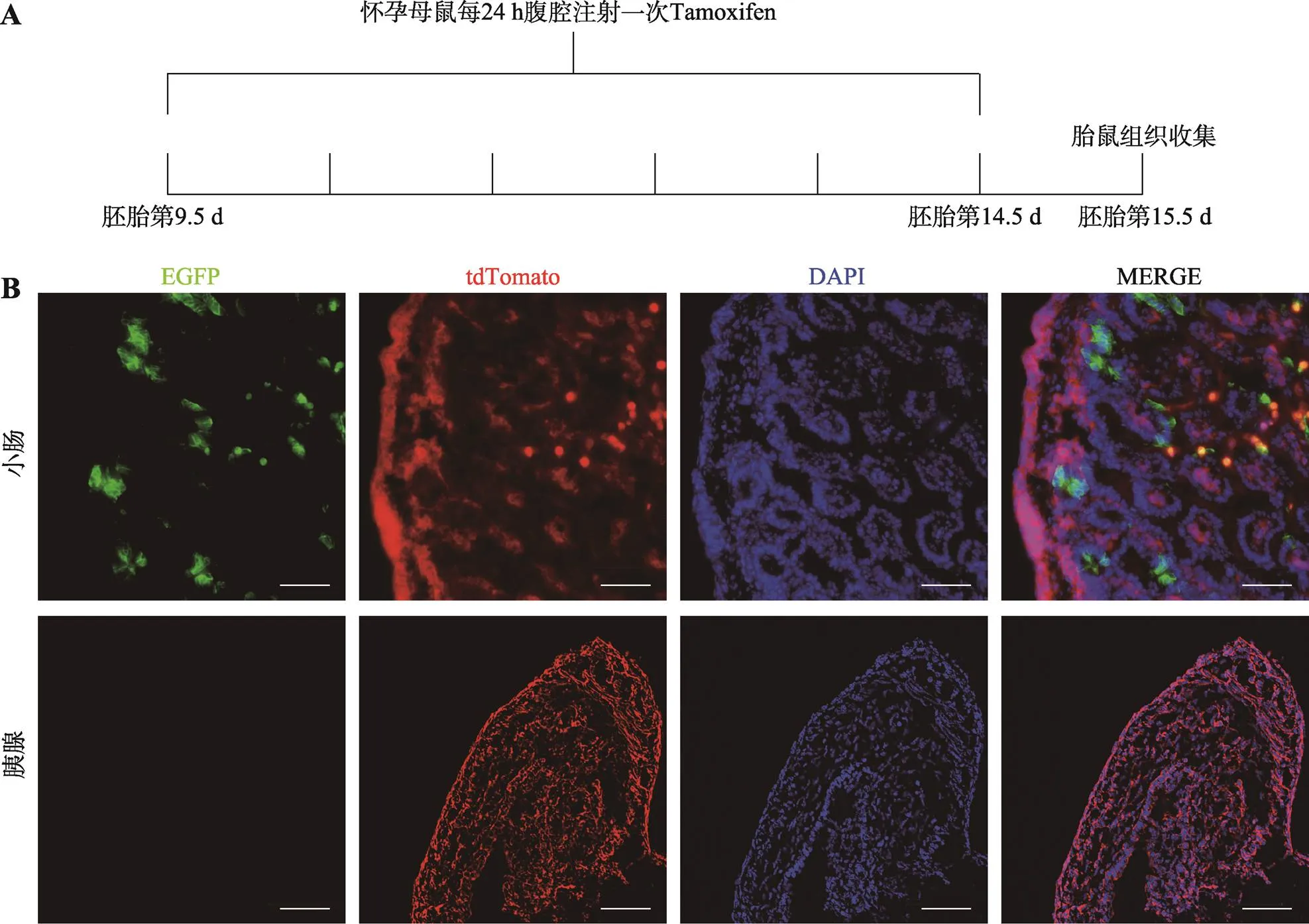
图4 Lgr5-CreERT2+/–; Rosa26-mTmG E15.5 d胎鼠胰腺组织Lgr5表达分析
A:Tamoxifen给药模式图;B:荧光显微镜观察Lgr5-CreERT2+/–; Rosa26-mTmG E15.5 d胎鼠小肠及胰腺切片图。EGFP标记Lgr5-CreERT2,显示为绿色;tdTomato标记细胞膜,显示为红色;DAPI染细胞核,显示为蓝色;比例尺:100 μm。
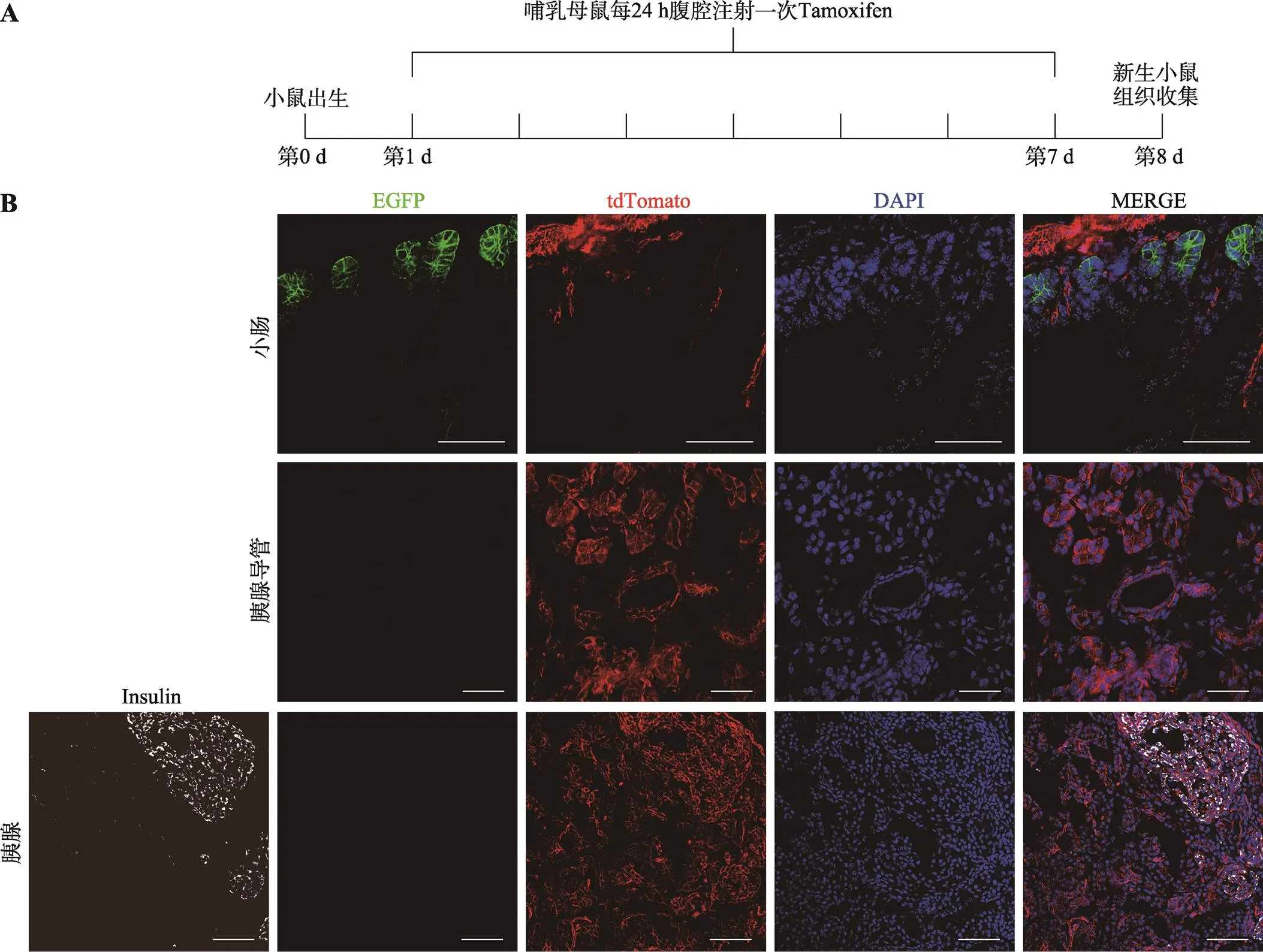
图5 Lgr5-CreERT2+/–; Rosa26-mTmG新生小鼠胰腺组织Lgr5表达分析
A:Tamoxifen给药模式图;B:荧光显微镜观察Lgr5-CreERT2+/–;Rosa26-mTmG新生小鼠小肠,胰腺导管和胰腺切片图。EGFP标记Lgr5-CreERT2,显示为绿色;tdTomato标记细胞膜,显示为红色;Insulin标记胰腺β细胞,显示为白色;DAPI染细胞核,显示为蓝色;比例尺:100 μm。
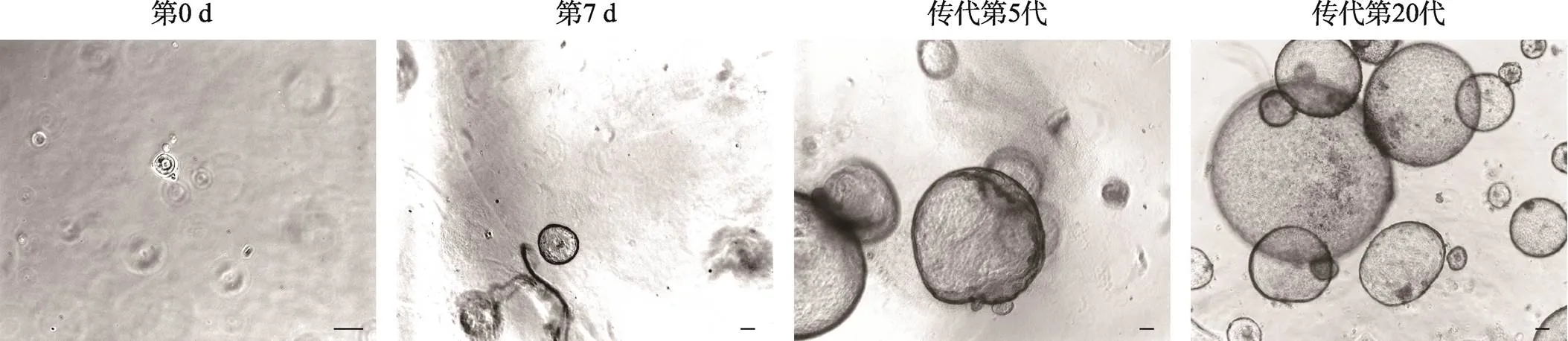
图6 mPDO生长及传代培养
比例尺:100 μm。
2.5 谱系追踪显示小鼠胰腺导管类器官有Lgr5表达
本研究在成体小鼠、新生鼠及E15.5 d胎鼠的胰腺导管内均未检测到Lgr5的表达。由于Lgr5广泛用作类器官的特异性标记,因此本研究通过观察谱系特异性的荧光变化,鉴定Lgr5的表达情况。首先制备了Lgr5-CreERT2+/–; Rosa26-mTmG小鼠胰腺导管类器官,在培养基中加入4-hydroxy-Tamoxifen进行培养,在第7 d,与未添加4-hydroxy-Tamoxifen组相比(图7A),4-hydroxy-Tamoxifen培养组观察到明显的EGFP表达(图7B),说明胰腺导管上皮细胞在体外3D培养后生成表达Lgr5的细胞。
3 讨论
糖尿病是功能性β细胞量严重减少的结果[14],目前细胞疗法有望成为糖尿病的潜在治疗方法。但寻找成体胰腺干/祖细胞一直饱受争议,也存在很多技术限制,因此利用类器官培养技术获得具有干细胞潜能的胰腺类器官已经成为疾病模型建立、研究损伤再生及胰岛移植新的细胞资源[15~17]。
本研究利用3D培养技术建立了小鼠胰腺导管类器官(mPDO)培养系统,发现mPDO表达干细胞标志基因。利用谱系追踪方法探讨胰腺发育过程中导管上皮细胞Lgr5体内表达情况,发现在正常成体小鼠的胰腺导管没有Lgr5的表达;在增殖和分化活跃的胚胎期和新生小鼠胰腺中也未发现表达Lgr5的细胞;但在Lgr5-CreERT2+/–; Rosa26-mTmG小鼠的原代胰腺导管类器官中检测到Lgr5的表达。
细胞谱系追踪(cell lineage tracing)是一种对动物特定细胞进行追踪的技术[18,19],基于Cre-系统,可以在组织或细胞中的任何时间进行特异性Tamoxifen诱导以对细胞进行特殊标记,通过检测标记物来研究被标记细胞的迁移、改变或存在与否等问题[20~23]。本研究所选用的Rosa26-mTmG转基因小鼠是一种基于Cre-系统的条件基因靶向标记的双荧光蛋白报告小鼠模型,在Cre酶介导切除之前,细胞膜特异性表达tdTomato红色荧光蛋白,当Cre介导切除后,细胞膜转变为特异性表达EGFP绿色荧光蛋白[18,23~25]。本研究通过杂交获得Lgr5- CreERT2+/–; Rosa26-mTmG转基因小鼠,经PCR检测发现目的条带与预期大小吻合(图2);小肠切片作为阳性对照,观察到EGFP的表达,说明小鼠体内Tamoxifen能有效诱导Cre酶切割位点,从而反映存在内源性Lgr5表达。
Lgr5属于糖蛋白激素受体类,是Wnt激动剂R-spondins受体,既可以作为小肠、胃、肝脏等多个组织中成体干/祖细胞的标记物,也可以作为机体(肿瘤)干细胞的标记物,参与Wnt等信号通路维持细胞自我更新,调控分化、增殖、迁移、极性以及凋亡等[12,18,22]。目前在自我更新率低的内胚层来源器官中未观察到Lgr5的表达,如肝脏或胰腺。但是在肝脏和胰腺损伤后的再生组织中,检测到Lgr5标记的祖细胞群[26,27]。本研究结果显示,在成体小鼠胰腺中未观察到Lgr5表达,与Huch等[26]研究结果一致。我们推测在增殖和分化活跃的胚胎期或新生小鼠中,胰腺组织可能会含有Lgr5标记的祖细胞,然而本研究结果显示,在胚胎E15.5 d和新生小鼠的胰腺组织也不表达Lgr5。但是最新的研究报道,在妊娠晚期及分娩后母鼠的胰腺中有Lgr5的表达,该研究推测妊娠相关的信号以及妊娠损伤可能会诱导导管附近的胰腺干/祖细胞增殖、分化,进而导致Lgr5表达[28]。但在正常小鼠胰腺导管中,无论是成体还是胎鼠或新生鼠,均没有发现Lgr5阳性细胞存在,暗示不适合作为标记胰腺祖细胞的特异基因。
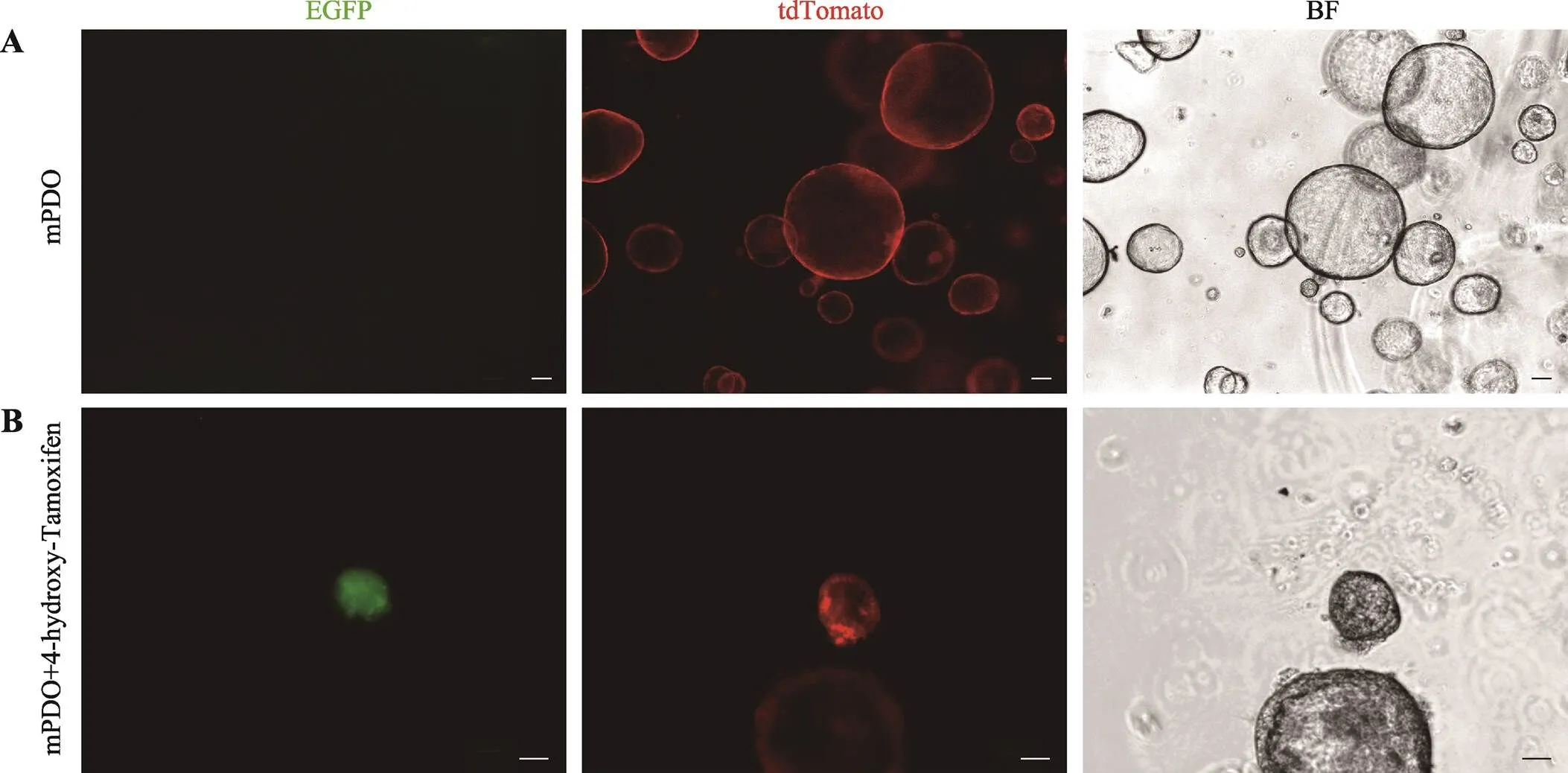
图7 Lgr5-CreERT2+/–; Rosa26-mTmG小鼠胰腺导管类器官Lgr5表达分析
A:荧光显微镜观察Lgr5-CreERT2+/–; Rosa26-mTmG成鼠制备的mPDO;B:体外使用4-hydroxy-Tamoxifen诱导培养7 d后的mPDO。EGFP标记Lgr5-CreERT2,显示为绿色;tdTomato标记细胞膜,显示为红色;BF:明场(bright field);比例尺:100 μm。
本研究进一步利用Lgr5-CreERT2+/–; Rosa26-mTmG小鼠原代胰腺导管细胞进行类器官培养,发现有表达Lgr5阳性细胞出现,且这些Lgr5标记的细胞可以长期在体外扩增,与Barker等[12]研究结果一致。这些结果暗示,在类器官培养过程中,Wnt信号通路可能被激活进而促使干细胞标志物Lgr5表达上调。
综上所述,本研究证明Lgr5不适合作为胰腺干/祖细胞的特异基因,但可以作为胰腺导管类器官的潜在标记物。本研究结果为干/祖细胞的特异基因的发掘,及利用胰腺类器官治疗糖尿病等胰腺疾病提供了新的思路。
[1] Barker N, van Es JH, Kuipers J, Kujala P, van den Born M, Cozijnsen M, Haegebarth A, Korving J, Begthel H, Peters PJ, Clevers H. Identification of stem cells in small intestine and colon by marker gene Lgr5., 2007, 449(7165): 1003–1007.
[2] Koo BK, Clevers H. Stem cells marked by the R-spondin receptor LGR5., 2014, 147(2): 289–302.
[3] Nagano K. R-spondin signaling as a pivotal regulator of tissue development and homeostasis., 2019, 55(1): 80–87.
[4] Cardinale V, Wang YF, Carpino G, Mendel G, Alpini G, Gaudio E, Reid LM, Alvaro D. The biliary tree--a reservoir of multipotent stem cells., 2012, 9(4): 231–240.
[5] Zaret KS, Grompe M. Generation and regeneration of cells of the liver and pancreas., 2008, 322(5907): 1490– 1494.
[6] Slack JM. Developmental biology of the pancreas., 1995, 121(6): 1569–1580.
[7] Gu G, Dubauskaite J, Melton DA. Direct evidence for the pancreatic lineage: NGN3+ cells are islet progenitors and are distinct from duct progenitors., 2002, 129(10): 2447–2457.
[8] Wang YF, Lanzoni G, Carpino G, Cui CB, Dominguez- Bendala J, Wauthier E, Cardinale V, Oikawa T, Pileggi A, Gerber D, Furth ME, Alvaro D, Gaudio E, Inverardi L, Reid LM. Biliary tree stem cells, precursors to pancreatic committed progenitors: evidence for possible life-long pancreatic organogenesis., 2013, 31(9): 1966– 1979.
[9] Huch M, Gehart H, van Boxtel R, Hamer K, Blokzijl F, Verstegen MMA, Ellis E, van Wenum M, Fuchs SA, de Ligt J, van de Wetering M, Sasaki N, Boers SJ, Kemperman H, de Jonge J, Ijzermans JN, Nieuwenhuis EE, Hoekstra R, Strom S, Vries RR, van der Laan LJ, Cuppen E, Clevers H. Long-term culture of genome-stable bipotent stem cells from adult human liver., 2015, 160(1–2): 299–312.
[10] Madisen L, Zwingman TA, Sunkin SM, Oh SW, Zariwala HA, Gu H, Ng LL, Palmiter RD, Hawrylycz MJ, Jones AR, Lein ES, Zeng HK. A robust and high-throughput Cre reporting and characterization system for the whole mouse brain., 2010, 13(1): 133–140.
[11] Sohal DS, Nghiem M, Crackower MA, Witt SA, Kimball TR, Tymitz KM, Penninger JM, Molkentin JD. Temporally regulated and tissue-specific gene manipulations in the adult and embryonic heart using a tamoxifen-inducible Cre protein., 2001, 89(1): 20–25.
[12] Barker N, Huch M, Kujala P, van de Wetering M, Snippert HJ, van Es JH, Sato T, Stange DE, Begthel H, van den Born M, Danenberg E, van den Brink S, Korving J, Abo A, Peters PJ, Wright N, Poulsom R, Clevers H. Lgr5+vestem cells drive self-renewal in the stomach and build long-lived gastric units., 2010, 6(1): 25–36.
[13] Jaks V, Barker N, Kasper M, van Es JH, Snippert HJ, Clevers H, Toftgård R. Lgr5 marks cycling, yet long-lived, hair follicle stem cells., 2008, 40(11): 1291– 1299.
[14] Aguayo-Mazzucato C, Andle J, Lee TB Jr, Midha A, Talemal L, Chipashvili V, Hollister-Lock J, van Deursen J, Weir G, Bonner-Weir S. Acceleration of β cell aging determines diabetes and senolysis improves disease outcomes., 2019, 30(1): 129–142.e4.
[15] Rezanejad H, Lock JH, Sullivan BA, Bonner-Weir S. Generation of pancreatic ductal organoids and whole-mount immunostaining of intact organoids., 2019, 83(1): e82.
[16] Ho BX, Pek NMQ, Soh BS. Disease modeling using 3D organoids derived from human induced pluripotent stem cells., 2018, 19(4): 936.
[17] Pan FC, Evans T, Chen SB. Modeling endodermal organ development and diseases using human pluripotent stem cell-derived organoids., 2020, 12(8): 580–592.
[18] Muzumdar MD, Tasic B, Miyamichi K, Li L, Luo LQ. A global double-fluorescent Cre reporter mouse., 2007, 45(9): 593–605.
[19] Kretzschmar K, Watt FM. Lineage tracing., 2012, 148(1–2): 33–45
[20] Hoffman RM. Recent advances onimaging with fluorescent proteins., 2008, 85: 485– 495.
[21] Vintersten K, Monetti C, Gertsenstein M, Zhang PZ, Laszlo L, Biechele S, Nagy A. Mouse in red: red fluorescent protein expression in mouse ES cells, embryos, and adult animals., 2004, 40(4): 241–246.
[22] Megason SG, Fraser SE. Digitizing life at the level of the cell: high-performance laser-scanning microscopy and image analysis for in toto imaging of development., 2003, 120(11): 1407–1420.
[23] Okabe M, Ikawa M, Kominami K, Nakanishi T, Nishimune Y. 'Green mice' as a source of ubiquitous green cells., 1997, 407(3): 313–319.
[24] Snippert HJ, van der Flier LG, Sato T, van Es JH, van den Born M, Kroon-Veenboer C, Barker N, Klein AM, van Rheenen J, Simons BD, Clevers H. Intestinal crypt homeostasis results from neutral competition between symmetrically dividing Lgr5 stem cells., 2010, 143(1): 134–144.
[25] Laugwitz KL, Moretti A, Lam J, Gruber P, Chen YH, Woodard S, Lin LZ, Cai CL, Lu MM, Reth M, Platoshyn O, Yuan JX, Evans S, Chien KR. Postnatal isl1+cardioblasts enter fully differentiated cardiomyocyte lineages., 2005, 433(7026): 647–653.
[26] Huch M, Bonfanti P, Boj SF, Sato T, Loomans CJM, van de Wetering M, Sojoodi M, Li VSW, Schuijers J, Gracanin A, Ringnalda F, Begthel H, Hamer K, Mulder J, van Es JH, de Koning E, Vries RG, Heimberg H, Clevers H. Unlimitedexpansion of adult bi-potent pancreas progenitors through the Lgr5/R-spondin axis., 2013, 32(20): 2708–2721.
[27] Huch M, Dorrell C, Boj SF, van Es JH, Li VSW, van de Wetering M, Sato T, Hamer K, Sasaki N, Finegold MJ, Haft A, Vries RG, Grompe M, Clevers H.expansion of single Lgr5+liver stem cells induced by Wnt-driven regeneration., 2013, 494(7436): 247–250.
[28] Rodriguez UA, Socorro M, Criscimanna A, Martins CP, Mohamed N, Hu J, Prasadan K, Gittes GK, Esni F. Conversion of α-cells to β-cells in the postpartum mouse pancreas involves Lgr5 progeny., 2021, 70(7): 1508–1518.
Study on Lgr5 expression in pancreas tissues and organoids by lineage tracing
Bingru Yan1, Xianhui Ai1, Miao Liu1, Lihong Tian2, Yang Liang1, Chun-Bo Teng1
Leucine rich repeat containing G protein-coupled receptor 5(Lgr5) is widely expressed in multiple tissues and can be used as a stem cell marker in a variety of epithelial organs (including the small intestine, colon, stomach and hair follicles). In this study, we used Lgr5-CreERT2+/–and Rosa26-mTmG hybridized transgenic mice to investigate the expression of Lgr5 in both ductal epithelial cells during pancreas development andcultured pancreatic duct organoids. After induction with Tamoxifen, the Lgr5 expression was analyzed by detecting the enhanced green fluorescence protein in the pancreatic tissue sections in adult animals and embryos at different developmental stages. The results showed that Lgr5 expression was detected neither in adult pancreatic duct epithelia nor in the embryonic pancreatic tissues at day 15.5 or in newborn mice. However, when 4-hydroxy-Tamoxifen was supplemented to the culture medium, EGFP could be detected in the primary pancreatic duct organoids from Lgr5-CreERT2+/–; Rosa26-mTmG mice. These results suggested that Lgr5 was not expressed in adult and embryonic pancreatic tissues; but could be expressed in the cultured pancreas ductal organoids. The research lays the foundation for exploring specific gene expression patterns in stem/progenitor cells during pancreatic development.
pancreas; duct; Lgr5; organoid; lineage tracing
2022-01-26;
2022-03-26;
2022-04-18
国家自然科学基金面上项目(编号:32072801)资助[Supported by the National Natural Science Foundation of China (No.32072801)]
闫炳儒,在读硕士研究生,专业方向:生物学。E-mail: heylr5553@163.com
滕春波,博士,教授,研究方向:细胞生物学。E-mail: chunboteng@nefu.edu.cn
10.16288/j.yczz.22-022
(责任编委: 赵冰)