谷子SiSULTR2.1基因的生物信息学分析及其对 硒、硫的响应
2022-05-24尹美强温银元李露露高志强
石 尧,尹美强,温银元,李露露,孙 敏,高志强
(1. 山西农业大学农学院,太谷 030801;2. 黄土高原特色作物优质高效生产省部共建协同创新中心, 太谷 030801)
谷子[Setaria italica(L.)Beauv]是起源于我国北方的传统优势农作物,具有耐干旱、耐贫瘠、抗逆、适应性高等特点。小米是谷子脱壳后的产物,其营养成分与其他禾谷类粮食作物相比相当或更优[1]。硒于1817年被瑞典化学家Berzeliu发现,位于元素周期表第四周期VI主族,化学性质与同一主族的硫和碲相似[2]。其是人和动物体内所必需的微量元素,对人体有抗癌、抗氧化防衰老、增强免疫力排毒解毒等作用[3]。人体只有在饮食中摄取有机硒这一条补硒途径,食源性补硒是改善我国居民健康状况的必然手段。此外,硒在植物体中也具有非常重要的生理生化作用及功能。
硫转运蛋白是主动转运硫酸盐时需要的载体蛋白,是植物吸收运输硫的必需蛋白[4]。硒和硫同属氧族元素,SeO42-和SO42-竞争细胞膜上的硫转运蛋白[5-6]进入植物体内。在模式植物拟南芥中共克隆得到12个硫转运蛋白基因,根据基因序列相似性,其可以分为4个亚族[7]:SULTR1、SULTR2、SULTR3、SULTR4。SULTR2亚族成员为低亲和性硫转运蛋白,负责将硫酸盐或硒酸盐从根皮层转运到木质部薄壁细胞,进而运往地上部,是长距离运输的主要转运蛋白[8]。所有亚族成员共同完成植物体内硫酸盐的吸收转运工作。
硫转运蛋白对SeO42-和SO42-选择性吸收的能力与外界植物种类、转运蛋白类型及硫酸盐水平等因素有关[9]。White等[10]研究发现,高浓度SO42-会在一定程度上抑制植物对SeO42-的吸收。硫酸盐会抑制拟南芥根系对硒酸盐的吸收,二者相互竞争硫转运途径,因而高浓度硒酸盐会使植物积累大量的硒元素,从而引发毒性效应。Shibagaki等[11]研究发现,在硒酸盐胁迫下,缺乏硫转运蛋白的拟南芥突变体对硒酸盐有耐受性,表明硒酸盐能通过硫酸盐转运蛋白进入植物体内。Awazuhara等[12]研究发现,AtSULTR2.1参与控制硫酸盐的转移,并可能调节拟南芥种子的硫状态。
植物体内硒的含量与植物对硒的吸收和转运能力密切相关。本研究以拟南芥(Arabidopsis thaliana)、水稻(Oryza sativa)硫转运蛋白第二亚族基因序列为模板,在谷子基因组数据库筛选出与硫酸盐转运蛋白基因高度相似的同源序列,通过改良RNAiso Plus法[13]提取到谷子幼苗的RNA,并反转录得到谷子硫酸盐转运蛋白基因SiSULTR2.1的cDNA序列。利用生物信息学方法对基因的序列、系统发育、结构以及理化性质进行分析,利用实时荧光定量RCR(quantitative real-time PCR,qRT-PCR)技术研究基因在Na2SeO4、Na2SO4处理后不同时间的表达变化,以求为谷子SiSULTR2.1基因硒、硫转运机制的研究提供理论依据。
1 材料与方法
1.1 材料及处理
以在山西农业大学申奉试验地播种的晋谷21号谷子作为试验材料。取苗期(播种后25 d)完整无病虫害根、茎、叶部材料和灌浆期(播种后90 d)根、茎、叶、穗部材料,用液氮速冻后置于-80℃冰箱保存备用,用于SiSULTR2.1在不同组织中的表达分析。
以晋谷21号为材料,选用10.0 cm×10.0 cm×8.5 cm栽培盆,品氏泥炭土培养,每盆播种12粒完整饱满的种子,出苗后间苗到每盆9株幼苗。发芽前均以自来水浇灌,发芽后在2次Hoagland’s(霍格兰氏)营养液浇灌之间浇灌2次同体积的自来水。将其培养于宁波东南仪器有限公司的RDN-260E-3D型低温人工气候箱中,培养温度为25℃,湿度为60%/40% RH,光照强度为22000 Lx,光照时间为16 h/8 h。在三叶一心期将其分成三组,一组叶面喷施清水作为对照(130 mL/m2),一组叶面喷施12.5 μmol/L Na2SeO4,一组叶面喷施12.5 μmol/L Na2SO4,后两组喷施体积与对照组清水体积相同。分别在处理0、12、24、48、96 h后,取完整健康幼苗,液氮速冻后置于-80℃冰箱保存备用,用于SiSULTR2.1在Na2SeO4、Na2SO4处理后表达分析。
1.2 试验方法
1.2.1 总RNA提取及cDNA合成
采用改良RNAiso Plus法提取到谷子幼苗的RNA,并通过BioDrop超微量紫外分光光度计检测提取到的RNA的浓度和纯度,总RNA置于-80℃冰箱保存备用。将提取得到的谷子幼苗总RNA参照TaKaRa公司反转录试剂盒PrimeScript®RT Reagent Kit With gDNA Eraser反转录说明书,利用BIO-GENER基因扩增仪反转录合成cDNA。
1.2.2 SiSULTR2.1生物信息学分析
利用蛋白结构域数据库SMART(https://smart.embl-heidelberg.de/smart/show_motifs.pl)进行蛋白结构域分析。利用ExPASy-Protparam tool数据库(http://web.expasy.org/protparam/)进行氨基酸数目、相对分子质量、理论等电点等理化性质分析;利用ExPASy-ProtScale数据库(https://web.expasy.org/protscale/)进行蛋白质亲疏水性预测;利用蛋白质信号肽在线预测工具SignalP-5.0(https://services.healthtech.dtu.dk/service.php?SignalP-5.0)进行信号肽预测;利用TMHMM-2.0数据库(https://services.healthtech.dtu.dk/service.php? TMHMM-2.0)预测蛋白跨膜结构;利用DNAMAN软件对谷子硫酸盐转运蛋白基因的氨基酸序列进行多序列比对分析;利用MEGA7.0软件构建系统发育树;利用数据库PredictProtein(https://predictprotein.org/)预测蛋白质的二级结构;利用SWISS-MODEL数据库(https://swissmodel.expasy.org/)预测蛋白质的三级结构;利用Cell-PLoc 2.0数据库(http://www.csbio.sjtu.edu.cn/bioinf/Cell-PLoc-2/)、WoLF PSORT(https://wolfpsort.hgc.jp/)进行亚细胞定位预测。
1.2.3SiSULTR2.1表达模式分析
将1.2.1处反转录合成的cDNA稀释5倍,-20℃保存,用于后续qRT-PCR分析。使用软件Primer Premier 5.0设计引物(表1),引物由上海生工生物工程股份有限公司合成。qRT-PCR反应体系:SYBR Premix Ex Taq 5.0 μL;上、下游引物(10.0 μmol/L)各0.4 μL;ROX Reference DyeⅡ 0.2 μL;cDNA 1.0 μL;加水至总体积10.0 μL;重复3次。qRT-PCR反应程序:95℃预变性3 min;95℃变性10 s,52℃退火30 s,42个循环;从65℃以每隔5 s上升0.5℃的速度上升至95℃。以Actin为内参基因,采用2-△△Ct法分析结果。

表1 引物序列Tab. 1 Sequence of primers
1.3 数据分析
所有试验均设3次生物学重复。使用SPSS25软件进行数据处理及多重比较,采用Microsoft Excel 2010软件制表作图。
2 结果与分析
2.1 SiSULTR2.1的基因鉴定
查阅文献并在美国国立生物技术信息中心(National Center for Biotechnology Information,NCBI)搜索下载获得拟南芥AtSULTR2.1、水稻OsSULTR2.1基因序列。以获得的拟南芥、水稻硫转运蛋白基因序列为参考,在Phytozome(https://phytozome.jgi.doe.gov/pz/portal.html)和NCBI(https://www.ncbi.nlm.nih.gov/)数据库中进行Blast检索和比对,获得谷子硫转运蛋白基因序列,并将其命名为SiSULTR2.1。
2.2 SiSULTR2.1蛋白的理化性质分析
2.2.1 SiSULTR2.1蛋白的保守结构域分析
理化性质分析结果显示:SiSULTR2.1的蛋白质相对分子质量为70374.55 Da,氨基酸数目为656个;理论等电点为8.81,富含碱性氨基酸;带负电荷的残基总数(Asp+Glu)有47个,带正电荷的残基总数(Arg+Lys)有56个;SiSULTR2.1蛋白的分子式为C3195H5112N828O893S30,脂肪指数为110.61,不稳定蛋白指数为36.88,此类蛋白为稳定性蛋白;SiSULTR2.1蛋白中丙氨酸含量最高,占总氨基酸数的10.8%。
蛋白结构域分析数据库SMART显示,SiSULTR2.1蛋白具有硫转运蛋白所特有的Sulfate-transp结构域(位置:89~471)和STAS结构域(位置:522~641)(图1)。

图1 SiSULTR2.1蛋白的保守结构域Fig. 1 Conservative domains of SiSULTR2.1 protein
2.2.2 SiSULTR2.1蛋白的亲疏水性、信号肽及跨膜结构域预测
利用ExPASy-ProtScale数据库对蛋白的亲疏水性进行预测。如图2所示,SiSULTR2.1蛋白亲水性区域和疏水性区域是交叉排列的。Score>0为疏水区,Score<0为亲水区,我们可以看到Score>0区域比Score<0区域密集。由此可表明,SiSULTR2.1编码的蛋白是疏水性蛋白。蛋白信号肽预测结果显示(图3),SiSULTR2.1无信号肽位点,属于非分泌蛋白。跨膜结构域预测显示,SiSULTR2.1有9个跨膜结构域(图4),表明SiSULTR2.1蛋白属于跨膜蛋白。

图2 SiSULTR2.1蛋白的亲疏水性预测Fig. 2 Prediction of the hydrophobicity of SiSULTR2.1 protein
图3 SiSULTR2.1蛋白的信号肽预测Fig. 3 Prediction of SiSULTR2.1 protein signal peptide

图4 SiSULTR2.1蛋白跨膜结构域预测Fig. 4 Prediction of the transmembrane domain of SiSULTR2.1 protein
2.3 SiSULTR2.1蛋白的系统发育分析
利用DNAMAN软件将谷子硫转运蛋白第二亚族基因与水稻、玉米(Zea mays)、大豆(Glycine max)、拟南芥硫转运蛋白第二亚族基因进行多序列比对,发现其序列比对一致性达到71.79%。将谷子硫转运蛋白氨基酸序列与水稻、玉米、拟南芥硫转运蛋白氨基酸序列分别进行双序列比对,分析发现其与水稻、玉米同源序列相似性较高,分别为85.45%、88.91%,与拟南芥同源序列相似性不高,为55.99%。
根据4个物种的10个硫转运蛋白基因氨基酸序列,利用MEGA7.0软件构建进化树。由图5可知,谷子与玉米、水稻聚为一大类,其与玉米亲缘关系最近。谷子、玉米、水稻均为禾本科作物,亲缘关系较近;谷子和玉米均为C4作物,而水稻为C3作物,因而谷子玉米亲缘关系最近。

图5 SiSULTR2.1蛋白与其他植物SULTR2蛋白的系统进化树分析Fig. 5 Phylogenetic analysis of protein between SiSULTR2.1 and SULTR2 of other plantsZm:玉米;Os:水稻;Gm:大豆;At:拟南芥。Zm: Zea mays; Os: Oryza sativa; Gm: Glycine max; At: Arabidopsis thaliana.
2.4 SiSULTR2.1蛋白的结构分析
2.4.1 SiSULTR2.1蛋白的二级结构预测
数据库PredictProtein预测显示,谷子硫酸盐转运蛋白二级结构主要由α-螺旋、β-折叠和无规则卷曲构成。SiSULTR2.1蛋白二级结构α-螺旋、β-折叠和无规则卷曲占比分别为25.30%、8.54%、66.16%。SiSULTR2.1蛋白含有丰富的α-螺旋和无规则卷曲结构,其中α-螺旋可以形成多个跨膜结构域。
2.4.2 SiSULTR2.1蛋白的三级结构预测
利用SWISS-MODEL数据库在线构建SiSULTR2.1的三维结构模型。结果显示,SiSULTR2.1可以较明显地区分出STAS结构域和Sulfate-transp结构域(图6a)。其中STAS结构域(图6b)位于羧基末端(C端),含有核苷三磷酸(nucleotide triphosphate,NTP)结合位点[9],通过磷酸化和去磷酸化过程[19]调控SeO42-的转运活力;Sulfate-transp结构域(图6c)位于氨基末端(N端),与α-螺旋相互缠绕形成了一个通道结构,有利于硒酸盐的跨膜转运。

图6 SiSULTR2.1蛋白的三级结构及STAT结构域、Sulfate-transp结构域预测Fig. 6 Prediction of tertiary structure of SiSULTR2.1 protein, STAS domain and Sulfate-transp domain (a)SiSULTR2.1蛋白的三级结构预测;(b)STAS结构域;(c)Sulfate-transp结构域。(a) Prediction of tertiary structure of SiSULTR2.1 protein; (b) STAS domain; (c) Sulfate-transp domain.
2.4.3 SiSULTR2.1蛋白的亚细胞定位预测
利用Cell-PLoc和WoLF PSORT数据库对SiSULTR2.1进行亚细胞定位预测,结果略有不同。Cell-PLoc预测结果显示,该蛋白定位于线粒体、叶绿体的可能性不大,定位于细胞膜上的可能性较大。WoLF PSORT预测结果显示,该蛋白定位于液泡膜上。上述结果表明,SiSULTR2.1可能以一种膜结合蛋白形式参与SeO42-在细胞的跨膜转运。
2.5 SiSULTR2.1的表达模式分析
2.5.1SiSULTR2.1的组织表达特异性分析
谷子苗期根、茎、叶(图7a)和灌浆期根、茎、叶、穗(图7b)的qRT-PCR结果显示,SiSULTR2.1在谷子不同部位均有表达,且在不同时期表达量有差异,表现出时空特异性。SiSULTR2.1在苗期茎中的表达量最高,在灌浆期茎、叶片中的表达量均较高。SiSULTR2.1在不同时期根中的表达量均最低,在灌浆期穗中的表达量也较低。
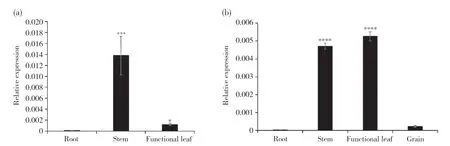
图7 SiSULTR2.1在谷子不同时期不同组织中的表达Fig. 7 Expression of SiSULTR2.1 in different tissues of millet in different periods(a)SiSULTR2.1在谷子苗期不同组织中的表达;(b)SiSULTR2.1在谷子灌浆期不同组织中的表达。差异显著性分析采用LSD法。*P<0.01;***P<0.001;****P<0.0001。(a) Expression of SiSULTR2.1 in various tissues of millet at seedling stage; (b) Expression of SiSULTR2.1 in various tissues of millet at filling stag. LSD method was used to analyze the difference significance. *P<0.01; ***P<0.001; ****P<0.0001.
2.5.2SiSULTR2.1在Na2SeO4、Na2SO4处理后的表达分析
由图8可知,SiSULTR 2.1对Na2SeO4、Na2SO4处理均有表达响应,但其对Na2SeO4和Na2SO4处理表达响应的模式不一致。Na2SeO4处理12 h时,谷子幼苗SiSULTR 2.1的相对表达量与对照组相近,但处理24、48、96 h时幼苗中的相对表达量均显著高于对照组,且96 h时表达量达到峰值,是对照组的6.75倍。Na2SO4处理12 h时,谷子幼苗SiSULTR 2.1的相对表达量达到峰值,是对照组的17.75倍,处理24、48 h时幼苗中的相对表达量均显著高于对照组,但与12 h相比表达量呈下降趋势,且96 h表达量低于对照组。

图8 SiSULTR2.1在Na2SeO4、Na2SO4处理下的表达分析Fig. 8 Expression analysis of SiSULTR2.1 under various Na2SeO4 and Na2SO4 treatment conditions(a)SiSULTR2.1在Na2SeO4处理下的表达;(b)SiSULTR2.1在Na2SO4处理下的表达。差异显著性分析采用LSD法。***P<0.001;****P<0.0001。(a) Expression of SiSULTR2.1 in Na2SeO4 treatment conditions; (b) Expression of SiSULTR2.1 in Na2SO4 treatment conditions. LSD method was used to analyze the difference significance. ***P<0.001; ****P<0.0001.
3 讨论
SiSULTR2.1编码的谷子硫转运蛋白含有硫转运蛋白所特有的STAS结构域和Sulfate-transp结构域[14],与前人在茶树(Camellia sinensis)[9]、马铃薯(SolanumtuberosumL.)[15]、短柄草[Brachypodiumdistachyon(L.)Beauv.][16]上的研究结果一致。该基因编码的蛋白质含有多个跨膜结构域,是一种跨膜转运蛋白。根据序列同源性,可将SiSULTR2.1归属于硫转运蛋白基因家族第二亚族基因,主要负责硒、硫的迁移转运[17]。SiSULTR2.1是疏水性蛋白,无信号肽序列,属非分泌蛋白,这些特征与玉米、水稻、薄壳山核桃[Carya illinoinensis(Wangenh.)K. Koch][18]的硫转运蛋白具有高度的相似性。
组织特异性表达结果揭示,SiSULTR2.1在谷子根、茎、叶、穗中均有表达,且表达模式与张晶晶等[9]在茶树上的研究结果相近,具有明显的组织特异性。SiSULTR2.1在谷子茎、叶片中的表达量较高,但在根、穗中表达量很低。SiSULTR2.1在根中表达量很低,张晶晶[19]的研究中也有类似发现。SiSULTR2.1在穗中较低的表达量与前人研究结果有差异,可能与品种的特异性有关。
本研究发现,SiSULTR2.1对硒、硫处理有不同的响应模式。Na2SeO4处理结果显示,处理后12 h内SiSULTR2.1表达变化量不大,24 h后表达量显著增加,且在处理后96 h达到最高。SiSULTR2.1在Na2SeO4处理下随着处理时间的延长,相对表达量总体呈上升趋势,倪钟涛等[18]和胡玉荣等[20]也有类似发现。Na2SO4处理结果显示,处理后12 hSi-SULTR2.1的表达就能被显著诱导,处理后24、48 h 其表达量有所下降,处理后96 h表达量恢复到原来的水平。这可能是因为硫是谷子生长发育所必须的大量元素,谷子幼苗喷施Na2SO4后,硫转运蛋白基因受SO42-诱导短时间内大量表达用以转运硫元素。由此可见,SiSULTR2.1能在短时间内迅速响应Na2SO4的诱导,而响应Na2SeO4诱导需要较长时间。Kataoka等[21]研究发现,SULTR2;1与SULTR3;5均表达于根系维管组织中,主要负责硫酸盐向地上部运输,但是二者是否同样负责硒酸盐从根部向地上部的运输还未可知。
谷子硫转运蛋白基因家族成员众多,它们均可能在吸收转运Na2SeO4或Na2SO4的某环节中有特定的作用[22]。本研究初步探讨了谷子SiSULTR2.1对硒、硫的响应,但该基因在硒、硫的吸收、转运方面具体的功能仍需进一步研究探讨。
