红光/近红外LED光疗抑制疼痛相关机制的研究
2022-05-24张涵旭郭庆霞张凤民宋武琦
易 斌,吴 昊,张涵旭,郭庆霞,何 军,宋 楠,张凤民,宋武琦*
(1. 北京创盈光电医疗科技有限公司,北京 1001762; 2. 哈尔滨医科大学,人体自身免疫疾病诊疗技术国家地方联合工程研究中心,哈尔滨 150081)
慢性疼痛包括多种类型,其中非特异性颈肩腰痛是指既找不到确切的组织结构、病理改变,又无法明确病因的颈肩腰背部疼痛,主要原因可能包括肌肉的劳损、肌筋膜炎、椎小关节紊乱等[1]。常在较长时间固定姿势,如低头伏案工作、受凉、异常活动或异常受力后发生,表现为局部酸胀、钝痛或刺痛,以及无力或发沉感,如未得到及时合适的治疗或反复发作,易导致疼痛慢性化,并发牵涉痛以及颈、肩、腰背等部位功能障碍,严重影响工作效率和生活质量[2]。
目前,非特异性颈肩腰痛主要采取综合康复治疗,例如:手法按摩可以选择性地进行软组织松解术或关节松动术,以及深部肌肉刺激治疗缓解筋膜炎和肌肉劳损[3];口服或者外用非甾体抗炎药物治疗,并在医师指导下进行运动康复治疗等;超短波疗法、激光、中频电疗等物理治疗也广泛用于临床和社区[4-7]。
在炎症相关慢性疼痛患者和动物模型中,局部组织和神经系统中的炎症因子以表达升高为主,使用药物或者其他辅助治疗方法抑制炎症因子或者进行镇痛处理之后,炎症因子的表达水平下降,且与患者或者动物模型中疼痛评分呈正相关[8-9]。本研究在前期研究的基础上选取疼痛相关趋化因子和炎症因子为指标,以正常人外周血单核细胞(peripheral blood mononuclear cell,PBMC)和人单核细胞THP-1为研究模型开展体外细胞学试验,以明确630 nm红光和850 nm近红外LED光疗的作用机制。
1 材料与方法
1.1 试验对象
本研究经哈尔滨医科大学伦理委员会批准,取20~24岁健康男性志愿者的外周血,使用人淋巴细胞分离液提取PBMC进行后续光照处理和细胞因子检测。人单核细胞THP-1购自中国科学院细胞库。
1.2 仪器设备
发光二极管(light-emitting diode,LED)阵列式光源为北京创盈光电医疗科技有限公司制造(CY-1004C),光源红光波长为630 nm、近红外波长为850 nm。两种波长的光同时照射,平均光功率密度为25 mW/cm2,其中630 nm和850 nm光的光功率密度比例为10∶1。
1.3 试剂
荧光定量PCR引物由黑龙江省博仕生物公司合成,具体序列见表1。逆转录试剂使用赛默飞世尔科技(中国)有限公司(Invitrogen)的SuperScript III Kit;荧光定量PCR试剂使用宝生物工程(大连)有限公司(TaKaRa)的2×SYBR Premix Ex Taq;RNA提取试剂盒购自哈尔滨新海基因检测有限公司;人淋巴细胞分离液购自天津市灏洋生物制品科技有限责任公司。具体操作参见试剂盒说明书。

表1 相关引物序列Tab. 1 Sequence of the primers
1.4 试验分组
单核细胞THP-1用于评价光照剂量对细胞的安全性。22.5 J/cm2功率密度下分别照射3次和5次,最后一次光照结束后,细胞立即与细胞计数试剂盒(cell counting kit-8,CCK-8)溶液孵育,37℃孵育2 h后,用酶标仪检测450 nm 波长处的吸光度。通过CCK-8试验检测细胞活性,并与对照组进行对比。将每位志愿者的PBMC分为对照组和LED组,共4例,LED组的细胞接受22.5 J/cm2的固定剂量照射5次,间隔90 min,对照组采用相同操作,但是不进行LED光疗处理。最后一次照射30 min后,提取细胞总RNA,并进行荧光定量PCR检测。
1.5 统计方法
所有数据用平均数±标准差(x±s)表示,采用Shapiro-Wilk检验进行正态性检验。所有试验中差异的统计学意义均采用未配对t检验。每个分析的显著性水平设为0.05。使用GraphPad Prism(5.0版)统计程序对数据进行统计分析。
2 结果与分析
2.1 红光/近红外LED光疗对单核细胞活性的影响分析
为了评价红光/近红外LED光疗对单核细胞活性的影响,常规培养THP-1细胞,接种铺板24 h后选择两种方式进行LED照射:照射3次,每次15 min(22.5 mW/cm2),间隔180 min;照射5次,每次15 min(22.5 mW/cm2),间隔90 min。然后使用CCK-8法检测THP-1的细胞活性。图1结果显示,上述剂量下LED光疗对于单核细胞的活性没有影响。因此,本文选择对PBMC照射5次LED进行后续研究,其照射方式与上述THP-1细胞照射5次的方式相同。

图1 LED光疗后对单核细胞活性的影响Fig. 1 Effect of LED phototherapy on monocyte activity与对照组(NC)比较,固定剂量22.5 J/cm2照射3次和5次对THP-1细胞活性没有明显影响。ns:P>0.05。Fixed dose 22.5 J/cm2 irradiation for 3 and 5 times had no significant effect on the activity of THP-1, compared with the control group (NC). ns: P>0.05.
2.2 红光/近红外LED光疗对PBMC主要疼痛相关趋化因子表达的影响
将PBMC接种在24孔板后常规培养,6 h开始照射第一次,一共照射5次,每次间隔时间为90 min,照射时间为15 min,照射剂量为22.5 J/cm2。末次照射30 min后,收取细胞并提取总RNA。荧光定量PCR检测趋化因子mRNA的表达水平,发现PBMC中CXCL12、CXCL13和CX3CL1的基因转录水平显著下调,CXCR1和CXCR2基因转录未见显著变化(图2)。

图2 LED光疗后PBMC主要疼痛相关趋化因子及受体表达情况Fig. 2 Expression of main pain related chemokines and receptors in PBMC after LED phototherapy(a)红光/近红外LED光疗流程;(b)在PBMC中CXCL12 mRNA的表达情况;(c)在PBMC中CXCL13 mRNA的表达情况;(d)在PBMC中CXCL10 mRNA的表达情况;(e)在PBMC中CX3CL1 mRNA的表达情况;(f)在PBMC中CXCR1 mRNA的表达情况;(g)在PBMC中CXCR2 mRNA的表达情况。光照剂量为22.5 J/cm2,照射5次。ns:P>0.05,*P<0.05。(a) Red/near infrared LED phototherapy process; (b) CXCL12 mRNA expression in PBMC; (c) CXCL13 mRNA expression in PBMC; (d) CXCL10 mRNA expression in PBMC; (e) CX3CL1 mRNA expression in PBMC; (f) CXCR1 mRNA expression in PBMC; (g) CXCR2 mRNA expression in PBMC. The illumination dose was 22.5 J/cm2, 5 times. ns: P>0.05, *P<0.05.
在上述相同处理条件下,PBMC中CCL4基因转录水平显著下调,CCL1基因表达水平没有明显变化,但CCR2基因转录显著下调(图3)。

图3 LED光疗后PBMC主要疼痛相关趋化因子及受体表达情况Fig. 3 Expression of main pain related chemokines and receptors in PBMC after LED phototherapy(a)在PBMC中CCL4 mRNA的表达情况;(b)在PBMC中CCL1 mRNA的表达情况;(c)在PBMC中CCL2 mRNA的表达情况;(d)在PBMC中CCL3 mRNA的表达情况;(e)在PBMC中CCR2 mRNA的表达情况;(f)在PBMC中CCR4 mRNA的表达情况。光照剂量为22.5 J/cm2,照射5次。ns:P>0.05,*P<0.05,**P<0.01。(a) CCL4 mRNA expression in PBMC; (b) CCL1 mRNA expression in PBMC; (c) CCL2 mRNA expression in PBMC; (d) CCL3 mRNA expression in PBMC; (e) CCR2 mRNA expression in PBMC; (f) CCR4 mRNA expression in PBMC. The illumination dose was 22.5 J/cm2, 5 times. ns: P>0.05, *P<0.05, **P<0.01.
2.3 红光/近红外LED光疗对PBMC主要疼痛相关炎症因子表达的影响
在上述相同处理条件下,经LED光疗之后参与疼痛诱导的IL-4和IL-6基因表达显著下调,IL-1β和IL-8基因的表达没有明显变化(图4)。
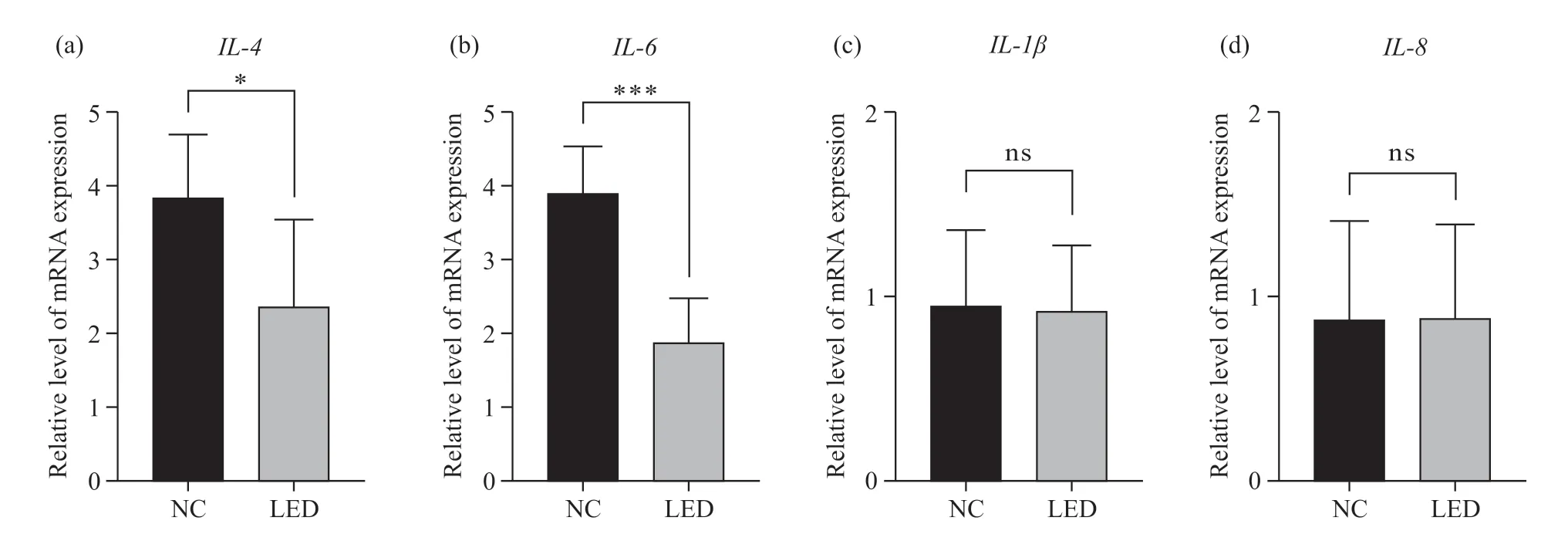
图4 LED光疗后PBMC主要疼痛相关炎症因子表达情况Fig. 4 Expression of main pain related inflammatory factors in PBMC after LED phototherapy(a)在PBMC中IL-4 mRNA的表达情况;(b)在PBMC中IL-6 mRNA的表达情况;(c)在PBMC中IL-1β mRNA的表达情况;(d)在PBMC中IL-8 mRNA的表达情况。光照剂量为22.5 J/cm2,照射5次。ns:P>0.05,*P<0.05,***P<0.001。(a) IL-4 mRNA expression in PBMC; (b) IL-6 mRNA expression in PBMC; (c) IL-1β mRNA expression in PBMC; (d) IL-8 mRNA expression in PBMC. The illumination dose was 22.5 J/cm2, 5 times. ns: P>0.05, *P<0.05, ***P<0.001.
2.4 红光/近红外LED光疗对PBMC主要疼痛相关金属蛋白酶表达的影响
在上述相同处理条件下,参与疼痛诱导的基质金属蛋白酶2(matrix metalloproteinase 2,MMP2)的基因经LED光疗之后其表达显著下调,但MMP9和PTGR3基因表达没有明显变化(图5)。

图5 LED光疗后PBMC主要疼痛相关金属蛋白酶的表达情况Fig. 5 Expression of major pain related metalloproteinases in PBMC after LED phototherapy (a)在PBMC中MMP2 mRNA的表达情况;(b)在PBMC中MMP9 mRNA的表达情况;(c)在PBMC中PTGR3 mRNA的表达情况。光照剂量为22.5 J/cm2,照射5次。ns:P>0.05, **P<0.01。(a) MMP2 mRNA expression in PBMC; (b) MMP9 mRNA expression in PBMC; (c) PTGR3 mRNA expression in PBMC. The illumination dose was 22.5 J/cm2, 5 times. ns: P>0.05, **P<0.01.
2.5 红光/近红外LED光疗调控疼痛作用机制
本试验结果表明,红光/近红外LED光疗可以有效降低PBMC中炎症因子和趋化因子的表达水平,可通过炎症因子和趋化因子对于神经疼痛敏感性的调节作用发挥镇痛功能(图6)。
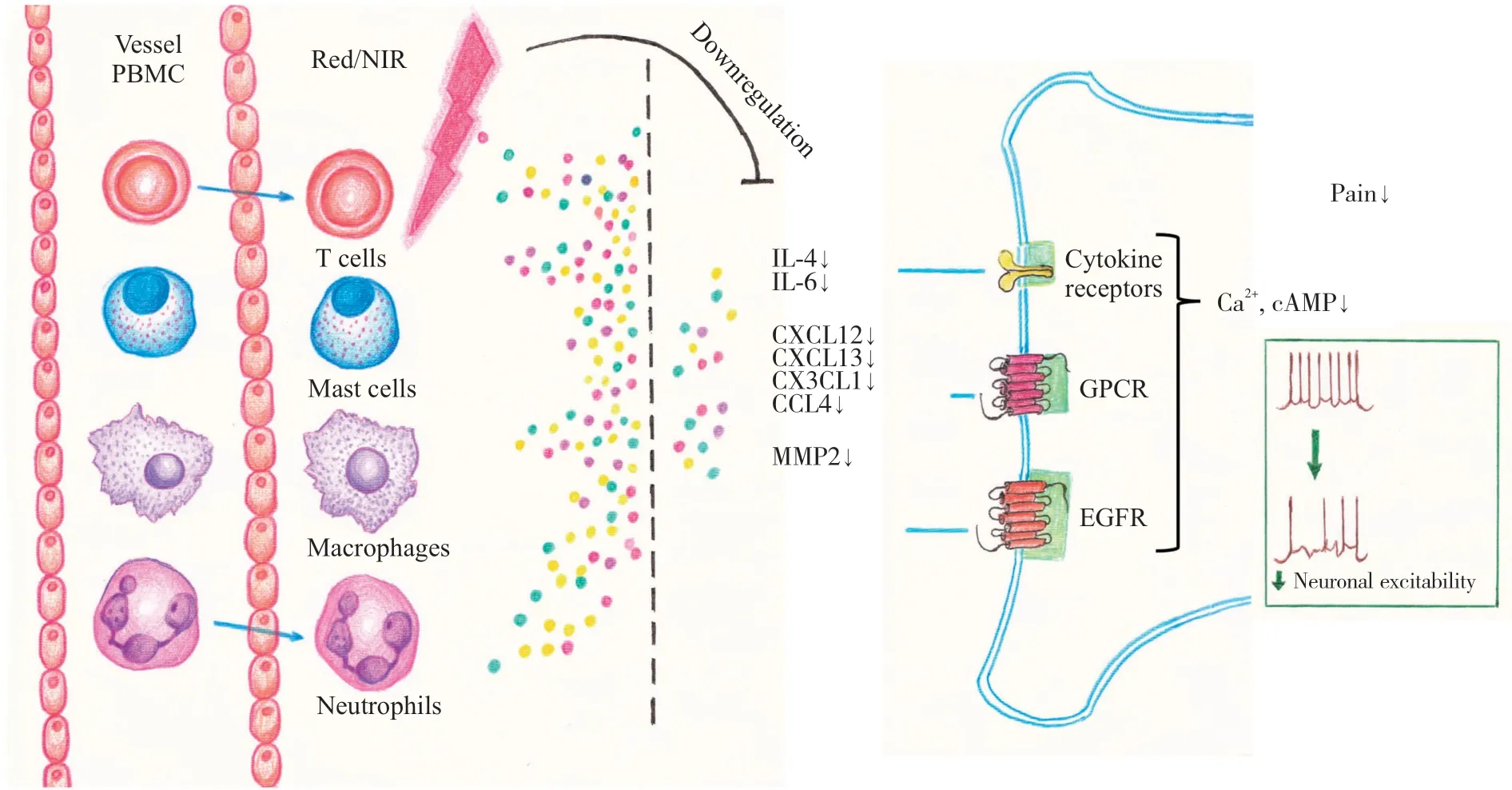
图6 红光/近红外LED光疗调控疼痛作用机制Fig. 6 Mechanism of pain modulation by red/near infrared LED phototherapyGPCR:G蛋白偶联受体;EGFR:表皮生长因子受体。GPCR: G protein-coupled receptors; EGFR: Epidermal growth factor receptor.
3 讨论
光生物调节(photobiomodulation,PBM)是细胞吸收可见光和近红外光谱范围内的非电离光辐射,从而引发光物理和光化学过程的机制。光生物调节疗法(photobiomodulation therapy,PBMT)是基于PBM原理的光子照射疗法,可使用在可见和近红外光谱中来自光源的非电离形式的光(包括激光、发光二极管和宽带光)来引起生理变化和治疗效果[10]。红光和近红外光由于具有良好的组织穿透性,已广泛地应用于临床物理治疗。
目前认为,通过超短波、超声等理疗可以加速炎症部位的血液循环,加快渗出液的吸收,从而达到消炎、镇痛的目的。近年来LED光电设备作为低功率激光的替代品,越来越多地被应用于医学实践。大量研究表明,红光和近红外波段内的LED光源具有抗炎、组织修复等生物学功能[11-13]。临床应用也发现,其对局部组织的消炎镇痛具有良好的效果,但其镇痛的分子机制目前还不是十分清楚。
疼痛本身可作为机体受到伤害时的一种警告,引发机体做出一系列防御性保护反应。由炎症引起的慢性疼痛往往给患者带来了难以忍受的折磨,并严重影响患者的生活质量。本研究通过红光(630 nm)/近红外(850 nm)LED光源对正常人PBMC进行照射,通过荧光定量PCR方法检测疼痛相关细胞因子的表达,分析红光/近红外光对慢性疼痛的抑制作用机制。
本研究采用PBMC作为研究对象。它是血流中趋化因子和炎症因子的主要来源,可用来模拟正常使用条件下光疗照射部位血液和组织液中相关因子的表达水平;慢性炎症局部单核细胞释放的细胞因子可有效调控炎症在组织局部引发疼痛。组织和神经来源的各种细胞因子对光照的反应还需要进一步进行深入研究。
趋化因子在机体发生炎症、损伤及病原体入侵时,其表达含量增高,并向受损部位募集免疫细胞,使机体产生免疫应答。大量研究表明,趋化因子可通过外周和中枢敏化的双重机制参与慢性疼痛[14]。CXCL12是一种肝素结合趋化因子,CXCL12/CXCR4在神经性疼痛的发病机制中是充分和必要的。阻断CXCL12/CXCR4信号通路可能有助于缓解过敏性接触性皮炎的瘙痒和疼痛感[15]。急性鞘内给药CXCL12可直接诱导触发大鼠机械过敏[16]。鞘内注射CXCL12中和抗体或CXCR4拮抗剂AMD3100可延迟机械异常疼痛的发生,并逆转PSNL或SNI诱导的机械异常疼痛[17]。在疼痛大鼠模型中,CXCL13表达显著上调,激活p38/ERK/AKT通路,从而对抗吗啡的镇痛作用[18]。CX3CL1与MMP9上调共同参与了坐骨神经慢性收缩损伤(chronic constriction injury,CCI)、大鼠机械异常痛和热痛觉过敏的过程[19]。CX3CL1和CCL2的表达分别与下肢疼痛和腰痛的视觉模拟评分法(visual analogue scale,VAS)的评分呈正相关[20]。
CCL4与CCR1和CCR5结合,在部分坐骨神经结扎后,受损坐骨神经的巨噬细胞和雪旺细胞中的CCL3、CCL4、CCR1和CCR5显著上调[21]。鞘内注射CCR2/CCR5拮抗剂可以减轻大鼠慢性结扎损伤模型的神经性疼痛,镇痛药物的使用也可以显著下调CCL4的表达[22]。
本研究发现,给与红光/近红外光照处理后,PBMC中IL-4和IL-6的表达水平显著下降,这一作用可以缓解局部无菌性炎症引发的疼痛。项目组前期的研究也发现,630 nm 红光LED照射可以抑制滑膜细胞和巨噬细胞的炎症反应[11-12]。本研究采用正常人PBMC作为细胞模型,通过光照处理后,趋化因子和炎症因子表达都有显著下降。虽然是体外试验,但可以部分地说明,红光/近红外光照处理可以有效抑制疼痛相关细胞因子表达,进而影响疼痛过程。
活化的星形胶质细胞释放MMP2和MMP9诱导中枢敏感化并维持神经性疼痛。通过药物下调MMP2和MMP9的表达可以上调结扎损伤模型鼠的疼痛阈值[23]。本研究发现,光照后PBMC中MMP2的表达水平显著下降,提示其可能参与了抑制疼痛的过程。
综上所述,炎症因子和趋化因子对于神经疼痛的敏感性有调节作用,通过调控其表达可发挥镇痛作用。本研究证明了红光(630 nm)/近红外(850 nm)LED光疗可抑制PBMC中炎症因子和趋化因子的表达,进而缓解疼痛。这一发现有望成为新的疼痛辅助治疗手段。
