肿瘤抗原肽M1-10的抑瘤活性研究
2022-05-24黄文强卜会铜裴超柱黄明敏谭拥军
黄文强,卜会铜,裴超柱,黄明敏,谭拥军
(湖南大学生物学院,长沙 410082)
全球疾病负担研究显示,大多数国家的恶性肿瘤发病率呈上升趋势[1-2],目前其主要的治疗方式为化疗和放疗[3]。近年来,恶性肿瘤免疫治疗这一新型治疗方式备受关注[4]。肿瘤细胞通常特异性高表达一些蛋白或表达一些突变蛋白,这些蛋白质可在胞内降解成8至11个氨基酸组成的寡肽,通过人类白细胞抗原(human leukocyte antigen,HLA)呈递到癌细胞表面,引发T细胞响应而杀死细胞。这些寡肽被称为肿瘤抗原。开发新的肿瘤抗原是提高肿瘤免疫治疗水平的重要手段之一。目前,基于肿瘤抗原的肿瘤多肽疫苗已在多种恶性肿瘤中显示出良好的抑瘤效果[5-6],且与其他相关抗原[7]或免疫检查点抑制剂共同使用时产生的治疗效果更好[8-9]。
FOXM1是FOX转录因子家族的成员[10],在许多恶性肿瘤如卵巢癌、乳腺癌、宫颈癌等中呈高表达,而在正常组织中不表达或低表达[11-14],预示在多种恶性肿瘤中,FOXM1可能是肿瘤抗原的来源蛋白。目前针对FOXM1作为肿瘤药物靶点的研究主要集中在对其转录活性功能进行抑制,从而阻遏细胞生长和诱导细胞凋亡[15],而以FOXM1蛋白为对象开发抗肿瘤疫苗才刚刚起步。已有研究发现,FOXM1蛋白的特定肽段可以诱导机体产生HLA-A2限制性的细胞毒性T细胞响应;对宫颈癌患者进行临床I期研究,将FOXM1(262~270)肽段与VEGFR1[12]、VEGFR2[12]、MELK[16]、HJURP[17]来源的四种抗原肽段联合接种,引发T细胞响应且未发现剂量毒性,患者临床反应良好,初步显示其具有抗肿瘤疗效。因此,以FOXM1蛋白为对象筛选肿瘤抗原并开发抗肿瘤疫苗,是肿瘤免疫治疗研发的有效策略。
本课题组围绕FOXM1与恶性肿瘤开展了分子机制研究和生物药物开发[18]。在此基础上,我们筛选得到FOXM1肽段(719~728)作为肿瘤抗原肽,命名为M1-10。通过细胞试验和两种小鼠乳腺癌模型开展了M1-10的免疫原性和抑瘤活性分析,证实了该肽的抑瘤效果,获得了一种新的肿瘤抗原肽。
1 材料与方法
1.1 主要材料与仪器
二氯树脂、氨基酸购于希施生物科技有限公司;二甲基甲酰胺(N,N-Dimethylformamide,DMF)、哌啶(Piperidine,PIP)、N,N-二异丙基乙胺(N,N-Diisopropylethylamine,DIEA)、O-苯并三氮唑-四甲基脲六氟磷酸酯(O-Benzotriazole-N,N,N',N'-tetramethyl-uronium-hexafluorophosphate,HBTU)、二氯甲烷(dichloromethane,DCM)、三氟乙酸(trifluoroacetic acid,TFA)、乙二硫醇(ethanedithiol,EDT)、三异丙基硅烷(triisopropylsilane,TIS)、无水乙醚、乙腈(色谱级)、无水乙醇、甲醇、异丙醇、吡啶等购于国药集团化学试剂有限公司,不完全弗氏佐剂购自上海生工生物工程有限公司;Dulbecco改良Eagle培养基(Dulbecco’s modified Eagle medium,DMEM)、RP1640培养基以及胎牛血清(fetal bovine serum,FBS)购于GIBCO公司;乳腺癌4T1细胞购自美国模式培养物集存库(American type culture collection,ATCC);细胞计数试剂盒-8(cell counting kit-8,CCK-8)、乳酸脱氢酶细胞毒性检测试剂盒以及Mouse IFN-γ ELISA试剂盒购自碧云天生物技术公司;小鼠淋巴细胞分离液、200目尼龙网购自达科为公司;BALB/c小鼠购自湖南斯莱克景达实验动物有限公司,MMTVPyMT基因型小鼠购自邦耀生物公司。
多肽合成仪购买于希施生物科技有限公司;高效液相色谱仪购买于广州睿栢仪器科技有限公司;AKTA蛋白纯化仪购买于通用电器公司(General Electric Company,GE);CO2细胞培养箱购买于美国Thermo公司;倒置荧光显微镜购买于日本Nikon公司;微孔板检测仪(酶标仪)购买于上海美谷分子仪器有限公司。
1.2 方法
1.2.1 抗原肽的筛选
使用抗原表位预测软件NetMHCpan和IEDB对FOXM1的C端相关肽段进行预测。筛选出与HLA-A2分子结合等级最高的抗原肽,通过分子模拟软件Chimera 1.15绘制出抗原肽的分子结构。从PDB数据库(https://www.rcsb.org/)中查找HLA-A2所对应的PDB文件并下载。通过三维分子模拟软件PyMOL将筛选出的抗原肽摆放至HLA-A2分子结合口袋附近,并保存为PDB文件。通过分子对接软件FlexPepDock预测出最优的结合模型,再通过数据处理工具Rosetta计算出两者结合的重要参数。
1.2.2 抗原肽的合成、纯化及鉴定
使用固相多肽合成仪分别合成M1-10、HJURP、MELK、VEGFR1、VEGFR2五种抗原肽,将合成的抗原肽粗品在蛋白纯化仪上使用C18柱反向层析进行纯化。对纯化出的多肽进行质谱鉴定,再用高效液相色谱仪进行纯度检测,通过出峰面积百分比得出多肽质量浓度。
各抗原肽的序列信息如下。M1-10:ILLDISFPGL;MELK-87-7N:EYCPGGNLF;HJURP-408:KWLISPVKI;VEGFR1-1084:SYGVLLWEI;VEGFR2-169:RFVPDGNRI。
1.2.3 抗原肽对预免疫后小鼠淋巴细胞的增殖、 干扰素γ释放以及杀伤作用的影响
将年龄为5周左右的BALB/c健康小鼠(Mus musculus)随机分成4组,分别注射PBS、M1-10、4种抗原肽(HJURP、MELK、VEGFR1、VEGFR2)、5种抗原肽(M1-10、HJURP、MELK、VEGFR1、VEGFR2),以上4组均与不完全弗氏佐剂混合注射,进行预免疫试验。每周免疫1次,共3次。每种抗原肽的剂量为100 μg,注射方式为皮下注射。待预免疫结束后,将小鼠断颈处死。在无菌的条件下取出小鼠的脾脏,分离出脾脏内的淋巴细胞,使用含10% FBS的RP1640培养基进行培养。
采用CCK-8法测定抗原肽对小鼠淋巴细胞增殖的影响。将上述分离的4组淋巴细胞分别接种到96孔板中,每孔3×105个细胞,之后使用对应的4组抗原肽组合进行刺激。每种刺激物的质量浓度为100 μg/mL,置于37℃,5% CO2的培养箱中培养24 h。待培养时间结束,各孔加入10 μL CCK-8检测试剂,放入培养箱中继续培养4 h,之后使用酶标仪在450 nm处测定各孔的吸光值。
使用酶联免疫吸附法测定抗原肽对小鼠淋巴细胞释放干扰素γ的影响。将上述分离的4组淋巴细胞以每孔1.5×105个细胞分别接种到96孔板中,之后分别使用对应的4组抗原肽组合进行刺激。每种刺激物的质量浓度为100 μg/mL,置于37℃、5% CO2的培养箱中培养24 h。待培养结束,将各孔的培养液分别转移到1.5 mL的离心管中,500×g离心,吸取上清,保存备用。使用Mouse IFN-γ ELISA试剂盒测定上述收集的上清中淋巴细胞释放IFN-γ的量,按照试剂盒的说明书中详细的操作步骤进行操作。
使用乳酸脱氢酶法(lactate dehydrogenase,LDH)测定淋巴细胞的细胞杀伤作用。在正常情况下,细胞中的乳酸脱氢酶不会释放到胞外,而当细胞受损或死亡时,其会在胞外富集,此时该酶的含量就与细胞的死亡数成正比。该试验采用的靶细胞为小鼠乳腺癌4T1细胞,效应细胞为上述分离得到的淋巴细胞。将靶细胞以每孔1×104个细胞接种到96孔板中,待细胞贴壁后,再分别加入上述分离的4组淋巴细胞,以靶效比(target effect ratio,T∶E ratio)为1∶25和1∶50进行混合,同时设置靶细胞自然释放孔、淋巴细胞自然释放孔以及靶细胞最大释放孔作为对照。将上述96孔板放入37℃、5% CO2的培养箱中培养24 h。培养结束时,按照乳酸脱氢酶试剂盒中步骤进行操作,最后使用酶标仪在490 nm处测定各孔的吸光值,计算杀伤率。
1.2.4 抗原肽在两种动物模型上的抑瘤效果
待健康状况良好的BALB/c小鼠年龄达到5周左右时,分别注射PBS、M1-10、4种抗原肽(HJURP、MELK、VEGFR1、VEGFR2)、5种抗原肽(M1-10、HJURP、MELK、VEGFR1、VEGFR2),以上4组均与不完全弗氏佐剂混合注射,进行预免疫试验,每周免疫1次,共3次。每种抗原肽的剂量为100 μg,注射方式为皮下注射。待3次免疫结束,间隔1周后,对免疫后的小鼠皮下接种5×105个4T1乳腺癌细胞,建立移植瘤模型,等肿瘤长到可测量的大小时测量小鼠的体重和肿瘤大小。
待健康状况良好的MMTV-PyMT原发乳腺癌雌性小鼠2周大时,取其尾尖裂解进行基因型鉴定。其中正向引物为GGAAGCAAGTACTTCACAAGGG,反向引物为 GGAAAGTCACTAGGAGCAGGG。反应体系:正向引物和反向引物各1 μL,模板2 μL,金牌mix酶16 μL。PCR反应条件:98℃预变性5 min;98℃变性15 s;58℃退火20 s;72℃延伸10 s,共32个循环;最后72℃再延伸5 min。PCR反应结束后,将PCR产物进行1%的琼脂糖凝胶电泳分离,观察目的条带。目的条带大约为500 bp,即鉴定为阳性。
取鉴定为阳性的MMTV-PyMT原发乳腺癌雌性小鼠,待其生长到5周左右开始进行预免疫试验,免疫方案和之前的一样。免疫结束后,定期观察小鼠乳腺部位肿瘤生长的情况,期间做好小鼠体重变化和肿瘤体积变化的记录。
1.3 数据统计与分析
所有试验结果均采用Prism软件进行统计分析。计量资料使用平均值±标准差(±s)表示。试验得到的数据通过Two-way ANOVA或t检验计算得到P值,其统计学显著差异用星号*表示,其中*P≤0.05,**P≤0.01,***P≤0.001。P<0.05则认为具有统计学差异。
2 结果与分析
2.1 抗原肽M1-10的预测及分析
已有研究发现[19],来源于FOXM1蛋白的FOXM1(709~728)肽段能够显著抑制肿瘤的生长。于是我们使用该肽段进行了抗原表位预测分析,共得到21种肽段,其中只有5种肽段能够与HLA-A2分子结合。通过比较这5种肽段与HLA-A2的结合分数,发现肽段FOXM1(719~728),即M1-10(ILLDISFPGL)与HLA-A2分子结合分数最高(图1a),结合等级也最强(图1b,分数小于0.5为强结合)。通过分子模拟软件Chimera 1.15绘制出HLA-A2分子和抗原肽的分子结构,之后通过分子对接软件和数据处理工具Rosetta分析M1-10与HLA-A2分子的对接情况(图1c)以及相关的结合参数。此外,本文对应用于临床I期研究的FOXM1(262~270)也进行了上述的对接分析(图1d),通过比较M1-10、FOXM1(262~270)与HLA-A2结合的相关参数,发现M1-10与HLA-A2分子的结合更强(表1)。
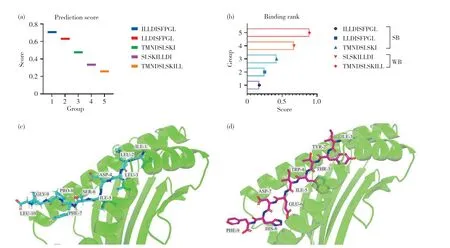
图1 抗原肽M1-10的预测与分析Fig. 1 Prediction and analysis of antigenic peptides M1-10(a)抗原肽M1-10的预测分数;(b)抗原肽M1-10与HLA-A2的结合等级;(c)抗原肽M1-10与HLA-A2的结合情况;(d)抗原肽FOXM1(262~270)与HLA-A2的结合情况。SB:强结合;WB:弱结合。(a) The predicted score of antigenic peptide M1-10; (b) The binding grade of antigenic peptide M1-10 to HLA-A2; (c) The binding of antigenic peptide M1-10 to HLA-A2; (d) Antigenic peptide FOXM1 (262~270) binding to HLA-A2. SB: Strong binder; WB: Weak binder.

表1 对接结合的重要参数Tab. 1 Important parameters of docking and combination
2.2 抗原肽的合成与鉴定
为了检测多肽是否合成成功,我们对所合成的抗原肽进行了质谱分析以及纯度检测(图2),结果显示,M1-10、HJURP、MELK、VEGFR1、VEGFR2分别在1086、1084、998、1080、1074处有明显峰图。这与各个抗原肽的相对分子质量一致,说明合成成功,并且使用高效液相色谱对合成的抗原肽进行纯度检测,发现五种抗原肽的质量浓度均在90%以上。
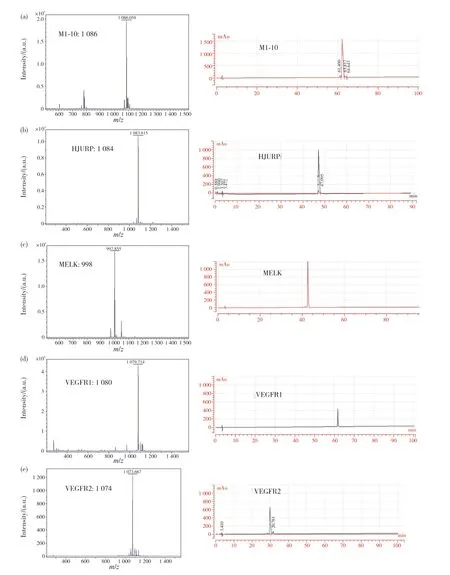
图2 抗原肽的鉴定及纯度检测Fig. 2 Identification and purity detection of antigen peptides(a)M1-10;(b)HJURP;(c)MELK;(d)VEGFR1;(e)VEGFR2。(a) M1-10; (b) HJURP; (c) MELK; (d) VEGFR1; (e) VEGFR2.
2.3 抗原肽M1-10可在小鼠体内诱导有效的免疫记忆
已有研究证实,致敏后的淋巴细胞再次受到同种抗原肽刺激时会发生增殖、分泌细胞因子干扰素γ以及分化为细胞毒性T细胞,从而对靶细胞进行杀伤。因此,为了分析抗原肽M1-10是否能在小鼠体内诱导免疫记忆,我们通过CCK-8试剂盒、Mouse IFN-γ ELISA试剂盒以及乳酸脱氢酶细胞毒性检测试剂盒,使用各组对应的抗原肽组合,依次对预免疫后小鼠淋巴细胞的增殖情况、干扰素γ的释放情况以及淋巴细胞的杀伤作用进行了测定。结果发现,单独使用抗原肽M1-10能显著促进淋巴细胞的增殖,也可促进淋巴细胞释放细胞因子干扰素γ,当M1-10与其他4种抗原肽联用时,其展现的效果更加明显(图3a、3b);此外,抗原肽M1-10也能促进淋巴细胞分化为细胞毒性杀伤T细胞,并对4T1细胞进行杀伤(图3c)。细胞杀伤试验显示,当靶效比为1∶25时,各组的杀伤作用不太明显,但当靶效比为1∶50时,M1-10与其他4种抗原肽联用时的杀伤率达到了30%,并且杀伤率可随着效应细胞的增多而上升。这些结果表明,使用抗原肽M1-10对小鼠进行预免疫,可在小鼠体内形成有效的免疫记忆。
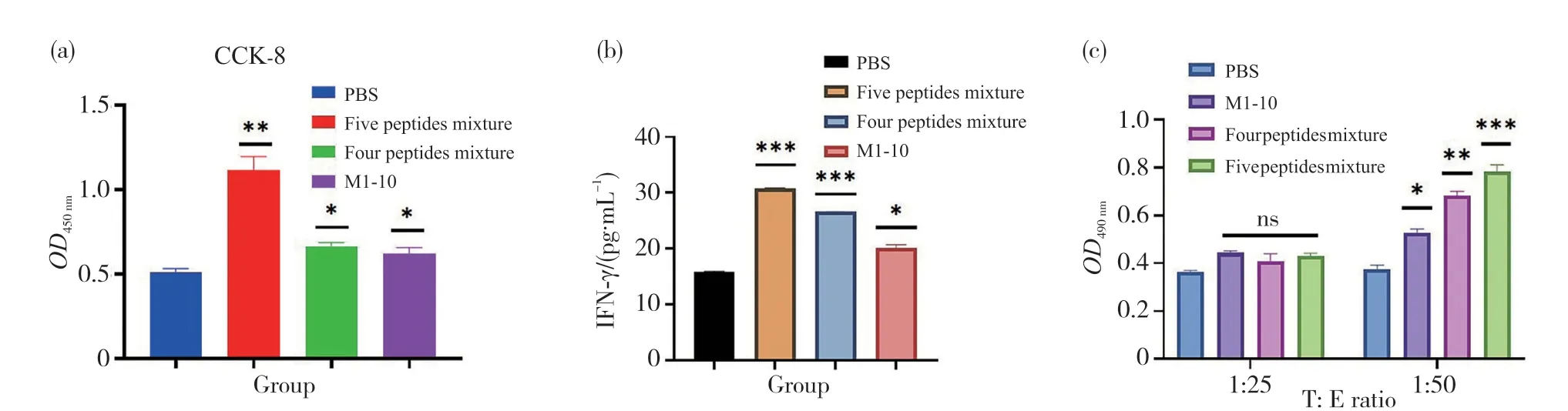
图3 抗原肽可促进淋巴细胞增殖、释放干扰素γ以及细胞杀伤作用Fig. 3 Antigenic peptides can promote lymphocyte proliferation, release interferon gamma, and cell killing (a)淋巴细胞增殖;(b)淋巴细胞释放干扰素γ;(c)淋巴细胞的杀伤作用。(a) Proliferation of lymphocytes; (b) Interferon gamma release by lymphocytes; (c) Killing effects of lymphocytes.
2.4 抗原肽M1-10预免疫可明显抑制BALB/c荷瘤小鼠肿瘤的生长
试验分为4组,每组分别使用PBS、M1-10、4种抗原肽(HJURP、MELK、VEGFR1、VEGFR2)、5种抗原肽(M1-10、HJURP、MELK、VEGFR1、VEGFR2),均与不完全弗氏佐剂混合注射,对5周大的BALB/c小鼠进行预免疫试验,每周免疫1次,共3次。每种抗原肽的剂量为100 μg,注射方式为皮下注射。待3次免疫结束,间隔1周后,进行皮下植瘤(图4a),观察小鼠体重和肿瘤体积的变化。试验过程中,抗原肽无明显毒性(图4b),各试验组肿瘤体积均小于PBS对照组(图4c)。试验终止时,收集各组皮下瘤观察大小(图4d)并称重(图4e)。以上结果表明,M1-10抗原肽预免疫能有效抑制肿瘤生长,呈现出良好的抑瘤效果,5种抗原肽联用时进一步提升了肿瘤的免疫效应。
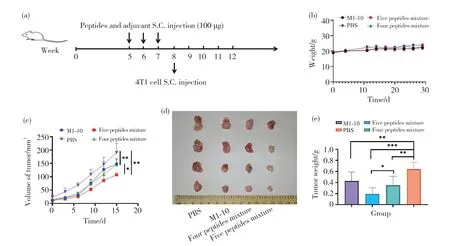
图4 抗原肽预免疫在BALB/c荷瘤小鼠模型中抑瘤效果的验证Fig. 4 Validation of antitumor effects of antigen peptide pre-immunization in BALB/c tumor-bearing mouse model (a)BALB/c小鼠预免疫过程;(b)BALB/c小鼠的体重变化;(c)BALB/c小鼠的肿瘤体积变化;(d)各组小鼠肿瘤的最终大小;(e)各组小鼠肿瘤的质量。(a) Pre-immunization process of BALB/c mice; (b) Body weight change of BALB/c mice; (c) Tumor volume change of BALB/c mice; (d) Final tumor size of mice in each group; (e) The weight of tumor in each group of mice.
2.5 抗原肽M1-10预免疫可明显抑制MMTVPyMT原发乳腺癌小鼠肿瘤的生长
已有研究证实[20],经PCR和琼脂糖凝胶电泳鉴定为阳性的MMTV-PyMT原发乳腺癌小鼠会在乳腺部位自发形成肿瘤(图5a),因此,我们在第5周分别将PBS、M1-10、4种抗原肽(HJURP、MELK、VEGFR1、VEGFR2)、5种抗原肽(M1-10、HJURP、MELK、VEGFR1、VEGFR2)与弗氏不完全佐剂混合,对鉴定为阳性的MMTV-PyMT原发乳腺癌小鼠进行皮下免疫,免疫3次后观察小鼠肿瘤的生长情况。试验过程中(图5b),抗原肽无明显毒性(图5c);此外,各抗原肽组与对照组相比呈现出较好的治疗效果,其中5种抗原肽混合组的抑瘤效果最好(图5d)。试验终止时,收集各组小鼠的肿瘤称重并对比大小(图5e、5f)。这些结果都表明,在MMTV-PyMT原发瘤小鼠模型中,抗原肽M1-10预免疫也能有效抑制肿瘤生长,当M1-10与其他4种抗原肽联用时进一步提升了肿瘤的免疫效应。
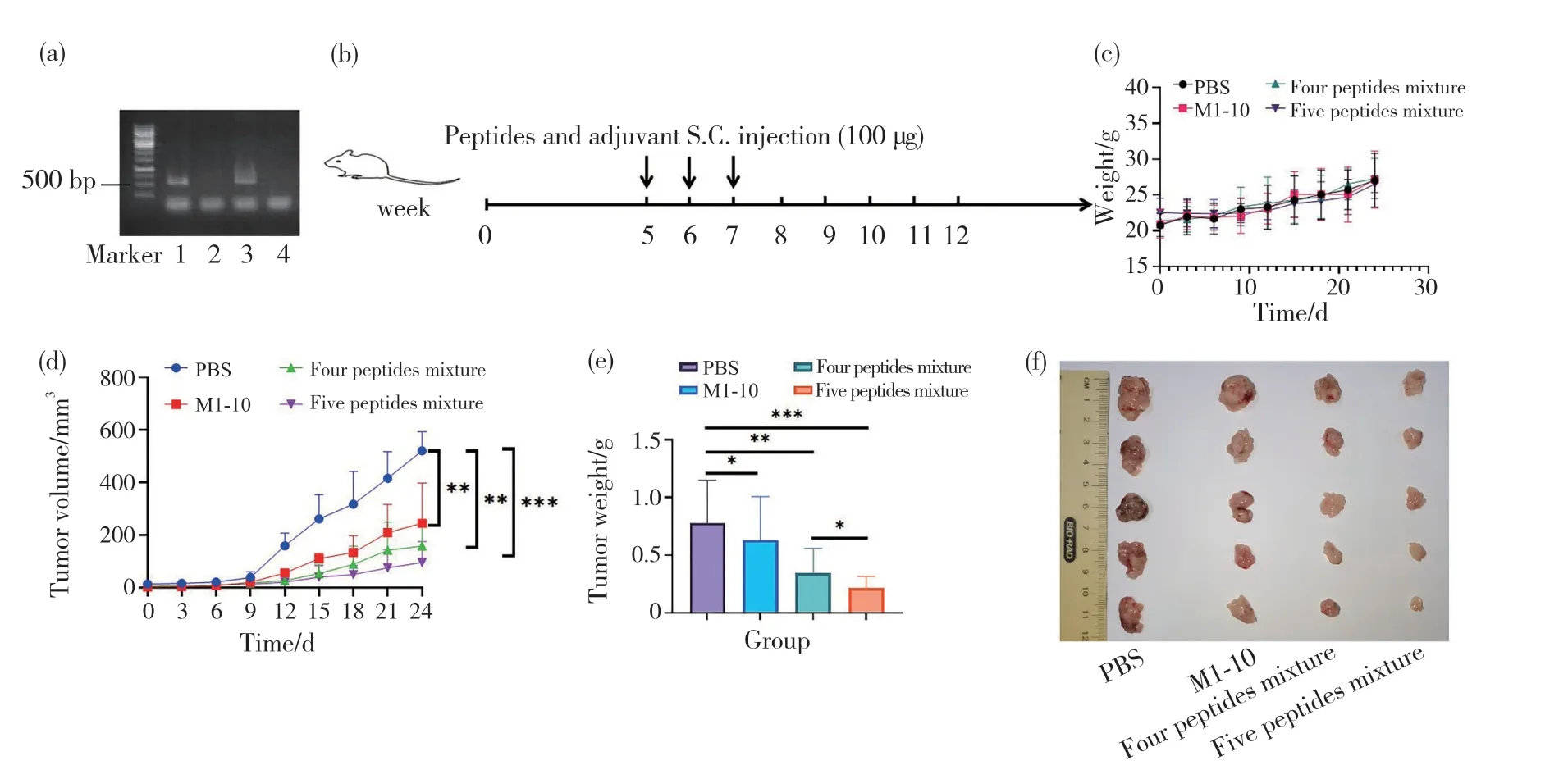
图5 抗原肽预免疫在MMTV-PyMT原发乳腺癌小鼠模型中抑瘤效果的验证Fig. 5 Validation of antitumor effect of antigen peptide pre-immunization in MMTV-PyMT primary breast cancer mouse model (a)MMTV-PyMT原发乳腺癌小鼠PCR鉴定结果。1为阳性小鼠基因组,2为阴性小鼠基因组,3和4为试验鉴定鼠;(b)MMTV-PyMT原发乳腺癌小鼠预免疫过程;(c)MMTV-PyMT原发乳腺癌小鼠体重变化;(d)MMTV-PyMT原发乳腺癌小鼠肿瘤体积变化;(e)每组小鼠肿瘤的质量;(f)各组小鼠肿瘤的最终大小。(a) PCR identification results of MMTV-PyMT primary breast cancer mice. 1 is positive mouse genome, 2 is negative mouse genome, 3 and 4 are experimentally identified mice; (b) Pre-immunization process of MMTV-PyMT primary breast cancer mice; (c) Body weight changes of MMTVPyMT primary breast cancer mice; (d) Tumor volume changes of MMTV-PyMT primary breast cancer mice; (e) Tumor weight of mice in each group; (f) Final tumor size of mice in each group.
3 讨论
肿瘤的免疫疗法是通过刺激和增强机体免疫功能,从而对肿瘤进行控制和杀伤的。目前主要的免疫疗法分为三类,即主动免疫治疗(DC疫苗、多肽疫苗等)、被动免疫治疗(抗体、效应细胞等)、免疫检查点治疗(PD1、CTLA-4等)。肿瘤多肽疫苗就属于主动免疫治疗,通过肿瘤特异性抗原和相关抗原诱发机体特异性免疫应答。与其他肿瘤疫苗相比,肽疫苗因易合成、安全性良好、能特异性激活免疫细胞等优点已成为研究的热门[21]。
在本研究中,抗原肽M1-10来源于FOXM1,而FOXM1在多种恶性肿瘤中高表达,在正常组织中低表达或不表达,这意味着FOXM1可能是肿瘤抗原的来源蛋白。本文通过淋巴细胞增殖、干扰素γ释放及细胞杀伤试验,证实了抗原肽M1-10可在小鼠体内诱导免疫记忆。在细胞杀伤试验中,当效靶比为1∶25时,杀伤作用无显著性差异,可能是由于效应细胞数目不够,对肿瘤细胞的杀伤力不足;但当效靶比为1∶50时,每组的杀伤作用都明显上升,说明杀伤作用可随着效应细胞的数量增加而上升。在两种小鼠肿瘤模型中,M1-10均显示出了良好的免疫原性,可被抗原递呈细胞上的MHC分子识别并结合,之后被T淋巴细胞的TCR受体所捕获,形成肽-HLA-TCR复合体,诱导淋巴细胞转化成细胞毒性T淋巴细胞(cytotoxiclymphocyte,CTL),从而对表达此类抗原的肿瘤进行杀伤。此外,我们还使用M1-10与来源于MELK、HJURP、VEGFR1、VEGFR2的4种抗原肽联用进行试验,以诱发更强的免疫应答,结果也与细胞试验的情况一致,所产生的抑瘤效果比单独使用抗原肽M1-10要好。
尽管肽疫苗具有较多的优点,也具有较好的临床效果,但也存在一定的不足。多肽疫苗由于其免疫原性强度有限和体内不稳定性等因素,使得它们易于被蛋白酶体所降解[22]。目前对于多肽的优化有多种策略,如鉴定出多肽发挥功能的特异性位点之后,对该多肽的其他位点进行氨基酸替换,从而优化其水溶解性;此外,可将该线性多肽制备成环状多肽[23],又或者将这些混合的抗原肽制备成相应的纳米颗粒,进一步提高多肽的免疫原性和稳定性,更好地诱发机体免疫。
