西红花球茎腐烂病拮抗真菌的筛选、鉴定及抑菌机制
2022-05-24陆洁淼张家豪明乾良周桂芬秦路平
陆洁淼,张家豪,明乾良,王 洁,周桂芬,朱 波*,秦路平*
西红花球茎腐烂病拮抗真菌的筛选、鉴定及抑菌机制
陆洁淼1,张家豪1,明乾良2,王 洁1,周桂芬1,朱 波1*,秦路平1*
1.浙江中医药大学药学院,浙江 杭州 311402 2.陆军军医大学(第三军医大学)药学与检验医学系,重庆 400038
筛选西红花球茎腐烂病拮抗真菌,探讨其抑菌机制。以前期分离得到的24株西红花内生真菌为材料,采用平板对峙法筛选球茎腐烂病拮抗真菌;应用ITS分子技术进行菌种鉴定,用扫描电镜观察拮抗后病原菌尖孢镰刀菌菌丝形态;检测拮抗菌株CS05菌丝产生β-1,3-葡聚糖酶与几丁质酶的含量及病原菌产碱性磷酸酶(alkaline phosphatase,AKP)的含量。筛选得到对尖孢镰刀菌有显著拮抗作用的内生真菌8株,其中CS05抑制效果最好,相对抑制率为(76.53±3.82)%;将CS05鉴定为担子菌门多孔菌目栓菌属真菌变色栓菌;CS05能产生β-1,3-葡聚糖酶与几丁质酶,促使尖孢镰刀菌胞外AKP含量增加,菌丝出现稀疏紊乱、缠绕皱缩等现象。西红花内生真菌CS05能较好地拮抗球茎腐烂病菌尖孢镰刀菌,为西红花球茎腐烂病的生物防治提供了参考依据。
西红花;球茎腐烂病;内生真菌;拮抗活性;抑菌;β-1,3-葡聚糖酶
西红花L.是鸢尾科番红花属多年生植物,是世界名贵珍稀中药材,全株仅雌蕊的三分叉红色丝状柱头入药,产量低而价值高,具有活血化瘀、凉血解毒、解郁安神的功效,主治经闭癥痕、产后瘀阻、温毒发斑、忧郁痞闷、惊悸发狂[1]。西红花病害主要有球茎腐烂病与病毒病2类,由尖孢镰刀菌引起的球茎腐烂病是目前已知的最具破坏性的西红花病害[2]。以浙江省为例,每年有30%~50%的西红花种植面积遭受病害[3]。目前对于该病害的防治在实际生产中依然多用化学药液(主要为多菌灵等)喷灌或溴甲烷熏蒸土壤[4],以减轻病情的发展。然而长期使用化学农药会对环境及生态系统产生不良影响[5],并影响与植物相关的有益微生物区系,同时存在病原菌耐药性的问题[6]。生物防治是植物病害防治的重要措施,植物内生菌能提高宿主抗病性已被多次报道[7-9]。目前对内生真菌防治尖孢镰刀菌的研究主要集中在农作物上,如防治黄瓜黄萎病、番茄枯萎病和西瓜枯萎病等[10-13],关于药用植物内生真菌提高宿主抗病性的研究鲜有报道。
研究表明,真菌主要通过分泌病程相关蛋白(如几丁质酶、葡聚糖酶等)、与病原菌竞争生态位和营养物质等方式,抑制病原菌生长[14-15]。赵沛等[16]发现棉花内生真菌腐皮镰刀菌CEF-373可以上调棉花几丁质酶基因表达,从而破坏病原真菌大丽轮枝菌的细胞壁,抑制病原菌生长。本研究在前期建立的西红花内生真菌资源库的基础上,筛选能拮抗球茎腐烂病病原菌尖孢镰刀菌的内生真菌,并探讨其抑菌机制,为西红花内生真菌资源开发及球茎腐烂病生物防治提供实验依据。
1 材料与仪器
1.1 供试菌株
24株西红花内生真菌及病原菌尖孢镰刀菌由本实验室前期分离保存。高山被孢霉(CGMCC,编号3.12824)和哈茨木霉(CGMCC,编号3.15684)购买自中国普通微生物菌种保藏管理中心。
1.2 试剂与仪器
2×Taq Mix(+Dye),莫纳生物科技有限公司;DL 1000 DNA Marker,宝日医生物技术(北京)有限公司;几丁质酶活性检测试剂盒,北京索莱宝科技有限公司;β-1,3-葡聚糖酶(β-1,3-GA)活性检测试剂盒,北京索莱宝科技有限公司;AKP试剂盒,南京建成生物工程研究所;SU8010型场发射扫描电子显微镜(日本日立公司);UV-3600型紫外-可见分光光度计(日本岛津公司);SW-CJ-2FD型超净工作台(上海博讯实业有限公司);YXQ-LS-75S11型立式压力蒸汽灭菌锅(上海博迅实业有限公司);LMI-100型霉菌培养箱(上海龙跃仪器设备有限公司);MC-100B型立式恒温摇床(上海牟测仪器科技有限公司);GenoSens 1850型凝胶成像分析系统(上海勤翔科学仪器有限公司);Applied Biosystems Veriti 96 Well PCR Thermal Cycler型(美国Thermo Fisher Scientific公司);Centrifuge 5427R型台式高速冷冻离心机(德国Eppendorf公司)。Thermo Fisher Multiskan FC 1510型全自动酶标仪(美国Thermo Fisher Scientific公司)。
2 方法
2.1 内生真菌抑菌活性筛选
用平板对峙法测定供试菌株对病原菌的抑菌活性,共设24个内生真菌处理组,2个阳性对照组(高山被孢霉处理组、哈茨木霉处理组),病原菌空白对照组,计算相对抑制率,实验平行3次。
相对抑制率=(对照病原菌菌落直径-对峙病原菌菌落直径)/对照病原菌菌落直径[16]
2.2 内生真菌ITS分子鉴定
无菌条件下挑取少许CS05菌丝置于PDA培养基中活化。28 ℃避光培养7 d,根据徐丽莉[17]研究的方法提取基因组DNA。供试真菌的ITS和5.8S基因采用通用引物ITS4(5’-TCCTCCG- CTTATTGATATGC-3’)及ITS5(5’-GGAAGTAA- AAGTCGTAACAAGG-3’)进行扩增。50 μL PCR反应体系:DNA模板1 μL,稀释10倍后的引物各1 μL,2×Taq Master Mix(Takara Bio)25 μL,ddH2O 2 μL,扩增程序:95 ℃预变性5 min;95 ℃变性40 s,55 ℃退火50 s,72 ℃延伸1 min,共30次循环;最终72 ℃延伸10 min。PCR产物经1%琼脂糖电泳检测合格后,送生工生物工程(上海)股份有限公司测序。扩增产物测序结果通过NCBI进行BLAST比对,然后用MEGA 7.0软件进行序列相似性分析,邻接树(neighbor-joining)方法建立系统发育树。
2.3 扫描电镜观察
参考侯媛媛[18]的方法进行扫描电镜样品处理,经过固定、脱水、干燥和喷金后在扫描电镜下观察对照组病原菌与处理组病原菌的菌丝形态。
2.4 活性酶含量测定
无菌条件下挑取少许CS05菌丝置于PDA培养基中活化。28 ℃避光培养7 d。培养结束后,分别按照β-1,3-GA活性测定试剂盒与几丁质酶活性测定试剂盒中提供的方法,采用分光光度计测定酶活性,实验设3次重复。β-1,3-GA以每毫克组织每小时分解几丁质产生1 μmol-乙酰氨基葡萄糖的酶量为1个酶活性单位,几丁质酶以每毫克组织每小时产生1 mg还原糖定义为1个酶活单位。
对CS05进行发酵,28 ℃,180 r/min振荡培养7 d后,离心(10 000 r/min,4 ℃,30 min),收集上清液,用0.22 μm孔径的无菌滤器滤过除菌制成无菌发酵液,4 ℃保存待用[19-21]。
采用微量法测病原菌胞外AKP含量,设CS05无菌发酵液处理组,以哈茨木霉为阳性对照,无菌PDB为对照组。对尖孢镰刀菌进行发酵,发酵液经真空抽滤,取得新鲜菌丝用无菌水反复冲洗后,每称取菌丝鲜质量2 g分装在一个离心管内。向离心管中分别加入30 mL真菌无菌发酵液和无菌PDB,混匀后置于28 ℃,180 r/min条件下继续培养,分别在0、2、4、6、9、12 h定时取混合液5 mL,离心(10 000 r/min,4 ℃,30 min),收集上清液,按照AKP试剂盒中提供的方法,采用酶标仪对AKP含量进行测定,以100 mL液体在37 ℃与基质作用15 min产生1 mg酚为1个金氏单位(1金氏单位=7.14 U/L),实验设3次重复[22]。
2.5 数据分析
通过SPSS 25.0软件对于实验数据进行方差分析,采用Duncan多重极差检验(DMRT)进行统计学分析,<0.05被认为存在显著性差异。
3 结果与分析
3.1 内生真菌对尖孢镰刀菌的拮抗作用
平板对峙结果显示,从24株供试菌株中筛选出对尖孢镰刀菌有显著拮抗作用的内生真菌8株,占比33.33%;其中CS05对病原菌尖孢镰刀菌的抑菌效果最好,相对抑制率为(76.53±3.82)%,显著高于阳性对照高山被孢霉(53.06±5.20)%和哈茨木霉(57.75±3.45)%(<0.05)(图1)。
3.2 CS05菌种鉴定
CS05的ITS序列经过PCR扩增后,电泳图见图2-A。以CS05的ITS和5.8S基因为靶序列,用Blast程序在GenBank中进行DNA序列相似性搜索。结果表明,CS05与变色栓菌有较高序列相似性。下载比对网页中相似性最高的3个参考菌株序列,用MEGA 7.0软件构建系统发育树,用于系统发育分析,以Agaricales (Basidiomycota)的(MN557371)作为外群。系统发育树显示CS05与(MW742535)、(MW742533)、(KY950437)聚在一起,其序列相似性均为99.33%,形成支持强度为100%的末端分支。
CS05菌落在PDA平板上呈白色,圆形,凸起,干燥,可见细长菌丝,中间紧密,边缘稀薄,隐约可见同心环带(图2-B),结合变色栓菌形态特征[23],将CS05鉴定为担子菌门栓菌属变色栓菌。
3.3 CS05对病原菌菌丝形态影响
扫描电镜显示,空白对照组尖孢镰刀菌菌丝粗壮稠密,光滑均匀,整体平整饱满,且排列有序(图3-A、B、C);经CS05拮抗后,尖孢镰刀菌菌丝较为稀疏,排列紊乱(图3-D),菌丝出现缠绕(图3-E箭头处)、皱缩等现象(图3-F箭头处)。说明CS05对尖孢镰刀菌的菌丝生长有较大的影响。
3.4 活性酶含量测定
结果表明,CS05能产生几丁质酶和β-1, 3-GA产量分别为(1.880 0±0.004 4)U/mg与(0.600 0±0.002 7)U/mg。CS05无菌发酵液与尖孢镰刀菌菌丝体共培养4 h后,AKP活性显著增强,4~6 h略有下降,6~12 h又出现上升趋势(图4)。真菌胞外AKP活性增强可作为细胞壁被破坏的重要指标之一[22],方差分析显示,共培养12 h后,CS05处理组AKP(10.06±0.88)U/L显著大于对照组(4.72±1.31)U/L和阳性对照组(5.27±0.71)U/L(<0.05),表明CS05无菌发酵液对病原菌尖孢镰刀菌细胞壁的破坏可能是抗菌作用的重要机制之一。
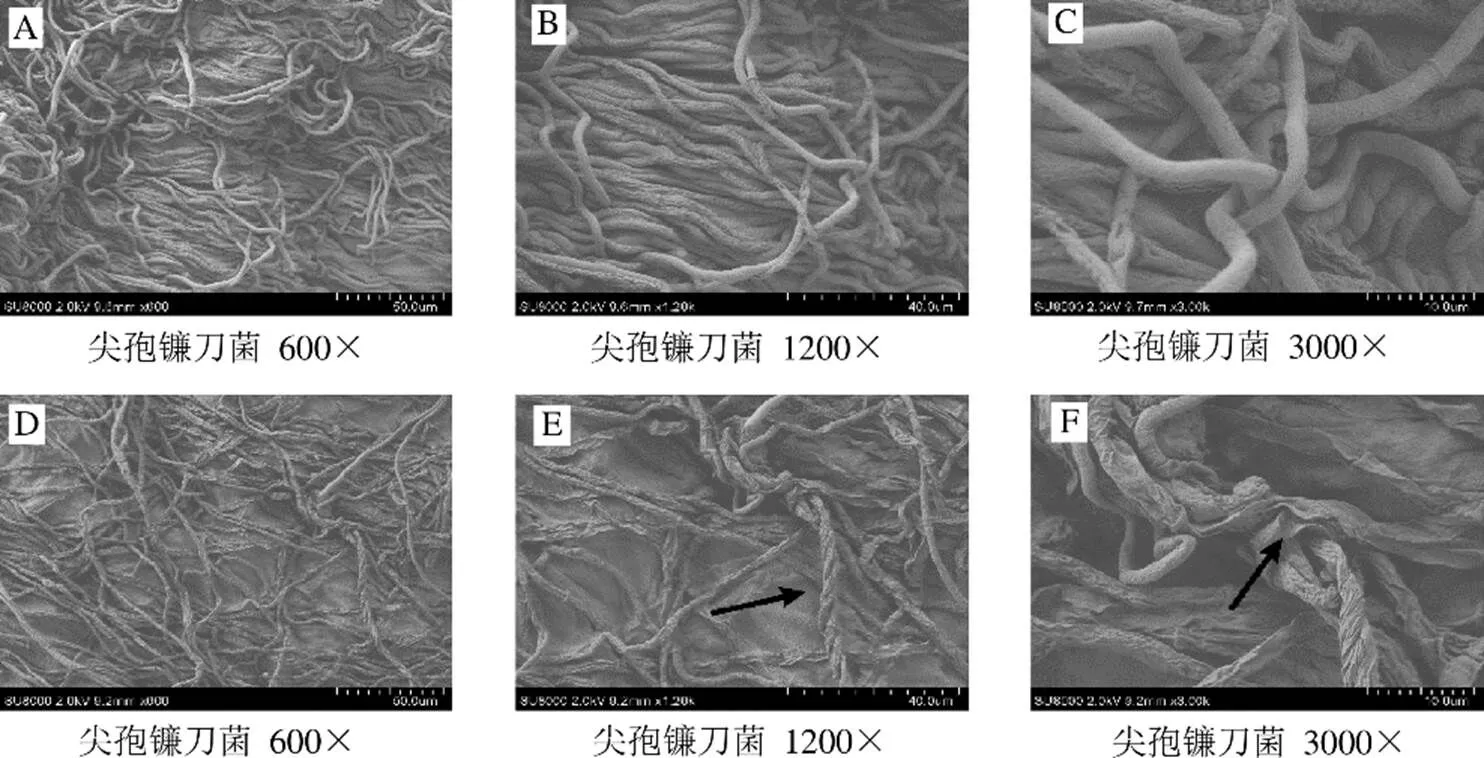
A、B、C-对照组 D、E、F-CS05处理组
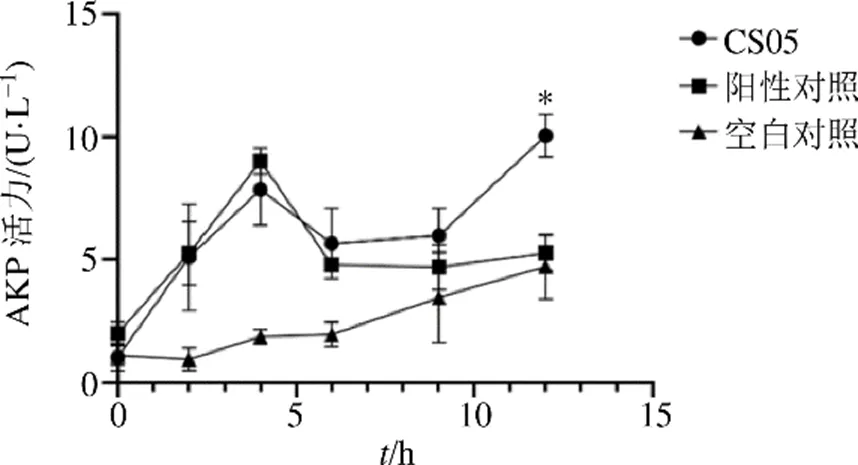
*表示0.05水平上有显著差异,P<0.05
4 讨论
本实验从24株内生真菌中筛选得到一株能显著抑制尖孢镰刀菌菌丝生长的菌株CS05,鉴定为担子菌门多孔菌目栓菌属变色栓菌,该菌种序列已上传至NCBI,Genbank号为:MZ030718,同时专利保藏于中国菌种保藏中心,保藏号为CGMCC No.21948。为栓菌属真菌,能够分泌胞外氧化酶如木聚糖酶、锰过氧化物酶、漆酶等从而降解木质素[24],通常被用作商业化生产漆酶,作为有机污染物降解剂、农药污染降解剂、工业废水降解剂等[25-26]。在植物病害的防治方面,Lorito等[27]曾利用从培养滤液中提纯的蛋白质组防治谷类作物病原菌,结果表明的胞外蛋白质组对的生长有显著的抑制作用。本实验筛选得到的西红花内生真菌CS05对西红花病原菌尖孢镰刀菌具有较强的抗性,为西红花球茎腐烂病的生物防治提供了菌种资源。
真菌细胞壁降解酶的产生被认为是抑制病原菌生长的重要特性之一[28-29]。植物病原真菌的细胞壁主要组成成分为几丁质和β-1,3-葡聚糖等[30],几丁质酶可以催化几丁质水解,在裂解真菌细胞壁、抑制真菌生长的过程中起重要作用[31],β-1,3-GA是一类能特异作用于β-葡聚糖中β-1,3-糖苷键的水解酶,因此该酶的水解活性能够抑制真菌的生长与增殖[32]。本研究发现,CS05能产生几丁质酶和β-1,3-GA,促进了病原菌胞外AKP含量积累,这可能是加速病原菌细胞壁裂解,导致菌丝排列稀疏,出现皱缩、缠绕与萎蔫情况,最终导致病原菌死亡的原因。今后将对CS05在西红花体内定殖情况、与西红花共生及对宿主生长的影响、田间生防效果等进行进一步的研究,为西红花球茎腐烂病防治提供科学依据。
利益冲突 所有作者均声明不存在利益冲突
[1] 中国药典 [S].一部.2020: 134-135.
[2] Wani Z A, Kumar A, Sultan P,.CS10E4, an oleaginous fungal endophyte ofL.enhances apocarotenoid biosynthesis and stress tolerance in the host plant [J]., 2017, 7(1): 8598.
[3] 吴李芳.西红花球茎腐烂病的致病菌鉴定及其生防菌解淀粉芽孢杆菌C612的筛选和应用 [D].杭州: 浙江大学, 2017.
[4] Waller F, Achatz B, Baltruschat H,.The endophytic fungusreprograms barley to salt-stress tolerance, disease resistance, and higher yield [J]., 2005, 102(38): 13386-13391.
[5] Hernández A F, Parrón T, Tsatsakis A M,.Toxic effects of pesticide mixtures at a molecular level: Their relevance to human health [J]., 2013, 307: 136-145.
[6] Hobbelen P H F, Paveley N D, van den Bosch F.The emergence of resistance to fungicides [J]., 2014, 9(3): e91910.
[7] 黄宝康, 秦路平.药用植物内生菌的生物多样性及活性成分 [J].药学实践杂志, 2006, 24(4): 193-196.
[8] 宋金秋, 田璨熙.植物内生菌在植物病害中的生物防治 [J].湖北农机化, 2020(4): 69-70.
[9] Pandey S S, Singh S, Babu C S V,.Fungal endophytes ofenhance vindoline content by modulating structural and regulatory genes related to terpenoid indole alkaloid biosynthesis [J]., 2016, 6: 26583.
[10] 张晓蓉, 李涛, 王超君, 等.深色有隔内生真菌甘瓶霉对番茄抗枯萎病的作用 [J].中国生物防治学报, 2017, 33(3): 394-400.
[11] 陆楚月, 马艳, 王巧, 等.绿色木霉TV41对尖孢镰刀菌FW0在西瓜植株空间分布和枯萎病防控效果的影响 [J].微生物学通报, 2015, 42(11): 2159-2167.
[12] 陈孝利.苜蓿内生菌的分离及生防菌株的筛选与鉴定 [D].北京: 中国农业科学院, 2017.
[13] 王艳红, 吴晓民, 朱艳萍, 等.温郁金内生真菌L18对植物病原菌的抑菌谱及拮抗机理 [J].生态学报, 2012, 32(7): 2040-2046.
[14] 杨玉锋, 李保利.植物内生真菌在植物病害生物防治中的作用 [J].河南农业科学, 2011, 40(3): 25-28.
[15] 赵沛, 冯自力, 师勇强, 等.棉花内生真菌CEF-373菌株对棉花黄萎病的防效及其作用机理 [J].植物保护学报, 2019, 46(6): 1203-1213.
[16] 隋韵静.“核桃黑”病原研究及拮抗菌筛选 [D].杨凌: 西北农林科技大学, 2018.
[17] 徐丽莉.人参内生真菌及其次生代谢产物研究 [D].上海: 第二军医大学, 2009.
[18] 侯媛媛.大黄和黄芩抑菌活性物质追踪及其抑菌机理研究 [D].上海: 上海海洋大学, 2015.
[19] 李亚男.高海拔土壤中稻瘟病拮抗细菌的筛选及其抗菌机理研究 [D].绵阳: 西南科技大学, 2017.
[20] 郝苑汝.核桃内生真菌SYS-5-2的抑菌活性和作用机理研究 [D].杨凌: 西北农林科技大学, 2020.
[21] 王璐.萎缩芽孢杆菌CP 297和解淀粉芽孢杆菌CP 2014对毛桃致腐霉菌的抑菌机理及保鲜应用 [D].太谷: 山西农业大学, 2019.
[22] 何艳喜.HN0511的鉴定及其产木聚糖酶的分离纯化、性质分析和基因的克隆 [D].广州: 暨南大学, 2010.
[23] Archibald F S, Bourbonnais R, Jurasek L,.Kraft pulp bleaching and delignification by[J]., 1997, 53(2/3): 215-236.
[24] Premjet S, Duangporn P, Premjetsiripong.Selection ofFungi from a dry dipterocarp forest in Thailand [J]., 2015, 9(20): 210-219.
[25] 曾盛泉.产漆酶及其在有机污染物降解中的应用基础研究 [D].杭州: 浙江大学, 2017.
[26] Parroni A, Bellabarba A, Beccaccioli M,.Use of the secreted proteome offor controlling the cereal pathogen[J]., 2019, 20(17): 4167.
[27] Lorito M, Farkas V, Rebuffat S,.Cell wall synthesis is a major target of mycoparasitic antagonism by[J]., 1996, 178(21): 6382-6385.
[28] Inglis G D, Kawchuk L M.Comparative degradation of oomycete, ascomycete, and basidiomycete cell walls by mycoparasitic and biocontrol fungi [J]., 2002, 48(1): 60-70.
[29] 祝贺, 杨蓉娅, 王文岭, 等.真菌组成成分及代谢产物检测在真菌病诊断中的应用进展 [J].中国真菌学杂志, 2007, 2(2): 119-121.
[30] 程笑笑, 冯自力, 冯鸿杰, 等.真菌源几丁质酶在植物抗真菌病害中的应用 [J].植物保护, 2017, 43(3): 29-35.
[31] 杨合同, 郭勇, 李纪顺, 等.木霉菌产生的葡聚糖酶和植物病害防治 [J].山东科学, 2003, 16(4): 1-7.
[32] Marcello C M, Steindorff A S, da Silva S P,.Expression analysis of the exo-beta-1,3-glucanase from the mycoparasitic fungus[J].2010, 165(1): 75-81.
Screening, identification, and antifungal activity of endophytic fungi fromand their antagonistic mechanism
LU Jie-miao1, ZHANG Jia-hao1, MING Qian-liang2, WANG Jie1, ZHOU Gui-fen1, ZHU Bo1, QIN Lu-ping1
1.School of Pharmaceutical Sciences, Zhejiang Chinese Medical University, Hangzhou 311402, China 2.Department of Pharmacognosy, Army Medical University (Third Military Medical University), Chongqing 400038, China
To screen antagonistic fungi against corm rot pathogenic fungus of() and explore its antifungal mechanism.Twenty-four endophytic fungi isolated fromwere used to screen antagonistic fungi against corm rot pathogenic fungus via plate confrontation method.Molecular biological methods were used to identify the antagonistic strain.The antifungal mechanism was studied by scanning electron microscope, detecting the β-1,3-glucanase, chitinase and alkaline phosphatase activity.Eight endophytic fungi strains were screened since they possessed a significant antagonistic effect against.Among them, CS05 had the best inhibitory effect whose relative inhibitory rate was (76.53 ± 3.82)%.Moreover, CS05 was identified as.Enzyme activity assay showed that CS05 could produce β-1,3-glucanase and chitinase, and increase extracellular alkaline phosphatase content ofsignificantly, causing sparse and disordered growth, twining and shrinking ofmycelia.The endophytic fungus CS05 could effectively antagonize, which provided a reference for the biological control of corm rot of
L.; corm rot disease; endophytic fungi; antifungal activity; antagonistic mechanism; β-1,3-glucanase
R286.2
A
0253 - 2670(2022)10 - 3165 - 06
10.7501/j.issn.0253-2670.2022.10.027
2021-11-06
浙江省一流学科(中药学)开放基金项目(ZYAOX2018011);浙江省公益技术研究计划项目(LGN21H280001);浙江中医药大学人才专项(2021ZR09);浙江省医药卫生青年创新人才支持计划(2022492838)
陆洁淼(1997—),女,浙江杭州人,硕士研究生,研究方向为中药品质评价。E-mail: 201911114011486@zcmu.edu.cn
通信作者:朱 波,博士,副研究员,硕士生导师,研究方向为植物内生菌。E-mail: zhubo@zcmu.edu.cn
秦路平,博士,教授,博士生导师,研究方向为中药资源及品质评价。E-mail: lpqin@zcmu.edu.cn
[责任编辑 时圣明]
