ATF3在视神经损伤后大鼠视网膜的表达及作用
2022-05-21赵凤琼李战梅周米露罗云霞
赵凤琼,杨 宇,李战梅,周米露,罗云霞
(南充市中心医院,川北医学院第二临床医学院眼科,南充 637000)
视神经损伤又称外伤性视神经炎病变,属于常见的眼外伤,会导致视力降低、视野缺损乃至传入性瞳孔对光反射异常[1]。神经损伤发病与颅脑外伤、动脉硬化、青光眼、高血压、脑膜炎、败血症、视神经炎、糖尿病以及各种甲状腺等代谢类疾病有关[2]。曾有研究表明,视神经损伤是不可逆的[3],但相关研究报道,目前约有50%的视神经损伤患者会有不同程度上的视力恢复[4],说明视神经损伤后在某种条件下视神经可以再生。视神经损伤后的再生与多种因素、各个因子的相互作用以及外界环境具有一定的相关性。转录激活因子3(ATF3)由181个氨基酸组成,是一种适应性反应基因,在缺血、缺血再灌注、组织损伤、化学毒素等应激状态下表达上调[5]。相关研究表明,ATF3在神经损伤后的表达明显上调,视为神经系统中神经损伤的独特神经元标记物[6],故推测视神经损伤可能与ATF3表达相关。本研究通过探讨ATF3在视神经损伤后大鼠视网膜神经节细胞存活中的作用和分子机制,为治疗视神经损伤相关疾病提供理论参考。
1 材料和方法
1.1 材料
1.1.1 实验动物 成年雌性SD大鼠65只,清洁级,无眼部疾病,购自北京维通利华实验动物技术有限公司,许可证号:SYXK(京)2017-0033,体质量210~250 g,12 h光照和12 h黑暗交替,温度和湿度相对恒定,分笼饲养,每笼5只,自由饮食和饮水。
1.1.2 主要试剂和仪器 ATF3抗体购自美国abcam公司;ATF3过表达质粒引物序列(pIRES2/ATF3)、ATF3-shRNA表达质粒和阴性对照(shNC)序列由上海吉玛基因有限公司合成;CCK-8试剂盒购自中国biosharp生物科技公司;BCA蛋白定量试剂盒购自武汉博士德生物工程有限公司,GAPDH抗体购自北京宝日医生物技术有限公司;免疫组化试剂盒购自美国abcam公司;光学显微镜、蛋白电泳仪购自美国Bio-Rad公司;DNA电泳仪设备购自北京市六一仪器厂;CO2细胞培养箱购自美国Thermo Fisher公司;OCT(Cirrus-HD 4000)购自德国Carl Zeiss公司。
1.2 方法
1.2.1 视神经损伤模型建立 从65只大鼠中,随机取55只大鼠,建立右眼视神经损伤模型[7](实际使用51只),作为视神经损伤组,腹腔注射10%水合氯醛麻醉,将大鼠固定手术台上,钝性分离暴露视神经眶内段,采用中号显微血管夹在大鼠视神经眼球后2 mm处夹住,夹持力大约为98 g,时间为20 s,术中术眼对光的反射消失,眼瞳孔散大,检眼镜下没有看到视网膜的完全缺血,采用8-0尼龙线缝合球结膜2针,术后当天使用红霉素眼膏外敷右眼,视神经损伤动物模型建立术后,手术切口愈合较好,无渗血渗液,无化脓,眼角膜透明,玻璃体无积血和炎性反应,无视网膜脱离发生,瞳孔散大约4 mm,并进行直接对光反射和间接对光反射检查,发现间接反射良好,直接对光反射迟钝或者消失,即视为建模成功。剩余10只正常大鼠作为对照组(实际使用9只)。
1.2.2 实时荧光定量PCR检测视网膜中ATF3的表达 取对照组大鼠3只、视神经损伤组大鼠3只,10%水合氯醛腹腔注射大鼠,待完全麻醉后处死,大鼠仰卧位并固定四肢,剪开球结膜,钝性分离眼周组织,球后视神经约2 mm位置剪断视神经,采用平镊和剪刀摘出眼球,分离视网膜,4%戊二醛固定,-80 ℃保存。选取冻存标本剪碎并研磨,Trizol溶液进行裂解,按照产品说明书采用一步法提取总RNA,再按照使用说明进行逆转录成cRNA,采用primer premier 5.0软件进行设计合成引物,ATF3上游引物序列:5′-ACTGTCGGTCCAGAGTGCTT-3′,下游引物序列:5′-CAGTGCTGATCTGGATGTGTG-3′;以GAPDH作为内参,GAPDH上游引物序列:5′-GAAAGATGGCTCACCGGG-3′,下游引物序列:5′-GCTTCACCTCCTTGCCACT-3′。应用ABI step one plus system定量PCR仪,热循环条件为50 ℃ 2 min;94 ℃ 5 min;94 ℃ 15 s,57 ℃ 30 s,共30个循环,检测ATF3 mRNA的表达水平。各组各样本均做3个平行样。
1.2.3 免疫组织化学检测ATF3的表达 取对照组大鼠3只、视神经损伤组大鼠8只,视神经损伤组大鼠分别于感染后3,7,14,35 d采用水合氯醛溶液麻醉处死大鼠,各时点处杀2只,取右眼球,采用40 g/L多聚甲醛固定,去除晶状体后,梯度乙醇脱水,二甲苯透明,浸蜡之后,采用石蜡包埋,平行于眼球矢状位,进行连续切片,厚度为4 μm。然后在0.3%的H2O2去离子水中孵育30 min,阻断内源性过氧化物酶,PBS冲洗;采用1%牛血清白蛋白进行抗原封闭20 min,然后在一抗中孵育30 min,冲洗5 min,生物素标记的二抗孵育30 min,冲洗5 min,在氧化物酶底物溶液中孵育,观察染色强度,自来水冲洗,复染、分化、脱水、透明,封片,高倍显微镜随机选取5个视野拍照保存,计算各切片的阳性细胞数,以每个视野100个细胞中阳性细胞的数量计算各切片的平均阳性细胞数观察ATF3阳性表达情况。各组各样本均做3个平行样。
1.2.4 免疫荧光组织化学检测胶质原纤维酸性蛋白(GFAP)的表达 取对照组大鼠3只、视神经损伤组大鼠8只,采用水合氯醛溶液对大鼠进行腹腔注射麻醉,开胸经左心室插管至主动脉,上腔静脉开口排出灌注液,灌注生理盐水,立即取视神经标本置于2.5%戊二醛固定液中,视神经损伤组大鼠分别于感染后3,7,14,35 d处死大鼠,各时点处杀2只,摘除眼球并标记,4%多聚甲醛固定、脱水、石蜡包埋,通过视神经乳头,沿眼球的垂直经线行前后方向视网膜全层进行切片,厚度为6 μm,放在含有0.3%Triton X-100%和10%正常驴血清中封闭1 h,添加一抗GFAP抗体(1 ∶1 000)孵育过夜,洗涤后,加二级抗体(结合Alexa 488荧光驴抗鼠IgG和结合Alexa 555的驴抗兔IgG)孵育,PBS清洗。荧光显微镜获取图像,并使用ImageJ软件进行分析,用共焦显微镜进行成像。各组各样本均做3个平行样。
1.2.5 实验分组及视网膜神经纤维层(RNFL)厚度测量 取32只视神经损伤组大鼠随机分为4组,每组8只,分别为NC组、ATF3过表达质粒(pIRES2/ATF3)组、阴性对照(shNC)组和ATF3-shRNA组。除NC组外,其他组分别转染pIRES2-ATF3过表达质粒、ATF3-shRNA表达质粒和shNC,参照Lipofectamine的说明书,分别将ATF3过表达质粒、ATF3-shRNA表达质粒和shNC采用PBS溶解,然后和相应体积的脂质体混匀,室温下静置30 min,再加入PBS,各得到总量为200 μl。将NC组大鼠腹腔注射生理盐水500 μl;pIRES2/ATF3组大鼠注射ATF3过表达质粒转染的复合物;shNC组注射shNC的复合物;ATF3-shRNA组注射ATF3-shRNA表达质粒的复合物。采用SD-OCT扫描,测量感染后0,7,14,35 d的RNFL厚度。各组各样本均做3个平行样。
1.2.6 OCT检查 按1.2.5实验分组,NC组、pIRES2/ATF3组、shNC组、ATF3-shRNA组各取8只大鼠采用OCT扫描,测量感染后0,7,14,35 d的RNFL厚度,每个时点各取2只,每只大鼠仅检查右眼,撑开眼睑,固定于OCT颌架合适位置,保证OCT探测光源对准视乳头,采用监视屏观察,采用Optic Disc Cube 200×200程序进行扫描,选择RNFL和ONH OU程序分析结果,重复测量3次。各组各样本均做3个平行样。
1.2.7 分离视网膜神经节细胞 按照文献[8]进行视网膜神经节细胞分离,大鼠腹腔注射水合氯醛溶液麻醉处死,取出视网膜,溶解于0.04 g/L的脱氧核糖、0.2 g/L左旋/右旋半胱氨酸和15 U/ml木瓜蛋白酶的混合液中,离心处理,加入IgG抗体(1 ∶400)和兔抗巨噬细胞抗体(1 ∶75)孵育30 min,再将贴壁的视网膜神经节细胞胰蛋白酶消化,离心处理后,将视网膜神经节细胞接种于96孔板中,放含有0.01 g/L庆大霉素、2 mmol/L谷氨酰胺的培养基中培养,放在温度为37 ℃,5%CO2条件下,每3 d更换液体1次,流式细胞术检测活化星形胶质细胞、小胶质细胞和视网膜神经节细胞,并计算视网膜神经节细胞纯度。
1.2.8 CCK-8法检测视网膜神经节细胞存活情况 按1.2.5实验分组,NC组、pIRES2/ATF3组、shNC组、ATF3-shRNA组每组取8只大鼠,感染后0,7,14,35 d每个时间取2只大鼠,将4组大鼠的视网膜神经节细胞胰酶消化,接种于96孔细胞培养板中,调整细胞密度为1×106个/孔,待细胞贴壁生长,加入不同浓度DATS,分别进行培养,再向细胞中加入CCK-8工作液,温度为37 ℃;酶标仪在450 nm下完成吸光度值测定(OD)值。各组各样本均做3个平行样。
1.2.9 流式细胞术检测视网膜神经节细胞凋亡情况 按1.2.5实验分组,NC组、pIRES2/ATF3组、shNC组、ATF3-shRNA组感染后14 d每组取2只大鼠,将4组大鼠的视网膜神经节细胞以每孔1×106个细胞接种于24孔板中。孵育过夜,按照制造商说明书,用Annexin Ⅴ-FITC-PI凋亡试剂盒染色,上流式细胞仪上检测,所有实验重复3次。各组各样本均做3个平行样。
1.2.10 免疫印迹法检测Bcl-2相关X蛋白(Bax)、B淋巴细胞瘤-2(Bcl-2)蛋白的表达 按1.2.5实验分组,NC组、pIRES2/ATF3组、shNC组、ATF3-shRNA组感染后14 d每组取2只大鼠,RIPA裂解液提取神经节细胞的总蛋白,BCA法测定蛋白浓度,聚丙烯酞胺凝胶电泳,然后转移到PVDF膜,将膜浸入5%脱脂牛奶的封闭液中,封闭1 h。分别加入Bax(1 ∶1 000)和Bcl-2(1 ∶1 000)一抗,放于4 ℃环境中孵育过夜,添加HRP标记的山羊抗兔IgG(1 ∶5 000),孵育1 h,将PVDF膜放入到电化学发光显色液内,显色处理,使用Image-Pro Plus分析蛋白质灰度值。各组各样本均做3个平行样。
1.3 统计学处理

2 结果
2.1 ATF3在大鼠视神经损伤后视网膜中的表达
qRT-PCR检测结果显示,对照组和视神经损伤组中ATF3 mRNA表达分别为1.02±0.01和2.69±0.43,视神经损伤组ATF3 mRNA明显高于对照组(t=11.648,P=0.000,见图1)。
2.2 大鼠视神经受损后视网膜中ATF3与GFAP的表达
免疫组织化学检测发现,ATF3阳性染色呈深棕色,感染后35 d时在视网膜中大量存在(见图2)。对照组、视神经损伤组感染后3,7,14,35 d的ATF3蛋白阳性相对表达分别为1.26±0.28,2.96±0.81,6.33±1.48,7.27±2.14,12.07±3.39,与对照组相比,感染后3,7,14,35 d视神经损伤组大鼠ATF3阳性细胞的表达增加(P<0.05,见图2),在感染后35 d,ATF3的阳性细胞表达在视网膜中大量存在。

与对照组比较,*P<0.05图1 ATF3 mRNA在正常大鼠神经组织和视神经损伤后视网膜中的表达Figure 1 Expression of ATF3 mRNA in normal rat nerve tissue and retina after optic nerve injury
免疫荧光组织化学检测结果显示:对照组中GFAP仅在神经节细胞层表达(见图2)。损伤后,GFAP的表达通过内网状层(IPL)和内核层(INL)向外核层(ONL)传递,与对照组相比,视神经损伤大鼠GFAP在感染后3,7,14,35 d的表达增加(P<0.05,见图2),在感染后35 d,视网膜中出现大量的GFAP,提示视神经受损后,ATF3与GFAP的表达水平升高。
2.3 ATF3对RNFL厚度的影响
感染后0,7 d,pIRES2/ATF3组上象限、颞侧、下象限、鼻侧RNFL厚度以及RNFL的平均厚度与NC组比较无明显差异(P>0.05,见表1);感染后14,35 d,与NC组比较,pIRES2/ATF3组中上象限、颞侧、下象限、鼻侧RNFL厚度以及RNFL的平均厚度显著减少(P<0.05,见表1)。
感染后0,7 d,与shNC组比较,ATF3-shRNA组上象限、颞侧、下象限、鼻侧RNFL厚度以及RNFL的平均厚度比较无明显差异(P>0.05,见表2);感染后14,35 d,与shNC组比较,ATF3-shRNA组上象限、颞侧、下象限、鼻侧RNFL厚度以及RNFL的平均厚度明显增加(P<0.05,见表2)。

与对照组比较,*P<0.05图2 大鼠视神经受损后视网膜中ATF3与GFAP的表达Figure 2 Expression of ATF3 and GFAP in rat retina after optic nerve injury
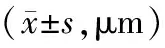
表1 NC组和pIRES2/ATF3组不同时点RNFL厚度比较
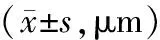
表2 shNC组和ATF3-shRNA组不同时点RNFL厚度比较
2.4 ATF3对视网膜神经节细胞存活的影响
CCK-8法检测结果显示,与NC组比较,感染后14,35 d,pIRES2/ATF3组视网膜神经节细胞存活率显著降低(P<0.05);与shNC组比较,ATF3-shRNA组视网膜神经节细胞存活率显著升高(P<0.05,见图3)。
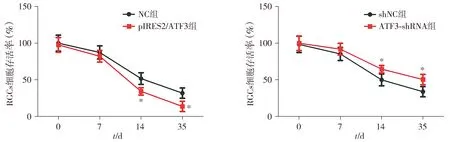
与NC组或shNC组相比,*P<0.05图3 ATF3对视网膜神经节细胞存活的影响Figure 3 Effect of ATF3 on survival of retinal ganglion cells
2.5 ATF3对视网膜神经节细胞凋亡的影响
流式细胞术检测结果显示,与NC组比较,pIRES2/ATF3组视网膜神经节细胞凋亡率显著升高(P<0.05);与shNC组比较,ATF3-shRNA组视网膜神经节细胞凋亡率显著降低(P<0.05,见图4)。

与NC组或shNC组相比,*P<0.05图4 ATF3对视网膜神经节细胞凋亡的影响Figure 4 Effect of ATF3 on apoptosis of retinal ganglion cells
2.6 ATF3对视网膜神经节细胞凋亡相关蛋白影响
免疫印迹法检测结果显示,与NC组比较,pIRES2/ATF3组中Bax蛋白水平明显升高,Bcl-2蛋白水平显著降低(P<0.05,见图5);与shNC组比较,ATF3-shRNA组中Bax蛋白水平明显降低,Bcl-2蛋白水平显著升高(P<0.05,见图5)。

与NC组或shNC组相比,*P<0.05图5 ATF3对视网膜神经节细胞凋亡相关蛋白的影响Figure 5 Effect of ATF3 on apoptosis-related proteins of retinal ganglion cells
3 讨论
视神经损伤一般是由于颅脑损伤或者颌面部外伤而引起的一系列并发症,该病预后较差[9]。因其自身的解剖学特点,损伤的部位多为视神经管段,该段的神经走形特点决定了其致伤原因是间接性的[10]。视神经的损伤多由于眼球外伤、受压迫和眼眶骨折间接伤害引起。该病一旦确诊应当及时救治,从而及时减轻视神经的水肿,扩张局部血管,增加血流量促进血液微循环,起到营养视神经并且加强信号传导的作用[11]。视神经损伤后视网膜神经节细胞数目的减少是导致视功能下降的主要原因,而细胞数量的减少是由凋亡、坏死引起[12]。相关研究表明,视神经节细胞具有有限的再生能力,所以抑制视神经节细胞坏死和干扰其凋亡的过程,对于视觉损伤后视觉功能的恢复具有重要的作用[13]。
ATF3为ATF/CREB家族的重要成员之一,其家族包括众多的碱性区-亮氨酸拉链的转录因子,比较典型的代表为ATF3、ATF4、CREB和CREBP1等[14]。其中ATF3在不同组织中的表现功能存在一定的差异,在正常情况下,ATF3的表达水平较低,但受其他细胞因子、生长因子和毒性应激剂等的刺激,其表达会明显的上升[15]。相关研究表明,ATF3参加人体的多种生物学功能,包括细胞黏附、伤口愈合、炎症反应以及维持身体的环境平衡等[16]。ATF3基因在肿瘤的发展中扮演着正反两方面的作用,既能够抑癌,促进癌细胞凋亡,又能促癌,促进癌细胞的增殖[17]。曾有研究报道,ATF3在组织损伤早期反应中也起着主要作用,在神经元代谢机制中具有促进存活和再生的功能,在多种组织中的应激反应中被诱导[18]。ATF3可以介导多种基因的转录,在应激和损伤中是必不可少的因子。虽然ATF3在压力损伤中上调,但对视神经损伤后大鼠视网膜神经节细胞存活情况尚不清楚,所以本研究探讨ATF3表达对视神经损伤后对视网膜神经节细胞存活和凋亡的影响,为临床视神经损伤的治疗提供一定的理论基础。
本实验首先验证了ATF3在大鼠视神经损伤后视网膜中的表达,结果显示:视神经损伤的大鼠视网膜中ATF3的表达明显升高,免疫组织化学检测结果也显示,ATF3随着时间的延长,表达逐渐增加,且感染后35 d,ATF3的表达在视网膜中大量的存在。说明ATF3在视神经损伤中表达升高,且随着损伤时间的延长,表达会逐渐上升。相关研究只表明ATF3在不同压力的作用下表达升高[19],而未报道ATF3随着时间而产生不同的变化。为了证明ATF3在视神经损伤的表达作用,本实验采用免疫荧光组织化学检测GFAP表达,结果显示:GFAP在感染后3,7,14 d表达逐渐增加,在感染后35 d视网膜中出现大量的GFAP。GFAP是中枢神经系统中一种独特的细胞骨架蛋白,星形胶质细胞及Müller是视网膜主要的神经胶质细胞,在星形胶质细胞受损时GFAP的表达明显增加[20],并产生角质化反应,可以活化神经胶质细胞释放一系列生长因子,对神经节细胞具有保护和再生作用。另外,GFAP对于评估创伤性脑外伤损伤严重程度、监测继发性脑损伤以及预后也是最具潜力的生物标志物[21]。
为了验证ATF3在大鼠视神经损伤后的作用,本研究采用SD-OCT扫描测量RNFL厚度,结果显示:感染后14,35 d,促进ATF3的表达,RNFL厚度显著减少,沉默ATF3的表达,RNFL厚度明显增加;又继续验证ATF3对神经节细胞存活和凋亡的影响,结果显示:促进ATF3的表达,视网膜神经节细胞存活显著降低,凋亡率显著升高,且相关凋亡Bax蛋白水平升高;沉默ATF3的表达,视网膜神经节细胞存活显著升高,凋亡率明显降低,且Bcl-2表达升高。相关研究表明,下调ATF3的表达能抑制Sw-13和NCI-H259R细胞增殖,激活细胞凋亡通路诱导细胞凋亡[22]。也有研究报道,上调ATF3的表达可以促进结肠癌细胞的增殖[23],说明ATF3也起到了促癌作用,与本研究相反。
综上所述,ATF3视神经损伤的大鼠视网膜中的表达升高,ATF3能够调控视神经损伤后大鼠视网膜神经节细胞存活和凋亡能力,在大鼠视神经损伤中发挥作用,为临床上视神经损伤治疗提供一些思路。
