厚壳贻贝抗菌肽myticusin-1 的重组表达及功能分析
2022-05-18杨金月何治江何梦岚郝明梅张晓林严小军
杨金月,刘 璐,何治江,何梦岚,郝明梅,张晓林,严小军,廖 智
(浙江海洋大学海洋科学与技术学院,海洋生物功能蛋白与活性多肽研究室,浙江舟山 316022)
抗菌肽是当前生物活性多肽研究的重要领域,也是新型生物抗生素开发的先导分子,在医学和药学等方面具有重要的研究和应用价值[1]。贻贝抗菌肽因其抗菌活性强,分子多样性丰富而成为海洋生物抗菌肽研究的重要物种[2]。目前已从贻贝体内鉴定到的抗菌肽家族至少有9 种,包括在蛋白层面鉴定到的mytilin[3]、myticin[4]、mytimycin[5]和defensin[6]4 类经典贻贝抗菌肽家族,以及在基因层面鉴定的big defensin、mytimacin[7]和myticalin[8];此外,我们在前期研究中从厚壳贻贝Mytilus coruscus 血清中鉴定到myticusin-1[9]和mytichitin[10]。上述抗菌肽的发现使得贻贝成为目前海洋生物中鉴定抗菌肽家族种类最多的物种。
Myticusin-1 是此前从厚壳贻贝血清中分离到的一种分子量较大的抗菌肽,为本实验室首次发现并命名[9]。Myticusin-1 成熟肽由104 个氨基酸残基所组成,分子量11 kDa;其序列中含有10 个半胱氨酸,形成5 对二硫键,是一种典型的富含二硫键的贻贝抗菌肽[9]。Myticusin-1 对革兰氏阳性菌和阴性菌均表现出明显的抑菌活性,但对革兰氏阳性菌的抑菌活性比革兰氏阴性菌要强约10 倍[9],但其对革兰氏阳性菌和阴性菌的免疫响应机制仍不明确。与经典的贻贝抗菌肽,如mytilin、myticin、defensin 等相比,myticusin-1 表现出较大的分子量,偏中性的等电点(pI 为6.8),特殊的半胱氨酸分布模式,以及结构预测中表现出以alpha-螺旋为主等结构特征[9];上述结果表明,myticusin-1 在贻贝免疫防御中具有较为特殊的结构和功能。Myticusin-1 在贻贝体内含量极低,同时,由于myticusin-1 分子较长且二硫键较多,采取固相化学合成手段具有较大困难,因此,采用原核重组表达的手段开展厚壳贻贝抗菌肽myticusin-1 的制备是开展后续研究的重要前提。此外,为进一步研究myticusin-1 在贻贝体内的功能,采取实时荧光定量PCR 手段,对厚壳贻贝分别在金黄葡萄球菌、溶藻弧菌和白色念珠菌的诱导下,其血细胞myticusin-1 基因基因表达水平的时间变化曲线。上述研究将为深入了解贻贝myticusin-1 这一新型抗菌肽的功能以及后续的工程化应用奠定基础。
1 材料与方法
1.1 Myticusin-1 的重组表达、复性及分离纯化
Myticusin-1 的cDNA 基因(GeneBank 编号JQ806765.1)编码1 个由128 个氨基酸残基组成的前体蛋白,包括由24 个氨基酸残基所组成的信号肽和由104 个氨基酸残基所组成的成熟肽区。对其成熟肽区的编码核苷酸序列(315 bp)开展了基因密码子优化设计。采用OptimumGeneTM技术平台(http://www.genscript.com/)对目标基因的密码子进行大肠杆菌偏爱密码子替换,结合GC 含量、mRNA 二级结构等因素进行了优化设计;同时,在目标基因的5′端,添加Nco I 酶切位点(CCATGG)、保护碱基(CA)和多聚组氨酸标签(CATCATCATCATCATCAC);在目标基因的3′端,添加终止密码子(TAA)和Xho I 酶切位点(CTCGAG);最终设计出的目标基因全长为347 bp,该目标基因由南京金斯瑞公司合成。
合成后的目标基因经测序验证无误后,采用Nco I 和Xho I 进行双酶切并连接表达载体pET28a;连接产物转化至大肠杆菌DH5α 感受态细胞中,经抗性筛选和培养后,挑取单克隆进行菌落PCR 鉴定,阳性克隆送上海生工生物公司测序验证。
将成功构建的重组表达质粒转化到大肠杆菌BL21 表达菌株感受态细胞中,经抗性筛选和培养,挑取单克隆菌落于相应抗性的LB 液体培养基中进行2 次培养。培养后的菌液按照1:100 比例进行扩大培养。分别设置37 °C 和15°C 2 种培养温度,以IPTG(1 mmol·L-1)进行重组表达诱导。
诱导表达后的菌液经离心(1 000 ×g,10 min,4 ℃),收集菌体进行冰浴超声破碎,之后离心(8 000 ×g,15 min,4 ℃),分别收集上清和沉淀(包涵体)。用缓冲液A(10 mmol·L-1咪唑,8 mol·L-1尿素,0.1 mol·L-1NaCl,0.1 mol·L-1PBS,pH 8.0)溶解包涵体,之后离心(8 000 ×g,15 min,4 ℃)收集上清液,经0.45 μm 微孔膜过滤后上样镍柱(Ni-NTA,上海生工生物工程有限公司)。之后以缓冲液B(30 mmol·L-1咪唑,8 mol·L-1尿素,0.1 mol·L-1NaCl,0.1 mol·L-1PBS,pH 8.0)洗柱;再以缓冲液C (300 mmol·L-1咪唑,8 mol·L-1尿素,0.1 mol·L-1NaCl,0.1 mol·L-1PBS,pH 8.0) 洗脱目标蛋白。
经镍柱纯化后的目标蛋白采用透析复性策略。分别配置复性液I、II 和III,其中复性液I 配方为:4 mol·L-1尿素,0.1 mmol·L-1氧化型谷胱甘肽,0.9 mmol·L-1还原型谷胱甘肽,20 mmol·L-1Tris-HCl,pH 8.0;复性液II 配方为:2 mol·L-1尿素,0.1 mmol·L-1氧化型谷胱甘肽,0.9 mmol·L-1还原型谷胱甘肽,20 mmol·L-1Tris-HCl,pH 8.0;复性液III 配方为:0.1 mmol·L-1氧化型谷胱甘肽,0.9 mmol·L-1还原型谷胱甘肽,20 mmol·L-1Tris-HCl,pH 8.0;4 °C 搅拌透析。
复性后的目标蛋白采用高效液相色谱进行进一步纯化。高效液相色谱仪为Waters600 E 型(美国,Waters 公司),检测器为Waters 2487 双波长紫外检测器;色谱柱为C8 反相色谱柱(Vydac,218TP);采用线性梯度洗脱,即B 液(含0.1%的乙腈)在30 min 内,其比例由5%上升至60%,A 液为含0.1%的纯水;流速为1 mL·min-1;检测波长为280 nm。
1.2 SDS-PAGE 和Western Blot 分析
SDS-PAGE 采用12%分离胶,样品事先以电泳上样缓冲液(上海生工公司)溶解;以牛血清白蛋白(上海生工生物工程公司)作为定量分析对照,上样量为20 μL。采用120 V 恒压模式电泳。电泳结束后以考马斯亮蓝R250 进行胶染色并观察。
Western 印迹分析参照文献[11]方法进行;将电泳分离后的蛋白胶转印至PVDF 膜。因所表达的目标蛋白含有多聚组氨酸标签(His-tag),因此,膜经洗涤和封闭后,采用鼠抗His-tag 抗体(南京金斯瑞公司,货号A00186)进行孵育过夜,之后再加入辣根过氧化物酶标记的羊抗鼠二抗(南京金斯瑞公司,货号A00160)孵育60 min,以ECL 化学发光试剂进行显影。
1.3 重组myticusin-1 的抑菌活性测试
参照文献[6],采用生长曲线抑制法结合培养基倍比稀释检测myticusin-1 的抑菌活性。细菌事先用LB液体培养基培养至对数生长期(OD630为0.01),在96 孔板每个孔加入90 μL 菌液。重组myticusin-1 样品预先用PBS 缓冲液(pH 7.4)溶解,重组myticusin-1 配置成水溶液并加入至96 孔板中,加样量为10 μL/孔,蛋白终浓度分别为125、62.5、31.3、15.6、7.8 和3.9 μmol·L-1浓度梯度。以同体积PBS 缓冲液作为阴性对照。
将96 孔板在振荡器上轻柔的振荡使样品和菌液充分混合,然后放入37 ℃培养8~12 h。采用酶标仪测定培养前后的每孔OD 值,以衡量多肽对于细菌生长的抑制作用。多肽的最低抑制浓度(minimal inhibitory concentrations,MIC)用[a]~[b]表示,其中[a]代表细菌继续生长的最大浓度,而[b]代表细菌完全被杀灭的最低浓度。
所用的菌种为:2 种真菌:黑曲霉Aspergillus niger(ATCC16404)、白色念球菌Monilia albican(ATCC10231);5 种革兰氏阳性菌:藤黄叠球菌Sarcina lut ea(ATCC4698)、苏云金芽孢杆菌Bacillus thuringiensis(ATCC10792)、枯草芽孢杆菌B.subtilis(ATCC19659)、巨大芽孢杆菌B.megaterium(ATCC 19161)、金黄色葡萄球菌Staphylococcus aureus(ATCC25923);7 种革兰氏阴性菌:大肠杆菌Escherichia coli、溶藻弧菌Vibrio alginolytica (ATCC17749)、副溶血弧菌V.parahaemolyticus (ATCC17802)、绿脓杆菌Pseudomonas aeruginosa(ATCC9027)、哈维氏弧菌V.harveyi(ATCC33842)、荧光假单胞菌P.fluorescens(ATCC13525)、鳗弧菌V.anguillarum(ATCC43306)。
1.4 厚壳贻贝的采集与诱导
成年厚壳贻贝(壳长7~8 cm)采集自舟山嵊泗枸杞岛海域。采集后以洁净海水中暂养于恒温(22 ℃)养殖池48 h。将厚壳贻贝分为对照组和诱导组。其中诱导组分别采用金黄葡萄球菌、溶藻弧菌和白色念珠菌进行后闭壳肌注射诱导(各菌种注射量为106CFU),对照组注射采用无菌海水。诱导后分别在30 min、1 h、2 h、4 h、8 h、12 h、24 h、48 h、72 h 取贻贝血细胞。
1.5 血细胞中myticusin-1 基因表达的定量分析
用TRIzo1 试剂提取贻贝血细胞总RNA。对提取RNA 进行反转录,反转录反应混合物包括:2×RT buffer 10 μL,反转录引物(F:GGAGGACCATTAAGTACAGCTCG,R:ATATTTCCATGACACCACAAACG)1 μL、RT-mix 1 μL、模板(RNA)5 μL、DEPC 水3 μL。反转录反应的条件为:25 ℃5 min,42 ℃50 min,85 ℃5 min。内参基因为Beta-actin (F:ATGAAACCACCTACAACAGT,R:TAGACCCACCAATCCAGACG)。荧光定量PCR反应体系(50 μL)为:2× PCR buffer 25 μL、Primer F(25 pmol·μL-1)1 μL-1、Primer R(25 mol·μL-1)1 μL、Sybr green I 0.5 μL、模板(cDNA) 2 μL、DEPC 水20.5 μL。荧光定量PCR 扩增条件为:95 ℃预变性3 min,95 ℃变性20 s,59 ℃退火20 s,72 ℃延伸25 s,35 个循环。然后用ABI 7500 SDS 软件(Applied Biosystems)对PCR 数据进行分析,并自动设置基线以保持一致性。表达水平采用2-ΔΔCt进行分析。
1.6 统计学分析
采用平均值±方差(mean±SD)记录数据,实验重复3 次。利用SPSS 25.0 软件包中one-way ANOVA 单因素方差检验进行统计学分析,P<0.05 代表显著性差异,P<0.01 代表极显著差异。
2 结果
2.1 重组myticusin-1 的表达与纯化
天然myticusin-1 成熟肽区域的基因长度为315 bp,经重新设计和优化,目标基因长度为347 bp,设计后的目标基因编码一条长度为112 个氨基酸残基组成的重组蛋白(图1A),与天然myticusin-1 相比,重组myticusin-1 在N 端多出一段MAHHHHHH 肽段,其余序列与天然myticusin-1 一致。重新设计的目标基因与天然myticusin-1 的序列一致性为68%。对优化后的目标基因开展了密码子适应指数(codon adaptation index,CAI)分析,结果如图1。Myticusin-1 基因在优化前,其CAI 值经OptimumGeneTM软件在线计算(http://www.genscript.com.cn/technology-support/on-line-tools),为0.67;经优化后,其CAI 值达到了0.96。CAI值大于0.8 则意味着该目标基因在大肠杆菌中的表达效率较高[12-13]。

图1 myticusin-1 基因经优化前后的密码子使用偏好性分布比较图Fig.1 The distribution of codon usage frequency along the gene sequence of myticusin-1 before and after OptimumGeneTM optimization
Myticusin-1 重组菌经IPTG 诱导表达后,收集重组菌菌体,经超声破碎和离心后,上清与沉淀部分分别以SDS-PAGE 进行检测,结果如图2。由图2A 可见,目标蛋白主要表达于沉淀部分,呈包涵体表达特征。目标蛋白条带位于10 kDa 和20 kDa 之间,约为12 kDa,与重组myticusin-1 的预期分子量接近。进一步经Western Blot 检测,所表达的目标条带能与抗组氨酸抗体结合并产生特异性亮带,表明所表达的重组myticusin-1 带有多聚组氨酸标签(图2B)。
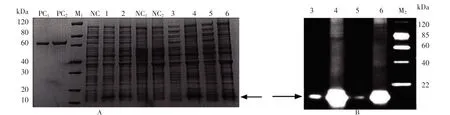
图2 重组myticusin-1 蛋白在大肠杆菌BL21(DE3)表达的SDS-PAGE 和Western Blot 分析Fig.2 SDS-PAGE with Coomassie blue staining (A) and Western Blot(B) analysis of recombinant myticusin-1
因myticusin-1 含有10 个半胱氨酸并形成5 对二硫键,因此,重组表达后的myticusin-1 经镍柱纯化采用透析复性策略,以期完成正确折叠。复性后的重组myticusin-1采用反相高效液相色谱进行分离,结果如图3。由图3 可见,复性后重组myticusin-1 的纯度较高,可用于后续功能试验。

图3 复性后的重组myticusin-1 反相液相色谱分离图Fig.3 The isolation of recombinant myticusin-1 by reverse-phase HPLC after oxidation
2.2 重组myticusin-1 的抑菌活性
重组myticusin-1 经HPLC 纯化和复性后,采用生长曲线抑制法开展抑菌活性测试。结果见表1。重组myticusin-1 对革兰氏阳性菌、革兰氏阴性菌以及真菌均表现出明显的抑菌活性。其中,重组myticusin-1 对革兰阳性菌株,包括藤黄叠球菌、巨大芽孢杆菌和金黄葡萄球菌有较强抑菌活性(MIC<20 μmol·L-1),对苏云金芽孢杆菌和枯草芽孢杆菌抑菌活性较弱;重组myticusin-1 对革兰氏阴性菌株的抑菌活性,除哈维氏弧菌和绿脓杆菌外普遍较弱。其中,对大肠杆菌、溶藻弧菌、副溶血弧菌、鳗弧菌和荧光假单胞菌的抑菌活性较弱(MIC>30 μmol·L-1)。重组myticusin-1 对真菌,包括黑曲霉和白色念珠菌也有较强的抑菌活性(MIC<20 μmol·L-1)。

表1 重组myticusin-1 的抑菌活性Tab.1 The antimicrobial activities of recombinant myticusin-1
2.3 Myticusin-1 经不同菌种诱导后在血细胞中的表达
分别采用金黄葡萄球菌、溶藻弧菌和白色念珠菌对贻贝进行注射诱导,利用荧光定量PCR 检测厚壳贻贝血细胞myticusin-1 基因在诱导前后的时空表达变化,结果如图4 所示。其中,注射金黄葡萄球菌1 h 后myticusin-1 在血细胞中的表达量较对照组有明显上调,并在4 h 达到最大值,随后逐渐下降并恢复至正常水平,之后在72 h 再次出现轻微上调;注射白色念珠菌和溶藻弧菌后,myticusin-1 均在2 h 的表达量较对照组有明显上调并达到最大值,随后表达量整体呈下降趋势。

图4 在金黄葡萄球菌、溶藻弧菌和白色念珠菌对厚壳贻贝感染后,血细胞中myticusin-1 基因表达量变化Fig.4 Myticusin-1 expression changes in blood cells after infection with S.aureus,V.alginolyticus and C.albicans in M.coruscus
3 讨论
贻贝属滤食性生物,容易造成微生物在体内的积累,因此贻贝体内众多的抗菌肽分子对于贻贝的生存至关重要。myticusin-1 是目前已报道的分子量最大的贻贝抗菌肽。由于myticusin-1 在贻贝体内含量极低,因而妨碍了后续深入研究。抗菌肽的原核重组表达由于密码子偏爱性、序列中的二硫键以及本身的抑菌活性而成为抗菌肽工程研究中的难点[12],目前采用原核系统表达真核生物抗菌肽成功的例子并不多。为此,本文采用密码子优化策略,一方面解决原核生物表达真核生物所面临的的密码子问题[12-14],另一方面采用透析复性手段促进重组表达产物的二硫键氧化形成[15]。在本研究中,通过密码子优化,重组myticusin-1 在大肠杆菌中的表达量达到10 mg·L-1菌液并且成功复性。但是其氧化复性的效率较低(10%左右)。推测与myticusin-1 二硫键数目较多有关。这对后续myticusin-1 的大规模生产带来了不小的困难,因此在后续研究中,针对这种含有多对二硫键的目标蛋白的氧化复性依然需要进一步研究,以寻找合适的氧化复性方法。
经复性及纯化后的重组myticusin-1 表现出对革兰氏阳性菌、阴性菌以及真菌的广谱抑制活性,与天然myticusin-1 相比,其抑菌活性类似,表明重组myticusin-1 经氧化复性后,其结构与天然myticusin-1 相似,且N 端的多聚组氨酸标签未对抑菌活性造成明显影响。从MIC 值来看,重组myticusin-1 对革兰氏阳性菌活性较强,而对革兰氏阴性菌抑制活性较弱,这表明myticusin-1 在抑菌活性方面具有选择性。目前,多数已报道的贻贝抗菌肽在抑菌活性方面均表现出选择性,例如,defensin[6],mytilin[3],mytichitin[16],myticusin-1[9]和myticins[4]均对革兰氏阳性菌具有较强活性,对革兰氏阴性菌抑制活性较弱;mytimycin[17]则主要对真菌有抑制活性。贻贝抗菌肽的选择性机制目前尚不清楚,推测与阳性菌和阴性菌细胞壁的组成差异有关。进一步的研究表明,厚壳贻贝血细胞myticusin-1 基因对金黄葡萄球菌的反应表现最为敏感,其诱导后表达量上调倍数与溶藻弧菌和白色念珠菌诱导组相比为最大。综合重组myticusin-1 的功能以及myticusin-1 基因在不同微生物诱导后的表达量变化,我们推测,厚壳贻贝myticusin-1 可能在贻贝对抗革兰氏阳性菌的免疫过程中发挥着重要作用。
海洋贻贝的生活特性导致海水中的各种微生物与贻贝各组织处于直接接触状态。从现有数据来看,海水中革兰氏阴性菌的丰度比革兰氏阳性菌要大[18]。同时,目前已知海水中贝类的致病菌大多数是革兰氏阴性菌,特别是弧菌属(包括Vibrio alginolyticus、V.splendidus、V.anguillarum、V.tubiashi,V.tapetis,V.aestuarianuns,V.neptunius 等),假单胞菌属Pseudomonas 和气单胞菌属Aeromonas[19-22]。而革兰氏阳性菌中,贝类致病菌目前发现的不多,其主要代表是诺卡氏菌属(Nocardia,主要感染牡蛎,但致死率不高)[23-24]。厚壳贻贝myticusin-1 对革兰氏阳性菌的强抑制活性以及myticusin-1 对革兰氏阳性菌的高敏感性事实上很难解释贻贝对于其生存环境微生物群落的适应。因此我们推测,贻贝在长期进化过程中已经形成了对革兰氏阴性菌的耐受机制,可能与部分革兰氏阴性菌形成了共/附生关系[25],而贻贝对革兰氏阳性菌较强的敏感性表明贻贝与革兰氏阳性菌之间存在较大的不兼容性,因此,myticusin-1 在功能上表现出对阳性菌具有较强的抑制活性,并且其基因表达对阳性菌的胁迫更为敏感。此外,上述研究结果也表明,贻贝可能通过某种复杂的机制来识别革兰氏阳性菌和阴性菌,并且分泌不同的抗菌肽来进行免疫防御。对此,还需要更为详细和更为深入的研究来探讨贻贝免疫系统与不同微生物之间的关联以及相互作用机制。
