白粉病对大叶黄杨叶片内生细菌群落的影响
2022-05-16吴璐瑶金德才高丹蕾
吴璐瑶,张 卓,孔 晓,金德才,高丹蕾,袁 涛
(1 北京林业大学 园林学院,国家花卉工程技术研究中心,城乡生态环境北京实验室,北京 100083;2 湖南农业大学 植物保护学院,湖南 长沙 410128;3 湖南省农业科学院,湖南省植物保护研究所,湖南省园艺作物病虫害防治重点实验室,湖南长沙410125;4 青岛大学 公共卫生学院,山东 青岛266021;5 中国科学院 生态环境研究中心,环境生物技术重点实验室,北京100085)
大叶黄杨(Euonymusjaponicus)为卫矛科卫矛属常绿灌木,又名冬青卫矛、日本卫矛等,其分布广、抗性强、耐修剪、易繁殖,是园林中常用的绿篱树种。大叶黄杨白粉病是大叶黄杨主要真菌病害之一,近年来发生比较普遍,部分地区病叶率高达38%[1]。大叶黄杨白粉病病原菌是白粉菌科的Erysiphealphitoides[2-3],它常寄生在枝叶表面形成白色粉末状病斑,严重时导致病叶卷曲、皱缩,枝梢扭曲变形,极大影响大叶黄杨的健康生长及景观效果。目前大叶黄杨白粉病的主要防治手段是采用杀菌剂及栽培管理。杜津钊等[4]评价了15种杀菌剂对大叶黄杨白粉病的药效;刘兴元[5]提出通过加强栽培管理,控制栽植密度增强树势,结合修剪整形及时除去病叶、病梢等提高大叶黄杨的抗病力。针对大叶黄杨白粉病生物防治的相关研究尚未见报道,因此大叶黄杨叶内生细菌群落对白粉病感染的响应效应值得深入研究。
植物内生菌是指生活史的一定阶段或全部阶段生活于健康植物各个组织,不引起宿主植物明显病害症状,与植物互利共生的真菌或细菌[6-7]。叶内生菌与叶表附生微生物一起被称为叶圈微生物[8-9],其与植物光合和蒸腾作用及叶部病害息息相关,是植物生态系统的重要组成部分[10]。植物内生菌产生的抗生素类物质可以增强宿主植物的抗病性。Arnold等[11]发现,可可豆(Theobromacacao)幼苗受到疫霉属(Phytophthorasp.)病菌侵袭时,将从自然感染的无症状寄主中分离的内生菌接种无内生菌的叶片可以显著降低叶片死亡率。有研究发现,从中国南海红树中分离的内生真菌能产生抑制酵母菌和霉菌灰的黄霉素A和多种醌类抗生素[12];从大戟(Euphorbiapekinensis)新鲜叶片中分离得到的镰刀菌E5能使宿主对枯草杆菌(Bacillussubtilis)、轮梗霉、裂殖酵母及腐霉产生拮抗作用[13]。
在植物内生菌研究中,传统的培养鉴定法受不可培养的内生菌的限制,而高通量测序技术成本低廉、覆盖度深,近年来得到广泛应用。如Kumaresan等[14]借助高通量测序技术发现,红树(Rhizophoraapiculata)随着叶龄的增加内生菌丰富度呈增加趋势,且某些内生菌在凋落物降解中有重要作用。本研究采集北京市绿化带内大叶黄杨健康叶片与白粉病叶片,利用Illumina MiSeq测序技术分析大叶黄杨叶片内生细菌群落特征及其互作关系,确定群落的关键种,以探究大叶黄杨叶片内生细菌群落对白粉病入侵的响应情况。
1 材料与方法
1.1 叶片采集
2017年12月,从北京市海淀区林大北路中国科学院生态环境研究中心西门大叶黄杨绿化带5 m×1 m区域内分别采集大叶黄杨健康叶片(healthy leaves,HL)和感染白粉病叶片(diseased leaves,DL)各90片,每组叶片随机分成9个重复,每个重复10片。DL白色病斑面积超过叶面积50%,HL无病斑。采集的叶片一部分保存于4 ℃冰箱用于叶片理化性质的测定,另一部分保存于-80 ℃冰箱用于检测内生细菌种类。
1.2 大叶黄杨叶片理化成分的测定
采用水杨酸比色法[15]测定叶片硝酸盐含量,采用蒽酮比色法[16]测定叶片可溶性糖含量,采用考马斯亮蓝G250染色法[17]测定叶片可溶性蛋白质含量,采用丙酮萃取法[18]测定叶片叶绿素含量。
1.3 大叶黄杨叶片内生菌16S rRNA 的PCR扩增和Illumina测序
将HL、DL用体积分数75%乙醇浸泡10 min,25 g/L NaClO溶液浸泡10 min,无菌水清洗5次,以防止叶片表面的微生物影响测量结果。使用Fast DNA Spin Kit for Soil (MP Biomedals,Santa Ana,USA)提取叶片总DNA。采用通用引物799F(5′-AACMGGATTAGATACCCKG-3′)和1115R(5′-AGGGTTGCGCTCGTTG-3′),对细菌16S rRNA基因的V5-V6高变区进行PCR扩增,以避免叶绿体DNA的扩增[19]。PCR扩增体系:10×PCR缓冲液5 μL,dNTPs 4 μL,TaqDNA聚合酶0.5 μL(北京TaKaRa生物科技公司),上下游引物各1.5 μL(10 μmol/L),DNA模板1 μL(20~30 ng/μL),超纯水补至50 μL。PCR反应条件:94 ℃预变性1 min;94 ℃变性20 s,57 ℃退火25 s,72 ℃延伸45 s,共30个循环;最后72 ℃延伸10 min,4 ℃保存。
用1%琼脂糖凝胶电泳分离PCR产物(电泳条件:110 V,300 mA),使用E.Z.N.A.TMGel Extraction Kit (Omega Bio-tek,Norcross,GA,USA) 试剂盒纯化16S rRNA。用Qubit hs-DS-DNA kit (Invitrogen,Carlsbad,CA,USA)试剂盒在Tecan Infinit F200 Pro平板阅读器上对纯化的16S rRNA扩增产物进行定量。所有PCR扩增片段等量混合(每样品150 ng)后,用上海生物制药科技有限公司Illumina MiSeq(2×250)测序仪(Illumina,Inc.,San Diego,CA,USA)测序。将16S rRNA基因测序数据提交至Galaxy平台(http://mem.rcees.ac.cn:8080)。首先,按照标签将原始数据中的不同样品区分,去掉标签和引物序列,使用FLASH合并相同序列的上、下游引物[20]。然后用Btrim过滤序列,保留平均质量得分大于20的序列,删除带有简并碱基以及长度小于200 bp的序列[21]。最后用UPARSE去除序列中的嵌合体[22],同时以97%的相似度阈值将序列聚类成可操作的分类单元(operational taxonomic units,OTU),并利用核糖体数据库项目16S分类器将16S rRNA基因代表性序列分类注释[23]。
1.4 统计分析
大叶黄杨叶片内生菌细菌群落多样性及优势门、属相对丰度与叶片理化性质的相关性分析采用Pearson相关性分析法和t检验进行。细菌群落丰富度(observed species richness,Sobs)和多样性指数(香浓指数(Shannon)、辛普森指数(Simpson)和Chao1)用R软件VEGAN进行分析。
使用Jaccard、Bray-Curtis距离矩阵表示细菌群落结构,其不相似性分析采用ADONIS、MRPP和PERMANOVA方法进行。使用R软件VEGAN进行典范对应分析(canonical correspondence analusis,CCA)和Mantel分析。
通过在线平台(http://ieg2.ou.edu/MENA)构建大叶黄杨叶片内生细菌群落分子生态网络[24],结果通过Gephi0.9.2实现可视化。基于随机矩阵理论(random matrix theory,RMT)进行网络拓扑特征、网络互作和模块节点拓扑角色识别。
2 结果与分析
2.1 大叶黄杨叶片的理化成分
由表1可以看出,与HL相比,DL的叶绿素和硝酸盐含量下降,而可溶性蛋白质和可溶性糖含量增加,其中叶绿素和可溶性蛋白质含量差异显著。

表1 大叶黄杨健康叶片(HL)和白粉病叶片(DL)的理化成分含量Table 1 Physicochemical properties content in healthy leaves (HL) and powdery mildew leaves (DL) of Euonymus japonicas
2.2 大叶黄杨叶片的内生细菌群落特征
经质量筛选、嵌合体检测和非靶标生物剔除,从大叶黄杨HL与DL的18个样本共获得高质量细菌16S rRNA基因序列1 981 980条,每个样本获得16S rRNA基因序列介于10 257~840 990条。由于样本间序列差异较大,将所有样本随机重新抽样到相同的测序深度(10 257个序列),重抽后所有样本序列被聚类为1 931个OTU,每个样本的细菌OTU数量在76~318个,平均为172个。大叶黄杨HL和DL内生细菌群落OTU组成无显著差异(P=0.952)。对大叶黄杨HL和DL的Sobs和Shannon、Simpson、Chao1多样性指数进行比较,结果见表2。由表2可以看出,根据Sobs值, HL的细菌群落多样性稍低于DL;而根据Shannon、Simpson和Chao1多样性指数,HL的细菌群落多样性稍高于DL,但差异均不显著。

表2 大叶黄杨健康叶片(HL)和白粉病叶片(DL)的内生细菌群落多样性Table 2 Endophytic bacterial communities diversity in healthy leaves (HL) and powdery mildew leaves (DL) of Euonymus japonicas
将DL和HL的内生细菌群落多样性与叶片理化性质进行Pearson相关性分析,结果(表3)表明,HL的硝酸盐含量与叶内生细菌群落的Chao1指数呈显著负相关,而DL的硝酸盐含量与叶内生细菌群落的Simpson指数呈显著正相关。HL和DL的可溶性糖、可溶性蛋白质和叶绿素含量与叶内生细菌群落多样性的相关性均未达显著水平。
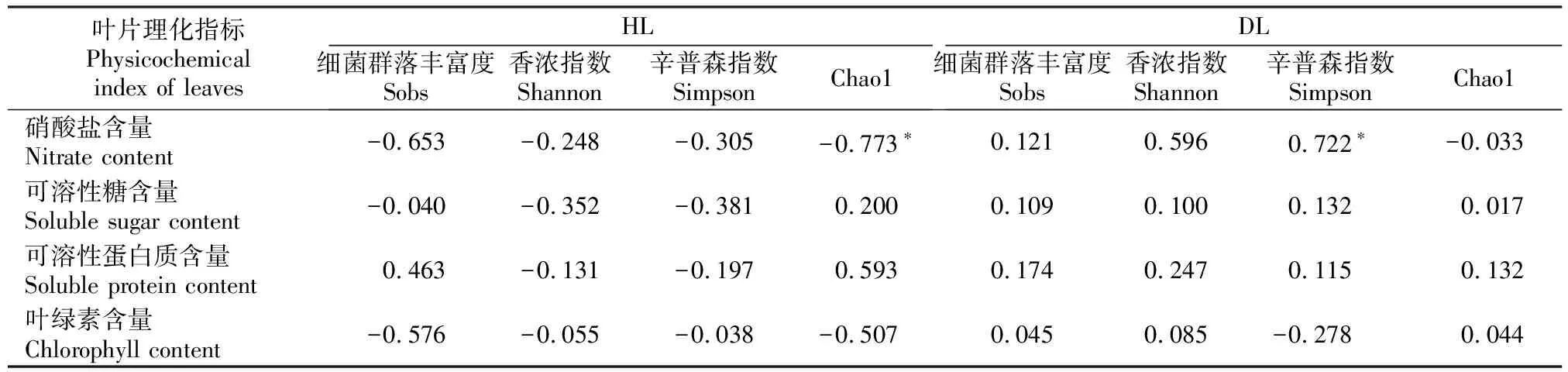
表3 大叶黄杨健康叶片(HL)和白粉病叶片(DL)内生细菌群落多样性与叶片理化成分的相关性Table 3 Correlation analysis of endophytic bacterial communities diversity and physicochemical properties in healthy leaves (HL) and powdery mildew leaves (DL) of Euonymus japonicas
2.3 大叶黄杨叶片内生细菌群落结构
HL和DL内生细菌群落在门水平上的分布如图1-A所示。由图1-A可以看出,HL的优势门为变形菌门(Proteobacteria)、放线菌门(Actinobacteria)、厚壁菌门(Firmicutes)、蓝细菌门(Cyanobacteria)和拟杆菌门(Bacteroidetes),其相对丰度分别为70.93%,14.87%,9.55%,1.38%和2.58%;DL的优势门为变形菌门、放线菌门、厚壁菌门和蓝细菌门,其相对丰度分别为74.20%,12.15%,4.82%和7.33%。两组样本中,变形菌门的相对丰度均最高,其次为放线菌门。HL的放线菌门、厚壁菌门与拟杆菌门占比稍高于DL,而DL细菌群落中的蓝细菌门相对丰度显著高于HL。

相对丰度≤1%的门和属被归类为“其他”Phylum and genus with relative abundance less than 1% were classified as “Others”图1 大叶黄杨健康叶片(HL)和白粉病叶片(DL)内生细菌在门(A)和属(B)水平上的群落组成Fig.1 Community composition of endophytic bacteria of Euonymus japonicas healthy leaves (HL) and powdery mildes leaves (DL) at phylum (A) and genus (B) levels
由图1-B可知,在属水平上,HL内生细菌群落的分布与DL差别较大。HL优势属为罗尔斯通氏菌属、无色杆菌属、贪铜菌属、类芽孢杆菌属、盐孢菌属、芽孢杆菌属、伯克霍尔德菌属、土单胞菌属和节杆菌属,其相对丰度分别为8.40%,5.42%,5.06%,4.88%,3.98%,2.91%,2.12%,1.97%和1.35%;DL优势属为罗尔斯通氏菌属、盐孢菌属、伯克霍尔德菌属、芽孢杆菌属和罗河杆菌属,其相对丰度分别为13.69%,6.09%,3.16%,1.32%,1.27%。大叶黄杨叶片内生细菌群落中未分类细菌占比最大,罗尔斯通氏菌属为叶内最常见属。HL的无色杆菌属、贪铜菌属、类芽孢杆菌属、芽孢杆菌属、土单胞菌属、节杆菌属的相对丰度大于DL。DL的罗尔斯通氏菌属、盐孢菌属、伯克霍尔德菌属和罗河杆菌属的相对丰度高于HL。
HL和DL内生细菌群落结构的不相似性结果表明,两者的群落结构无显著差别。
2.4 大叶黄杨叶片理化成分与叶片内生细菌群落结构的关系
用典范对应分析(CCA)来评估大叶黄杨叶片内生细菌群落结构与叶片理化性质之间的可能联系,结果见图2。

图2 大叶黄杨健康叶片(HL)和白粉病叶片(DL)内生细菌群落与叶片理化特性的CCA分析Fig.2 CCA analysis of endophytic bacterial community and physicochemical properties of Euonymus japonicas healthy leaves (HL) and powdery mildew leaves (DL)
图2表明,大叶黄杨叶片内生细菌群落的CCA模型是显著的(F=1.531,P=0.032),两个轴(CCA1、CCA2)对大叶黄杨内生细菌群落结构的解释率合计为23.62%。第一轴(CCA1)与大叶黄杨叶片的叶绿素含量呈显著正相关(P=0.002),与硝酸盐含量、可溶性糖含量呈正相关,而与可溶性蛋白质含量呈负相关。CCA-VPA结果表明,大叶黄杨叶片的叶绿素、可溶性蛋白质、可溶性糖、硝酸盐含量4个理化特性共解释39.39%的内生细菌群落变化,解释量分别为20.02%,12.856%,10.37%和8.37%。Mantel分析结果(表4)进一步证实,大叶黄杨叶片的叶绿素含量显著影响内生细菌群落的丰度,而硝酸盐、可溶性糖和可溶性蛋白质含量对细菌群落结构无显著影响。

表4 大叶黄杨叶片内生细菌群落结构与叶片理化成分的Mantel分析Table 4 Mantel analysis of endophytic bacterial community structure and physicochemical properties of Euonymus japonicas leaves
相关性分析结果(表5)显示,HL的叶绿素含量与变形菌门相对丰度呈极显著负相关,而与放线菌门呈极显著正相关,硝酸盐含量与蓝细菌门呈极显著负相关。DL的理化性质与细菌群落优势门的分布无显著相关性。
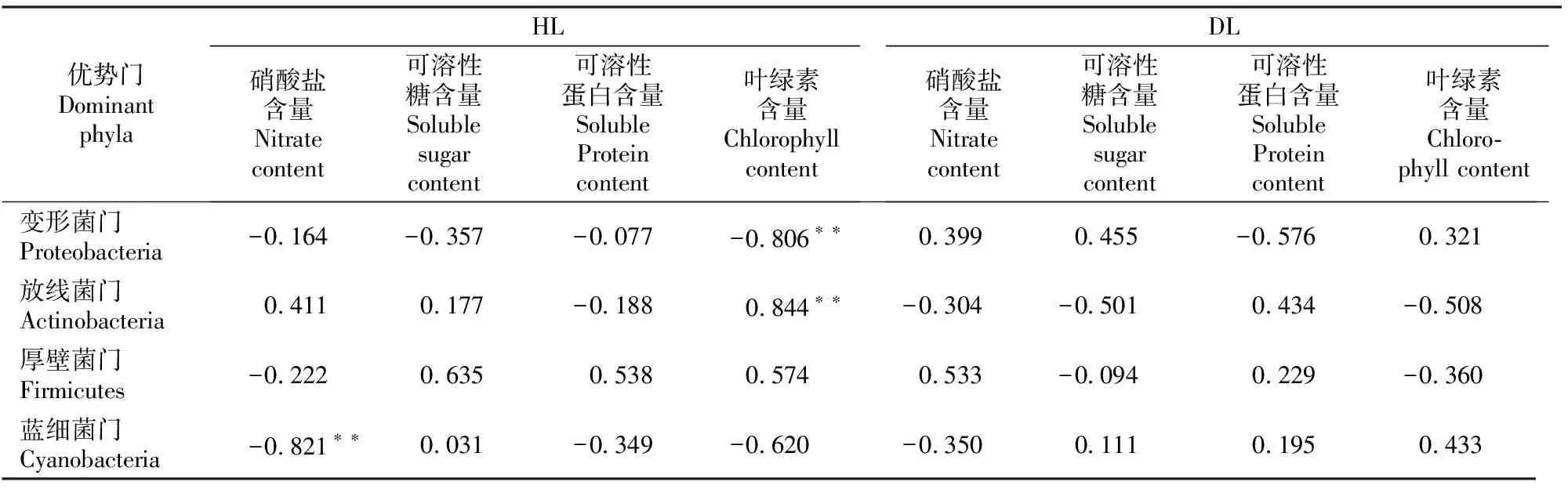
表5 大叶黄杨健康叶片(HL)和白粉病叶片(DL)内生细菌群落4个优势门相对丰度与叶片理化成分的相关性Table 5 Correlation analysis between relative abundance of 4 endophytic bacterial dominant phyla and physicochemical properties in healthy leaves (HL) and powdery mildew leaves (DL) of Euonymus japonicas
由表6可以看出,HL的可溶性糖含量与罗尔斯通氏菌属、盐孢菌属、伯克霍尔德菌属、罗河杆菌属相对丰度呈显著或极显著负相关,可溶性蛋白质含量与芽孢杆菌属呈显著正相关,叶绿素含量与贪铜菌属、类芽孢杆菌属、土单胞菌属、节杆菌属的相对丰度呈极显著正相关。DL的硝酸盐含量与芽孢杆菌属呈极显著正相关,其他理化指标与细菌群落优势属的分布无显著相关性。
2.5 大叶黄杨叶片内生细菌群落的分子生态网络分析
分子生态网络能够反映不同微生物种间的互作关系,从而可识别微生物群落中的关键物种,对于筛选具有抵御病菌作用的微生物具有很高的参考价值。本研究筛选并保留在50%样本中同时出现的OTU,在相同的相似度阈值水平(0.94)比较HL与DL内生细菌群落的拓扑性质。结果(表7)显示,HL和DL内生细菌群落的网络连接性分布符合幂律模型(power-law module)。HL与DL内生细菌网络与其对应的随机网络的聚类系数、平均距离和模块化值差异极显著,表明网络结构并非随机无序构建,其相互连接具有显著的确定性意义。将两个细菌互作网络可视化,结果(图3)表明,DL的内生细菌平均连接性要高于HL,且细菌网络更复杂。HL中厚壁菌门、变形菌门与其他细菌联系较为密切,DL中变形菌门和放线菌门与其他细菌联系更密切。HL、DL大部分细菌之间的互作关系是负向的,负相关关系占比分别为68.46%和71.43%,表明不同细菌之间多为相互竞争关系,且白粉病感染加剧了细菌间的竞争。

表6 大叶黄杨健康叶片(HL)和白粉病叶片(DL)内生细菌群落10个优势属相对丰度与叶片理化指标的相关性Table 6 Correlation analysis between relative abundance of 10 endophytic bacterial dominant genera and physicochemical properties of Euonymus japonicas’s healthy leaves (HL) and powdery mildew leaves (DL)

表7 大叶黄杨健康叶片(HL)和白粉病叶片(DL)内生细菌实证分子生态网络的拓扑特性与随机网络比较Table 7 Comparison of topological characteristics between empirical molecular ecological network and random network of endophytic bacteria in healthy leaves (HL) and powdery mildew leaves (DL) of Euonymus japonicas
分子网络中每个节点都具有不同的拓扑角色,根据节点的模块内连通性(Pi)和模块间连通性值(Zi)将节点区分为外围节点(peripherais)、连接节点(connectors)、模块中心点(module hubs)和网络中心点(network hubs)4类(图4),其中连接节点、模块中心点、网络中心点可作为群落关键种[25]。从图4可以看出,HL和DL细菌网络中的大多数节点都是外围节点,且均无网络中心点;仅DL细菌网络有模块中心点和连接节点,模块中心点为OTU_722(放线菌门诺卡氏菌科红球菌属),连接节点为OTU_142(变形菌门生丝微菌科生丝微菌属)、OTU_90(变形菌门华杆菌科)、OTU_128(放线菌门类诺卡氏菌科)、OTU_80 (放线菌门鱼孢菌科)。关键种的变化表明,大叶黄杨叶片内生细菌群落对白粉病有响应效应。

一个节点(node)代表一个OTU;节点颜色代表门水平的不同分类,节点大小代表其连接数;每条边分别表示由其连接的两个节点之间的相关性,橙色线代表负相关关系,蓝色线代表正相关关系A node represents an OTU.The color of nodes represents the different classification of gate level,and the size of nodes represents the number of connections.Each edge represents the correlation between the two nodes.The orange line represents the negative correlation, while the blue line represents the positive correlation图3 大叶黄杨健康叶片(HL)和白粉病叶片(DL)内生细菌群落的互作网络Fig.3 Interaction of endophytic bacterial community networks in Euonymus japonicas healthy leaves (HL) and powdery mildew leaves (DL)

节点1~4分别代表OTU_80、OTU_128、OTU_90和OTU_142Nodes 1-4 represent OTU_80,OTU_128,OTU_90,OTU_142图4 大叶黄杨健康叶片(HL)和白粉病叶片(DL)内生细菌模块节点的拓扑角色分布Fig.4 Endophtic bacterial module node topology role distribution of Euonymus japonicas healthy leaves (HL) and powdery mildes leaves (DL)
3 讨 论
内生菌在植物根、茎、叶、花和果实的细胞或细胞间隙中普遍存在,它们与植物的关系可能比叶表面的微生物更密切。国内外研究表明,植物体内分离的某些微生物对病原菌有拮抗作用,可增强植物的抗病性[10-11,14]。因此植物内生菌的研究有助于叶部病害的生物防治。
本研究结果显示,大叶黄杨叶片内生细菌群落中,变形菌门占绝对优势,这与邓平香等[26]、Fernando等[27]、Natacha等[28]对东南景天(Sedumalfredii)、番茄(Solanumlycopersicum)和拟南芥(Arabidopsisthaliana)内生细菌的研究结果一致。人们对水稻(Oryzasativa)[29]、杨树(PopulustremulaxPopulusalba)[30]、甜叶菊(Steviarebaudiana)[31]以及一些非栽培植物[32]内生细菌的研究发现,拟杆菌属、芽孢杆菌属、罗尔斯通氏菌属、伯克霍尔德菌属、节杆菌属、假单胞菌属(Pseudomonas)、鞘氨醇单胞菌属(Sphingomonas)、甲基杆菌属(Methylobacterium)是植物叶内生菌中的常见属。本研究中除了假单胞菌属、鞘氨醇单胞菌属和甲基杆菌属未发现外,其余叶片内生细菌群落优势属均出现。另外,本研究在大叶黄杨叶片中检测到的贪铜菌属、无色杆菌属、盐孢菌属、土单胞菌属细菌在其他植物叶内生菌研究中尚未见报道,这可能与本研究大叶黄杨叶片采集地的环境相关。有研究发现,北京城区交通干道附近绿化带重金属含量超过北京土壤背景值[33],并且大叶黄杨叶表也具有吸附空气中铝、铜、锌、砷和镉等重金属元素的能力[34]。因此具有重金属耐受性与修复性的贪铜菌属微生物[35-36]以及其他属微生物得以在叶内富集。
研究表明,一些病菌感染宿主植物后会降低植物内生菌的多样性[37-38],但也有研究表明,病菌感染对宿主植物内生细菌群落的丰富度无显著影响[39-40]。还有研究认为,病菌感染可能会提高宿主植物内生菌的丰富度,如感染白叶枯病后,水稻叶片内生细菌群落多样性增大[41]。本研究中,大叶黄杨健康叶片与染病叶片细菌群落差异很小;Shannon、Simpson及Chao1值表明,健康叶片的细菌群落多样性稍高于白粉病感染的叶片,但差异不显著。可见在不同条件下,病菌对宿主植物内生细菌群落多样性的影响及两者的互作关系仍需进一步研究。
大量研究证实,叶龄[9]、CO2浓度[8]、温度[42]等均会影响叶内生菌群落,但关于叶绿素含量等叶片理化性质对微生物群落结构影响的研究较少。本研究结果表明,大叶黄杨叶片叶绿素含量与叶内生细菌群落结构呈显著正相关,主要影响健康叶片变形菌门与放线菌门的相对丰度,这与Martin等[43]对欧洲山毛榉(Fagussylvatica)的研究结果一致。大叶黄杨叶片是发挥园林景观价值和生态效益的重要器官,叶绿素含量与细菌群落结构的关系有待今后深入研究。
本研究中,感染白粉病后大叶黄杨叶内生细菌群落的分子生态网络更加复杂,这与前人研究结果相似。Hu等[44]研究发现,相较于健康植株,青枯病侵染的烟草(Nicotianatabacum)根内生细菌群落具有更复杂的网络结构和更多的相互作用关系。Víctor等[45]研究发现,在土壤中接种病原菌后甜菜根内生菌网络连接性变得更高。此外,大叶黄杨白粉病削弱了厚壁菌门与其他细菌的联系,加强了放线菌门和变形菌门与其他微生物的联系,放线菌门诺卡氏菌科红球菌属、类诺卡氏菌科和鱼孢菌科及变形菌门生丝微菌科生丝微菌属和华杆菌科是叶内生细菌群落的关键种。关键种的变化表明,大叶黄杨白粉病叶片内生细菌群落中的关键种与白粉病菌入侵关系密切,可能通过分泌抗菌类物质或与病原菌争夺生态位等来抵御白粉病[10-11,14]。今后可分离内生细菌群落的关键种,并探究其在白粉病感染中的作用,这对大叶黄杨白粉病生物防治具有重要意义。
