中华穿山甲腹泻治疗前后粪便微生物群落组成的差异
2022-05-16颉志刚谢纯刚何海健蒙海峰郑荣泉
颉志刚 毛 韵 谢纯刚 许 佳 何海健 蒙海峰 郑荣泉
(1.浙江师范大学化学与生命科学学院,浙江省野生动物生物技术与保护利用重点实验室,金华,321004;2.金华市自然资源和规划局野保站,金华,321052;3.金华职业技术学院农学院,金华,321000;4.金华市陆生野生动物救护中心,金华,321052)
中华穿山甲(Manispentadactyla)隶属于鳞甲目(Pholidota),穿山甲科(Manidae),穿山甲属。由于人类的过度利用和栖息地被破坏,穿山甲野生种群资源已极度衰退。目前,世界自然保护联盟(IUCN)在其濒危物种红色名录上,将中华穿山甲定为极危(CR)物种,所有种类的穿山甲均被列入华盛顿公约(CITES)附录Ⅰ中。国家林业和草原局于2020年6月3日将中华穿山甲升级为国家一级重点保护野生动物。尽管国内外相关机构和部分动物园在多年前就已经开展了穿山甲的救护和人工饲养工作[1-5],但救护成功率和饲养成活情况并不理想,目前穿山甲的人工养殖仍是世界难题。
野生穿山甲进入人工圈养环境后可能受到多种胁迫因素的影响,容易出现免疫或代谢相关的多种疾病。根据文献报道,肠胃炎、肺炎、皮肤病和寄生虫病是导致圈养穿山甲死亡最常见的疾病[6-8],超过50%的圈养穿山甲死于出血性胃溃疡和肺炎[9],腹泻是圈养穿山甲最常见的情况之一,也是导致死亡的主要病因之一。野生穿山甲以白蚁等昆虫为主要食物[10],在人工圈养条件下难以满足其对天然饵料的需求,通常需要人工饲料喂养,而不合理的人工饲料以及环境应激可能是导致穿山甲腹泻发生的直接原因[9,11]。因为食物组成和生存环境的改变均可直接或间接干扰动物肠道菌群的稳态[12-13],使得条件致病菌成为优势菌群,从而出现腹泻症状和电解质紊乱,最终引起动物的死亡。
以浙江省金华市陆生野生动物救护中心救护的2只雌性中华穿山甲为研究对象,利用高通量测序技术分析和比较2只穿山甲在圈养初期发生腹泻和治疗恢复后粪便细菌和真菌群落多样性及结构的变化,旨在为预防和治疗腹泻提供参考依据,从而提高圈养中华穿山甲群体的健康水平。
1 基本情况
1.1 动物与饲养条件
研究对象为浙江省金华市陆生野生动物救护中心(位于浙江省穿山甲保护繁育基地内)救护的2只雌性中华穿山甲(编号为Mp10和Mp13),救护时间分别为2020年7月13日和7月23日,救护时体重分别为2.13、2.37 kg。单只饲养于不锈钢笼内(120 cm×80 cm×100 cm),笼下带有接粪盘可收集粪便,笼内提供木质巢箱(50 cm×40 cm×40 cm),环境温度(27±1)℃,湿度(55±5)%。人工饲料以黑蚂蚁干、黄粉虫干、猫粮和葡萄糖为主要原料,按照一定比例配制,加入等体积饮用水后用匀浆机充分粉碎、混合制成糊状饲料(粗脂肪5.8%、粗蛋白12.6%、粗纤维0.3%,每百克总能量529.0 kJ),每日现用现配,每天16:30投喂,投喂量按体重计,约为50 g/kg。饲养期间通过人工诱导使穿山甲逐步适应人工饲料。
1.2 腹泻情况与治疗方案
2只穿山甲摄食人工饲料一段时间后出现腹泻症状,粪便呈黄色糊状(图1A),但无脓液或水样,也未出现食欲不振、精神萎靡和体温异常等症状。初步推测可能是食物改变引起肠道的应激反应,导致消化不良性腹泻。针对穿山甲消化不良性腹泻的治疗方案为:每日通过拌料口服蒙脱石散3 g/只(浙江海力生制药有限公司,有效成分为蒙脱石,辅料为葡萄糖、香兰素和糖精钠);枯草芽孢杆菌(Bacillussubtilis)二联活菌颗粒1 g/只(北京韩美药品有限公司,含益生菌屎肠球菌R-026、枯草杆菌R-179,以及VC、VB1、VB2、VB6、VB12、烟酰胺、乳酸钙和氧化锌)。用药后第6周开始好转,第12周粪便呈黑色条状(图1B)。

图1 中华穿山甲腹泻治疗前后粪便的形态Fig.1 The fecal form of Chinese pangolins before and after diarrhea treatment using probiotics
2 研究方法
2.1 粪便样品采集
中华穿山甲为夜行性动物,一般在夜间排便。根据监控记录,2只穿山甲活动时间主要集中在20:00—03:00,排便时间集中在21:00左右或01:00左右,收集粪便的时间选择在20:00—07:00。
收集时,首先在接粪盘上铺1层保鲜膜以防止粪便样品的污染,每隔0.5 h观察1次排便情况,如有排便立刻收集。为防止外部杂菌污染,用消毒后的镊子拨开粪便表层,取内部适量样品置于液氮中冷冻,-80 ℃保存。每只穿山甲在治疗前后各采集5个粪便样品,共20个样品。
2.2 高通量测序
委托北京百迈客生物科技有限公司进行粪便样品细菌和真菌的高通量测序。粪便基因组DNA提取采用MN NucleoSpin 96 Soil (Germany),具体步骤详见试剂盒说明书。扩增细菌16S rRNA基因V3—V4区,引物对为338F(5′-ACTCCTACGGGAGGCAGCA-3′)和806R(5′-GGACTACHVGGGTWTCTAAT-3′);扩增真菌ITS rRNA基因的S1区域,引物对为ITS1F(5′-CTTGGTCATTTAGAGGAAGTAA-3′)和ITS2(5′-GCTGCGTTCTTCATCGATGC-3′)。
PCR反应体系10.0 μL,其中基因组DNA模板50 ng,正向和反向引物(10 μmol/L)各0.3 μL,KOD FX Neo Buffer 5.0 μL,dNTP(2 mmol/L)2.0 μL,KOD FX Neo 0.2 μL,剩余体积用ddH2O补充。
反应条件为95 ℃预变性5 min;95 ℃变性30 s,50 ℃退火30 s,72 ℃延伸40 s,25个循环;72 ℃再延伸7 min。反应产物通过1.8%琼脂糖凝胶电泳评估,使用DNA凝胶提取试剂盒纯化,最终产物通过文库制备,库检后Illumina HiSeq 2500上机测序。
2.3 数据分析
原始序列组装用Trimmomatic v0.33质控[14],FLASH v1.2.7拼接[15],并用UCHIME v8.1去除嵌合体[16],得到高质量的Tags序列。OTU聚类和物种注释分别使用USEARCH v10.0[17]和RDP分类器v2.2[18],细菌16S的参考数据库为Silva数据库[19],真菌ITS的参考数据库选择Unite数据库[20]。OTU数据经归一化处理后进行分析和可视化展示,内容包括原始数据优化及有效优质序列统计。用Mothur v1.30.2计算Alpha多样性指数,包括Simpson、Shannon、ACE和Chao1等。基于binary jaccard算法计算Beta多样性距离矩阵,使用R软件进行非度量多维尺度分析(NMDS)。LEfSe分析默认设置LDA Score的筛选值为4。
3 结果与分析
3.1 粪便样本微生物序列及多样性
从20个粪便样品中获得细菌原始16S rRNA基因V3—V4区域序列1 509 222条,质控后获得高质量序列1 310 509条,平均每个样品具有序列41 787条。根据97%的序列相似性鉴定出356个核心OTU,治疗前平均每个样品含295个OTU,治疗后平均每个样品含204个OTU。真菌原始ITS rRNA基因S1区域获得序列1 530 406条,共获得高质量序列1 435 188条,平均每个样品具有序列71 759条。根据97%的序列相似性鉴定出1 572个核心OTU,治疗前平均每个样品含301个OTU,治疗后平均每个样品含429个OTU。得到的OTU在相应的数据库比对注释,细菌共有14个门、24个纲、49个目、77个科和162个属;真菌共有10个门、33个纲、83个目、184个科、371个属和484个种。
3.2 微生物群落多样性
通过比较腹泻治疗前后粪便菌群Alpha多样性指数(表1),发现细菌群落的丰度指数ACE和Chao 1在治疗后均降低,但多样性指数Shannon和Simpson前后变化不大;真菌群落ACE在治疗后降低,而Chao 1增加,Shannon和Simpson指数前后无明显变化。无度量多维标定法(NMDS)检验结果显示,治疗前后细菌和真菌群落的结构均发生了较大程度的变化(图2)。
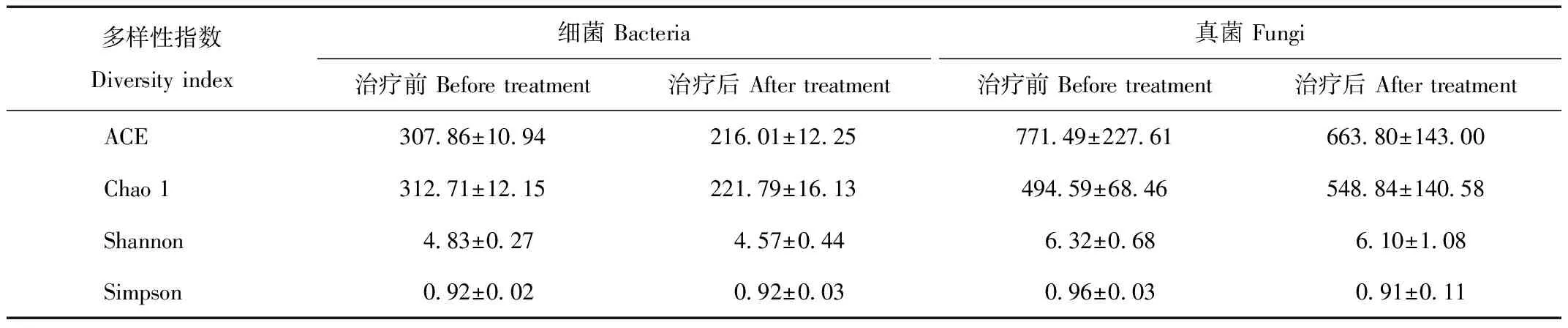
表1 中华穿山甲腹泻治疗前后粪便菌群Alpha多样性指数

图2 中华穿山甲腹泻治疗前后粪便微生物群落组成非度量多维尺度(NMDS)分析Fig.2 Non-metric multidimensional scaling (NMDS) analysis of fecal microbial community composition of Chinese pangolins before and after diarrhea treatment
3.3 治疗前后粪便核心微生物组成及相对丰度
治疗前,粪便细菌群落优势菌门(占比1%以上)依次为厚壁菌门(Firmicutes,65.59%)、变形菌门(Proteobacteria,15.67%)、梭杆菌门(Fusobacteria,8.32%)、拟杆菌门(Bacteroidetes,6.87%)和酸杆菌门(Acidobacteria,2.16%);治疗后为厚壁菌门(63.58%)、变形菌门(21.73%)、梭杆菌门(10.76%)和拟杆菌门(2.77%)(图3A)。在属水平上,治疗前的优势菌属(丰度排序前10)依次为乳杆菌属(Lactobacillus,24.10%)、狭义梭菌属1(Clostridiumsensu stricto 1,8.06%)、Cetobacterium(7.21%)、土孢杆菌属(Terrisporobacter,5.83%)、爱德华氏菌属(Edwardsiella,5.67%)、拟杆菌属(Bacteroides,5.66%)、大肠埃希菌-志贺菌属(Escherichia-Shigella,5.35%)、罗姆布茨菌属(Romboutsia,4.92%)、毛螺旋菌属(Parasutterella,2.10%)和梭杆菌属(Fusobacterium,1.08%);治疗后依次为狭义梭菌属1(23.21%)、罗姆布茨菌属(12.33%)、爱德华氏菌属(11.03%)、土孢杆菌属(6.64%)、梭杆菌属(6.60%)、毛螺旋菌属(5.62%)、大肠埃希菌-志贺菌属(4.02%)、Cetobacterium(3.86%)、拟杆菌属(2.03%)和乳杆菌属(0.72%)(图3B)。总体来看,治疗前后的优势菌门排序基本一致,但占比发生了一定变化,拟杆菌门的占比在治疗后减少,变形菌门和梭杆菌门增加;属水平上,优势菌属在排序和占比上均发生了较大改变,尤其是乳杆菌属的占比在治疗后明显减少,而狭义梭菌属1明显增加。

图3 中华穿山甲腹泻治疗前后粪便菌群组成Fig.3 The composition of fecal microbiota of Chinese pangolins before and after diarrhea treatment
治疗前,粪便真菌群落优势菌门(占比1%以上)依次为子囊菌门(Ascomycota,59.96%)、担子菌门(Basidiomycota,26.82%)、毛霉菌门(Mucoromycota,1.73%)和被孢霉门(Mortierellomycota,1.11%);治疗后依次为子囊菌门(71.72%)、担子菌门(16.57%)、毛霉菌门(1.24%)、被孢霉门(1.15%)和罗兹菌门(Rozellomycota,1.06%)(图3C)。在属水平上,治疗前,丰度排名前10的优势菌属依次为丝孢酵母属(Trichosporon,11.59%)、曲霉属(Aspergillus,8.09%)、Meyerozyma(5.40%)、青霉属(Penicillium,4.45%)、红菇属(Russula,2.98%)、假丝酵母属(Candida,2.70%)、镰刀菌属(Fusarium,2.12%)、被孢霉属(Mortierella,1.98%)、Saitozyma(0.54%)和Condenascus(0.32%);治疗后依次为Condenascus(17.49%)、曲霉属(7.61%)、丝孢酵母属(4.25%)、假丝酵母属(4.14%)、Saitozyma(3.34%),镰刀菌属(2.97%)、青霉属(1.62%)、被孢霉属(1.42%)、红菇属(0.77%)和Meyerozyma(0.08%)(图3D)。治疗前后的优势菌门在排序上基本一致,但占比发生了一定变化,治疗后的子囊菌门占比明显增加,而担子菌门明显减少;属水平上,优势菌属的排序和占比均发生了较大改变,尤其是Condenascus的占比在治疗后明显增加,而丝孢酵母属明显减少;种水平上,丰度排序前10的粪便真菌物种完全一致,但治疗后Condenascustortuosus、Candidaafricana和Saitozymapodzolica的相对丰度占比增多,而茶叶籽酵母(Meyerozymacaribbica)、杂色曲霉(Aspergillusversicolor)、青霉菌(Penicilliumhispanicum)和Candidamucifera的相对丰度占比均减少(表2)。

表2 中华穿山甲腹泻治疗前后粪便真菌在种水平上的相对丰度
3.4 治疗前后粪便微生物显著差异物种
利用LEfSe分析可见,2只腹泻穿山甲治疗前后粪便细菌属水平和真菌属或种水平上的差异。图4A表明,治疗前乳杆菌属和拟杆菌属为主要作用物种,而治疗后狭义梭菌属1、罗姆布茨菌属和狭义梭菌属13为主要作用物种。图4B表明,治疗前起主要作用的真菌是丝孢酵母属、Meyerozyma、茶叶籽酵母菌、红菇属的Russulapoichilochroa、青霉属和曲霉属的杂色曲霉,而治疗后起主要作用的真菌是Saitozymapodzolica和Condenascustortuosus。

图4 中华穿山甲腹泻治疗前后粪便菌群LEfSe分析Fig.4 LEfSe of fecal microbiota of the Chinese pangolins before and after diarrhea treatment
4 讨论
本研究对救护过程中出现腹泻症状的2只雌性中华穿山甲进行了成功治疗。根据高通量测序结果,分析中华穿山甲粪便细菌和真菌菌群Alpha多样性,发现治疗使细菌和真菌(除Chao 1指数外)的丰富度有所降低,但对细菌和真菌多样性的影响不大,经Beta多样性分析,发现治疗前后细菌和真菌菌群均表现出明显的分离。然而,对林麝(Moschusberezovskii)的研究表明,腹泻个体粪便细菌菌群的Alpha多样性指数比健康个体明显降低,同时两者粪便菌群呈现出明显分离,并且研究人员认为是有害菌大肠埃希菌-志贺菌属导致的腹泻[21]。此外,对马驹的研究表明,腹泻个体细菌OTU总数和Chao 1指数显著低于健康个体,但Alpha多样性无统计学差异[22]。对不同物种的研究结果表明,腹泻会引起菌群丰度的降低,但不一定会导致Alpha多样性的降低。在本研究中,引起2只中华穿山甲腹泻的主要原因可能是食物的改变而非有害菌,肠道菌群调整需要1个过渡阶段,在此阶段微生物可能在丰度上发生了一定变化而在物种多样性上变化不大,经过非抗生素治疗后,肠道菌群会调整为一种新的稳态。
在门水平上,中华穿山甲的细菌主要优势菌依次为厚壁菌门、变形菌门、梭杆菌门和拟杆菌门,且腹泻治疗前后优势菌门的排序无明显改变,但占比发生了一定变化。杨雪婷[23]通过宏基因组测序分析出野外马来穿山甲(Manisjavanica)肠道细菌主要为厚壁菌门、变形菌门和拟杆菌门;Ma等[24]通过宏基因组学预测了2只健康雌性马来穿山甲与2只不同性别、死于肺部炎症的穿山甲个体间的粪便细菌菌群,这4只穿山甲的优势菌门为拟杆菌门、变形菌门和厚壁菌门;Yan等[5]比较了在圈养条件下出生与从非法交易中救护后圈养2~3年的马来穿山甲粪便的微生物组成,这2组穿山甲核心菌门依次为厚壁菌门、变形菌门、拟杆菌门、放线菌门和梭杆菌门。这些研究结果说明2种穿山甲肠道的优势菌门都包括厚壁菌门、变形菌门和拟杆菌门,但同种或异种间在细菌门类和占比都存在一定差异。此外,对圈养大食蚁兽(Myrmecophagatridactyla)的研究表明,主要菌门为厚壁菌门(41%)、拟杆菌门(42%)和变形菌门(6%),而小食蚁兽(Tamanduatetradactyla)的优势菌门为拟杆菌门(35%)、厚壁菌门(31%)和变形菌门(3%)[23],表明食蚁类哺乳动物类群间肠道细菌群落在门水平上具有一定的相似性。
在属水平上,中华穿山甲大部分优势菌属治疗前后的丰度发生了较大变化,尤其是治疗后的乳杆菌属占比明显减少,而狭义梭菌属1明显增加。根据LEfSe分析,治疗前,乳杆菌属和拟杆菌属为主要作用物种;治疗后,狭义梭菌属1、罗姆布茨菌属和狭义梭菌属13为主要作用物种。拟杆菌属和乳杆菌属与纤维素降解和蛋白质分解利用有关[25],在治疗后这2个菌属占比减少,可能与食物的改变有关。梭状芽孢杆菌属(Clostridium)可以通过丙烯酸途径发酵丙氨酸产生丁酸,也可以在苏氨酸脱氢酶的作用下发酵苏氨酸产生丙酸[26],还具有降解几丁质的能力[27-28],而罗姆布茨菌属也与丁酸生成相关[29]。丙酸和丁酸是动物体内葡萄糖、胆固醇和脂质代谢的重要代谢底物[30]。日粮中补充丁酸类物质能够改善仔猪肠道发育,提高机体抗氧化能力和生长性能,并可通过调节肠道的通透性降低仔猪腹泻率[31-32]。因此,治疗后肠道内狭义梭菌属和罗姆布茨菌属丰度的增加对中华穿山甲的能量物质代谢和腹泻症状的改善具有积极意义。
有关穿山甲肠道真菌组成的研究尚未见报道,本研究发现,中华穿山甲粪便中的子囊菌门和担子菌门为绝对优势菌门,占比1%以上的菌门还包括毛霉菌门和被孢霉门等,治疗前后优势菌门的排序变化不大,但占比发生了一定变化,如治疗后子囊菌门占比明显增加,罗兹菌门占比也有所增加,而担子菌门明显减少。Sokol等[33]发现,炎症性肠病患者的担子菌门与子囊菌门的比值增加,推测可能与腹泻有关。艾生权等[34]发现亚成体大熊猫(Ailuropodamelanoleuca)肠道真菌的优势菌门也主要为子囊菌门和担子菌门。穿山甲主要以富含几丁质的蚁类为食,而大熊猫以富含纤维素的竹子为食,这两类哺乳动物肠道拥有共同的优势真菌菌门,是否与食物特化有关需要进一步研究。在属水平上,优势菌属在治疗前后有较大改变。治疗后Condenascus占比明显增加,而丝孢酵母属明显减少。在种水平上,虽然排序前10的物种完全一致,但是Condenascustortuosus、Candidaafricana和Saitozymapodzolica的相对丰度在治疗后占比增多,而茶叶籽酵母、杂色曲霉、青霉菌和Candidamucifera的相对丰度占比均减少。虽然真菌占肠道微生物的比例较低,但有研究表明真菌与细菌有密切关系,存在稳定的拮抗或互利共生关系[35-36]。这些特定真菌的丰度变化具体会对中华穿山甲食物的吸收、利用起到何种作用,以及真菌和细菌存在何种互作关系有待深入研究。
综上所述,野生中华穿山甲在救护饲养过程中可能因食物改变引起消化不良性腹泻,通过肠道收敛剂类药物和益生菌调理可以达到治疗目的,这为治疗圈养中华穿山甲最为常见的腹泻疾病提供了初步经验。由于该物种极度濒危,动物来源非常有限,本研究仅能分析2只腹泻个体粪便微生物多样性和组成,虽然生物学重复不能完全符合统计学要求,但本研究结果仍具有较为重要的参考价值,今后可根据相关微生物组成信息有目的地筛选肠道有益菌,以此作为饲料添加剂改善圈养中华穿山甲的健康程度和提高救治成功率等。
