黑曲霉发酵牛蒡根的化学成分及对α-葡萄糖苷酶和α-淀粉酶抑制作用
2022-05-14吴德超
田 盛,王 祎,吴德超,曲 扬
(辽宁中医药大学药学院,辽宁大连 116600)
牛蒡(Arctium lappa)在世界范围内得到广泛应用,牛蒡子作为解表药被中国药典收录,牛蒡根主要作为蔬菜和茶饮食用,具有抗炎、抗肿瘤、降糖等多种活性[1−3]。牛蒡根中的绿原酸等咖啡酰基奎宁酸具有抑制胃肠道内α-葡萄糖苷酶的作用,这可能是其具有降糖作用的机制之一[4−6]。绿原酸、咖啡酸等酚酸类化合物在植物体内与细胞壁结合,因减少了其酯化程度和位点限制了其发挥生物活性[7−8]。
在微生物发酵过程中,微生物产生的酶能够将植物中的结合型酚类化合物转化为游离型,从而可以增强其活性[9−10]。黑曲霉(Aspergillusniger)作为常用发酵菌株可产生纤维素酶、淀粉酶、脂酶等多种酶,能够分解细胞壁、降解食品原料中的成分,用于生产发酵食品[9,11]。发酵食品的生物活性的提升与其中化学成分的变化密切相关,例如以黑曲霉发酵牛蒡茶后,其中可溶性糖和总黄酮含量均提高,并产生多种风味物质,但对牛蒡根经黑曲霉发酵前后的其他化学成分以及其对胃肠道消化酶的作用尚未见报道[12−16]。因此,本文对黑曲霉发酵牛蒡根中的化学成分以及其对α-葡萄糖苷酶及α-淀粉酶的抑制作用进行研究,为采用发酵手段提升食品的生物活性提供实验基础。
1 材料与方法
1.1 材料与仪器
牛蒡 采自山东临沂,经辽宁中医药大学许亮教授鉴定为菊科、牛蒡属植物牛蒡(Arctium lappa)的根,切片后自然风干,粉碎后过3号筛备用;黑曲霉(编号41125) 中国工业微生物菌种保藏管理中心(CICC);沙氏葡萄糖琼脂培养基 杭州微生物试剂有限公司;α-葡萄糖苷酶 Sigma化学公司;α-淀粉酶、可溶性淀粉、还原型谷胱甘肽、对硝基苯-α-D-吡喃葡糖苷(pNPG) 上海阿拉丁试剂有限公司;葡萄糖、乙醇 天津大茂化学试剂厂;生理盐水 山东齐都药业有限公司;磷酸缓冲液(pH6.8) 北京索莱宝科技有限公司;甲醇 色谱级,天津科密欧化学试剂有限公司;色谱级乙腈 Oceanpak Alexative Chemical;绿原酸、咖啡酸、异绿原酸A标准品 四川维克奇生物生物技术有限公司;超纯水 采用Mili-Q system自制。
UU2100型紫外可见分光光度计 上海尤尼柯仪器有限公司;立式压力蒸汽灭菌器 上海博迅实业有限公司医疗设备厂;HD-650型桌上台式洁净工作台 苏州净化设备有限公司;DNP-9082电热恒温培养箱 上海精宏实验设备有限公司。
1.2 实验方法
1.2.1 菌种活化及孢子混悬液的制备 黑曲霉经沙氏培养基培养7 d后,以生理盐水清洗琼脂表面收集孢子混悬液。在波长为600 nm下,用紫外分光光度仪测孢子混悬液的光密度(OD值),以超纯水稀释使OD值为2.0,备用。
1.2.2 黑曲霉发酵牛蒡根 牛蒡根粉70 g置于500 mL锥形瓶中,于120 ℃灭菌30 min后加入黑曲霉孢子混悬液30 mL以及70 mL无菌水。充分混匀后于28 ℃发酵20 d。每天取样1 g,于120 ℃灭菌30 min、于烘箱中40 ℃烘干、保干器中保存,用于测定化学成分及酶抑制活性。
1.2.3 样品提取 取发酵牛蒡样品0.2 g以2 mL 95%乙醇超声(400 W)提取30 min,上清液作为用于测定酶抑制活性的样品溶液。另取1.5 mL上清液氮气吹干后以50 μL色谱甲醇涡旋复溶,14000 r/min离心10 min后取上清液用于HPLC测定。取发酵牛蒡样品0.6 g以6 mL水超声提取30 min,12000 r/min离心15 min后取上清液用于测定总糖。
1.2.4 酶抑制实验
1.2.4.1α-葡萄糖苷酶抑制实验 采用pNPG法测定发酵牛蒡对α-葡萄糖苷酶的抑制作用[17]:空白管-加酶不加药(A1)、空白对照管-不加酶不加药(A2)、抑制管-加酶加药(A3)、背景对照管-不加酶加药(A4)。首先在各管中加入0.003 mol/L GSH 20 μL、0.0096 mol/L pNPG 50 μL,在3和4号管中加入50 μL样品溶液;随后在1~4号管中分别加入PBS (pH6.8)480、520、430、470 μL,于37 ℃孵育5 min;再在1和3号管中加入5 U/mLα-葡萄糖苷酶溶液40 μL,继续孵育20 min;最后在各管中加入590 μL乙醇终止反应,于400 nm测定吸光度。抑制率(IP)以下式计算:
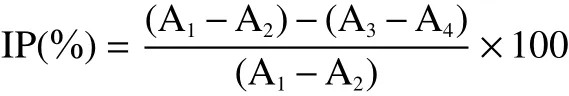
式中:A1~A4代表4个测定管的吸光度。
1.2.4.2α-淀粉酶抑制实验 采用碘比色法测定发酵牛蒡对α-淀粉酶的抑制作用[7]:空白管-加酶不加药(A1)、空白对照管-不加酶不加药(A2)、抑制管-加酶加药(A3)、背景对照管-不加酶加药(A4)。首先在3和4号管中加入100 μL样品溶液,1和2号管中加入等体积95%乙醇;1和3号管中加入50 U/μLα-淀粉酶100 μL,2和4号管中加入等体积PBS;随后于37 ℃孵育10 min后于各管中加入5 g/L可溶性淀粉1000 μL,继续孵育5 min后加入200 μL 终止液(含1%氯化铜(w/v)、0.37%盐酸(v/v));吸取反应液200 μL,加入碘液(含0.012%碘(w/v)、0.3% KI(w/v)),充分摇匀后立即在580 nm 处测定吸光度。抑制率(IP)以下式计算:

式中:A1~A4代表4个测定管的吸光度。
1.2.5 化学成分分析及含量测定 于Agilent 1100高效液相色谱仪上测定发酵牛蒡的化学组成。色谱柱:Diamonsil C18(250 mm×4.6 mm,5 μm);流动相:0.1%磷酸水(A)-乙腈(B)(v/v)梯度洗脱,洗脱梯度如下:0~10 min,3% B~10% B;11~15 min,10% B~16% B;16~25 min,16% B~22% B;26~30 min,22% B~26% B;31~50 min,25% B;51~61 min,25% B~55%B;61~75 min,55% B~90% B。流速:1 mL/min;柱温:30 ℃;进样量10 μL。检测波长:220 nm[18]。采用外标法测定发酵牛蒡中的绿原酸、咖啡酸和异绿原酸A。绿原酸和异绿原酸A在3.3~1000 μg/mL内线性关系良好,咖啡酸在3.3~330 μg/mL范围内线性关系良好。绿原酸、咖啡酸和异绿原酸A的线性回归方程分别为:Y=18525X−86.738(r=0.9999),Y=17290X+60.617 (r=0.9997),Y=22588X-23.476(r=0.9996)。
1.3 数据处理
2 结果与分析
2.1 牛蒡根发酵品对α-葡萄糖苷酶和α-淀粉酶抑制活性
未发酵的牛蒡根即对α-葡萄糖苷酶具有较好的抑制作用,抑制率为80%。牛蒡根对α-葡萄糖苷酶抑制率在发酵后提升。在发酵第1~3 d增加明显,在第4~5 d抑制率缓慢增强,第6 d即增长至90%,在随后的发酵过程中,该抑制率基本保持在90%以上,并且随着发酵时间的延长,抑制率升高。在发酵第20 d,抑制率达到97.8%。未发酵的牛蒡根对α-淀粉酶的抑制率较低,仅为4.17%,在发酵后随着发酵时间的延长,抑制率升高(见图1A和1B),在发酵第20 d,抑制率达到32.1%。该结果表明可以通过调整发酵时间调节牛蒡根对两种酶的抑制活性。牛蒡子中的咖啡酰基奎宁酸类成分对α-葡萄糖苷酶有抑制作用,其中5-O-咖啡酰基奎宁酸(绿原酸)和3, 5-O-二咖啡酰基奎宁酸(异绿原酸A)的抑制作用优于3-O-咖啡酰基奎宁酸(新绿原酸)和3, 4-O-二咖啡酰基奎宁酸(异绿原酸B)[19],小鼠在体实验表明咖啡酸能够抑制小鼠体内α-葡萄糖苷酶活性[20];此外,咖啡酰奎宁酸类物质能够抑制α-淀粉酶的活性,双咖啡酰基奎宁酸的效果优于单取代咖啡酰基奎宁酸[21],绿原酸的半数抑制浓度(IC50)是咖啡酸的5倍[22],牛蒡根经黑曲霉发酵后对α-葡萄糖苷酶和α-淀粉酶的抑制作用升高可能与该类成分的含量变化有关。
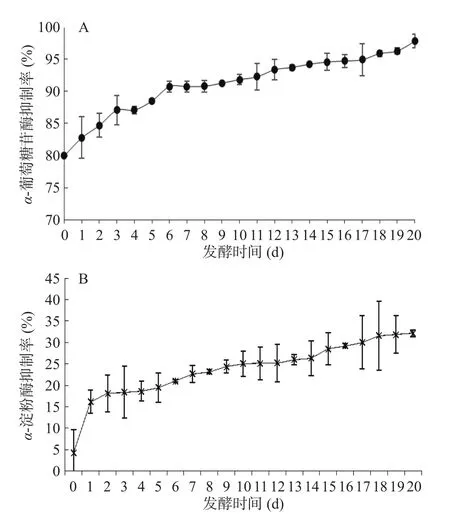
图1 黑曲霉发酵牛蒡根对α-葡萄糖苷酶(A)和α-淀粉酶(B)的抑制作用Fig.1 Inhibition effect of of Arctium lappa roots fermented by Aspergillus niger on α-glucosidase(A) and α-amylase (B)
2.2 牛蒡根发酵品的化学成分
2.2.1 HPLC分析牛蒡根发酵品的化学成分 采用HPLC分析牛蒡根发酵品中的化学成分,HPLC指纹图谱见图2,共匹配出23个共有峰,各谱图与对照谱图的相似度在0.21~0.74,表明经过黑曲霉发酵后牛蒡根中的化学成分发生变化。将谱图信号转换为包含峰面积和保留时间数据表进行PCA和PLS-DA等多元统计分析。
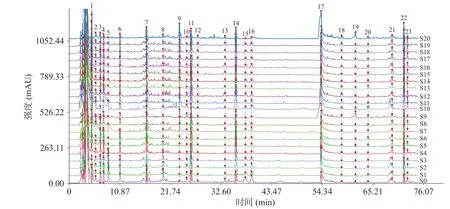
图2 牛蒡根发酵品的指纹图谱Fig.2 Fingerprint of fermented Arctium lappa root
2.2.2 牛蒡根发酵品化学成分的PCA分析 对牛蒡根发酵品中的化学成分进行PCA分析,结果见图3。根据各样品在图中的分布情况可知,牛蒡根发酵品依其化学组成及发酵时间可大致分为三组,即第一组(1~5 d)、第二组(6~14 d)、第三组(15~20 d)。对数据进一步进行PLS-DA分析,表明峰8、9、14的VIP值较大(见图4),是区分不同发酵阶段牛蒡根发酵品的主要成分。通过与对照品进行比对,将峰8、9、14确认为绿原酸、咖啡酸和异绿原酸A。牛蒡根在发酵后对α-葡萄糖苷酶和α-淀粉酶的抑制作用发生变化可能与这些化学成分有关。
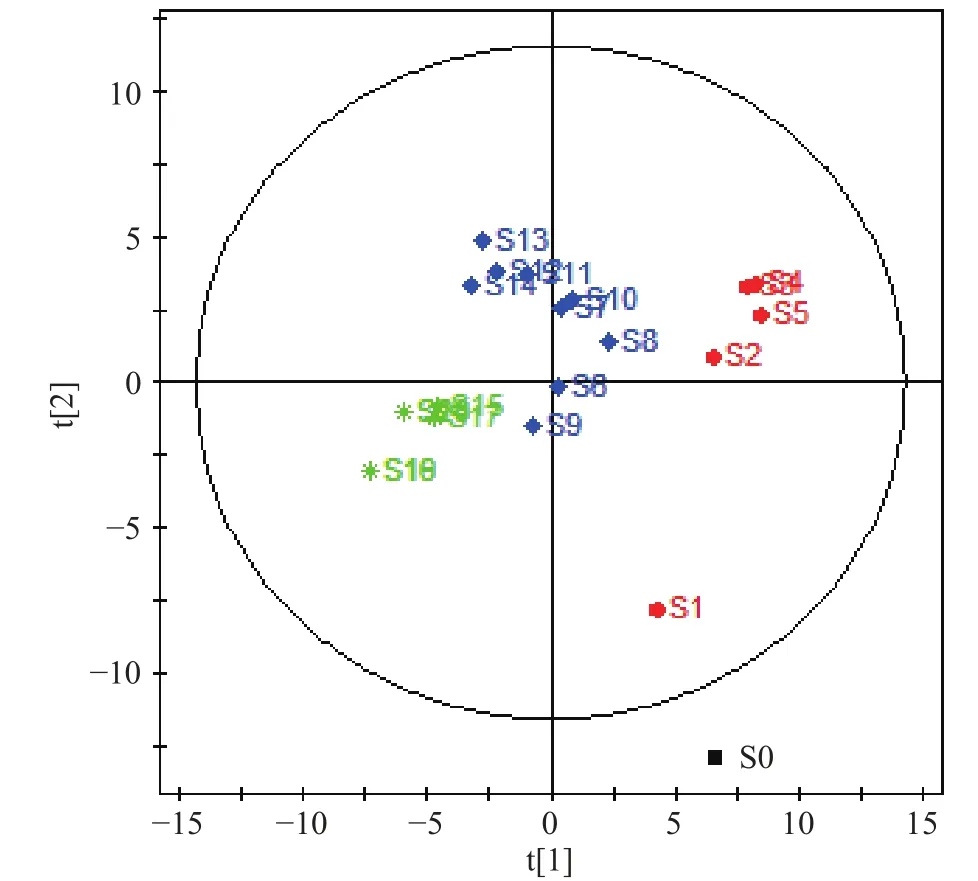
图3 牛蒡根发酵品化学成分的PCA分析(R2X:0.66, Q2:−0.0345)Fig.3 Principal component analysis (PCA) scores plots A for fermented Arctium lappa(R2X: 0.66, Q2: −0.0345)
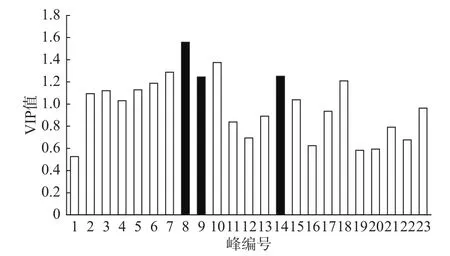
图4 牛蒡根发酵品化学成分PLS-DA分析中的VIP值Fig.4 Variables with VIP values generated from PLS-DA of fermented Arctium lappa
2.2.3 牛蒡根发酵品中绿原酸、咖啡酸和异绿原酸A的含量测定 牛蒡根发酵品中的绿原酸、咖啡酸和异绿原酸A的含量变化趋势如图5所示。绿原酸的含量在牛蒡根发酵过程中逐渐升高,从最初的0.26 mg/g(0 d) 升至0.54 mg/g(18 d),随后略有降低。在未发酵的牛蒡根中咖啡酸的含量仅为0.003 mg/g,远低于绿原酸的含量;在发酵的第4 d,咖啡酸含量即升至0.22 mg/g,并且在整个发酵过程中不断升高,在第20 d,达到0.44 mg/g。异绿原酸A的含量在未发酵牛蒡根中为0.56 mg/g,在发酵的第11 d升至0.69 mg/g,随后保持在0.62~0.68 mg/g之间。与绿原酸和咖啡酸不同的是,异绿原酸A的含量升高趋势不如绿原酸和咖啡酸明显。由于异绿原酸A是由两分子咖啡酸和一分子奎宁酸组成,并且可以分解为绿原酸,因此在发酵过程中释放出的异绿原酸A有可能分解为咖啡酸或绿原酸,导致其含量上下波动[23−24]。
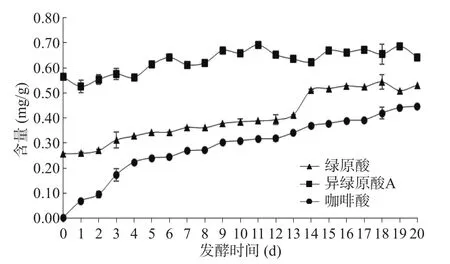
图5 牛蒡根发酵品中的绿原酸、咖啡酸和异绿原酸A的含量Fig.5 Contents of chlorogenic acid, caffeic acid, and isochlorogenic acid A in fermented Arctium lappa
2.3 牛蒡根发酵品对α-葡萄糖苷酶抑制活性与化学成分相关性分析
前两部分的实验结果表明,牛蒡根经黑曲霉发酵后对α-葡萄糖苷酶抑制活性的提升与绿原酸、咖啡酸、异绿原酸A以及糖含量变化有关。相关性分析结果表明,牛蒡根发酵品对α-葡萄糖苷酶和α-淀粉酶的抑制作用与绿原酸、咖啡酸、异绿原酸A含量极显著相关(P<0.01)(见图6)。对牛蒡子中的α-葡萄糖苷酶抑制剂的筛选结果表明,咖啡酰基奎宁酸类成分是牛蒡子的降糖成分,在体外实验中异绿原酸A的活性最强,而在体内实验中绿原酸的活性最佳[19]。绿原酸和异绿原酸A在体内约有1/3被吸收入血,
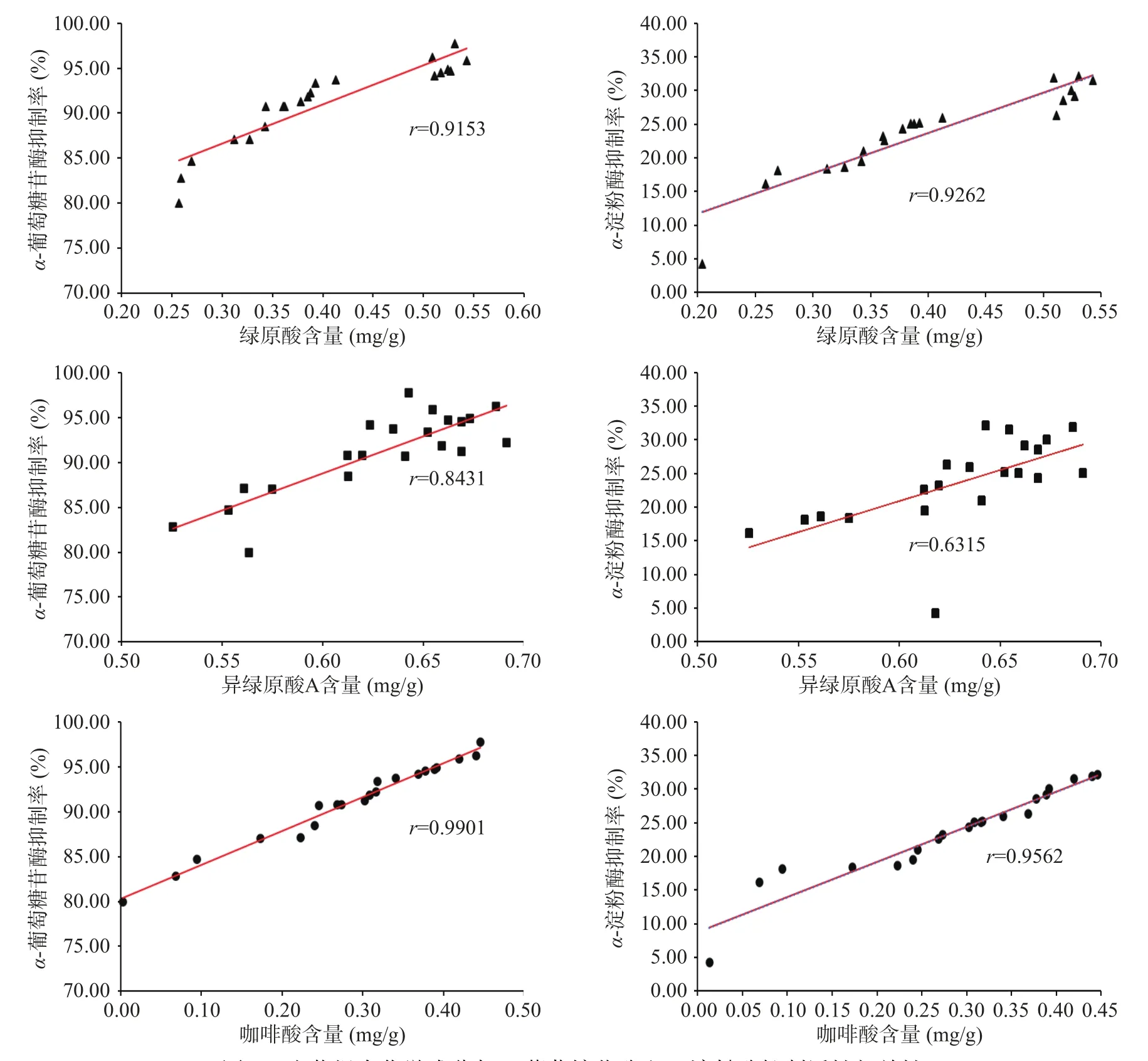
图6 牛蒡根中化学成分与α-葡萄糖苷酶和α-淀粉酶抑制活性相关性Fig.6 Correlation between AL chemical composition and α-glucosidase and α-amylase inhibitory
此外还可在小肠中糖苷酶和酯酶的作用下生成奎宁酸和咖啡酸[25−27]。咖啡酸能降低2型糖尿病大鼠的空腹血糖[28]。发酵牛蒡根对α-葡萄糖苷酶和α-淀粉酶抑制作用的增强与牛蒡根经发酵后绿原酸、咖啡酸以及异绿原酸A等酚酸类成分的含量升高有关,与文献报道的该类成分在体内体外模型中具有降糖活性的研究结果相吻合。相关性分析结果表明黑曲霉发酵牛蒡根的酶抑制活性变化与其化学成分变化相关,二者均与发酵时间有关。
3 结论
本研究对不同发酵时间的黑曲霉发酵牛蒡根中的化学成分及其对α-葡萄糖苷酶的抑制作用进行研究。经过发酵后,牛蒡根对α-葡萄糖苷酶抑制率最高可提升17.8%(20 d),对α-淀粉酶的抑制率可提升27.9%(20 d),绿原酸、咖啡酸、异绿原酸A的含量分别可达到发酵前的2.1(18 d)、148.7(20 d) 和1.2(11 d)倍,相关性分析结果表明牛蒡根对α-葡萄糖苷酶和-淀粉酶的抑制作用与该三个成分的含量相关。控制发酵时间能够使牛蒡根对α-葡萄糖苷酶和-淀粉酶的抑制活性提升。此外,绿原酸、咖啡酸、异绿原酸A的含量在牛蒡根发酵初期明显升高,因此牛蒡根发酵品也可作为咖啡酰基奎宁酸的制备原料。
