两种富硒黄牛肝菌伞多糖的制备、表征及其抗氧化活性
2022-05-13刘韫滔李林键刘爱平李小林唐自钟纪昌联
刘韫滔,李林键,李 诚,李 琴,曾 珍,刘爱平,李小林,唐自钟,纪昌联
(1.四川农业大学食品学院,四川 雅安 625014;2.四川省食用菌研究所,四川 成都 610066;3.四川农业大学生命科学学院,四川 雅安 625014;4.成都雅乐鲜生物科技有限公司,四川 成都 610400)
硒(Se)是人体所必需的一种微量元素,按化学形态主要分为无机硒和有机硒,无机硒主要指硒酸钠、亚硒酸钠和二氧化硒,而有机硒一般以硒蛋白和硒氨基酸等形式存在[1]。大量研究发现硒元素具有抗氧化、降血糖、抗癌、抑菌等多种生物活性[2-3],若机体缺硒则会引发大骨节病、心血管疾病和癌症等多种疾病[4],所以合理地补充硒元素可以增强人体免疫力,从而有效预防甚至治疗这些疾病。但是由于硒元素的推荐摄入量与可耐受最高摄入量非常接近,极易导致硒中毒,从而限制了其在膳食补充剂中的进一步应用。因此,研究开发高效低毒的富硒制剂意义重大。
硒多糖是一类由硒和多糖共价结合而形成的功能性多糖,与无机硒相比,硒多糖具有毒性低、副作用小、生物利用度高等优点[5],更易被机体吸收利用。有研究报道,通过亚硒酸酯化修饰获得的硒多糖[6-8]不但保留了多糖的基本结构和生物功能,而且使其更容易被吸收利用,提高了硒元素的生物利用度,从而表现出比硒元素和多糖本身更高的抗氧化、降血糖和免疫调节活性。例如,Feng Haibo等[9]制备的川明参硒化多糖可以促进脾细胞增殖,增加T淋巴细胞的活性,显著提高免疫活性。纳米硒是一种红色胶体状态的单质硒,与硒酸盐和亚硒酸盐化合物相比,纳米硒具有更高的生物活性、安全性以及生物相容性,纳米硒的功能活性通常具有尺寸效应,即粒径越小,活性越高。但是化学合成的纳米硒并不稳定,在水溶液中极易发生聚集或转化为其他不活跃的形式,从而影响其生物活性[10-13]。因此,为提高纳米硒的稳定性,近年来,多种多糖已被广泛用于修饰还原反应中最初形成的纳米硒粒子。
牛肝菌是牛肝菌科的大型野生药食两用真菌,其肉质肥美、营养丰富,被誉为“四大名菌”之一,含有多糖、多酚等活性物质,具有较好的抗氧化功能。主要分为白、红、黄、黑牛肝菌和美味牛肝菌[14-15]。其中黄牛肝菌(Suillellus luridus)主要分布在我国云南和四川两省,不仅富含蛋白质、碳水化合物、矿物质等营养物质,同时含有多种活性成分。本课题组前期研究发现,黄牛肝菌伞多糖(polysaccharides fromSuillellus luridus,SLPC)表现出较好的抗氧化、抗糖尿病等生理活性[16]。如果能将具有强抗氧化活性的SLPC与硒元素结合,很可能会显著提高多糖和硒单独表现出来的生物活性。然而目前鲜见关于这方面的研究报道,因此一方面可以通过亚硒酸酯化修饰SLPC制备硒多糖,降低硒的毒性和副作用,提高多糖的生物活性;另一方面SLPC也可作为分散剂,对纳米硒进行表面修饰,制备纳米硒-多糖复合物,提高硒纳米粒子稳定性的同时增加其生物活性,从而为富硒产品的开发提供新思路。
本研究以SLPC为原料,采用HNO3-Na2SeO3法进行亚硒酸酯化修饰制备硒化多糖(selenide polysaccharides fromSuillellus luridus,Se-SLPC),利用高效液相色谱、傅里叶变换红外光谱、核磁共振等对Se-SLPC的理化性质和结构特性进行表征;以SLPC为分散剂,以VC还原亚硒酸钠制备纳米硒-多糖复合物(nano-seleniumpolysaccharides fromSuillellus luridus,SLPC-SeNPs),通过纳米粒度仪和透射电子显微镜对SLPC-SeNPs的粒径和表面形貌进行表征。此外,评价Se-SLPC和SLPCSeNPs的体外抗氧化活性,探讨多糖结构和生物活性之间的构效关系,旨在为黄牛肝菌资源开发提供理论参考,也为研发安全高效的补硒制剂提供数据支撑。
1 材料与方法
1.1 材料与试剂
黄牛肝菌子实体采自于四川省。选取黄色(包括褐黄色、橘黄色、暗黄色等)、伞形完整无外伤的菌株,加冰袋运至四川农业大学食品学院。
1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)、邻苯三酚(分析纯) 上海泰坦科技股份有限公司;2,2’-联氮-双-(3-乙基苯并噻唑啉-6-磺酸)(2,2’-azino-bis(3-ethylbenzothiazoline-6-sulfonic acid),ABTS) 生工生物工程(上海)股份有限公司;亚硒酸钠(分析纯) 山东西亚化学工业有限公司;抗坏血酸(分析纯) 上海桑康生物技术有限公司;其余试剂均为国产分析纯。
1.2 仪器与设备
NICOLET IS10傅里叶变换红外光谱仪 美国赛默飞仪器有限公司;Nano-Zs90纳米粒度仪 英国Malvern公司;Libra 200FE透射电子显微镜 德国卡尔蔡司股份公司;DF-101S集热式恒温加热磁力搅拌器 河南予华仪器有限公司;DSA100-GL1超声波清洗机 福州德森精工有限公司;AB1104-N电子分析天平、DELTA320 pH计瑞士Mettler Toledo公司;400 MHz型核磁共振(nuclear magnetic resonance,NMR)仪 德国Bruker公司。
1.3 方法
1.3.1 黄牛肝菌伞多糖的分离纯化
根据本课题组前期报道的方法[17]分离纯化得到SLPC。
1.3.2 亚硒酸酯化多糖的制备
参考Liu Yuntao等[18]的方法,称取200 mg SLPC置于300 mL三颈烧瓶中,加入100 mL体积分数0.5%的HNO3溶液,磁力搅拌15 min使多糖完全溶解。加入200 mg亚硒酸钠,再加入1.00 g BaCl2,70 ℃磁力搅拌7 h后冷却至室温。用饱和Na2CO3溶液调节该反应液pH值至6.0后,加入10.0 mL 1.0 mol/L的Na2SO4溶液,振荡均匀后离心(3 000 r/min、10 min)去沉淀,上清液透析(截留分子质量1 kDa)后减压浓缩,加入3 倍体积无水乙醇充分沉淀,离心(3 000 r/min、10 min)取沉淀冷冻干燥后即得Se-SLPC。
1.3.3 纳米硒多糖的制备
参考Liu Yuntao等[12]的方法,将5 mL SLPC溶液(1.0 mg/mL)与5.0 mL 0.01 mol/L亚硒酸钠在25 ℃下磁力搅拌混合均匀,超声(80 W、40 kHz)处理60 min。然后,将5.0 mL现配的抗坏血酸溶液(0.04 mol/L)缓慢加入到上述混合物中,用NaOH和CH3COOH调节反应体系的pH值至7.0,待反应2 h后即得到SLPC-SeNPs复合体。利用纳米粒度仪测定刚制备的SLPC-SeNPs复合体的粒径。同时用等体积的超纯水代替SLPC溶液,以相同方法制备无SLPC作分散剂的SeNPs作为对照。
1.3.4 含硒量的测定
硒化多糖的含硒量由电感耦合等离子体质谱分析测定。仪器工作参数:入射功率1 100 W、等离子体气流量15 L/min、载气流量1.06 L/min、辅助气体流量1.2 L/min、氦气流量0.5 mL/min、雾化室温度为2 ℃、采样深度2.5 mm、采样速率0.5 L/min。
1.3.5 分子质量测定
样品分子质量由高效液相凝胶渗透色谱分析测定。色谱条件:TSK Gel G 5000 PWxl色谱柱(7.8 mm×30 cm),2410型示差折光检测器,以超纯水作为流动相,流速为0.8 mL/min,柱温为30 ℃,进样量为10 μL。
取不同分子质量的葡聚糖标准品2 mg溶于1 mL超纯水中,振荡混匀,按照上述仪器条件进行测定,以保留时间为横坐标,lgmw为纵坐标,绘制葡聚糖分子质量的标准曲线。称取2 mg硒多糖样品按照上述操作步骤测定分析。通过标准曲线和样品的保留时间,得出样品的分子质量。
1.3.6 单糖组成测定
采用气相色谱分析测定单糖组成,根据Liu Yuntao[19]和Gao Yingying[20]等的方法,采用糖腈乙酸酯衍生化法对水解产物进行衍生化:称取10.0 mg的Se-SLPC样品溶于2.0 mL 2 mol/L三氟乙酸中,110 ℃水解2 h后除去剩余的三氟乙酸,样品进行真空干燥后加入具塞试管内,加入10.0 mg盐酸羟胺和0.5 mL吡啶,置于90 ℃烘箱内加热30 min后,冷却至室温,加入0.5 mL乙酸酐,90 ℃反应30 min,所得产物进行气相色谱分析。气相色谱条件:PEG-20M毛细管柱(30 m×0.53 mm),检测器为火焰离子化检测器;升温程序为初始温度150 ℃保持3 min,以3 ℃/min的升温速率升至240 ℃,保持20 min,氮气流量40 mL/min、氢气流量30 mL/min、空气流量400 mL/min。以葡萄糖、半乳糖、海藻糖、吡喃木糖、阿拉伯糖和甘露糖为标准品绘制标准曲线,根据保留时间和峰面积确定单糖种类和各单糖的相对含量。
1.3.7 傅里叶变换红外光谱分析
Se-SLPC的红外光谱图由傅里叶变换红外光谱仪进行测定,取1.0 mg样品与溴化钾粉末以质量比1∶100混合,研磨均匀后压片检测,扫描波数范围为4 000~400 cm-1。
1.3.8 核磁共振分析
取50.0 mg的Se-SLPC样品用D2O溶解后冻干(重复3次),溶于1.0 mL D2O中加入核磁管中。采用400 MHz型NMR仪在室温下分析1H NMR和13C NMR谱。
1.3.9 SLPC-SeNPs的表征
1.3.9.1 透射电子显微镜观察
采用透射电子显微镜分别对SLPC-SeNPs和SeNPs的表面形貌进行表征,放大倍数分别为20 000、40 000。
1.3.9.2 SLPC-SeNPs的稳定性测定
采用马尔文纳米粒度仪的动态光散射模式分别测定SLPC-SeNPs溶液在不同贮存时间(0、20、40、60、80、100、120 d)、温度(4、25、37 ℃)和pH值(2、4、6、8、10、12)条件下的粒径,根据粒径变化探究SLPC-SeNPs的稳定性。
1.3.10 体外抗氧化活性测定
1.3.10.1 DPPH自由基清除活性
1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)自由基清除率的测定根据Blois[21]的方法并略作修改,取不同质量浓度多糖样品及VC溶液各2.0 mL,分别加入2.0 mL 0.2 mmol/L DPPH-乙醇溶液,混合均匀后在室温下避光静置30 min,在517 nm波长处测定样品吸光度,以VC作为阳性对照,按照公式(1)计算DPPH自由基清除率。
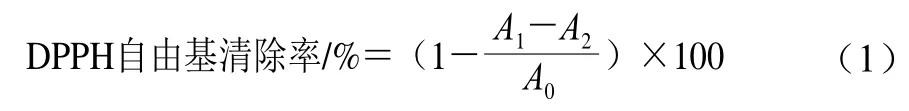
式中:A1为样品+DPPH-乙醇溶液的吸光度;A2为样品+无水乙醇的吸光度;A0为无水乙醇+DPPH-乙醇溶液的吸光度。
1.3.10.2 ABTS阳离子自由基清除活性
ABTS阳离子自由基清除率的测定根据的Cai Wenfei等[22]的方法并略作修改,取不同质量浓度的多糖样品溶液和VC溶液各1.0 mL,分别加入4.0 mL ABTS工作液,混合均匀后置于暗处反应6 min,于734 nm波长处测定样品吸光度,以VC作为阳性对照,以超纯水代替多糖样品溶液中的ABTS工作液作为空白样品,按照公式(2)计算ABTS阳离子自由基清除率。
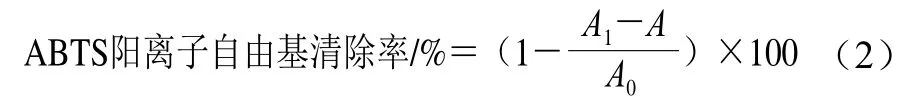
式中:A为不含ATBS工作液样品的吸光度;A0为空白样品的吸光度;A1为含ATBS工作液样品的吸光度。
1.3.10.3 O2-·清除活性
O2-·清除率测定参考Wu Yuntao等[23]的方法并稍作修改,取不同质量浓度的多糖样品溶液和VC溶液各1.0 mL,分别加入4.5 mL 10 mol/L Tris-HCl缓冲溶液(pH 8.2),在25 ℃水浴加热20 min,然后加入0.2 mL 3 mmol/L邻苯三酚溶液,混合均匀后在25 ℃水浴中加热5 min,最后加入8.0 mmol/L HCl溶液终止反应,于325 nm波长处测定样品吸光度,每隔30 s测一次,共测定5 min。绘制时间-吸光度曲线,斜率为邻苯三酚的自氧化速率。以VC作为阳性对照,按照公式(3)计算O2-·清除率。
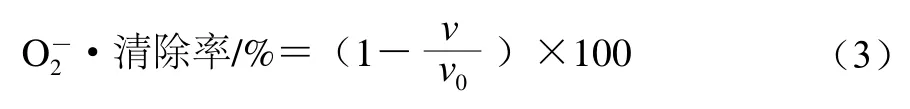
式中:v为加入样品后邻苯三酚的氧化速率;v0为邻苯三酚自氧化速率。
1.4 数据处理与分析
所有实验做3次平行,结果以平均值±标准差表示。用单因素方差分析(One-way analysis of variance,ANOVA)评估统计的显著性,然后进行Tukey检验,P<0.05被认为具有显著性差异。所有统计分析均使用SPSS 22.0软件进行。
2 结果与分析
2.1 黄牛肝菌子实体的形态学鉴定
通过查阅《中国真菌志》[24],对样品进行形态学鉴定。如图1所示,子实体中等大,菌盖直径约5~14 cm,呈半球形,菌盖边缘起初微向下卷,后渐平展;菌盖平滑,表面有短绒毛,以中央最为浓密,菌盖呈黄褐色,盖肉呈黄色,厚约1~3 cm,有菌香气息,伤后变蓝;菌柄呈棒状,或直或微微弯曲,长约6~15 cm,粗约1~3 cm,柄上部呈黄色,向下逐渐变深,基部呈暗黄色。

图1 黄牛肝菌子实体Fig. 1 Fruiting body of Suillellus luridus
2.2 Se-SLPC的理化性质
以SLPC为原料所制得硒化多糖Se-SLPC的含硒量为1.62 mg/g。根据标准分子质量葡聚糖的标准曲线可求得Se-SLPC的平均分子质量为8.2 kDa,由半乳糖(51.30%)、葡萄糖(34.22%)和少量甘露糖(13.48%)组成,其中半乳糖含量最高。有研究表明,以半乳糖或甘露糖为骨架的多糖具有多种生理活性,如免疫调节作用、抗氧化作用、抗炎作用和抗肿瘤活性等[25]。与SLPC(mw=9.4 kDa)[17]相比,Se-SLPC的单糖组成发生了变化,减少的阿拉伯糖可能是因为硒化修饰过程中较强的酸性环境破坏了多糖的结构,部分支链被降解成单糖或者寡糖,在后续透析的过程中被除去[26-27],从而导致分子质量降低,单糖组成减少。
2.3 Se-SLPC的结构表征
2.3.1 傅里叶变换红外光谱分析结果
傅里叶变换红外光谱是分析多糖结构的工具之一,通常用来判定糖环的类型和官能团的类型。根据本课题组前期研究可知,SLPC由α-吡喃葡聚糖和β-吡喃葡聚糖组成[17]。一般来说如果在605(Se=O)、760 cm-1(C—O—Se)和1 610 cm-1(O—Se—O)附近出现吸收峰,则说明亚硒酸基团在多糖上发生了取代反应[18,28]。如图2所示,Se-SLPC在619 cm-1处出现一个新的信号峰,该吸收峰是由Se—O—C伸缩振动造成的[18],表明SLPC被成功硒化,其他吸收峰均可以与SLPC的红外图谱一一对应。
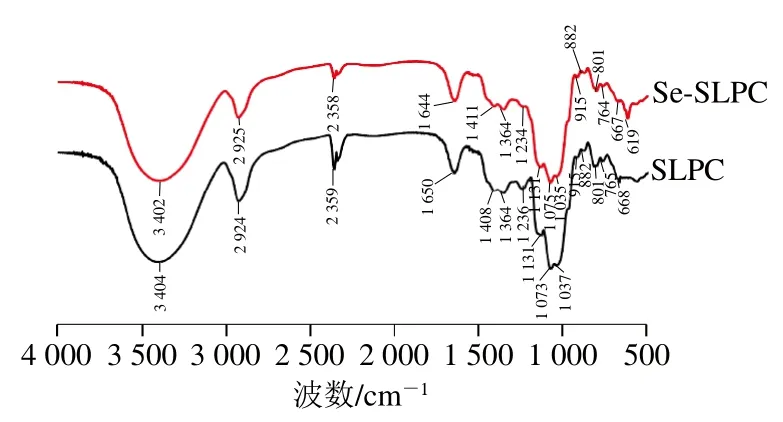
图2 SLPC和Se-SLPC的红外光谱Fig. 2 Infrared spectra of SLPC and Se-SLPC
2.3.2 NMR分析结果
NMR能够提供非常详细的多糖结构信息,包括单糖组成、α或β-异头物的构型、糖链的构成和序列及其构成多糖的糖单元。根据本课题组前期研究可知,SLPC的主链为→6)-α-D-Galp-(1→3)-α-D-Galp-(1→3,6)-α-D-Galpα-D-Galp-(1→6)-β-D-Glcp-(1→3)-β-D-Glcp-(1→3)-α-DGalp-(1→,支链由1,3-β-D-Glcp、1,3-α-L-Arap和1,3-α-DManp组成[17]。如图3所示,与SLPC相比,Se-SLPC在C4位(δ74.78)发生了较大的化学位移,一般来说,发生取代位置所对应碳原子的化学位移会向低场移动[29-30],因此推测亚硒酸基团可能在(1→6)-β-D-Glcp的C4位发生了取代;在δ79.88处出现一个新的信号峰,该峰是C3向低场移动而产生的,SLPC的主链糖苷键连接方式主要为1,3-糖苷键,因此可能在糖苷键连接位点C3处发生了取代反应[29]。综上所述,Se-SLPC在C4位和糖苷键连接位点C3发生非选择性取代。
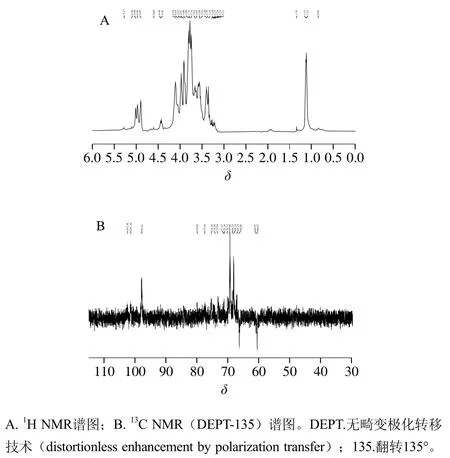
图3 Se-SLPC的NMR谱图Fig. 3 NMR spectra of Se-SLPC
2.4 SLPC-SeNPs的形貌表征结果
用透射电子显微镜分别观察SLPC-SeNPs和SeNPs的表面形貌特征,结果如图4所示。由图4A1、A2可以看出,SLPC-SeNPs呈规则的球状,且复合体分布较为均匀;而没有添加SLPC稳定分散的SeNPs出现明显的团聚现象,且纳米颗粒大小很不均匀(图4B1、B2),证明SLPC可以很好地防止SeNPs聚集,这主要是因为在多糖的分子结构中存在着许多对纳米硒形成、稳定和生长有重要作用的氨基、羟基或羧基基团[25],这些基团可以吸附和包裹纳米硒粒子,从而阻止纳米硒粒子的团聚。例如以壳聚糖[12]、茶多糖[31]以及莲藕渣多糖[32]为分散剂分别制备的硒纳米粒子呈均匀分散的球形结构,且粒径均小于未经表面修饰的SeNPs。

图4 SLPC-SeNPs与SeNPs的表面形貌Fig. 4 Surface morphology of SLPC-SeNPs and SeNPs
2.5 SLPC-SeNPs的稳定性
纳米粒子的粒径及其稳定性是衡量其生物活性和实际应用的关键指标,较小尺寸的纳米粒子比较大的纳米颗粒具有更高的活性[33]。本研究评价了贮存时间、温度和pH值对SLPC-SeNPs稳定性的影响。如图5A所示,刚制备(0 d)的SLPC-SeNPs的粒径为55.46 nm,随着贮存时间的延长,SLPC-SeNPs粒径呈逐渐增大的趋势,当贮存时间延长至100 d时,其粒径显著增大(P<0.05),达到78.90 nm,说明SLPC-SeNPs至少可以在4 ℃下稳定存放80 d左右,具有一定的贮存稳定性。贮存温度对SLPC-SeNPs稳定性的影响如图5B所示,在4 ℃下贮存的SLPC-SeNPs粒径没有明显变化;在25 ℃环境下,SLPCSeNPs的粒径在前15 d无显著变化(P>0.05),25 d后显著增大(P<0.05);而在37 ℃环境下,SLPC-SeNPs的粒径随着贮存时间的延长而显著增大(P<0.05),由此可知,贮存温度会影响SLPC-SeNPs的稳定性。研究表明多糖的黏度会影响纳米硒的稳定性,例如胞外多糖就是因为其较高的黏度从而可以用来稳定纳米硒粒子,而且多糖的黏度随贮存温度的升高而降低[12],因此,SLPC-SeNPs在4、25 ℃和37 ℃下的稳定性差异可能是因为SLPC在4 ℃下的黏度高于在25 ℃和37 ℃下的黏度。新鲜制备的SLPC-SeNPs溶液体系的初始pH值约为6.8(对照),如图5C所示,当溶液pH值为2和4时,SLPCSeNPs的粒径分别显著增加至119.93 nm和104.48 nm,这可能是在强酸条件下SLPC的质子化削弱了SLPC与SeNPs之间的静电相互作用[34-35],从而导致SLPC-SeNPs的聚集。而当pH值在6~12范围内时SLPC-SeNPs的粒径无显著变化。
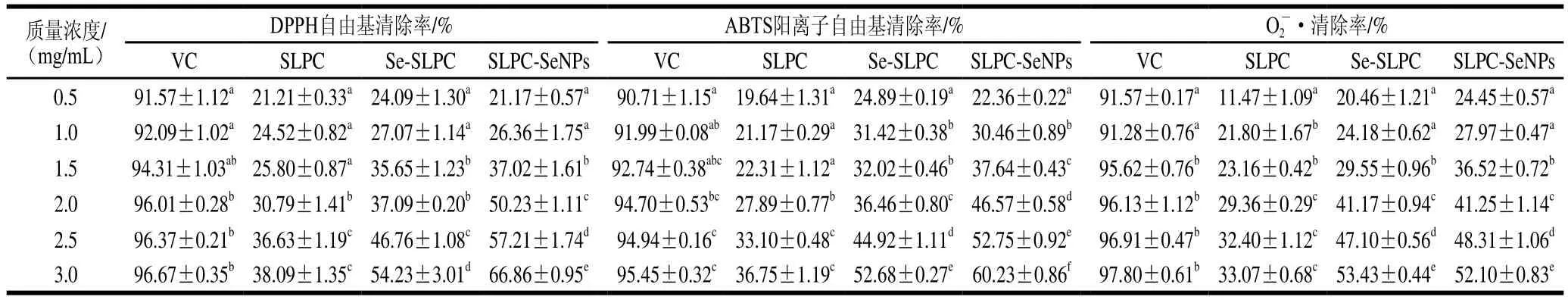
表1 SLPC、Se-SLPC、SLPC-SeNPs的抗氧化活性Table 1 Antioxidant activity of SLPC, Se-SLPC and SLPC-SeNPs
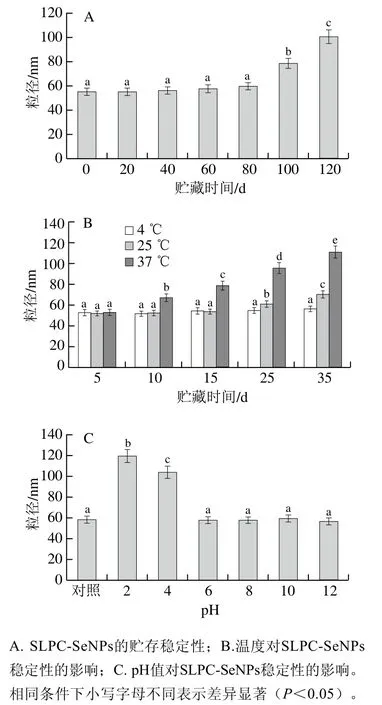
图5 SLPC-SeNPs的稳定性Fig. 5 Stability of SLPC-SeNPs
2.6 两种富硒黄牛肝菌伞多糖体外抗氧化活性
硒化可以通过活化多糖异构碳上的氢原子提高多糖的抗氧化活性,以VC作为阳性对照,通过体外实验分别评价SLPC、Se-SLPC和SLPC-SeNPs的抗氧化活性,结果如表1所示。在质量浓度0.5~3.0 mg/mL范围内,SLPC、Se-SLPC、SLPC-SeNPs对DPPH自由基、ABTS阳离子自由基和O2-·的清除能力均表现出质量浓度依赖性,且Se-SLPC、SLPC-SeNPs的清除能力均强于SLPC。此外,SLPC-SeNPs的体外抗氧化活性整体上略强于Se-SLPC,可能是因为纳米硒具有尺寸效应和表面效应[36]。总之,Se-SLPC和SLPC-SeNPs综合了硒和SLPC的优点,与单一的SLPC相比较大程度提高了抗氧化活性。
3 结 论
本实验以SLPC为原料,分别制备了Se-SLPC和SLPC-SeNPs两种硒-多糖复合物,主要得出以下结论:Se-SLPC的含硒量为1.62 mg/g,由半乳糖、葡萄糖和甘露糖组成,平均分子质量为8.2 kDa,NMR分析结果表明亚硒酸基团在(1→6)-β-D-Glcp的C4位和糖苷键连接位点C3发生了取代。SLPC-SeNPs呈均匀规则的球形结构,粒径为55.46 nm,在4 ℃下能稳定保持至少80 d。乳液、水凝胶等是良好的载体材料,一些复合型乳液或水凝胶具有耐强酸或是温度、pH值响应性释放的功能。在后续的研究中可以考虑采用以多糖、蛋白质、淀粉及其衍生物为原材料制备的乳液或水凝胶作为载体,以包埋、共价结合等形式与SLPC-SeNPs相互作用,减少SLPC-SeNPs在强酸环境中的聚集,从而提高富硒多糖的实际应用价值。此外,Se-SLPC和SLPC-SeNPs的抗氧化活性均显著高于SLPC,是具有良好应用前景的补硒剂和抗氧化剂。
