巴氏灭菌对不同油脂体乳液氧化稳定性的影响
2022-05-13武利春孙禹凡陈亚双闫世长谢凤英齐宝坤
武利春,孙禹凡,陈亚双,闫世长,谢凤英,齐宝坤,*,李 杨,2,*
(1.东北农业大学食品学院,黑龙江 哈尔滨 150030;2.黑龙江绿色食品科学研究院,黑龙江 哈尔滨 150028)
油脂体是植物储藏油脂的细胞器,广泛存在于大豆、葵花、花生等油料作物中,是一种天然的水包油乳液,结构呈球状,球体内部被油脂占据,球体表面被由蛋白质和单层磷脂构成的生物膜包围[1]。油脂体除蛋白质(质量分数0.59%~3.46%)、磷脂(质量分数0.59%~1.57%)和油脂(质量分数94.28%~98.17%)外,还有少量的生育酚和植物甾醇等抗氧化物质[2]。覆盖在油脂体表面的蛋白质能防止油脂体在种子萌芽之前被降解,其中油质蛋白(Oleosin)是含量最多的内源膜蛋白,约占油脂体总蛋白含量的80%,是一种低分子质量(15~26 kDa)碱性蛋白质,其次还有钙化蛋白(27~29 kDa)和甾醇蛋白(39~41 kDa)[2-3]。Oleosin中央疏水肽链嵌入单层磷脂并深入油脂基质中,具有亲水性的N端和C端位于油脂体外表面,将油脂体包裹起来[3-6],油脂体还存在由外源蛋白构成第二层膜,这层膜对维持油脂体稳定起积极作用。Nikiforidis等[7]对比含外源蛋白的玉米胚芽油脂体和不含外源蛋白的玉米胚芽油脂体,得出含外源蛋白的玉米胚芽油脂体平均粒径更低,抗聚集性更好。
许多研究表明油脂体具有良好的乳化性、营养性和稳定性,可被广泛应用于食品、药品和化妆品等乳液体系中,如植物奶[8]、豆腐[9]、蛋黄酱[10]、酶制剂[11]等产品。但在乳液实际加工过程中,灭菌是必不可少的流程。巴氏灭菌是行业内主要的灭菌方式,仅通过简单加热就可达到灭活微生物、抑制酶活力、延长产品保质期和保证产品安全性的目的[12]。诸多研究表明热处理会导致油脂体乳液理化性质发生改变,例如,de Chirico等[13]得出95 ℃加热6 min的油菜籽油脂体脂肪氧化酶活性显著降低,油脂体贮藏稳定性显著提升。Zaaboul等[14]研究表明花生油脂体无论是经巴氏灭菌还是经超高压灭菌,粒径并不会显著改变,而蛋白质、表观黏度和流动指数均发生显著改变。Zhao Luping等[15-16]研究发现立即对新鲜大豆油脂体进行巴氏灭菌,油脂体稳定性可显著提升。目前,研究者多集中对一种油脂体的理化性质研究,而对不同来源的油脂体研究较少。
本实验分别选取大豆、葵花籽仁、花生仁、芝麻仁和核桃仁作为原料,通过湿法磨浆的方式从原料中分离富集油脂体,通过测定不同油脂体的基本组成、相关蛋白组成和脂肪酸组成,进而探明巴氏灭菌对不同油脂体乳液特性和氧化稳定性的影响,为油脂体在沙拉酱、植物奶等产品中应用提供参考。
1 材料与方法
1.1 材料与试剂
大豆、花生仁、葵花籽、芝麻、核桃均购于哈尔滨市哈达友谊农贸市场;其他试剂均为分析纯。
1.2 仪器与设备
JJ-2组织捣碎机 常州市国旺仪器制造有限公司;GL-21M高速冷冻离心机 湖南湘仪离心机仪器有限公司;MODEL BE-210型垂直电泳仪 日本BIO CRAFT公司;Gel Doc EZ凝胶成像仪 美国Bio-Rad公司;激光共聚焦显微镜(confocal laser scanning microscope,CLSM) 德国莱卡公司;Zetasizer Nano ZS90型粒度及电位分析仪 英国马尔文仪器有限公司;UV-2600紫外分光光度计 日本岛津公司。
1.3 方法
1.3.1 提取油脂体和制备巴氏灭菌油脂体乳液
参考文献[17]方法提取油脂体并稍作修改,大豆、花生仁、葵花籽仁、芝麻仁、核桃仁预先低温浸泡18 h,籽仁与去离子水按照1∶9(m/V)比例混合磨浆,用4 层纱布过滤,滤液中加入20%(质量分数)蔗糖溶液,接着以14 000×g离心30 min。取上浮乳状物重新分散于20%(质量分数)蔗糖溶液,在相同条件下离心,该步骤重复3次。富集油脂体分散在去离子水中,在相同条件下离心,该步骤重复3次,以除去油脂体中蔗糖,最终上浮乳状液为油脂体。
灭菌油脂体乳液的制备:10 g油脂体分散于90 g含有20 mg/mL叠氮化钠的磷酸盐缓冲液(pH 7.4、10 mmol/L)中,参照文献[14]的方法对油脂体乳液进行巴氏灭菌,10%(质量分数)的油脂体乳液置于85 ℃水浴锅中加热10 min即得灭菌油脂体乳液,以未经巴氏灭菌处理的10%(质量分数)油脂体乳液为对照。
1.3.2 油脂体基本组成测定
对未经稀释的新鲜油脂体进行基本组成的测定,水分质量分数、蛋白质量分数和油脂质量分数分别参照GB 5009.3—2016《食品安全国家标准 食品中水分的测定》[18]、GB/T 31578—2015《粮油检验 粮食及制品中粗蛋白测定 杜马斯燃烧法》[19]、GB 5009.6—2016《食品安全国家标准 食品中脂肪的测定》[20]测定,脂肪酸组成和相对含量的测定参照文献[21]。
1.3.3 提取和表征油脂体相关蛋白
10 g油脂体加入至30 mL冰丙酮中,离心(5 000×g、10 min)取沉淀,按此方法用冰丙酮重复脱脂3次。沉淀物和3 倍体积氯仿-甲醇(体积比2∶1)溶液混合离心(5 000×g、10 min)取沉淀,上述步骤重复3次。最终将沉淀物冷冻干燥,即为油脂体相关蛋白。利用十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)表征相关蛋白。
SDS-PAGE和考马斯亮蓝蛋白质染色参照Nikiforidis等[22]的方法。标准蛋白分子质量为15.0~130.0 kDa。3 mg/mL蛋白溶液与上样缓冲液混合后,沸水浴5 min后上样,上样量15 μL,分离胶和浓缩胶质量分数分别为15%和5%,分离胶和浓缩胶电压分别为80 V和120 V。凝胶经考马斯亮蓝染色液染色30 min后脱色至条带清晰,借助凝胶成像仪进行拍照。
1.3.4 油脂体乳液ζ-电位和平均粒径测定
利用动态光散射法通过Zetasizer Nano ZS90型粒度及电位分析仪测定灭菌前后0.05%油脂体乳液ζ-电位和平均粒径,分散相和连续相的折射率分为1.456和1.330,测定温度25 ℃,平衡时间120 s。
1.3.5 激光共聚焦显微镜观察
在室温下进行CLSM观察,采用Ar/Kr和He/Ne双通道激光模式,激发波长分别是488 nm和633 nm,0.1 g尼罗红和0.01 g尼罗兰溶于1 mL异丙醇后经0.22 μm滤膜过滤后备用。10%油脂体乳液使用磷酸盐缓冲液(pH 7.4、10 mmol/L)稀释15 倍,1 mL样品中加入20 μL尼罗红染液和20 μL尼罗兰染液,混合均匀,染色30 min后,取一滴样品置于放载玻片上,盖上盖玻片并用甘油密封。放大200 倍进行观察,对于大豆油脂体乳液采用超高分辨显微镜,放大63×10 倍观察油脂体乳液分布,镜油数值孔径为1.42。
1.3.6 氢过氧化物值测定
氢过氧化物值(peroxide value,POV)是评价油脂体乳液在储藏期间油脂初级氧化程度的重要指标之一。参考Hu Min等[23]的方法,为加速油脂氧化,10%新鲜油脂体乳液置于45 ℃恒温培养箱中,测定周期14 d,每2 d取样测定一次。将0.3 mL油脂体乳液与1.5 mL异辛烷-异丙醇(体积比2∶1)混合后,漩涡振荡30 s,2 000×g离心2 min。取0.2 mL上清液,加2.8 mL甲醇-正丁醇(体积比2∶1)混合液,加入15 μL 3.94 mol/L的硫氰酸铵和15 μL Fe2+溶液(0.132 mol/L BaCl2和0.144 mol/L FeSO4等体积混合),避光反应20 min,以甲醇-正丁醇(体积比2∶1)混合液为对照,使用紫外分光光度计测定510 nm波长处吸光度。根据标准曲线计算POV,表示每千克油脂体乳液中所含氢过氧化物物质的量(mmol/kg)。以过氧化氢异丙苯作标准物曲线,标准曲线方程为y=0.451 1x-0.072 7,R2=0.990,其中y为吸光度,x为POV。
1.3.7 硫代巴比妥酸反应物值测定
硫代巴比妥酸反应物(thiobarbituric acid reactive substances,TBARS)值参考Zhang Haixia等[24]的方法测定。将1 mL油脂体乳液与2 mL TBARS测试液(含150 g/L三氯乙酸、3.75 g/L硫代巴比妥酸和0.25 mol/L盐酸)混合,沸水浴30min后立即冰浴10 min。溶液过0.22 μm滤膜后,使用紫外分光光度计测定532 nm波长处的吸光度,以1,1,3,3-四乙氧基丙烷作标准物,标准曲线方程为y=0.051 1x+0.048 3,R2=0.991,其中y为吸光值,x为TBARS值。
1.4 数据处理与分析
实验设置3个平行,结果表示为平均值±标准差,采用SPSS 26.0软件进行数据处理,采用单因素方差分析中的邓肯检验对数据进行差异显著性分析,P<0.05表示差异显著。采用Origin 8.0软件作图。
2 结果与分析
2.1 油脂体基本组成
不同油脂体的基本组成如表1所示,在不同油脂体中,大豆油脂体蛋白质量分数和水分质量分数最高,油脂质量分数最低,这可能是由于大豆油脂体有更多的蛋白质与自由水结合[25]。葵花、花生、芝麻和核桃油脂体的油脂质量分数和蛋白质量分数无显著差异,不同油脂体水分质量分数差异可能是由于油脂体中磷脂含量不同[25]。大豆油脂体的蛋白与油脂质量分数之比(0.136)最大,而葵花(0.045)、花生(0.041)、芝麻(0.045)、核桃(0.044)油脂体的蛋白与油脂质量分数之比无明显差异,从油脂体结构上分析,油脂体中蛋白与油脂质量分数之比越大,油脂表面有更多蛋白质,油脂体更稳定[5]。

表1 不同油脂体基本组成Table 1 Basic composition of oil bodies from various crops
2.2 不同油脂体相关蛋白组成
油脂体相关蛋白SDS-PAGE结果如图1所示,所有油脂体蛋白均显示出内源膜蛋白质(分子质量15~25 kDa)条带和外源蛋白质(分子质量大于41 kDa)条带。大豆油脂体内源膜蛋白相对分子质量为15~25 kDa,相关报道鉴定16、18、24 kDa蛋白条带是大豆油脂体Oleosin的3种同源体[26]。葵花油脂体内源膜蛋白分子质量低于大豆油脂体,条带集中分布在15~20 kDa,这与Nikiforidis等[21]的研究结果一致。花生油脂体内源膜蛋白分子质量为15~20 kDa,17 kDa处条带为花生油脂体Oleosin,97 kDa处条带为花生脂肪氧化酶,这与Zaaboul等[14]的研究结果相似。芝麻油脂体内源膜蛋白分子质量同样集中在15~20 kDa,15 kDa和17 kDa处条带为芝麻Oleosin(与Jiang[27]、Lin[28]等的结果相似),20~25 kDa条带和30~40 kDa条带分别是芝麻11S球蛋白碱性肽链和酸性肽链,而在分子质量低于15 kDa处观察到的蛋白质条带是2S清蛋白。核桃油脂体Oleosin(15~20 kDa)条带较为模糊,可能是Oleosin含量较低,核桃油脂体外源蛋白条带更加清晰,表明核桃油脂体表面吸附较多外源蛋白。
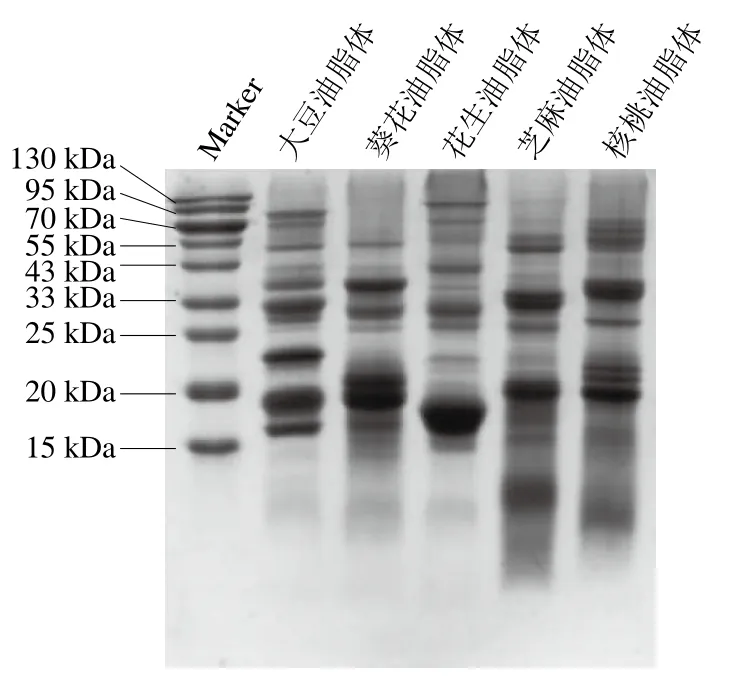
图1 不同油脂体相关蛋白的SDS-PAGE图Fig. 1 Sodium dodecyl sulfate-polyacrylamide gel electrophoresis(SDS-PAGE) profiles of oil bodies-associated proteins from various crops
2.3 不同油脂体的脂肪酸组成及相对含量
不同油脂体脂肪酸组成和相对含量如表2所示,5种油脂体中共检测出17种脂肪酸,脂肪酸组成上存在较大差异,其中相对含量较高的是棕榈酸、硬脂酸、油酸、亚油酸和α-亚麻酸,其中亚油酸和α-亚麻酸是人体必需脂肪酸,具有降血压、降胆固醇和增强免疫力等功效[29]。不同油脂体总饱和脂肪酸相对含量从大到小依次为:花生>大豆>芝麻>葵花>核桃,其中以棕榈酸和硬脂酸为主,占总饱和脂肪酸相对含量的90.22%~97.17%;总单不饱和脂肪酸相对含量从大到小依次为:花生>芝麻>葵花>核桃>大豆,其中以油酸为主,占总单不饱和脂肪酸相对含量的98.04%~99.29%;总多不饱和脂肪酸相对含量从大到小依次为:核桃>大豆>葵花>芝麻>花生,多不饱和脂肪酸全部来源于亚油酸和α-亚麻酸。值得注意的是,不同油脂体中花生油脂体总饱和脂肪酸相对含量(21.27%)最高。此外,核桃油脂体总不饱和脂肪酸相对含量高达90.10%,花生油脂体总不饱和脂肪酸相对含量仅为核桃油脂体的87.47%。脂肪酸的组成和相对含量与油脂氧化具有直接关系,主要是由于油脂氧化是氧气与脂肪酸不饱和双键相互作用,因此含有2个及以上双键的多不饱和脂肪酸氢解离能力更低,更易失去氢原子形成自由基[30],油脂不饱和程度越高,越易氧化,而油脂体可将油脂包裹在蛋白-磷脂膜内,防止油脂和氧气接触,进而抑制油脂氧化。
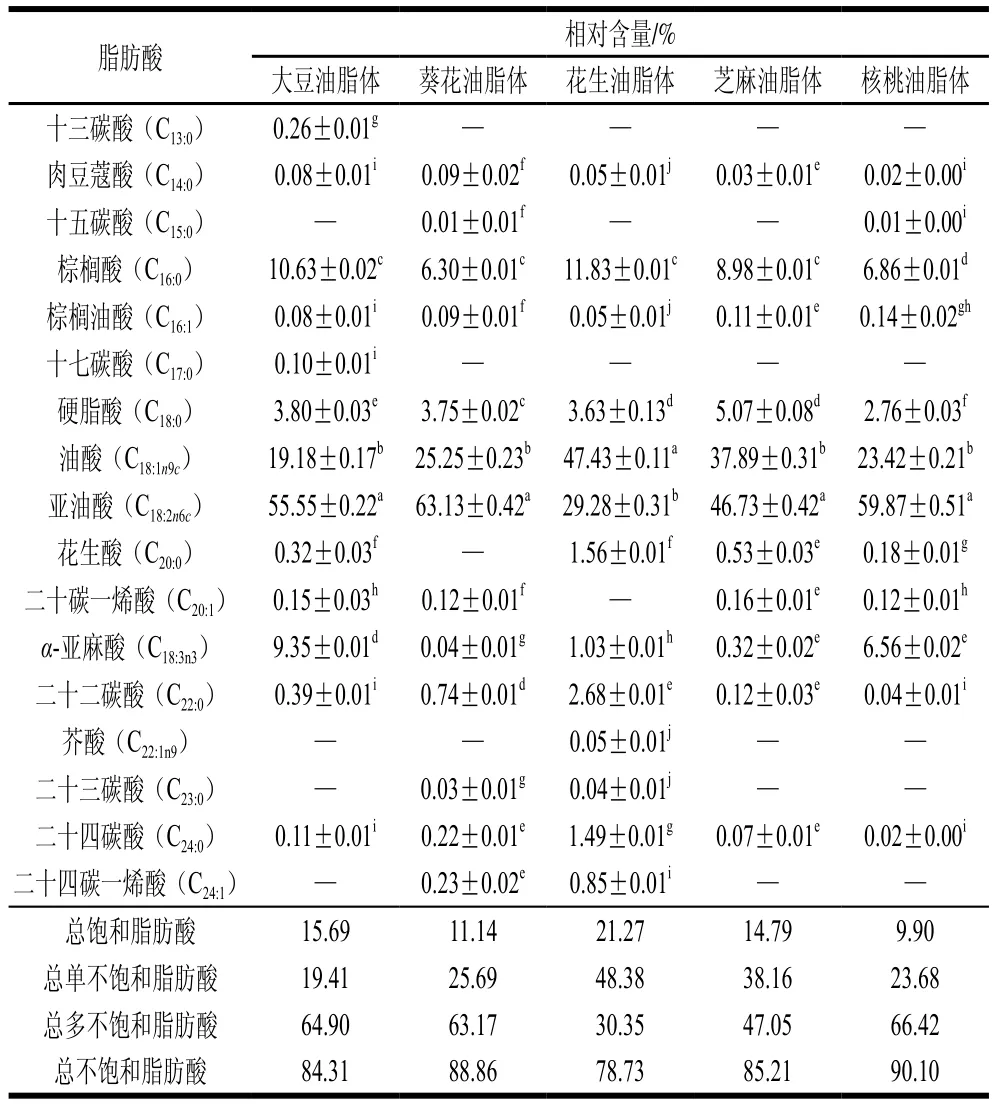
表2 不同油脂体脂肪酸组成及相对含量Table 2 Fatty acid composition of oil bodies from various crops
2.4 巴氏灭菌对不同植物油脂体乳液平均粒径和ζ-电位的影响
巴氏灭菌对不同植物油脂体乳液平均粒径影响如图2A所示,未经灭菌的油脂体乳液平均粒径从小到大依次为:大豆油脂体乳液<葵花油脂体乳液<花生油脂体乳液<芝麻油脂体乳液<核桃油脂体乳液,灭菌后花生油脂体乳液平均粒径为(2.41±0.40)μm,显著增加(P<0.05),可能是由于加热致使油脂体乳液液滴聚集形成大液滴,但核桃油脂体乳液平均粒径变化与花生油脂体乳液相反,灭菌后的核桃油脂体乳液平均粒径为(2.73±0.13)μm,显著减小(P<0.05),可能是加热导致核桃油脂体相关蛋白从油脂体表面脱落,溶液中相关蛋白的浓度增加,致使核桃油脂体乳液分散性变好[31]。大豆、葵花和芝麻油脂体乳液在灭菌后平均粒径无显著变化(P>0.05),表明这些油脂体乳液具有良好的热稳定性,加热不会促进大豆、葵花和芝麻油脂体乳液的聚集[32]。
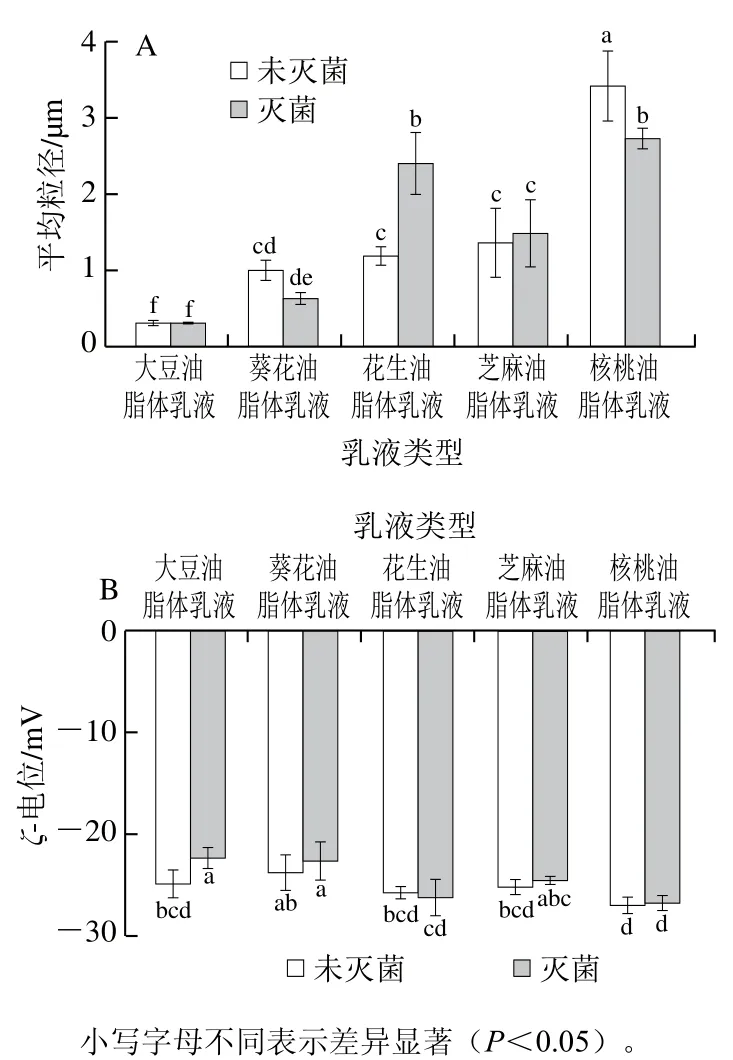
图2 巴氏灭菌对不同油脂体乳液平均粒径(A)和ζ-电位(B)的影响Fig. 2 Effect of pasteurization on average particle size (A) and ζ-potential (B) of oil body emulsions from various crops
巴氏灭菌对不同植物油脂体乳液ζ-电位的影响如图2B所示,未经灭菌的油脂体乳液ζ-电位的绝对值从大到小依次为:核桃油脂体乳液>花生油脂体乳液>芝麻油脂体乳液>大豆油脂体乳液>葵花油脂体乳液,灭菌后的大豆油脂体乳液ζ-电位为(-22.43±1.01)mV,绝对值显著降低(P<0.05),大豆油脂体负电性降低可能是油脂体蛋白构象发生改变,结合负电离子能力减弱,表面电荷密度下降[33]。静电斥力和空间位阻是维持蛋白稳定的乳液的主要作用力,表面电荷减少会导致液滴聚集。但这与图2A中大豆油脂体粒径无显著变化结果相反,这可能是体系表面电荷下降对大豆油脂体粒径影响较小。
2.5 巴氏灭菌对不同植物油脂体乳液微观结构的影响
不同油脂体乳液的微观结构如图3所示,绿色代表蛋白质,红色代表油脂。如图3B1所示,灭菌后的大豆油脂体乳液在蛋白质聚集体的位置出现乳滴聚集,但在视野范围内,这种聚集现象较少,大部分油脂体结构保持完整,灭菌对大豆液滴尺寸无明显影响,这与图2A结果一致,表明大豆油脂体膜结构稳定,巴氏灭菌不足以破坏其结构。
如图3B3所示,灭菌后的花生油脂体乳液粒径增加且油脂信号明显增强,这表明乳液聚集形成大脂滴,而蛋白质的绿色信号弱于红色信号可能是油脂渗出造成两种信号重合。灭菌的花生油脂体乳液呈现规则的圆形,表明灭菌不会显著影响油脂体结构蛋白,油脂体乳液的蛋白质-磷脂膜结构未被破坏,油脂体的整体结构保持完整[3],可能是由于油脂体的Oleosin中央疏水的部位能与带负电荷的磷脂通过盐桥结合,加热不能改变磷脂亲水性和带电性,但会削弱盐桥,而当温度降低时,削弱的盐桥可恢复原有状态[6]。

图3 巴氏灭菌对不同植物油脂体乳液微观结构的影响Fig. 3 Effect of pasteurization on micromorphology of oil body emulsions from various crops
如图3所示,葵花油脂体乳液分布情况与其他4种油脂体乳液存在明显差异,未灭菌的葵花油脂体乳液聚集,在水溶液中分散性较差,这可能是由于在葵花油脂体制备过程中,多次的高速离心步骤使得葵花油脂体形成难以在水溶液中分散的聚集体。灭菌的葵花油脂体乳液分散性得以改善,乳液粒径降低,这与图2A结果一致。图3B2中红色的油脂实体表明葵花油脂体乳液聚集,这种不规则的红色油脂实体与灭菌后的核桃油脂体乳液相似(图3B5),这可能是热处理导致蛋白结构改变,稳定油脂体的蛋白质-磷脂膜被破坏,为减少对蛋白的需求,乳滴以共用膜的方式来稳定油脂[33]。如图3B4、B5所示,芝麻和核桃油脂体乳液在灭菌后出现形状不规则乳滴,表明油脂从油脂体膜内渗漏,这可能是芝麻和核桃油脂体表面膜结构蛋白含量低,灭菌处理导致油脂体膜破裂,油脂渗出[5]。灭菌后的核桃油脂体乳液粒径减小,这与图2A结果一致,可能是由于灭菌致使核桃油脂体乳液中的聚集体以一种更小的聚集体形式存在。
2.6 巴氏灭菌对不同油脂体乳液氧化稳定性的影响
油脂体乳液在加速氧化过程中POV和TBARS值变化规律如图4所示,乳液初始POV和TBARS值均非常小,故而乳液初始油脂氧化可忽略。图4A1中,对于大豆油脂体乳液,随储藏时间延长,未灭菌的大豆油脂体乳液POV先增加后降低,在第8天POV达到最大值(1.62±0.05)mmol/kg,而灭菌的大豆油脂体乳液第14天的POV为(0.53±0.12)mmol/kg;图4B1中,未灭菌大豆油脂体乳液TBARS值从第8天增加速度加快,第14天TBARS值达到最大值(61.35±0.42)μmol/kg,而灭菌的大豆油脂体乳液TBARS值变化不大。说明灭菌可显著改善大豆油脂体乳液的氧化稳定性,这可能一方面是由于灭菌致使大豆油脂体乳液表面负电荷显著减少,油脂体表面与具有促进油脂氧化的金属阳离子相互作用减弱,从而抑制了氧化;另一方面,热处理可能致使大豆油脂体脂肪氧化酶活性降低,氧化脂肪能力下降[13]。
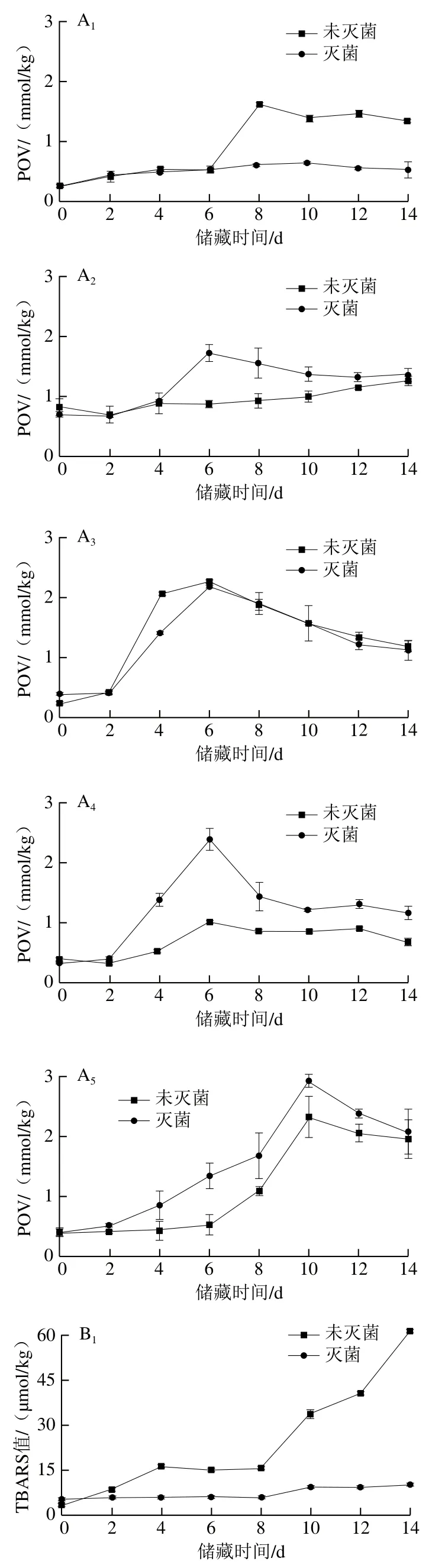
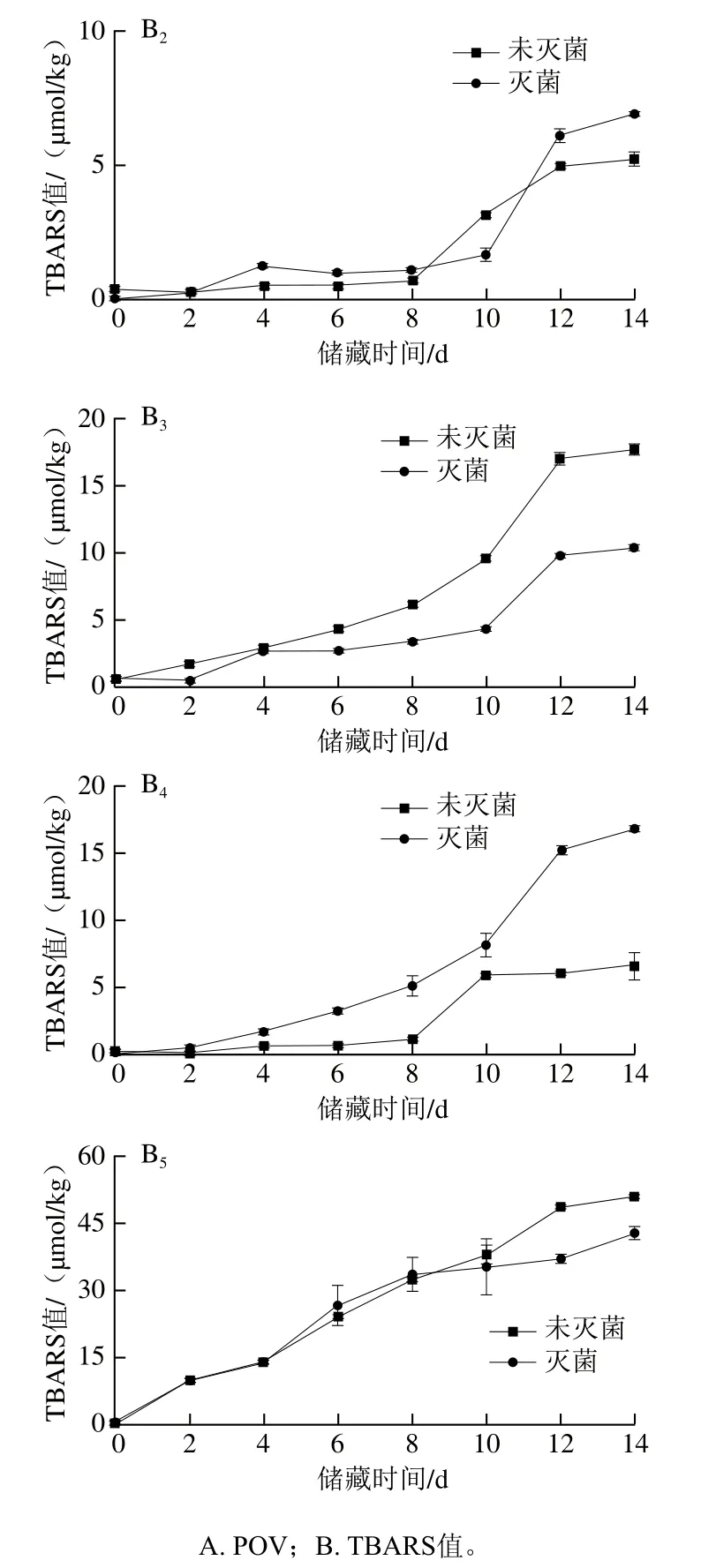
图4 巴氏灭菌对不同油脂体乳液氧化稳定性的影响Fig. 4 Effect of pasteurization on oxidative stability of oil body emulsions from various crops
如图4A3所示,对于花生油脂体乳液,POV随储藏时间延长呈先增加后将降低趋势,在第6天未灭菌和灭菌的花生油脂体乳液POV分别为(2.30±0.04)mmol/kg和(2.20±0.01)mmol/kg;图4B3中,TBARS值随储藏时间延长呈增加趋势,在第14天未灭菌和灭菌的花生油脂体乳液TBARS值分别为(17.79±0.56)μmol/kg和(10.36±0.15)μmol/kg,说明灭菌可显著抑制花生油脂体乳液次级氧化物的生成,这可能是由于灭菌导致花生油脂体乳液的脂肪氧化酶活性降低。花生油脂体乳液TBARS值明显低于大豆油脂体乳液,这可能是由于花生油脂体中与过氧化自由基反应的多不饱和脂肪酸浓度相对较低[30]。
如图4A2、A4、A5所示,对于葵花、芝麻和核桃油脂体乳液,随储藏时间延长,POV呈先增加后降低趋势,灭菌的葵花、芝麻和核桃油脂体乳液最大POV分别为(1.52±0.18)、(2.37±0.18)、(2.91±0.11)mmol/kg,而未灭菌的葵花、芝麻和核桃油脂体乳液最大POV分别为(0.99±0.09)、(1.00±0.03)、(2.33±0.34)mmol/kg。如图4B2、B4、B5所示,这3种油脂体乳液TBARS值随储藏时间延长而增加,未灭菌的葵花、芝麻和核桃油脂体乳液在第14天TBARS值分别为(4.73±0.21)、(6.82±0.95)、(50.76±0.75)μmol/kg,灭菌后分别为(6.21±0.07)、(16.80±0.23)、(42.78±1.53)μmol/kg。结果表明巴氏灭菌会促进葵花、芝麻油脂体乳液氧化,促进核桃油脂体乳液初级氧化并延缓其次级氧化,这可能是由于这3种油脂体乳液的蛋白与油脂质量分数之比较低,乳液热稳定性较差,灭菌破坏了油脂体的蛋白质-磷脂膜,渗出的油脂与氧气接触后自然氧化。
3 结 论
本实验揭示了巴氏灭菌对不同油脂体乳液氧化稳定性的影响,为接下来油脂体乳液在沙拉酱、植物奶等产品应用提供参考。结果表明:1)大豆、葵花、花生、芝麻、核桃的油脂体基本组成、相关蛋白组成和脂肪酸组成存在较大差异,所提取的油脂体相关蛋白包含内源膜蛋白和外源蛋白;2)不同油脂体中,大豆油脂体蛋白质量分数和水分质量分数最高,油脂质量分数最少。花生油脂体总饱和脂肪酸相对含量(21.27%)最高,核桃油脂体总不饱和脂肪酸相对含量(90.10%)最高;3)不同油脂体乳液经巴氏灭菌后表现出不同的理化特性:大豆、葵花和芝麻油脂体乳液经灭菌后平均粒径无显著变化,花生油脂体乳液经灭菌后平均粒径增加,核桃油脂体乳液经灭菌后平均粒径降低,灭菌后的大豆和芝麻油脂体乳液结构完整,而花生油脂体乳液聚集形成大脂滴,葵花和核桃油脂体乳液经灭菌后破乳;4)不同油脂体乳液经巴氏灭菌后表现出不同的氧化特性,巴氏灭菌可显著改善大豆和花生油脂体乳液氧化稳定性,而对葵花、芝麻和核桃油脂体乳液起促进氧化作用。
