Omicron变异株研究进展
2022-05-12陈曜星赖荣陶谢青
陈曜星 赖荣陶 谢青
Omicron变异株在南非卫生部长正式向世界卫生组织报告后,仅2天就被列为VOC。人们做出如此迅速的反应,是因为Omicron在刺突蛋白等关键位点产生了大量突变。而刺突蛋白又介导了病毒感染细胞的过程,也是体液免疫的主要靶标[1]。突变后的Omicron变异株具有高度传染性,截至2021年12月22日,已有110个国家发现了Omicron变异株。此外,Omicron对既往感染或接种疫苗所诱导产生的中和抗体(Neutralizing antibodies, NAbs)敏感性大幅下降[2]。而与先前的VOCs相比,Omicron感染的临床症状有所减轻[3]。Omicron目前已演变出多个亚谱系,其中BA.1(21K进化枝)和BA.2(21L进化枝)是目前主要流行的两种。SARS-CoV-2流行以来已经造成了数百万人的死亡,人们目前对Omicron仍知之甚少。因此,研究Omicron变异株的突变及其特性对于更好地应对新冠疫情至关重要。
一、Omicron变异株的独立进化
Omicron的大多数突变是非同义突变,与氨基酸改变相关,因此是病毒进化正向选择的结果。系统发育分析表明,Omicron是通过趋同进化独立进化而来(图1),但SARS-CoV-2逐步累积突变以适应人类宿主似乎更合理。这就产生了一个问题,即Omicron如何在不被注意的情况下独立进化。目前,研究者提出了三种理论来解释这一现象。第一种理论是新冠病毒在免疫功能低下的个体中长期有效复制。研究者发现,SARS-CoV-2在一个南非HIV感染者体内复制超过了6个月,并形成了类似于VOCs的突变[4]。第二种理论是,Omicron已经在人群中传播了一段时间,但出现在对病毒测序监测较少的国家。第三种理论是,动物被SARS-CoV-2感染后形成了病毒的储存库,病毒在动物中变异进化后再传染给人[5]。目前,这些可能性都不能完全排除,需要进一步研究来阐明Omicron的起源。
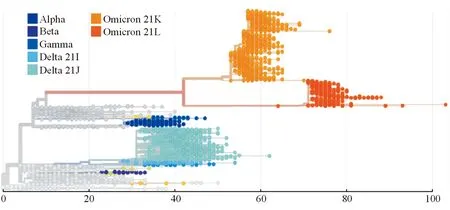
SARS-CoV-2代表性变异株的系统发育分析,进化枝长度与原始病毒株对比的差异成正比。2022年4月15日从Nextstrain获取数据(https://nextstrain.org/ncov/gisaid/global?m=div)。
二、Omicron变异株的基因组改变
(一)Omicron基因组中非刺突蛋白的突变 Omicron基因组中共有约20个氨基酸突变位于刺突蛋白基因之外(图2)。2/3的SARS-CoV-2基因组编码16种非结构蛋白,这些非结构蛋白发挥着天然免疫逃逸、病毒复制、蛋白水解和基因复制校对等重要作用。Omicron的Nsp6中Δ105-107突变可能会促进病毒的天然免疫逃逸[6]。Nsp3、Nsp5两种重要蛋白酶中的突变没有影响活性界面。Nsp7、Nsp8和Nsp12组成了RNA依赖性的RNA聚合酶(RNA-dependent RNA polymerase, RdRp)[7],仅有P323L一个突变。
SARS-CoV-2基因组的3'末端还编码包膜(Envelope, E)、膜(Membrane, M)和核衣壳(Nucleocapsid, N)蛋白,以及多种辅因子。这3种非刺突结构蛋白中都发现了突变。N蛋白中的P13位于一个重要的T细胞表位中,突变可能有助于病毒逃逸细胞免疫[8]。R203K和G204R的突变或与病毒载量和亚基因组RNA表达增高有关[9]。目前E蛋白和M蛋白中的突变对其功能的影响尚不清楚。
(二)Omicron基因组中刺突蛋白的突变 与原始毒株相比,BA.1和BA.2的刺突蛋白有21个相同的氨基酸改变,BA.1和BA.2还分别有13个和8个特异性突变(图3)。刺突蛋白通过与血管紧张素转化酶2(angiotensin-converting enzyme , ACE2)受体及辅因子结合,来介导对细胞的感染。其活化需要先被弗林蛋白酶切割,再被跨膜丝氨酸蛋白酶2(Transmembrane protease serine subtype 2, TMPRSS2)或组织蛋白酶L切割,从而释放出融合肽,通过膜融合入胞[10]。除了决定传染性,刺突蛋白还是疫苗接种和既往感染者抗体的主要靶标。
与原始病毒株相比,Omicron变异株有大量改变位于与ACE2受体直接作用的受体结合模体,这一改变影响了刺突蛋白对ACE2的亲和力。BA.1刺突蛋白RBD中R493、S496和R498与ACE2形成新的盐桥和氢键,从而代偿了K417N突变造成的亲和力丧失[11]。目前的研究认为,与delta变异株相比,Omicron刺突蛋白与ACE2的亲和力更强,这也与Omicron传染性增强的特性相符。
N679K和P681H这两个位于S1/S2附近的突变,增加了弗林蛋白酶对S1/S2的切割,并可能增强了病毒的复制适应性[12]。而与其他VOCs相比,Omicron被TMPRSS2处理效率更低,这也导致了其入胞方式的改变,膜融合率较低,主要通过TMPRSS2非依赖性的内吞途径入胞[13]。
BA.1中Δ69-70缺失可能不仅会增加病毒传染性和刺突蛋白加工[14],还与TaqPath试验中S基因靶基因失效(S-gene target failure, SGTF)有关,这一特殊改变提供了确定BA.1感染的方法[15]。BA.1的ins214EPE突变在其他变异株中都没有观察到,但存在于导致普通感冒的病毒和人类基因组中[16]。
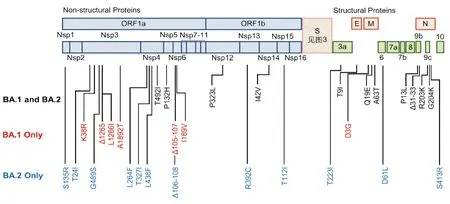
黑色表示共有部分,红色和蓝色分别表示BA.1和BA.2特有的突变。

黑色表示共有部分,红色和蓝色分别表示BA.1和BA.2特有的突变。
三、Omicron变异后的影响
(一)Omicron变异株的传染性 SARS-CoV-2的传染性主要取决于RBD和ACE2的亲和力。Omicron变异株刺突蛋白突变后与ACE2的结合自由能增高,BA.1的累计变化为2.60 kcal/mol,表明病毒传染性为原始病毒株的13倍、delta的2.8倍[17];BA.2更甚于BA.1,传染性为其1.5倍[18]。
这与真实世界的流行情况一致,Omicron变异株的倍增时间很短。根据一些国家的早期估计,其倍增时间约为2.4 d(英国)、2.0 d(丹麦)和3.0 d(澳大利亚)[19]。2021年11月底,英国发现了两例 Omicron患者,并在1个月后完全取代了delta变异株;BA.2于2022年1月出现,目前已占所有感染者的90%以上[20]。因此,Omicron是目前为止传染性最强的变异株。
(二)Omicron变异株感染后的临床严重程度 动物研究表明,由于TMPRSS2 在肺泡上皮中高表达[21],在刺突蛋白对TMPRSS2的利用减少后,Omicron更倾向于感染上呼吸道,引起的肺组织病理变化更弱,在小鼠中致死率更低[22]。
临床研究也证实,Omicron感染所引起的症状较轻。与delta变异株感染者相比,Omicron变异株引起的临床症状更轻,住院率更低(1.9% vs 2.6%,P=0.03),急性症状持续时间更短(6.87 vs 8.89 d,P <0.0001)[23],住院患者需要接受氧疗的比例也大幅下降(17.6% vs 74%,P<0.001)[3]。
从基础到临床的研究结果均表明,相较于其他SARS-CoV-2,Omicron变得更为“温和”。
(三)Omicron变异株的免疫逃逸性 Omicron变异株在RBD部位的大量突变使其传染性增加,而且由于构象变化,大多数疫苗接种或既往感染产生的NAbs无法有效结合RBD,因此Omicron表现出惊人的NAbs逃逸能力。研究证明,247种人类RBD 靶向的NAbs中有超过85%被Omicron逃逸[24]。在康复者的血浆样本中,与原始病毒株相比,Omicron的50%中和滴度(50% neutralization titer, NT50)降低了32%~58%。此外,在接种两针mRNA疫苗后1.3个月,Omicron的NT50比原始病毒株低了127倍[25]。
Omicron的RBD构象改变使其对记忆B细胞(memory B cell, MBC)也发生了严重的逃逸,所以MBC无法在NAbs滴度下降后进行迅速有效的补充。研究发现,mRNA疫苗接种者和既往感染者在接种或感染100 d后,仅有30%特异性MBC分泌的IgG对Omicron的RBD具有亲和力。尽管如此,MBC的保护力并没有完全丧失,所有受试者都仍然能够产生有效中和Omicron的MBC克隆[26]。而绝大多数已知的T细胞抗原表位保守,因此T细胞对Omicron的识别得到了保留。在接种疫苗后约6个月的受试者中,84%的CD4+和85%的CD8+T细胞对Omicron的应答被保留[27]。T细胞反应的保存可能在对不同突变株的预防中发挥了重要作用。
如何应对Omicron免疫逃逸的问题,是下一步的研究方向。越来越多的研究显示,疫苗加强针可加强对Omicron变异株的中和作用[28]。还有研究表明,第三剂疫苗采用混打可取得更好的效果[29]。英国卫生部开展了疫苗对于Omicron有效性的回顾性研究发现,AZD1222两剂接种20周后对预防Omicron无效,BNT162b2在两剂接种25周后对Omicron的保护力降为8.8%。而AZD1222初免接种者在BNT162b2加强后,对Omicron保护力则为62.4%[30]。
(四)针对Omicron变异株的药物治疗 自COVID-19大流行以来,已有大量研究致力于SARS-CoV-2的药物研发,旨在阻止病毒进入细胞或抑制病毒复制,多种单克隆抗体(Monoclonal antibodies, mAbs)及小分子药物相继问世,而由于Omicron大量位点的突变,这些药物的有效性需要重新评估。
通过结合刺突蛋白受体结构域的不同表位,mAb可阻断SARS-CoV-2与 ACE2 的相互作用。然而,Omicron刺突蛋白中的大量突变使其对临床上以之为靶标的mAbs产生了抗性。何大一团队评估了包括已获临床批准的治疗抗体在内的19种针对Omicron变异刺突蛋白的mAbs的中和活性[31],只有 LY-CoV1404一种可以同时抵抗Omicron的BA.1和BA.2两种亚谱系。另一项研究评估了Omicron对目前已批准临床使用或正在开发中的9种mAbs的敏感性[32],其中5种抗体(Bamlanivimab、Etesevimab、Casirivimab、Imdevimab和 Regdanvimab)对omicron无效;2种(Cilgavimab和 Andintrevimab)的中和活性相较于delta降低了约20倍;Sotrovimab抗Omicron的活性相较于delta降低了约3倍。此外,由于Omicron刺突蛋白突变后入胞模式的改变,TMPRSS2抑制剂Camostat对Omicron变异株的效果也较差[33]。
除了mAbs,Paxlovid、Molnupiravir和Remdesivir等小分子新冠药物针对病毒的酶发挥作用,而病毒酶结构的突变比刺突蛋白要少得多,因此有效性得以保持。新型口服抗病毒药物Paxlovid 中的Nirmatrelvir作为3CL蛋白酶抑制剂,可抑制SARS-CoV-2病毒复制,Molnupiravir和Remdesivir主要靶向RdRp。体外研究表明,这三种药物仍然具有对Omicron的抑制效果,其中奈玛特韦的抗病毒能力最强[34]。因此,未来针对病毒结构中相对保守、突变较少的部位设计药物或许能取得更好的效果,且能对多种变异株都能产生良好的效果。
四、总结与展望
Omicron变异株的全球感染人数正在急剧攀升。在关键部位发生的大量突变使其特性发生了巨大的改变。虽然致病力有所减弱,但却同时有着更高的传染性、更强的免疫逃逸能力,当前治疗药物的有效性也需要重新评估。这一VOC的大流行,对世界各地的医疗体系和资源也造成了巨大的冲击和挤兑。Omicron出现至今只有5个月,人们对于其临床特征还需要全面系统的评估。
虽然目前疫苗对Omicron的有效性有所下降,但疫苗接种仍可起到降低重症率、病死率的作用。因此,在如今Omicron大流行时期,大力推行疫苗接种,尤其是在高危人群中提高疫苗接种率至关重要。同时,正确佩戴推荐类型的口罩、避免大规模聚集活动、遵守防疫制度等理念也需要加强宣传。
SARS-CoV-2是否会出现新的变异株尚未可知,加强药物与疫苗研发尤为重要。病毒RBD部位由于进化选择优势可能会发生大量突变,从而导致针对该部位的药物或疫苗失效。而针对突变较少的病毒酶发挥作用的药物可能更为广谱,对各种变异株可能均能发挥作用。同时,疫苗加强针或序贯接种法可能会提供更强大的保护力,但仍需要进一步的临床试验来确定其保护性。
总之,通过全世界科研工作者的不懈努力,通过世界人民的守望相助,相信人类有能力将SARS-CoV-2的危害降到最低,实现和平共处。
