大肠杆菌感染对绵羊乳腺成纤维细胞损伤及TLR4表达的影响
2022-05-12马小军王加冕李世瑛颜丽娇麻强生张小丽
马小军,王加冕,李世瑛,颜丽娇,麻强生,张小丽
(1.甘肃农业大学 动物医学院,甘肃 兰州 730070;2.申联生物股份有限公司,甘肃 兰州 730070;3.新疆昌吉市大西渠镇农业畜牧业发展服务中心,新疆 昌吉 831100)
动物乳腺炎是由多种因素作用引起的乳腺炎症,最常见的致病因素为病原微生物感染[1-2]。动物乳腺炎的病原微生物种类繁多,多达150种以上,最为常见的病原微生物是细菌、病毒、支原体及真菌等,其中大肠杆菌占我国奶牛乳房炎临床分离病原菌总量的14.4%[3]。大肠杆菌性乳腺炎有2个最为显著的特点,即流行性和急性;大肠杆菌属于环境性致病菌,饮水、粪便、泥土、垫料及挤奶工具等都会成为其传播介质;大肠杆菌是一种革兰氏阴性菌,具有LPS、外毒素、黏附素及荚膜等多种致病力较强的毒性物质,大肠杆菌通过动物乳腺侵入血循环,细菌突破机体防御机制后在血液中生长、定居、繁殖并释放毒素,最终引起机体全身急性败血症,从而导致动物泌乳量减少、生产性能降低甚至急性死亡[4]。成纤维细胞的功能包括构成结缔组织、参与胶原纤维形成、分泌免疫蛋白、修复创伤及防治疾病,电镜观察可见成纤维细胞胞质中含有大量粗面内质网、核糖体和高尔基体,这表明成纤维细胞具有强大的合成及分泌蛋白功能;Picard等[5]、Davidson等[6]及von Bernuth等[7]研究指出,成纤维细胞可被用来定位并研究病原体检测和信号通路,其分泌的免疫蛋白可参与机体的免疫活动,在抗击感染中发挥重大作用,不少国内外研究发现也都预示着乳腺成纤维细胞的免疫机制在乳腺炎防治中有着重大意义。
TLRs是非特异性免疫系统中的主要模式识别受体,具有感知病原体侵袭、刺激免疫信号通路活化及调节免疫反应的重大功能;TLRs不仅参与机体的先天性免疫应答,同时也是维系机体先天性与获得性免疫的关键枢纽。1997年,Medzhitov等[8]发现了第一个存在于人体细胞表面的Toll样受体蛋白,它可激活适应性免疫有关基因,同时在人体抗感染免疫中有重要意义,该蛋白后来被称为TLR4;随后Poltorak等[9]发现TLR4可识别内毒素(LPS),同时发现TLR4突变而丧失功能的小鼠对LPS并无反应,从而推测TLR4是LPS的特异性识别受体[10]。急性大肠杆菌乳腺炎的核心阶段是大肠杆菌细胞壁上的LPS与细胞膜表面受体TLR4的识别,目前TLR4与绵羊乳腺炎的相关报道甚少,Goldammer等[11]为了分析先天免疫系统在抵抗乳腺感染中的作用,测定了健康和受感染的乳腺组织中TLR9、TLR2、TLR4、BNBD5的mRNA丰度,结果显示,除TLR9外,其他基因在受感染组织中mRNA丰度均显著增加 (4~13倍),这表明TLR4与先天性免疫系统在抵御乳腺炎中有着重大作用;王兴平等[12]对牛TLR4基因的遗传多态性与乳腺炎的关联进行了研究,他们分析并指出TLR4基因可能作为奶牛乳房炎抗性的候选基因。
目前,我国对于治疗乳腺炎常用抗生素疗法,该疗法副作用大且易增强细菌耐药性;机体的免疫反应作为机体抵抗病原微生物感染的重要途径,具有重大研究价值与意义。由于TLR4作为LPS的特异性识别受体,其在大肠杆菌性乳腺炎中必定扮演着重要角色,了解TLR4在大肠杆菌引发细胞损伤中的具体分子信号转导机制,有助于更清晰地认识大肠杆菌性乳腺炎;通过研究大肠杆菌对细胞损伤的影响,探究LPS特异性识别受体TLR4对乳腺炎发生发展的影响,有助于在分子水平了解机体自身的免疫机制,发掘机体的免疫能力以提高自身抗病性能,为有效防治乳腺炎提供基础资料。
1 材料和方法
1.1 试验材料
主要试剂:Giemsa染液、细胞增殖检测试剂盒、caspase-4,5活性测定试剂盒、高效细胞裂解液,索莱宝;DME/F-12细胞基础培养基,HyClone;FBS,Biological Industries;乳酸脱氢酶(LDH)测定试剂盒,建成;HiScript Ⅱ Q RT SuperMix for qPCR(+gDNA wiper)、ChamQ Universal SYBR qPCR、Bradford 蛋白浓度测定试剂盒,诺唯赞;TRIzol,Ambion;TLR4 阻断剂 CLI-095,InvivoGen;GEN,Biofroxx;0.22 μm PVDF 膜,Millipore;兔抗TLR4抗体,兔抗β-Actin抗体,羊抗兔IgG H&L标记抗体,博奥森。
主要仪器:梯度基因扩增仪,德国Eppendorf;qRT-PCR仪,美国Applied Biosystems;琼脂糖凝胶成像仪,美国BIO-RAD;全自动化学发光免疫分析仪,美国Beckman Coucter;全自动酶标仪,美国BioTek;超微分光光度计,美国Thermo。
1.2 试验方法
1.2.1 绵羊乳腺成纤维细胞的原代培养 酶消化法结合差速消化法获得乳腺成纤维细胞[13]。选择处于泌乳期且无乳腺炎病史的健康小尾寒羊,饲养观察14 d后无异常现象采集绵羊乳腺组织,剪碎组织后加入消化液(DME/F-12培养基中含 200 U/mL Ι 型胶原酶及120 U/mL透明质酸酶)消化3 h,收集细胞悬液于细胞瓶中继续培养,纯化时使0.05%胰蛋白酶消化 2 min收集成纤维细胞。
1.2.2 Giemsa染色法鉴定乳腺成纤维细胞 成纤维细胞的鉴定采用Giemsa染色法。细胞爬片上细胞贴壁面积达80%后用预冷PBS洗3次,混合液(PBS∶甲醇= 1∶1)染色2 min,甲醇固定后Giemsa染色2 min[14],蒸馏水洗去染液后显微镜下观察。
1.2.3 MTT法检测细胞增殖率 采用MTT比色法检测细胞增殖率[15]。调整细胞浓度为1.0×106个/mL,96孔板中每孔接种200 μL细胞悬液,细胞培养箱中分别培养0.5,1,2,3,4 d,设置调零孔,每组6个重复;MTT染色后加入Formazan溶解液振荡10 min,酶标仪测定OD492。
1.2.4 LDH法筛选大肠杆菌最适感染比 采用微量酶标法检测大肠杆菌感染细胞后培养上清液中LDH的释放量[16]。96孔板中细胞贴壁90%以上后弃培养液,将大肠杆菌按照MOI=1∶1、2∶1、3∶1、4∶1、5∶1 人工感染细胞 1,2,3,4,5 h,设置对照组不感染大肠杆菌,每组4个重复,收集细胞培养上清液。根据说明书操作后测定OD450,计算LDH 的活力(单位:U/L),即LDH 释放量。
1.2.5 qPCR检测细胞凋亡因子caspase-3基因表达 采用TRIzol法提取绵羊乳腺成纤维细胞总RNA[17],超微分光光度计测定RNA的纯度与浓度。2步法合成cDNA:4×gDNA wiper Mix,4 μL;RNA模板,1 μg;DEPC水补充总体积至16 μL;42 ℃反应2 min;向16 μL混合液中加入4 μL 5×HiScript Ⅱ qRT SuperMix Ⅱ;50 ℃反应 15 min,85 ℃反应 5 s。qRT-PCR 使用 25 μL反应体系:ChamQ Universal SYBR qPCR Master Mix,12.5 μL;DEPC水,8.5 μL;上、下游引物各 1 μL(表1);模板 2 μL。95 ℃预变性10 min;95 ℃变性 15 s,60 ℃退火15 s,72 ℃延伸30 s。根据所得Ct值计算caspase-3mRNA相对表达量,结果用 2-ΔΔCt表示。

表1 绵羊caspase-3引物信息Tab.1 Sheep caspase-3 primer information
1.2.6 比色法检测细胞焦亡蛋白caspase-4,5 酶活性变化 收集细胞蛋白裂解液至离心管中,Bradford法测定并调整蛋白浓度。根据说明书操作,设置空白组、对照组及试验组,每组3个重复,反应底物最后加入以确保反应起始时间相同。37 ℃培养至肉眼观察板内液体变黄后测定OD405,计算细胞蛋白裂解液中caspase-4,5的活性变化百分比。
1.2.7 qRT-PCR及WB检测TLR4的表达 qRT-PCR检测TLR4的表达参照1.2.5,绵羊TLR4引物信息如表 2 所示。WB检测TLR4蛋白表达,RIPA收集细胞总蛋白上清液,BCA法测定并调整蛋白浓度,蛋白变性后收集上清进行蛋白印迹分析[18]。目的蛋白TLR4的分子量大小为93 ku,选取5%的浓缩胶进行电泳,收集胶块后转膜,将PVDF膜置于孵育盒中,5% 脱脂奶粉4 ℃封闭过夜,一抗(1∶1 000)4 ℃孵育过夜,荧光标记二抗(1∶3 000)37 ℃孵育1 h;取Signal Fire ECL试剂滴于膜表面,化学发光仪显色曝光。

表2 绵羊TLR4引物信息Tab.2 Sheep TLR4 primer information
1.2.8 MTT法检测TLR4阻断剂CLI-095的细胞毒性作用 细胞于96孔板中长至单层后进行试验,每孔加入100 μL TLR4阻断剂CLI-095(终浓度1 μg/mL),37 ℃孵育细胞0.5,1,2 h后采用MTT法检测细胞增殖率,方法参照 1.2.3;同时设置不使用阻断剂的细胞作为对照组,每组6个重复。
1.2.9 qRT-PCR检测CLI-095对TLR4的阻断效果 非阻断组处理:大肠杆菌感染绵羊乳腺成纤维细胞(MOI=4∶1),37 ℃培养1 h;阻断组处理:每孔加入100 μL TLR4阻断剂CLI-095(1 μg/mL),37 ℃孵育1 h,大肠杆菌感染细胞1 h(MOI=4∶1),每组3个重复。参照1.2.5,利用qRT-PCR法检测各组别TLR4mRNA的相对表达量,验证CLI-095的阻断效果。
1.2.10 平板活菌计数法检测CLI-095对大肠杆菌黏附乳腺成纤维细胞的影响 细菌感染细胞 4 h后PBS洗去未黏附的细菌;每孔加入 1 mL 1% Triton X-100室温通透处理10 min,收集裂解液后平板活菌计数法测定细菌黏附数,每组取 200 μL细胞裂解液平板涂布,每组3个重复。细菌黏附数(单位:cfu/mL)=3个平板菌落平均数×5×稀释倍数,阻断率=(非阻断组-阻断组)/非阻断组×100%。
1.3 数据处理
试验数据均使用IBM SPSS Statistics 19进行单因素方差分析,P<0.05 、P<0.01 或P<0.001 表示数据具有统计学意义,利用OriginProPorable软件进行作图。
2 结果与分析
2.1 绵羊乳腺成纤维细胞培养及鉴定结果
细胞培养及纯化结果如图 1 所示,图 1 左为原代培养所得到的乳腺细胞,细胞贴壁状况良好且形态特征明显,绵羊乳腺成纤维细胞为长梭状、乳腺上皮细胞为铺路石状;图 1 右为纯化后的乳腺成纤维细胞,细胞纯度达90%以上。Giemsa染色如图 2 所示,成纤维细胞染色后呈蓝紫色、边缘光滑、排列整齐。
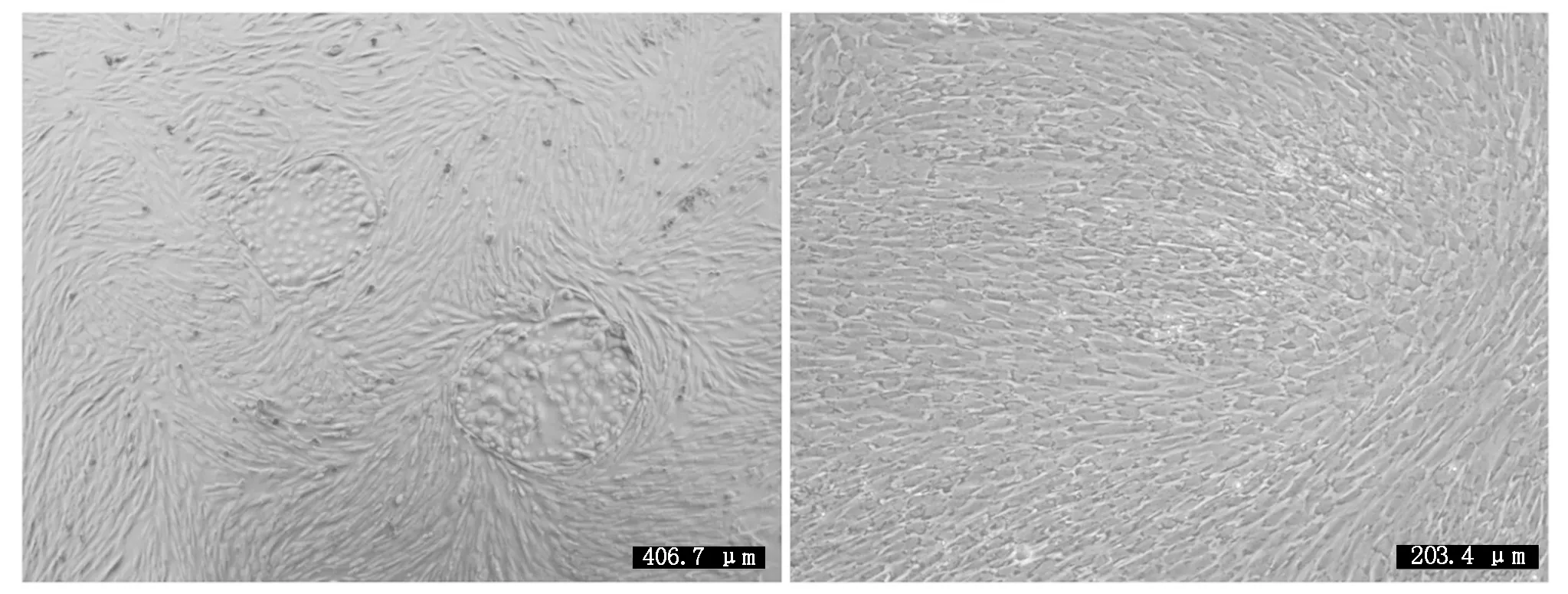
图1 乳腺成纤维细胞形态Fig.1 Mammary fibroblast morphology
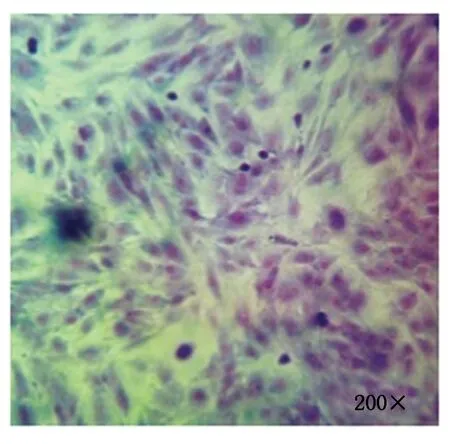
图2 乳腺成纤维细胞Giemsa染色Fig.2 Giemsa staining of mammary fibroblasts
2.2 MTT法检测细胞增殖率
在细胞培养1~4 d内 490 nm处OD值随着时间延长逐渐升高,说明细胞增殖率逐渐升高,反映细胞活力良好(图3)。
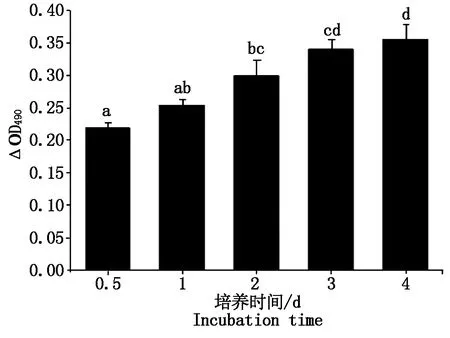
不同小写字母表示差异显著(P<0.05);相同小写字母表示差异不显著(P>0.05)。图4,6—9,11同。
2.3 LDH法筛选最适MOI比值
当MOI为 1∶1、2∶1、3∶1、5∶1时,LDH释放量均为不规则变化,无统计学意义;当MOI比值为4∶1。时,大肠杆菌感染乳腺成纤维细胞1~5 h内细胞培养液中LDH的释放量分别为75.81,95.46,188.27,213.36,229.48 U/L,且LDH的释放量随着感染时间的延长均显著升高(P<0.05),说明随着感染时间的延长,细胞损伤程度逐渐加深(图4),同时表明大肠杆菌对细胞的损伤是快速且持续的,因此选用MOI比值=4∶1建模最具统计学意义。

图4 LDH释放量的变化Fig.4 Changes in LDH release
2.4 大肠杆菌感染细胞后细胞状态
大肠杆菌感染细胞(MOI比值= 4∶1)后,倒置显微镜观察细胞状态。如图 5 所示,大肠杆菌感染细胞后细胞形态特点逐渐消失,并产生圆形小泡,且随着感染时间的延长,这一现象越来越明显。

图5 倒置显微镜观察大肠杆菌感染成纤维细胞Fig.5 Inverted microscope observation of E.coli infected fibroblasts
2.5 caspase-3基因表达
大肠杆菌感染细胞后caspase-3mRNA表达情况如图 6 所示。与对照组相比,大肠杆菌感染绵羊乳腺成细胞后1~5 h内caspase-3mRNA表达量显著增加至1.30~2.08倍(P<0.05)。
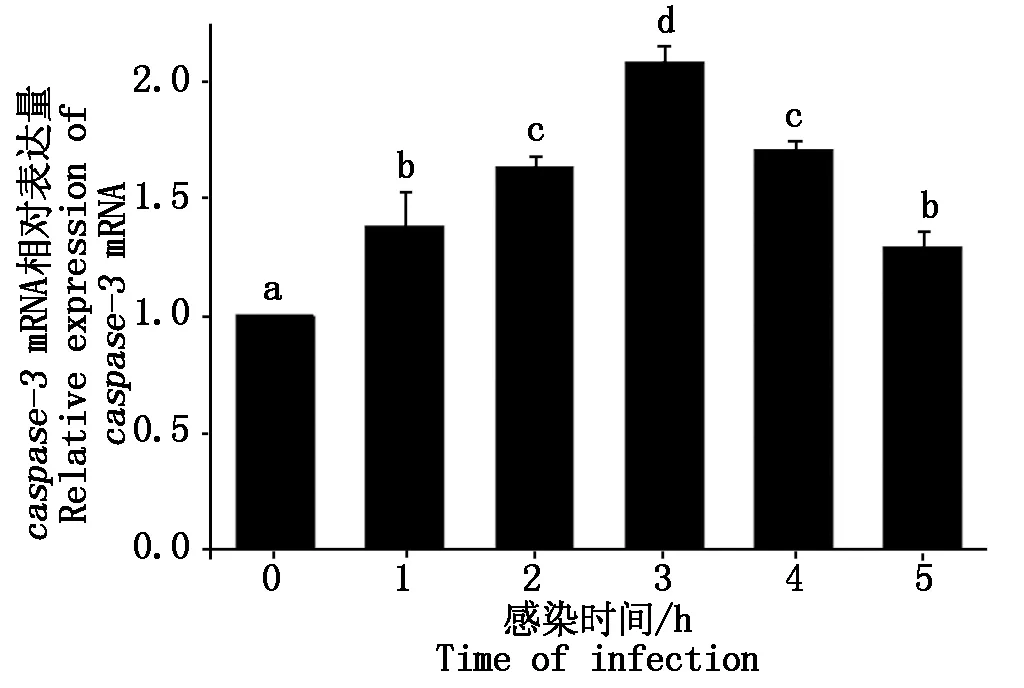
图6 caspase-3 mRNA相对表达量Fig.6 Relative expression of caspase-3 mRNA
2.6 caspase-4,5酶活性变化
大肠杆菌感染细胞后caspase- 4,5酶活性变化如图 7 所示。与对照组相比感染 1~3 h内caspase-4活性逐渐上升,caspase-5活性显著上升(P<0.05);在感染时间超过3 h后,caspase-4活性逐渐下降(P>0.05),caspase-5活性显著下降(P<0.05)。
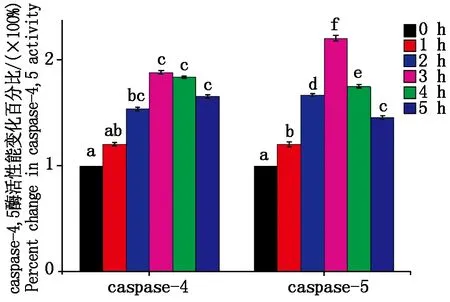
图7 caspase-4,5酶活性变化Fig.7 caspase-4,5 enzyme activity change
2.7 CLI-095对细胞的毒性作用
CLI-095说明书指出阻断剂孵育细胞 1 h即可达到阻断TLR4表达的效果,因此,检测2 h内阻断剂对细胞增殖率的影响足够判断本试验中阻断剂对细胞有无毒性作用。试验结果见图 8,阻断剂作用细胞后 2 h内ΔOD490显著升高(P<0.05),说明此时细胞活力仍正常,因此该抑制剂可用于后续试验。
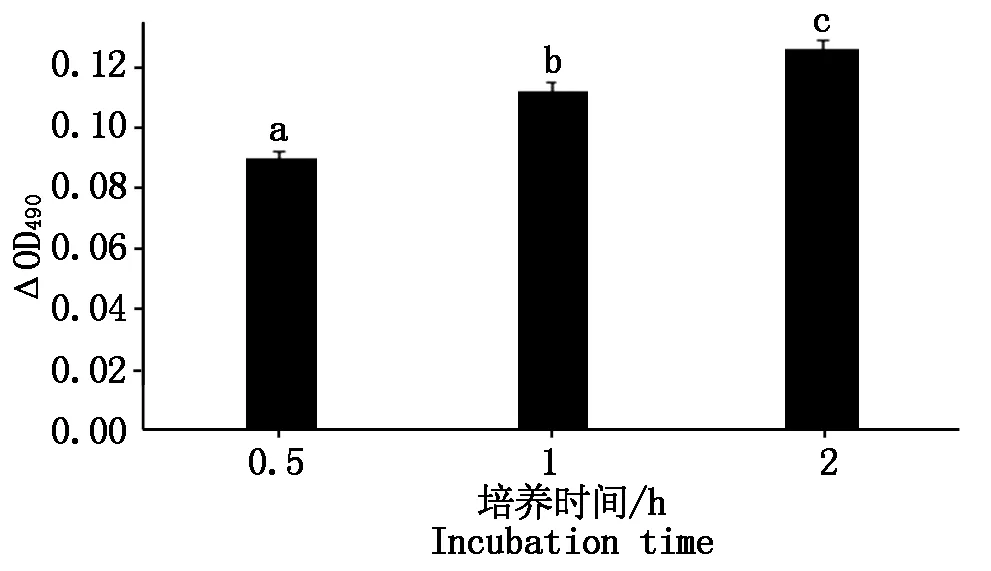
图8 CLI-095对细胞增殖率的影响Fig.8 Effect of CLI-095 on cell proliferation rate
2.8 TLR4 mRNA表达
大肠杆菌感染细胞后TLR4mRNA表达量如图 9 所示。非阻断组结果显示细菌感染细胞1~2 h内,TLR4mRNA相对表达量显著上升(P<0.05),感染2 h后TLR4表达量显著下降(P<0.05);阻断组结果显示,在细菌感染细胞1~3 h内,TLR4mRNA的相对表达量显著上升(P<0.05),感染3 h后TLR4表达量下降但无明显规律;阻断组与非阻断组对比可知,阻断剂孵育细胞 1 h后,细菌感染细胞1~4 h内对TLR4mRNA的表达均有显著抑制效果(P<0.05)。

图9 TLR4 mRNA相对表达量Fig.9 Relative expression of TLR4 mRNA
2.9 TLR4蛋白表达
大肠杆菌感染细胞后TLR4蛋白表达情况如图 10,11 所示,TLR4蛋白的相对表达量在大肠杆菌感染细胞1~2 h内显著升高(P<0.05),2 h后逐渐下降(P<0.05或P>0.05)。

图10 TLR4蛋白表达Fig.10 TLR4 protein expression
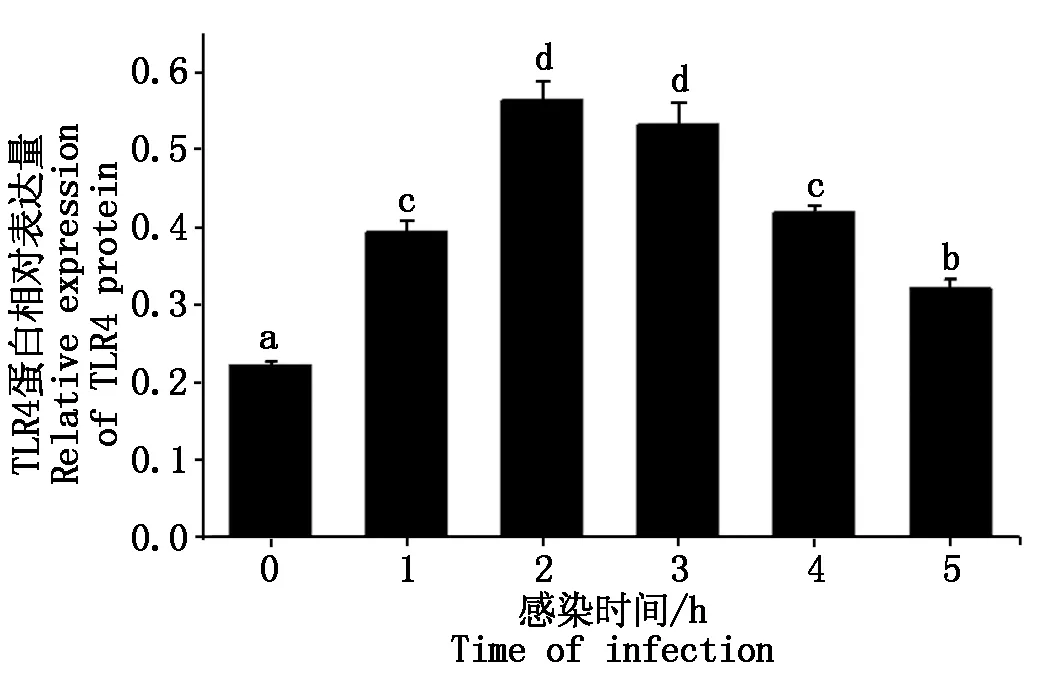
图11 TLR4蛋白相对表达量Fig.11 Relative expression of TLR4 protein
2.10 细菌黏附数测定
平板活菌计数结果见表 3,非阻断组的大肠杆菌黏附数为(40.3×106)cfu/mL,阻断组的大肠杆菌黏附数为 (33.0×106)cfu/mL;TLR4阻断剂CLI-095处理细胞后,细菌的黏附力有所下降,计算得出细菌黏附阻断率为18.32% 。

表3 细菌黏附数及黏附阻断率Tab.3 Bacterial adhesion number and adhesion blocking rate
3 讨论
目前乳腺细胞已被用来研究哺乳动物乳腺生长发育、泌乳机理、乳腺疾病的理想模型[19],Kandasamy等[20]利用体外培养获得奶牛乳腺成纤维细胞,大肠杆菌LPS感染后分析了细胞基因组的表达情况,结果显示,试验组IL-8、TNF-α基因表达存在显著性差异;Kandasamy 等[21]利用大肠杆菌LPS人工感染奶牛乳腺成纤维细胞建立大肠杆菌性乳腺炎细胞模型,从43头泌乳早期的奶牛中分离得到乳腺成纤维细胞,细胞经LPS感染后将各组IL-8蛋白的产生量进行了分析排序,结果显示,未感染LPS的细胞不分泌IL-8,LPS处理后的细胞在IL-8表达的变化量高达7倍左右;Benjamin等[22]利用金黄色葡萄球菌感染奶牛乳腺成纤维细胞,根据细胞的反应性将奶牛分为低反应型和高反应型,结果表明,乳腺成纤维细胞可作为进一步研究动物对乳腺感染反应差异的参考模型,这些研究发现都预示着乳腺成纤维细胞的免疫机制在乳腺炎防治中有着重要意义。本试验采用透明质酸酶结合Ι型胶原酶的酶消化法分离并获得乳腺成纤维细胞,利用MTT法检测细胞增殖率,结果显示,细胞活力良好,可用于后续试验。
LDH主要存在于细胞质中,细胞受损后细胞膜破裂,LDH释放至胞外,故细胞培养液中LDH的活力是反映细胞损伤的重要指标。Wellnitz等[23]为了研究体细胞SCC数和LDH活性在脂多糖(LPS)大肠杆菌性乳腺炎中的情况,发现LPS刺激可使牛奶SCC升高,且牛奶中LDH活性随着LPS的刺激而增加;SCC数升高和LDH活性增加反映了乳腺受损严重、机体免疫效率降低,这可能是由于细胞受损后无法参与产生免疫调节因子,同时说明乳腺细胞与乳腺组织的免疫功能密切相关。本试验结果显示,当大肠杆菌感染细胞后细胞培养液中LDH活力显著上升,说明细胞受损随着感染时间的延长进一步加强;大肠杆菌感染细胞3 h后细胞培养液中LDH的释放量即达到188 U/L,这与王胤杰[24]在研究金黄色葡萄球菌对奶牛乳腺上皮细胞LDH影响的结果相比,金葡菌在感染细胞8 h后才达到这一水平,这也说明大肠杆菌对细胞的损伤更为迅速,同时验证了大肠杆菌性乳腺炎具有急性这一特点[25-27]。Caspase是一类蛋白酶,在细胞质中表达不同的亚型,caspase-3位于级联反应的下游,在细胞凋亡中占据主导位置[28],caspase-3作为凋亡反应的效应子,其mRNA的相对表达量上调是细胞凋亡的标志性现象;caspase-4,5为炎性半胱天冬酶,在细胞焦亡中主要通过炎症反应实现生理功能。大肠杆菌感染后caspase-3、caspase-4、caspase-5表达均显著性升高(P<0.05);这反映大肠杆菌通过活化caspase-3来执行细胞凋亡信号,通过激活caspase-4,5诱导细胞发生焦亡;崔新洁[29]在用金黄色葡萄球菌诱导牛乳腺上皮细胞凋亡的过程中发现,凋亡过程中caspase-3基因表达显著性升高,与本试验结果一致。目前细胞焦亡在人及小鼠的研究中较为广泛,在绵羊乳腺炎中报道甚少。大肠杆菌作为革兰氏阴性菌,引起细胞焦亡的主要效应因子是caspase-4、caspase-5、caspase-11,本试验结果显示在大肠杆菌性乳腺炎中caspase-4、caspase-5酶活性变化百分比均存在显著性升高。
TLR4是细胞膜表面的受体,同时也是介导LPS应答的特异性受体。本试验结果表明,TLR4在感染大肠杆菌的绵羊成纤维细胞中基因和蛋白水平的表达均明显上升,说明TLR4在大肠杆菌性乳腺炎的发病机制中发挥了一定的作用。目前,关于TLR4与绵羊乳腺炎的相关报道甚少,Goldammer等[11]为了分析先天性免疫应答在抵抗乳腺感染中的作用,测定了健康和受感染的乳腺组织中TLR9、TLR2、TLR4、BNBD5mRNA的丰度,试验结果表明,除TLR9外,其他基因在受感染组织中的mRNA丰度均显著增加(4~13倍),这也表明TLR4在抵御乳腺炎中起着重要作用。Pandey等[30]、Werner-Misof等[31]研究了不同剂量大肠杆菌脂多糖在乳腺内部灌注时乳腺细胞的免疫反应和乳腺紧密连接的状态,结果显示,随着LPS剂量的升高,乳腺蛋白质斑块密度降低、TLR4mRNA表达显著增加,这些特点在Schmitz等[32]、Prgomet等[33]的研究中均有体现。
细菌的黏附力及侵袭力是衡量细菌致病力的重要指标。本试验结果显示,阻断剂可以降低细胞中TLR4的表达及E.coli的黏附力。Gonen等[34]利用小鼠乳腺炎作为模型来研究乳腺的先天炎症反应,发现将LPS输注在野生型小鼠中可诱发乳腺炎,但在表达突变TLR4的小鼠中不诱导乳腺炎;将TLR4表达的巨噬细胞移入小鼠肺泡乳腔,小鼠恢复野生型表型。此外,在缺乏功能性TLR4的情况下,细菌高效入侵并感染上皮细胞后形成胞内微菌落;并且TLR4表达的巨噬细胞过继转移大大减少了细菌对上皮细胞的侵袭。Wang等[35]在小鼠慢性淋巴细胞性脉络丛脑膜炎病毒(LCMV)感染模型中,发现TLR4通过亚致死剂量的LPS和PD-1阻断剂触发后,可以显著改善循环中病毒特异性CD8 T细胞的反应,结果反映了TLR4阻断剂可通过对LPS的作用显著改善病毒细胞的反应,这可能对开发针对慢性病毒感染的新型检查点疗法具有重要意义。本试验可能是由于CLI-095抑制了大肠杆菌LPS与细胞表面TLR4的特异性结合,从而降低了细菌的黏附力,减弱了细菌的致病力,试验结果可为大肠杆菌性乳腺炎的防治提供理论基础。
