过表达PnSMO1.1基因显著增强裂叶牵牛耐盐性
2022-05-12赵宇玮
唐 龙,赵宇玮
(1.西安交通大学 人居环境与建筑工程学院,陕西 西安 710049;2.西北大学 生命科学学院,陕西 西安 710069;3.陕西省生物技术重点实验室,陕西 西安 710069)
大多数真核细胞都可以合成甾醇类物质,其中胆固醇是脊椎动物特有的甾醇,麦角甾醇是大多数真菌和一些单细胞藻类的主要甾醇。而大多数高等植物细胞往往含有很复杂的甾醇类物质组成。24-乙基甾醇(谷甾醇和豆甾醇)是最主要的植物甾醇,占比超过总甾醇量的60%,24-甲基甾醇则占据了植物细胞总甾醇里剩余40%中的绝大部分,对脊椎动物维持细胞正常生理活性起到至关重要作用的胆固醇,在植物细胞中含量较少[1]。植物中甾醇类物质的功能,可总结为3个方面:首先,它们是膜脂的重要组成部分,在质膜中的含量与磷脂近似,在温度等条件变化时,承担着调节植物细胞膜的流动性和选择透性的作用[2]。其次,甾醇类物质还能通过动态调整膜上脂筏等微区的装配,充当多个信号通路的信号转导中心[3]。并且,甾醇是植物体内多种生化物质合成的前体,如甾醇衍生物油菜素类固醇,就是一类参与高等植物生长和发育调控的重要激素。甾醇衍生的物质还参与植物响应生物和非生物因素的应答反应[4]。
裂叶牵牛(Pharbitisnil(L.) Ching或Ipomoeanil,英文名:Japanese Morning Glory)是一种旋花科一年生草本植物。该植物全株表皮具有刺毛,果实为球形蒴果,无表皮毛,成熟后内有种子5~6 颗[5-6]。裂叶牵牛常常被当作模式植物,研究开花调控以及花发育遗传等[7-8]。裂叶牵牛的花期为7—9 月,光周期类型为严格的短日照型[9]。尽管在我国及日、韩等东亚国家被作为传统园艺植物和药用植物广泛种植,但裂叶牵牛是原产美洲热带的外来物种,其生境偏好与我国本地种圆叶牵牛(Pharbitispurpurea(L.) Voisgt)相似。因而分布广泛,可与许多土著牧草、农作物等形成种间竞争关系。分析裂叶牵牛对非生物因素耐受性和机制,是预测其潜在入侵能力重要的依据。
目前,裂叶牵牛应答非生物因素水平的相关分子机制依然不清楚。有研究显示:通过转基因过量表达裂叶牵牛PnAMP1和PnAMP2基因,可以显著增强转基因番茄对真菌的抗性。在使用裂叶牵牛作为试验材料进行脂代谢研究的过程中发现,过表达牵牛甲基甾醇单加氧酶基因(PnSMO1.1)可以显著提高转基因植物对培养基中200 mmol/L NaCl的耐受性。过量积累植物甾醇类物质有可能显著提升植物对非生物逆境的抗性[10]。为了揭示相关的分子机制,本研究首先通过子房注射法,构建了过表达PnSMO1.1的裂叶牵牛转基因株系;测量不同浓度NaCl处理条件下,各株系种子苗的根相对生长量、下胚轴相对生长量以及叶片丙二醛含量、相对电导率和油菜素内酯物质积累量,以便说明过表达PnSMO1.1是如何影响裂叶牵牛转基因植物的生长及其可能的耐盐性机制。
1 材料和方法
1.1 试验材料
所用植物裂叶牵牛种子由陕西省生物技术与生化工程重点实验室保存。萌发前的种子先用浓硫酸浸泡处理40 min,然后弃去浓硫酸,再用自来水冲洗10 min,置于无菌水中浸泡过夜,使其充分吸胀。第2天,将种子接种到直径90 mm,盛有无菌水浸润滤纸的培养皿中,在 25 ℃,16 h光照/ 8 h黑暗 (LD) 条件下发芽1 d。将露白的种子转接到长19.5 cm×宽14.5 cm×高11.0 cm育苗盒并在 25 ℃、LD 条件下生长5 d。然后,将幼苗定植到直径约25 cm的塑料花盆中,培养介质为蛭石/营养土/金刚砂(1∶1∶1)的混合营养土。定植种子苗在连续光照25 ℃条件下培养至种子采收完毕。培养室光源是由三基色荧光灯提供的强度为60 μmol/(m2·s)白光。
后续遗传转化及生化检测所用植物材料均取自这些种植于西北大学生命科学学院温室(34.3°N,108.9 E)的实生苗。
1.2 PnSMO1.1基因的克隆及表达载体构建
采用盐酸胍法结合苯酚/氯仿提取法,从使用100 mmol/L NaCl溶液处理24 h的裂叶牵牛4 周龄种子苗叶片中分离总RNA[11]。以约1 μg 总RNA为模板,使用PrimeScriptTMⅡ 1st Strand cDNA Synthesis Kit试剂盒(TaKaRa Co.,Ltd,中国辽宁),按照反应程序合成cDNA。按照NCBI收录的PnSMO1.1基因(GenBank Access:XM_019314878.1)序列,设计并合成用于PCR扩增该基因全长ORF的引物对P1和P2。引物的具体序列如下:P1:ACGCGTCGACATGTCAATTCAACATTACAC(下划线序列为用以载体构建的SalⅠ限制性内切酶切割位点),P2:GGAATTCCTAGTCAACTTTAATATCTTC(下划线序列为用以载体构建的EcoR Ⅰ限制性内切酶切割位点)。
以约0.1 μg 前述逆转录合成的cDNA为模板,PCR扩增PnSMO1.1基因全长ORF。然后将长度为1 089 bp的PCR扩增片段,按照预先分别设计在引物5′端的SalⅠ和EcoRⅠ限制性酶切位点,连接到双元表达载体pRI 101-AN质粒的T-DNA区,使其置于在组成型表达的CaMV-35S启动子和NOS终止子的控制之下,构建用于过表达PnSMO1.1基因的双元植物表达载体质粒。取重组质粒连接产物,转化大肠杆菌DH5α感受态细胞,并委托生工公司(Sangon,中国上海)对所携带目标基因序列进行测定。经测序验证,扩增序列与NCBI收录的XM_019314878.1基因序列完全一致的植物表达载体质粒被命名为pRI-PnSMO1.1,后续用于植物遗传转化试验,该质粒T-DNA区的结构示意图见图1。
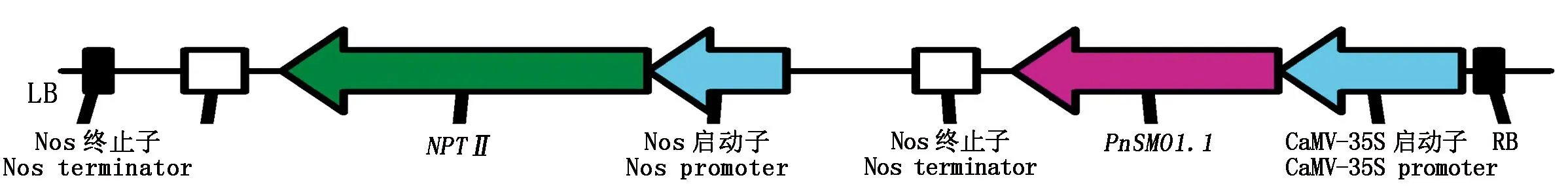
图1 pRI-PnSMO1.1质粒T-DNA区结构Fig.1 Diagram of T-DNA region in pRI-PnSMO1.1 plasmid
1.3 子房注射法转化裂叶牵牛
将携带pRI-PnSMO1.1质粒的DH5α大肠杆菌接种至200 mL添加了终浓度为50 μg/mL卡那霉素的新鲜LB液体培养基中,37 ℃培养过夜。待培养物OD600≈0.65,13 000 r/min 离心3 min收集细菌。再使用购自天根生化科技有限公司(中国北京)的高纯质粒大提试剂盒,制备和纯化pRI-PnSMO1.1质粒,使用ddH2O将纯化的质粒DNA稀释至100 ng/μL,在-80 ℃冰箱保存。直至实施植物子房注射前1 h,将冻存的质粒从-80 ℃冰箱取出,并置于冰上缓慢融化。
子房注射当日9:00—10:00,待裂叶牵牛花朵完全绽放时,剥去1片萼片,暴露出其所覆盖的花托与子房联合部。用微量注射器吸取约5 μL pRI-PnSMO1.1质粒溶液,从花托上部缓慢刺穿子房外壁,并将目标质粒缓慢注射入子房。子房注射完成后,将受体植物转移至温室中正常培养直至结实。
1.4 pRI-PnSMO1.1基因整合及表达的检测
收获所有经子房注射裂叶牵牛花朵正常发育而来的种子。将这些种子用0.1%的升汞水溶液表面消毒5 min后,用充足的无菌水洗去种皮上残留的升汞。再将其播种于不补充任何植物生长调节物质,添加100 mg/L卡那霉素筛选剂的1/2 MS琼脂培养基上,于25 ℃,连续光照条件下萌发。在卡那霉素筛选条件下能够萌发,且在保持100 mg/L卡那霉素筛选压力下继代28 d不发生白化的裂叶牵牛种子苗被标记为假定的T1转基因植物。
从不同株系假定的T1转基因植物上分别收集0.1 g幼嫩的叶片组织使用十二烷基磺酸钠(SDS)法提取总DNA[12]。进而以这些总DNA为模板,采取PCR方法验证目标基因及抗生素筛选标签基因在转化植物中的定位情况。PnSMO1.1基因的验证PCR引物为,pSS:5′-TGGTGATTTCAGCGTGTC-3′(位于pRI 101-AN质粒CaMV35S启动子区内部)和pSA:5′-GGCGTATGGCAGCATT-3′(位于PnSMO1.1基因CDS编码区内部),预期扩增片段长度为970 bp。卡那霉素抗性基因NPT Ⅱ的PCR扩增引物为,pNS:5′-CTCTGATGCCGCCGTGTT-3′和pNA:5′-CCCTGATGCTCTTCGTCCA-3′,预期扩增片段长度为399 bp。PCR程序设置如下:94 ℃预变性3 min;95 ℃变性30 s,55 ℃退火30 s,72 ℃延伸1 min,循环39 次;最终在72 ℃总延伸5 min。PCR产物经1%琼脂糖凝胶电泳检测。
将经过PCR鉴定为阳性转基因植株的T1种子苗转移至盛有营养土、蛭石、金刚砂等比例混合而成介质的花盆中,置于25 ℃温室中培育。种子苗先置于16 h光照/8 h黑暗的长日照条件下生长45 d,然后将温室的光照条件改为8 h光照,16 h黑暗的短日照条件,继续培养2 d以诱导裂叶牵牛开花,接着再在连续光照条件下培养至全部种子被收获。从T1PCR阳性转基因植株收获的种子萌发的卡那霉素抗性植株作为T2转基因植物,用于后续表型测定试验。
1.5 不同NaCl浓度条件下转基因裂叶牵牛生长的测定
将来自3 个不同来源T2转基因株系的2 日龄裂叶牵牛种子苗(分别命名为SMO1、SMO2和SMO3)和同步萌发的野生型对照(Wild-type,WT)以及未经改造的空载体pRI 101-AN转化植物(BL)种子苗各6 株分别移入添加0,50,100,150,200 mmol/L NaCl的1/2 MS水溶液中继续培养7 d,分别于不同浓度NaCl处理后的第4,7天测量不同株系植物的根长和下胚轴长度。把同一单株前后2个测量日测得数据作差,计算观测期内根的相对生长量ΔR和下胚轴的相对生长量ΔH,每个株系测定6个单株的相关生长数据作为样本的生物学重复。
1.6 不同NaCl浓度条件下转基因裂叶牵牛叶片丙二醛含量的测定
转基因株系SMO1、SMO2、SMO3和WT以及BL幼苗先在1/2 MS水溶液浸润的滤纸上培养21 d。然后用含有不同浓度氯化钠(分别为0,50,100,150,200 mmol/L)的1/2 MS液体培养基对所有待试植株进行处理。5 d后,分别取0.1 g SMO1、SMO2、SMO3、WT和BL幼苗新鲜叶片组织作为材料,采用硫代巴比妥酸(TBA)法[13]测定上述试验材料中MDA的含量。
1.7 不同NaCl浓度条件下转基因裂叶牵牛叶细胞液相对电导率的测定
为了评估盐生条件下不同株系植物细胞膜的渗透性变化,根据Zhang等[14]的方法测定了SMO1、SMO2、SMO3、WT和BL等株系幼苗在不同NaCl浓度条件下的相对电导率(Relative electrolytic conductivity,rEC)。植物材料的预处理方法同1.6。分别从完全发育的SMO1、SMO2、SMO3、WT和BL植物最小叶片的中部取直径约为1 cm叶圆盘。将收集到的叶圆盘放置在含有30 mL蒸馏水的螺帽的单独试管中。转移到150 r/min室温摇床孵育3 h,用DDS-303A型电导率探测器(中国上海)测定溶液(EC1)的电导率。将相同的样品放入沸水中30 min,并将溶液冷却到室温后测定第2次读数(EC2)。用来表征植物细胞电解质泄漏程度的相对电导率(rEC):rEC=EC1/EC2×100%。
1.8 不同NaCl浓度条件下转基因裂叶牵牛叶油菜素内酯物质含量的测定
使用同1.6描述的预处理方法准备植物材料。分别取SMO1、SMO2、SMO3、WT和BL幼苗新鲜叶组织作为材料,使用Wang等[15]描述的高效液相色谱-电喷雾电离-串联质谱 (HPLC-ESI-MS/MS) 方法对内源性油菜素内酯物质含量进行定量测定。
1.9 统计分析
采用方差分析(ANOVA)比较方法,分析了PnSMO1.1基因转化的裂叶牵牛株系与野生型植物及空载体转化对照植物株系抗逆相关生理指标的差异显著性。数据统计分析由 SPSS 12.0 软件完成,所有图表均使用 Origin 8.0 软件绘制完成。数据均来自同一株系6个不同生物学重复植株各自测量数据的平均值±标准差。
2 结果与分析
2.1 子房注射法对裂叶牵牛进行遗传转化结果分析
裂叶牵牛从开花、坐果到种子成熟一般需要45~60 d,在整个生活史中共形成12~14 朵花。在实施子房注射时,植株上最初形成5~6 朵花,最终结实率极低,大部分实施了子房注射的花朵最终都没有结实。而7~14 朵花,随着植株的逐渐生长壮大,子房注射后的结实率有了明显提高。在整个试验周期中,累计对2 541 朵不同花期的花朵实施了子房注射,共收获924 粒自然成熟的种子,其中收获自31 朵花的75 粒能在150 mmol/L卡那霉素筛选条件下萌发,转化率约为1.22%。
2.2 目的基因在T1转基因裂叶牵牛中的PCR结果
对75 个卡那霉素抗性植株的基因型进行PCR检测(图2),其中56 株目标基因PnSMO1.1的PCR检测结果为阳性,61 株抗性筛选标签NPTⅡPCR检测结果为阳性,其中52 株PnSMO1.1基因和NPTⅡPCR结果均为阳性的植株,被认为是T1转基因植株。
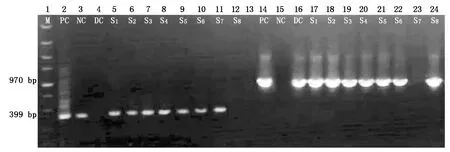
M.DL5000 DNA Marker;PC.pRI-PnSMO1.1质粒DNA为模板的PCR阳性对照;NC.pRI 101-AN空载体转化系植株基因组DNA为模板的PCR空白对照;DC.PnSMO1.1基因cDNA为模板的阳性对照;S1—S8.不同的假定SMO1-1基因过表达株系基因组DNA为模板的PCR扩增结果;2—12.卡那霉素抗性基因NPT II的PCR扩增结果;14—24.目标基因PnSMO1.1的PCR扩增结果。
2.3 不同浓度NaCl条件下转基因裂叶牵牛的生长
对SMO1、SMO2、SMO3、WT和BL等株系幼苗在测量周期内的根长相对生长量检测结果显示,在正常生理非胁迫条件下,不同株系植物种子苗在3 d测定内的根长相对生长量没有显著差异。在50 mmol/L NaCl处理下,植株的根都受到了显著抑制而生长缓慢,不同转基因株系间也表现出显著差别,其中SMO1株系幼苗表现出显著高于其他2个转基因株系植株的根相对生长量。在100~200 mmol/L NaCl处理下,PnSMO1.1过表达植株的根长的增加量显著大于WT和BL对照植株(图3)。这表明:PnSMO1.1基因的过表达显著增强了转基因裂叶牵牛根的生理耐受能力。

不同大写字母表示NaCl浓度间差异显著;不同小写字母表示株系间差异显著(P<0.05)。图4—7同。
不同浓度NaCl浓度条件下,PnSMO1.1过表达植株与WT和BL对照植株下胚轴相对生长量的测定结果显示,NaCl浓度的增加对裂叶牵牛下胚轴生长的影响小于其对根长增加的影响。在100,150 mmol/L NaCl处理下,SMO1、SMO2和SMO3转基因株系的下胚轴相对生长量高于WT和BL对照植株,而在200 mmol/L NaCl处理下,SMO2和SMO3转基因株系的相对生长量与BL对照植株的无显著差异(图4)。
这一结果表明,PnSMO1.1基因的过表达可以显著提高转基因植物根组织对100 mmol/L以上NaCl的耐受性(P<0.05)。
2.4 不同NaCl浓度处理下裂叶牵牛各株系叶片丙二醛的含量
丙二醛(Malondialdehyde,MDA)是脂质过氧化的产物,与细胞膜上多不饱和脂肪酸的氧化降解密切相关。SMO1、SMO2、SMO3、WT和BL等株系在无NaCl影响条件下幼苗叶片中的MDA含量处于较低水平且无显著差异,随NaCl处理浓度的增加,所有被测植物株系中MDA含量均显著上升。但过表达PnSMO1.1基因的转基因裂叶牵牛叶片的MDA含量,在各NaCl处理浓度水平下均低于对应的WT对照植株,而空载体转化对照系BL的MDA积累量与WT植株差异不显著(图5)。
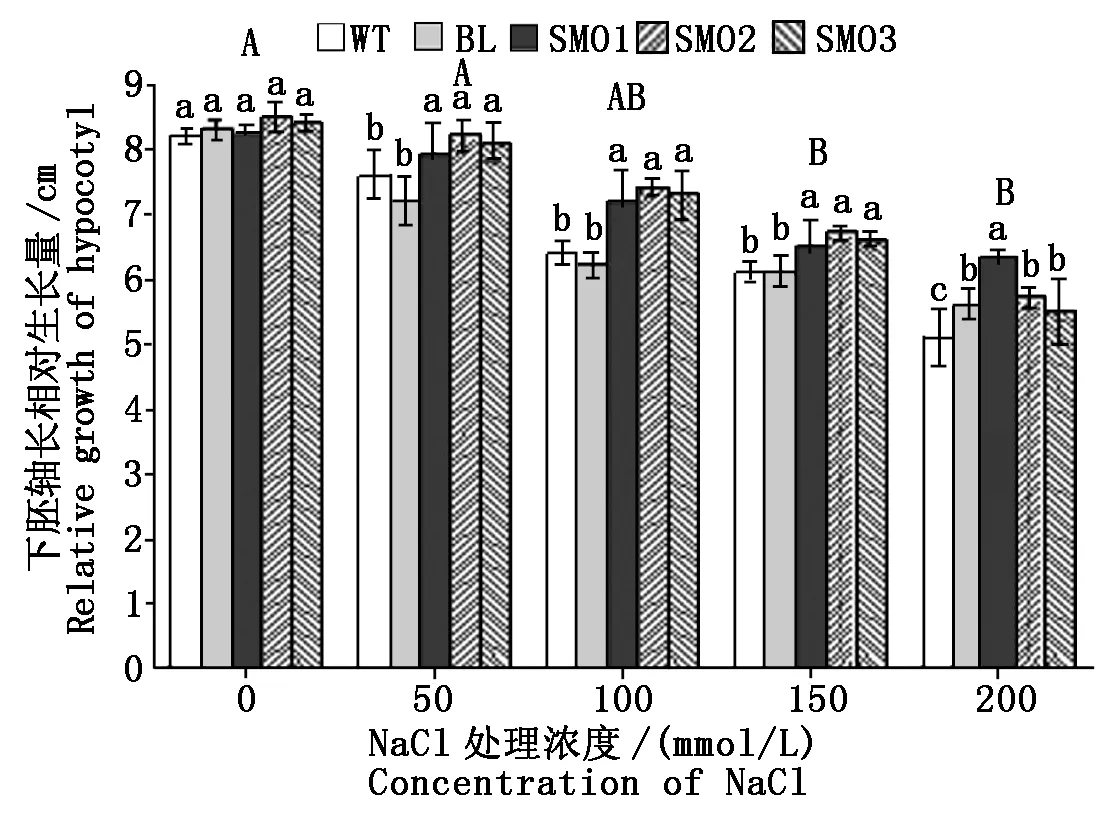
图4 不同浓度NaCl处理下植株下胚轴相对生长量Fig.4 Relative growth of hypocotyl length of different plants under treatment of various NaCl concentrations

图5 不同浓度NaCl处理下植株叶片中MDA含量Fig.5 The content of MDA in leaves of different plants under treatment of various NaCl concentrations
2.5 不同NaCl浓度处理下裂叶牵牛各株系叶片细胞电导率
随着NaCl浓度的升高,不同株系裂叶牵牛种子苗叶片的相对电导率(rEC)测量值均随之显著升高(P<0.05)(图6)。在相同的NaCl浓度条件下,WT和BL植株叶片中的rEC值显著高于3个转基因过表达株系SMO1、SMO2和SMO3植物叶片rEC。在200 mmol/L NaCl条件下,WT幼苗的rEC达到了未受NaCl影响时WT植株对应值的4.72倍。而同样在200 mmol/L NaCl条件下,SMO1、SMO2和SMO3幼苗的rEC值仅仅是相同株系种子苗在未受到NaCl影响时的该值的3.86~3.92 倍。当从正常生长状态转移到200 mmol/L NaCl浓度条件下,转基因植物叶片细胞与对应野生型细胞相比,其膜结构损伤和细胞内外的电解质渗漏均显著较轻。

图6 不同浓度NaCl处理下植株叶片相对电导率Fig.6 The relative conductivity in leaves of different plants under treatment of various NaCl concentrations
2.6 不同NaCl浓度处理下裂叶牵牛各株系叶油菜素内酯的含量
为了测试PnSMO1.1过表达是否能影响转基因植株的内源油菜素甾醇类化合物(Brassinolides,BRs)的含量,分别测定并比较了WT、BL和3个不同PnSMO1.1过表达株系植物体内油菜素甾醇的含量,包括油菜素内酯(Brassinolide,BR)、油菜素甾酮(Castasterone,CS) 和6-脱氧油菜素甾酮(6-deoxocastasterone,6-deoxoCS)(以鲜质量计)。结果显示,在不同NaCl浓度处理下,WT和BL植物叶片内CS含量基本无显著差别,仅在NaCl浓度为100 mmol/L时,BL植株测量值高于WT。但PnSMO1.1过表达株系植物与同等NaCl浓度条件下的WT和BL植株相比,其叶片内的6-deoxoCS含量均显著增加(P<0.05),而CS积累量则相对显著减少(仅在NaCl浓度为100 mmol/L时,SMO2植株测量值与WT相当,但仍显著低于BL植株)(图 7)。油菜素内酯在裂叶牵牛中的含量较低,未能在当前试验对象中检出。
3 讨论
裂叶牵牛常常被当作模式植物。然而,目前还没有建立裂叶牵牛高效组织培养体系的报道,因此植物转基因相关的成熟方法不能被直接用来研究该植物的遗传转化。在农杆菌介导法对裂叶牵牛实施遗传转化的报道中,获得次生胚胎转化幼苗的实际转化率较低[16-17],甚至有些裂叶牵牛的遗传转化研究报道仅限于获得T0转基因愈伤组织的阶段[18]。鉴于花粉管导入或子房注射等方法已成功应用于玉米、小麦、瓜类、黄瓜以及棉花等作物的转基因育种工作[19],本研究使用子房注射法对裂叶牵牛进行了遗传转化。对2 541 朵裂叶牵牛实施子房注射,实际获得卡那霉素抗性植株75 株,其中56 株的PCR鉴定结果显示,目标转基因已经成功整合到裂叶牵牛的基因组DNA中,实际转化效率约为1.22%,能满足进一步在裂叶牵牛中开展功能基因组研究的需要。因此,将携带目标基因序列的植物双元表达质粒DNA注射到花朵子房中,是一种稳定有效的裂叶牵牛遗传转化方法。
4-甲基甾醇和4,4-二甲基甾醇是真核生物体内甾醇类合成的中间体,通常被认为是胆固醇、麦角甾醇和植物甾醇生物合成的前体[20]。植物机体发生代谢抑制或遗传损伤时,往往会导致4-甲基甾醇和4,4-二甲基甾醇2种物质的过度积累,从而引发严重的细胞和发育异常[21]。对甲基甾醇功能研究的相关报道显示,它们既能在动物体内充当减数分裂激活剂,如调控免疫系统发育;也能在植物体内充当信号分子,如调控生长素信号传导[22-23]。从拟南芥cDNA 文库中克隆得到,长度分别为801,783 bp 的AtSMO1和AtSMO2基因是最早被鉴定的甲基甾醇加氧酶。核苷酸序列比对分析结果显示:AtSMO1和AtSMO2基因编码的蛋白质与来自酿酒酵母的甾醇-4α-甲基氧化酶编码基因ERG25的相似性分别为32%和 29%[24]。进一步的研究报道显示,AtSMO1和AtSMO2基因分别编码2种不同类型的 C-4-甲基甾醇氧化酶,进而分别控制植物体内4-甲基甾醇和4,4-二甲基甾醇的丰度。对沙漠植物白花牛角瓜的研究报道证明,SMO1和SMO2基因的表达受到了干旱信号和光照信号的诱导,表现出表达节律性,同时还控制了植物体内β-谷甾醇生物合成[25]。这些已有的研究结果表明,SMO基因及其表达产物可能在植物抗逆过程中起重要作用,并可能影响植物内源油菜素内酯信号物质的合成。
裂叶牵牛体内过表达甲基甾醇加氧酶基因PnSMO1.1能够显著增加不同浓度NaCl条件下根组织的生长量,并显著改善了叶片组织中由丙二醛含量和相对电导率表征的细胞水平上的耐盐性生理表现。这些结果与前人使用外源低浓度油菜素内酯物质处理植物,促进根组织生长的结果一致[26]。此外,过表达PnSMO1.1基因,显著地增加了转基因裂叶牵牛植株中的内源油菜素内酯信号物质6-脱氧油菜素甾酮的含量。特别值得注意的是,在200 mmol/L NaCl条件下,转基因株系植株体内,6-脱氧油菜素甾酮的积累量达到了野生型对照系植株的1.58 倍和空载体转化系对照植物的1.61倍。另外一种重要的内源油菜素内酯类物质是油菜素甾酮,当NaCl浓度低于100 mmol/L,该物质的含量在转基因株系与对照株系之间相似。但当NaCl浓度达到或高于150 mmol/L,所有转基因株系植株中的油菜素甾酮含量均降低到显著低于对照系的含量。上述结果表明:油菜素甾酮等内源油菜素内酯物质不是简单线性调控植物营养生长和耐受过程,其在逆境下的动态平衡才是决定植物耐受性的关键。这个结果与以前的发现吻合,即细胞内油菜素内酯物质的稳态平衡,而不是它们的绝对累积量,对于逆境条件下根系维持生长起着至关重要调控作用[27]。
总之,以NaCl浓度处理作为盐胁迫条件时,过表达PnSMO1.1基因,可导致转基因植物体内油菜素内酯物质积累量呈现显著的变化,但某一油菜素内酯物质积累量的线性变化并不破坏转基因植物体内所有油菜素内酯物质的整体平衡。这种内源油菜素内酯物质整体平衡的动态微调,可能导致了转PnSMO1.1基因植物在细胞生理和营养生长调控2 个水平上耐盐性的显著增强。
