苹果MdSGR2基因克隆及植物超表达载体构建
2022-05-12赵惠英杨光凯张小军郝燕燕
赵惠英,杨光凯,高 燕,2,张小军,2,郝燕燕,2
(1.山西农业大学 园艺学院,山西 太谷 030801;2.果树种质创制和利用山西省重点实验室,山西 太原 030031)
果实色泽是衡量果实外观品质的重要指标之一,主要由花青素、叶绿素和类胡萝卜素含量决定[1]。苹果果实色泽由底色和表色共同决定,其中底色主要受叶绿素和类胡萝卜素含量影响,表色主要受花青素含量影响[2]。在果实成熟前,多数品种苹果底色均呈绿色,随着果实成熟果皮叶绿素不断降解,使底色呈现黄白色,此现象称为果实褪绿[3-4]。
植物叶绿素降解主要发生在叶片衰老和果实成熟过程中,其降解是一个多种酶共同调节的复杂过程。目前,已鉴定出6种叶绿素代谢酶(Chl catabolic enzymes,CCEs)调控叶绿素降解[5],其中,叶绿素b还原酶(Non-yellow coloring 1,NYC1)[6]、脱镁叶绿酸a加氧酶(Pheophorbide a oxygenase,PAO)[7-8]、红色代谢产物还原酶(Red chlorophyll catabolite reductase,RCCR)[9]等叶绿素降解关键酶在多种植物中已得到分离。此外,滞绿基因STAYGREEN(SGR)也是叶绿素降解的关键基因[10]。Armstead等[11]首次在豌豆中鉴定出SGR基因为叶绿素降解的关键调控因子。此后,陆续从许多植物中克隆鉴定了SGR基因,如水稻[12]、拟南芥[13]和番茄[14]。在高等植物中,SGR基因家族分为2个亚家族,包括SGR和SGR-LIKE(SGRL)亚家族[14],单子叶植物[15-16]和双子叶植物[13,17]中都含有这2个家族。但在不同的植物类群中同源基因的数目不同,已有研究表明,拟南芥有3个SGR同源基因(AtSGR1/NYE1、AtSGR2、AtSGRL)[13],大豆有5个SGR同源基因(GmSGR1、GmSGR2、GmSGR3a、GmSGR3b、GmSGR4)[18],水稻有2个SGR同源基因(OsSGR、OsSGRL),柑橘有2个SGR同源基因(CsSGRa和CsSGRb)[19]。近年来,SGR基因的功能已在水稻[16]、柑橘[19]、拟南芥[20]、番茄[21-22]等物种中有了广泛的研究。Zhu等[19]研究发现,超表达CsSGRa显著降低了烟草叶片中叶绿素含量,而超表达CsSGRb烟草叶片中叶绿素含量没有明显变化;CsSGRa突变抑制了棕橙果实和叶片中叶绿素的降解。Sakuraba等[20]研究发现,AtSGR2负调控拟南芥叶片叶绿素的降解。Hu等[22]通过RNAi干扰沉默番茄中的SlSGR1,降低了番茄叶片和果实叶绿素的降解。但目前有关苹果SGR基因的相关研究尚未见报道。
本研究以成熟澳洲青苹苹果果皮为试验材料,克隆获得MdSGR2基因,并对其编码的蛋白结构特征进行了生物信息学分析,构建其植物超表达载体,旨在为进一步研究MdSGR2基因在苹果果皮叶绿素降解中的生物学功能奠定基础。
1 材料和方法
1.1 试验材料
供试材料为澳洲青苹成熟果实,种植于山西农业大学园艺试验站。2019年10月下旬进行样品采集,果实采收后迅速带回实验室,用人工打皮刀取胴体部位的果皮(果皮厚度约1 mm),锡箔纸包好后液氮速冻,-80 ℃保存待用。
1.2 试验方法
1.2.1MdSGR2基因克隆 利用热硼酸法提取苹果果皮总RNA,经琼脂糖电泳凝胶检测以及核酸蛋白仪(Thermo ND2000C)测定浓度合格后,利用HiScript lI 1st Strand cDNA Synthesis Kit(+gDNA wiper)反转录试剂盒合成cDNA第一链。根据澳洲青苹转录组测序结果分析得到MdSGR2基因的CDS序列(XM_029098422.1),利用Primer 5.0设计引物,即上游引物MdSGR2-F:5′-CGAGCTCATGGGCGTTTTGGCTGC-3′,下游引物MdSGR2-R:5′-GGGACTAGTCTAGTTTGATTTGCAC-3′,引物由北京擎科生物科技有限公司合成。以反转录得到的cDNA为模板,进行PCR扩增,扩增体系为:cDNA 1.0 μL(1 ng/μL),2×Phanta®Flash Master Mix 25.0 μL,引物(10 μmol/L)各2.0 μL,ddH2O 20.0 μL,共50.0 μL。扩增程序为:95 ℃预变性3 min;95 ℃变性15 s,56 ℃退火15 s,72 ℃延伸1 min,35个循环;72 ℃延伸5 min,4 ℃保存。PCR产物经1.2%琼脂糖凝胶电泳检测回收后,与克隆载体pMD-18T连接,连接产物转化大肠杆菌DH5α感受态细胞,经蓝白斑筛选和菌落PCR检测后,选取阳性单克隆送往北京擎科生物科技有限公司测序。
1.2.2MdSGR2基因生物信息学分析 利用ExPASY ProtParam tool(https://web.expasy.org/protparam/)在线工具分析MdSGR2的理化性质;MdSGR2蛋白的二级结构和三级结构分别利用SOPMA(https://npsa-prabi.ibcp.fr/cgi-bin/npsa_automat.pl?page=npsa_sopma.html)和Phyre2(http://www.sbg.bio.ic.ac.uk/phyre2/html/page.cgi?id=index)进行预测;利用TMHMM 2.0 Server(http://www.cbs.dtu.dk/services/TMHMM/)在线软件预测MdSGR2蛋白跨膜区;利用PSORT Ⅱ Prediction(https://psort.hgc.jp/form2.html)在线软件分析苹果MdSGR2蛋白亚细胞定位;MdSGR2基因启动子分析利用PlantCARE(http://bioinformatics.psb.ugent.be/webtools/plantcare/html/)完成。
1.2.3MdSGR2基因超表达载体的构建 将克隆载体pMD-MdSGR2和表达载体pCAMBIA2301分别用QuickCutTMSacⅠ和QuickCutTMSpeI酶进行双酶切。双酶切体系:质粒(0.5 ng/μL)4 μL;QuickCutTMSacⅠ酶1 μL;QuickCutTMSpeⅠ酶1 μL;Buffer 4 μL;ddH2O 30 μL。双酶切产物经琼脂糖凝胶电泳检测后,用琼脂糖凝胶DNA回收试剂盒(天根)分别对克隆载体目的片段和pCAMBIA2301空载体进行回收。随后将目的片段和空载体按摩尔比1∶3的比例进行连接。连接体系为:目的基因1.7 μL,表达载体5.3 μL,T4连接酶1 μL,Buffer 2 μL,16 ℃过夜。将连接产物转入大肠杆菌DH5α感受态细胞,经蓝白斑筛选后,选取白色单菌落进行PCR验证。挑取阳性单克隆送往北京擎科生物科技有限公司测序,将测序正确的菌液进行质粒提取并保存。
2 结果与分析
2.1 MdSGR2基因的克隆
以澳洲青苹果皮cDNA为模板,使用同源克隆引物MdSGR2-F和MdSGR2-R进行PCR扩增,结果获得与预期结果相符的目的片段(图1),测序结果表明,目的基因cDNA序列为840 bp,编码279个氨基酸。
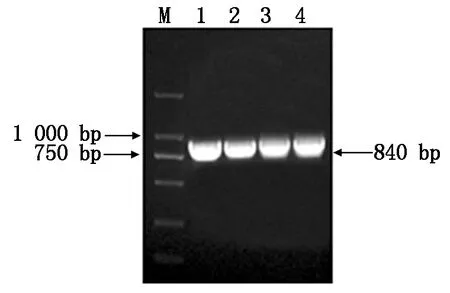
M.D2000 DNA Marker;1—4.MdSGR2基因PCR扩增产物。M.D2000 DNA Marker;1—4.PCR products of MdSGR2.
2.2 MdSGR2蛋白同源性分析
利用NCBI网站在线工具Blast检索得到MdSGR2蛋白的同源蛋白,并进行同源性分析。利用DNAMAN进行氨基酸多序列比对,结果显示,MdSGR2蛋白与秋子梨SGR蛋白具有较高同源性(图2),其中与秋子梨(KAB2632630.1)同源性为84.12%,与甜樱桃(XP 021803389.1)的同源性为72.83%,与桃(XP 007209459.1)的同源性为73.55%,与草莓(XP 004298724.1)的同源性为68.68%。

Md.苹果;Pu.秋子梨;Pp.桃;Pa.甜樱桃;Fa.草莓。Md.Malus domestica;Pu.Pyrus ussuriensis;Pp.Prunus persica;Pa.Prunus avium;Fa.Fragaria vesca subsp.vesca.
同时利用ClustalX软件和MEGA 7.0软件绘制苹果与秋子梨、梅、桃、猕猴桃、草莓、杏、陆地棉等物种间的系统进化树(图3)。结果发现,苹果MdSGR2与秋子梨聚为一小分支,表现为亲缘关系越近同源性越高。

图3 苹果MdSGR2与其他同源蛋白系统进化分析Fig.3 Phylogenetic analysis of MdSGR2 protein and other homologous proteins
2.3 MdSGR2基因编码蛋白的理化性质分析
利用ExPASY网站在线软件ProtParam对MdSGR2基因编码蛋白质进行了理化性质分析,结果表明,MdSGR2基因编码279个氨基酸,蛋白分子质量为31.27 ku,理论等电点pI为8.52,编码的蛋白分子式为C1403H2175N391O400S11;由20种氨基酸组成,其中负电荷氨基酸残基总数为29,正电荷氨基酸残基总数为33;不稳定系数为46.64,属于不稳定蛋白(小于40为稳定);脂肪指数为82.19,总平均亲水性为-0.291,属亲水性蛋白。
2.4 MdSGR2蛋白的二级结构和三级结构预测
采用SOPMA在线工具对MdSGR2蛋白二级结构进行了预测,结果显示,其主要由α-螺旋、β-转角、无规则卷曲和延伸链构成,其中,α-螺旋占40.50%,β-转角占2.51%,延伸链占12.54%,无规则卷曲占44.44%,α-螺旋、无规则卷曲占的比例较大。采用在线软件Phyre2预测了MdSGR2蛋白三级结构,结果显示(图4),其主要由α-螺旋和无规则卷曲构成,与二级结构预测结果相一致。
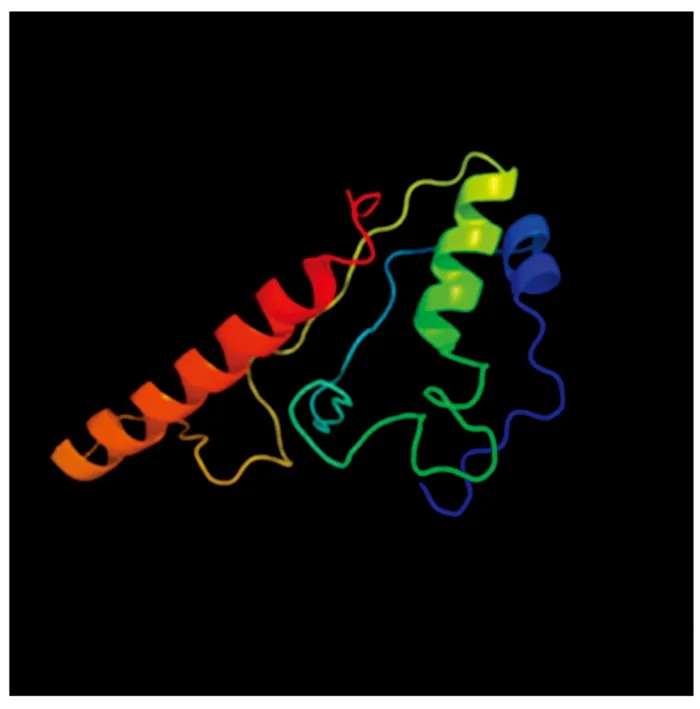
图4 MdSGR2蛋白三级结构模型Fig.4 Tertiary structure model of MdSGR2 protein
2.5 MdSGR2蛋白结构域、跨膜区、亚细胞定位预测
根据NCBI的Conserved Domain Database(CDD)(https://www.ncbi.nlm.nih.gov/ Structure/cdd/wrpsb.cgi)对MdSGR2蛋白的结构域进行了预测,结果表明,该蛋白属于Staygreen超家族,具有很高的保守性。
采用TMHMM 2.0 Server在线软件预测了MdSGR2蛋白的跨膜区,结果显示,MdSGR2蛋白不具有跨膜区,在胞外的可能性比较大,属于胞外蛋白。
植物体中不同基因编码的蛋白质有不同的存在部位,利用PSORT Ⅱ Prediction在线软件分析了MdSGR2蛋白的亚细胞定位,结果表明,该蛋白定位在线粒体的概率为56.5%,定位在细胞质的概率为13.0%,定位在细胞核的概率仅有4.3%。
2.6 MdSGR2基因启动子分析
利用PlantCARE对NCBI数据库中查找到的MdSGR2基因转录起始位点上游2 000 bp的启动子序列进行分析,查找到其所包含的顺式作用元件,并对顺式作用元件的种类、序列、功能和数量进行了分析,结果表明(表1),MdSGR2基因启动子区域片段包含ABRE元件,表明该基因受脱落酸的诱导与调控;MdSGR2基因启动子区域片段包含CGTCA-motif元件、TGACG-motif元件,表明MdSGR2基因参与茉莉酸甲酯的诱导反应;MdSGR2基因启动子区域片段包含TCA-element元件,表明MdSGR2基因参与水杨酸反应;MdSGR2基因启动子区域片段包含LTR元件,表明MdSGR2基因参与低温反应。

表1 MdSGR2基因启动子区顺式作用元件及功能Tab.1 Cis-active elements and functions in the promoter region of MdSGR2
2.7 pCAMBIA2301-MdSGR2超表达载体构建
对克隆载体pMD-MdSGR2和超表达载体pCAMBIA2301分别进行双酶切后(图5-A、B),回收MdSGR2目的片段和超表达载体的双酶切产物,连接转化后,选取阳性菌落测序,将测序正确的菌液进行了质粒的提取,成功构建pCAMBIA2301-MdSGR2植物超表达载体(图5-C)。
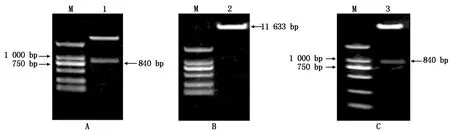
A.pMD-MdSGR2双酶切;B.pCAMBIA2301载体双酶切;C.超表达载体pCAMBIA2301-MdSGR2鉴定结果。M.D2000 DNA Marker;1.pMD-MdSGR2质粒双酶切产物;2.pCAMBIA2301载体双酶切产物;3.超表达载体pCAMBIA2301-MdSGR2双酶切产物。
3 结论与讨论
SGR蛋白参与叶片衰老和果实成熟,其对植物叶绿素降解至关重要。在高等植物中,SGR通过激发多个叶绿素降解酶与捕光复合物Ⅱ(Light-harvesting complex Ⅱ,LHCⅡ)相互作用,形成SGR-CCE-LHCⅡ复合体,进而调控叶绿素的降解[23]。苹果叶绿素降解程度对果实色泽有重要影响,目前研究主要集中于不同植物激素处理对采后果实叶绿素降解代谢的影响[24-25],而有关SGR基因调控苹果果实叶绿素降解尚未报道。本研究克隆获得澳洲青苹MdSGR2基因,结构域和序列比对分析表明,MdSGR2蛋白具有典型的Staygreen结构域,属于Staygreen超家族,与青绿苔草[26]、番茄[27]、黑麦草[28]预测的结果相一致。亚细胞定位预测结果表明,该蛋白位于线粒体的概率最大,为56.5%。而前人在日本结缕草[29]、水稻[12]、蒺藜苜蓿[12]等SGR蛋白亚细胞定位的研究结果显示,SGR蛋白均定位于叶绿体中,属于典型的叶绿体蛋白。本研究预测结果与前人研究结果不一致。因此,后续还需进一步构建亚细胞定位载体35S-GFP∷MdSGR2并瞬时转化烟草叶片,经共聚焦显微镜观察进一步确定MdSGR2蛋白的亚细胞定位。
MdSGR2基因启动子在线分析结果表明,该基因启动子区域片段包含了脱落酸、水杨酸、茉莉酸甲酯多个激素响应元件。前人研究发现,植物叶片衰老或果实成熟相关植物激素参与调控SGR基因的表达。张倩丽[30]研究表明,外源ABA处理促进了菊花脑叶片的衰老,且促进了CnSGR1基因的表达和叶绿素的降解。Yang等[31]研究表明,在ABA处理下,番茄中过表达SlSGRL加速了叶片的黄化;酵母双杂试验表明,SlSGRL主要通过与SlPPPH和SlCHa2相互作用参与ABA诱导的叶绿素降解。Tan等[32]研究发现,外源施用茉莉酸甲酯(MeJA)加速了卷心菜叶片衰老,且BrPAO1、BrNYC1、BrPPH1和BrSGR1基因的表达量显著提高。由此推断,MdSGR2基因可能亦受果实成熟相关植物激素的调控,这为今后进一步研究ABA、MeJA等植物激素对MdSGR2基因表达的调控机制提供了思路。
目前,构建植物表达载体进行模式植物遗传转化是验证目的基因生物学功能的有效手段。近年来,利用转基因技术解析SGR基因调控植物叶绿素降解生物学功能的研究已有较多报道。刘凌云等[26]利用花序侵染法将青绿苔草滞绿基因CbSGR转化拟南芥,过表达株系表现出黄化,加速了植株的衰老。檀鹏辉等[33]利用转基因技术,将ZjSGR基因整合到烟草基因组中,转基因烟草出现黄化现象,并且提高了烟草中SAG113、SAG12、NCED和AAO3衰老基因的表达量。周志湘等[34]研究发现,ZjSGR基因转化至匍匐剪股颖其叶绿素含量明显加速下降。这些结果都表明,SGR基因参与调控多种不同植物中叶绿素降解代谢,因此,本研究构建了植物超表达载体pCAMBIA2301-MdSGR2,进一步探究MdSGR2基因在叶绿素降解中的作用。
