希金斯炭疽菌效应子基因ChEP085的功能研究
2022-05-12祝一鸣刘艳潇何九卿段灵涛周而勋
祝一鸣,刘艳潇,何九卿,段灵涛,周而勋
(华南农业大学 植物病理学系,广东省微生物信号与作物病害防控重点实验室,广东 广州 510642)
炭疽菌(Colletotrichumspp.)是一类重要的植物病原真菌,该真菌在2012年被评选为世界十大植物病原真菌之一[1]。希金斯炭疽菌(C.higginsianum)是炭疽菌中一种典型的半活体营养型真菌,能够侵染诸多十字花科植物,如芸薹属(Brassica)、萝卜属(Raphanus)植物以及模式植物拟南芥(Arabidopsisthaliana)等,引起十字花科炭疽病[2-3]。菜心(B.parachinensis)是华南地区特产蔬菜之一,该地区高温高湿的气候条件,非常有利于菜心炭疽病的发生,该病一旦发生,轻则影响蔬菜的外观品质,重则造成30%~40%的减产[4]。目前,十字花科炭疽病的防控手段主要以化学农药防治为主,选育和推广抗病品种为辅,但总体来说仍缺乏十分有效的防治措施。由于希金斯炭疽菌易于在实验室中培养,也便于进行基因操作,同时该菌的完整基因组数据及转录组数据也已测序完成并公布[3,5]。基于以上这些条件,希金斯炭疽菌-拟南芥互作体系非常适合作为植物病害系统模型来研究这类真菌的致病机制,因而对于探索植物炭疽病新的防控策略具有重要的意义。
病原菌在侵染植物过程中,会分泌与植物相互作用的蛋白,这类蛋白称为效应蛋白或效应子(Effector),在植物细胞内发挥着重要作用,从而影响病原菌与植物的相互作用结果[6]。植物可以利用2层免疫系统来保护自身以免受外界病原菌的侵染。首先,植物细胞表面的模式识别受体(Pattern recognition receptors,PRRs)检测到保守的病原相关分子模式(Pathogen associated molecular patterns,PAMPs),并触发植物第1道免疫防线—病原相关分子模式触发的免疫(PAMP triggered immunity,PTI);其次,当病原菌效应子被寄主植物相应的抗性蛋白直接或间接识别之后,寄主植物的第2道防线—效应子触发的免疫(Effector-triggered immunity,ETI)则被激活[7]。一般来说,PTI提供植物更基础和更为广泛的抗性,而ETI则给植物提供了更强烈和更加特异性的免疫反应,如过敏性反应[8]。近年来,随着真菌和植物的基因组及转录组数据的增多,关于植物-真菌互作方面的研究取得了重大进展。在与植物的互作过程中,真菌能够分泌数百种被称为效应子的蛋白质来操纵寄主生理过程或抑制寄主免疫,以利于病原真菌的侵染[9]。由于许多效应子是改变寄主新陈代谢和发育方向的工具,它们的合成数量和合成时机都被病原菌严格控制,以达到最佳的、平衡的结果,特别是在需要保持寄主生存能力的活体营养阶段。现有的研究表明,多种病原真菌能严格控制效应子合成时机及其分泌位置和方式,如稻瘟病菌、玉米黑粉菌[10-12]。与此同时,众多转录组试验也证明了效应子在真菌侵染阶段特异性表达,如专性活体营养病原菌青杨叶锈菌(Melampsoralarici-populina)、半活体营养真菌希金斯炭疽菌、专性活体营养真菌大麦布氏白粉菌(Blumeriagraminis)、根际共生菌印度梨形孢(Serendipitaindica)等[5,13-15]。因此,在真菌侵染阶段特异性表达并诱导植物过敏性坏死成为筛选效应子的有效手段之一。
本研究基于本研究室前期预测的希金斯炭疽菌候选效应子进行筛选[16],得到一个能稳定引起烟草叶片死亡、且在侵染阶段有特异性表达的候选效应子ChEP085,并对该效应子进行深入的分析,明确其功能,以期更好地了解希金斯炭疽菌的致病机理,为十字花科植物炭疽病的防控提供理论支撑。
1 材料和方法
1.1 菌株、质粒及植物材料
希金斯炭疽菌国际标准菌株IMI349063由华中农业大学植物科学技术学院黄俊斌教授惠赠,在PDA培养基、28 ℃黑暗下培养,备用。大肠杆菌(Eschrichiacoli)DH5α购买于擎科公司;根癌农杆菌(Agrobacteriumtumefaciens)GV3101由南京农业大学卵菌与真菌分子生物学实验室惠赠,现由华南农业大学实验室留种保存;根癌农杆菌AGL1由华南农业大学群体微生物研究中心邓懿祯教授惠赠,现由本实验室留种保存。本氏烟草(Nicotianabenthamiana)种子由南京农业大学卵菌与真菌分子生物学实验室惠赠,现由本实验室留种保存;植物培养室中培育,光照16 h/25 ℃、黑暗8 h/22 ℃,选取生长至35 d的烟草用于试验。拟南芥Col-0,光照16 h/22 ℃,黑暗8 h/20 ℃培养28 d,用于试验。
马铃薯X病毒(PotatovirusX,PVX)表达载体PVX用于烟草瞬时表达,抗生素选择性标记为卡那霉素(Kanamycin),INF1(来自致病疫霉(Phytophthorainfestans)的凋亡诱导蛋白)已构建在PVX表达载体上,由南京农业大学卵菌与真菌分子生物学实验室惠赠。增强型绿色荧光表达载体pBinceGFP,抗生素选择性标记为卡那霉素,由南京农业大学卵菌与真菌分子生物学实验室惠赠。敲除载体为pFGL821,载体大小8 401 bp,抗性标记为卡那霉素和潮霉素(HygromycinB),由华南农业大学群体微生物研究中心邓懿祯教授惠赠。回补载体为pFGL822-NeoR,载体大小8 288 bp,抗性标记为卡那霉素和新霉素(Neomycin),由本实验室提供。
1.2 试验方法
1.2.1 候选效应子基因表达模式分析 收集希金斯炭疽菌野生型(Wild type,WT)的分生孢子。并用血球计数板计数,将孢子悬浮液浓度调至1.0×106个/mL,随后均匀喷洒接种至拟南芥叶片上,置于光照培养箱中保湿培养(光照16 h/26 ℃,黑暗8 h/25 ℃),分别于接种后的6,12,24,36,48,60 h收取拟南芥叶片样品,每个时间段3株重复,液氮速冻后,按照TaKaRa Mini BEST plant RNA Extration Kit RNA提取试剂盒步骤进行提取,剩余样品保存于-80 ℃冰箱备用。以提取的总RNA为模板,按照TaKaRa PrimeScriptTMRT reagent Kit with gDNA Eraser(Code No.RR047A)反转录试剂盒步骤合成第1链cDNA。实时荧光定量PCR(qRT-PCR)采用擎科2×T5 Fast qPCR Mix(SYBR Green I)Lot#TSE202,按照说明使用20 μL反应体系,在实时荧光定量 PCR 仪(Bio-Rad CFX96)运行,程序为:94 ℃ 30 s;40 个循环(95 ℃ 5 s,55 ℃ 15 s,72 ℃ 10 s);95 ℃ 10 s。以希金斯炭疽菌的Actin基因作为内参基因,相对表达量采用2-ΔΔCt法计算。试验中的所有引物见表1。

表1 使用的PCR引物Tab.1 Primers used in this study
1.2.2 烟草瞬时表达和烟草叶片酒精脱色观察 注射基质的配制:10 mmol/L MgCl2,10 mmmol/L MES,150 μmol/L AS。菌液制备:挑取含有目的基因质粒的农杆菌GV3101单菌落至5 mL含有50 mg/L卡那霉素和100 mg/L利福平的LB液体培养基中,28 ℃、200 r/min摇床中培养48 h;室温5 000 r/min离心3 min,弃上清;加入3 mL 10 mmol/L MgCl2重悬,室温5 000 r/min离心3 min,弃上清;加入配好的注射基质,使用分光光度计调OD600为0.5,28 ℃黑暗孵育2 h。
选取长势良好的烟草植株,从顶端向下数第3~6片真叶注射农杆菌,每个处理注射不同植株的3片叶片以上;做好标记后于植物培养室中继续培养。每片烟草叶片上注射4个位点,左上角注射PVX-HA空载体作为阴性对照,右上角注射PVX-INF1作为阳性对照,左下角注射PVX-ChEP085,右下角注射PVX-ChEP085-noSP,设置5个重复,6 d后观察诱导坏死试验结果。为了便于观察烟草叶片的坏死效果和程度,可对烟草叶片进行脱色处理。剪下烟草叶片拍照后放入培养皿,加入无水乙醇至没过叶片,室温置于脱色摇床上,100 r/min脱色24~36 h,待叶绿素完全褪去后拍照观察。
1.2.3 ChEP085信号肽功能研究 ChEP085生物信息学分析,即从NCBI网站搜索ChEP085(locus_tag="CH063_11815,product="hypothetical protein",protein_id="CCF41571.1),确定基因大小及mRNA序列,使用SignalP 4.1(http://www.cbs.dtu.dk/services/SignalP/),Conserved Domain Datebase预测有无已知功能的结构域。
ChEP085信号肽诱导或抑制烟草叶片坏死研究。为明确信号肽对诱导烟草叶片坏死或对INF1诱导的坏死的影响,分别将效应子全长及缺失信号肽序列单独注射烟草、与INF1共注射烟草观察试验结果。根据信号肽预测结果,设计缺失信号肽序列引物。以PVX-ChEP085质粒为模板,将缺失信号肽序列构建至PVX表达载体,转化农杆菌GV3101后先单独注射烟草,验证ChEP085缺失信号肽后是否影响诱导烟草叶片坏死的功能。注射方法参照1.2.2。
ChEP085信号肽对亚细胞定位的影响:为明确希金斯炭疽菌效应子ChEP085的亚细胞定位及信号肽对亚细胞定位的影响,将效应子ChEP085全长序列与缺失信号肽序列构建到含有增强型绿色荧光蛋白的绿色荧光表达载体pBinceGFP上。转化农杆菌进行烟草注射,方法参照1.2.2。亚细胞定位实验进行全叶片注射,注射后48 h切下烟草叶片,制作水玻片,利用荧光显微镜在波长480 nm下观察叶片下表皮细胞中绿色荧光分布情况并进行拍照。
1.2.4 效应子基因ChEP085敲除菌株的获取与验证 以希金斯炭疽菌基因组DNA为模板进行所需基因片段克隆,将质粒pFGL821进行双酶切,选用Hind Ⅲ和SalⅠ酶切位点,作为上游片段重组位点进行重组连接,测序验证连接正确后,将其命名为p821-85us。继续对质粒p821-85us进行双酶切,选用BamH Ⅰ和XbaⅠ酶切位点,作为下游片段重组位点进行重组连接,转化大肠杆菌DH5α并进行菌落验证,菌落验证正确后送公司测序,测序验证连接正确后提取质粒,将其命名为敲除质粒p821-85ko。利用T-DNA介导的农杆菌转化法获得敲除转化子经过抗性筛选、PCR验证,获得候选敲除转化子[17]。利用Southern Blot技术对候选转化子进行拷贝数验证,具体参照Gu等[18]关于敲除突变体的获取与验证的方法进行。
1.2.5 效应子基因ΔChEP085互补菌株的获取与验证 将质粒pFGL822-NeoR进行单酶切,选用EcoR Ⅰ酶切位点,使用试剂盒VazymeCloneExpress Ⅱ One Step Cloning Kit重组连接,具体操作参照1.2.4,转化大肠杆菌后进行PCR验证,验证引物使用HBAtg8-F/R,测序验证正确后,将其命名为p822-85hb。互补菌株的获取与验证方法同1.2.4。
1.2.6 野生型菌株、ΔChEP085突变菌株及CΔChEP085互补菌株基本生长情况的测定 用打孔器分别在野生型菌株、ΔChEP085突变菌株和CΔChEP085互补菌株上打取直径为6 mm 的新鲜菌饼,接种于 PDA 培养基中心位置,每个菌株设置3个重复。在 28 ℃恒温培养箱中培养3 d 后用十字交叉法测量菌落直径,并记录菌落的生长形态。
1.2.7 野生型菌株、ΔChEP085突变菌株及CΔChEP085互补菌株产孢量测定 用打孔器取6 mm的野生型菌株、ΔChEP085突变菌株及CΔChEP085互补菌株的新鲜菌饼若干,分别接种到含 150 mL PDB 培养基的锥形瓶中,28 ℃摇床振荡培养 5 d,过滤,5 000 r/min离心 10 min,过滤收集分生孢子,使用血球计数板对每个菌株产生分生孢子的数量进行计数。
1.2.8 野生型菌株、ΔChEP085突变菌株及CΔChEP085互补菌株致病力的测定 参照1.2.7获得希金斯炭疽菌野生型菌株和各敲除突变体的孢子悬浮液,调孢子浓度为1.0×106个/mL,采用喷雾接种的方法接种活体拟南芥,每个菌株喷雾接种3株拟南芥,拟南芥叶面与叶背都喷雾接种完全后放进塑料盆中,并在塑料盆上铺上一层保鲜膜,于25 ℃培养箱中培养,培养光照条件为16 h光照、8 h黑暗,培养4 d后观察活体拟南芥发病情况并拍照记录。
接种后第5天,按照表2 所列的病情分级标准,对拟南芥进行病情指数统计。

表2 拟南芥接种希金斯炭疽菌后的病情分级标准Tab.2 Disease grading criteria for Arabidopsis thaliana inoculated with Colletotrichum higginsianum
病情指数=∑(病级叶片株数×病级数值)/(叶片总和×发病最高级的代表数值)×100。
2 结果与分析
2.1 ChEP085生物信息学分析
希金斯炭疽菌ChEP085基因(GenBank登录号:OBR03416)的序列长度为675 bp,无内含子,编码224个氨基酸,翻译产物为假定蛋白;通过SingnalP 4.1 分析表明,其N端含有一段21个氨基酸的信号肽序列(图1),利用Conserved Domain Datebase进行预测,未发现已知功能的结构域。
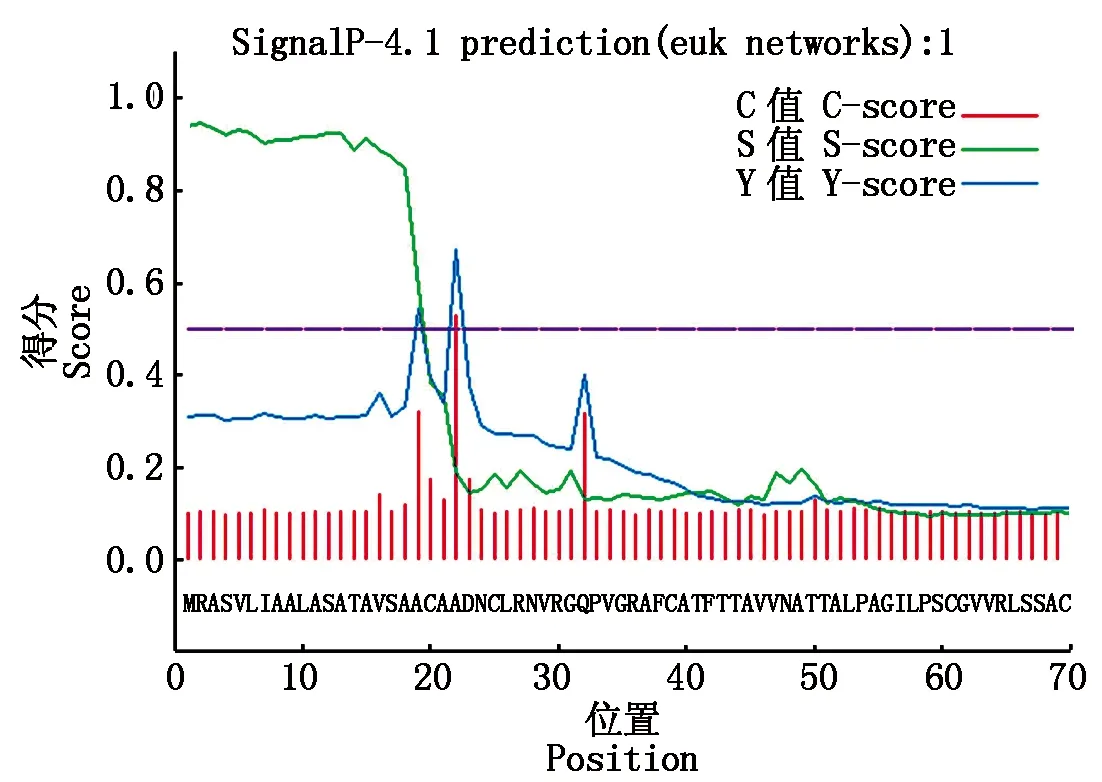
图1 希金斯炭疽菌效应子ChEP085在SingnalP 4.1的信号肽预测Fig.1 Signal peptide prediction of effector ChEP085 of Colletotrichum higginsianum in SingnalP 4.1
2.2 ChEP085基因在希金斯炭疽菌侵染拟南芥过程中诱导表达
为探索效应子ChEP085在希金斯炭疽菌侵染寄主过程中的表达情况,分析了ChEP085基因在分生孢子悬浮液喷雾接种拟南芥6,12,24,36,48,60 h后的表达情况,0 h样品为菌丝。从图2可看出,ChEP085基因在菌丝中有一定表达;在侵染后,ChEP085基因一开始表达量较低,在24 h有最大表达量,之后该基因表达量下降,达到接种初期水平。

图2 希金斯炭疽菌效应蛋白基因ChEP085的表达模式Fig.2 Expression patterns of effector gene ChEP085 of Colletotrichum higginsianum
2.3 效应子ChEP085的亚细胞定位
由图3可知,表达空载pBinceGFP的绿色荧光在细胞核(红色箭头指示)和细胞膜上均有分布,表明载体上的绿色荧光蛋白在烟草细胞中成功表达;重组表达载体pBinceGFP-ChEP085的绿色荧光大部分分布在细胞膜上,有少量堆积在细胞质中;而重组表达载体pBinceGFP-ChEP085-noSP的绿色荧光在细胞核(红色箭头指示)、细胞膜和细胞质中都有定位。以上结果说明,信号肽在效应子ChEP085的定位过程中起到重要作用。
2.4 ChEP085信号肽的功能研究
为明确效应子ChEP085信号肽的功能,将其缺失信号肽的序列构建至PVX表达载体,利用农杆菌瞬时表达系统注射烟草,注射6 d后观察叶片坏死情况。以空载PVX为阴性对照、INF1为阳性对照,表达效应子ChEP085和去除信号肽的效应子ChEP085-noSP,6 d后观察坏死情况,结果显示,去除信号肽后,仍能引起烟草叶片坏死反应(图4),说明信号肽的缺失不影响ChEP085引起烟草叶片坏死的功能。

A.空载pBinceGFP荧光分布;B.pBinceGFP-ChEP085荧光分布;C.pBinceGFP-ChEP085-noSP荧光分布。A.The localization of empty vector pBinceGFP under fluorescence microscope;B.The localization of pBinceGFP-ChEP085;C.The localization of pBinceGFP-ChEP085-noSP.
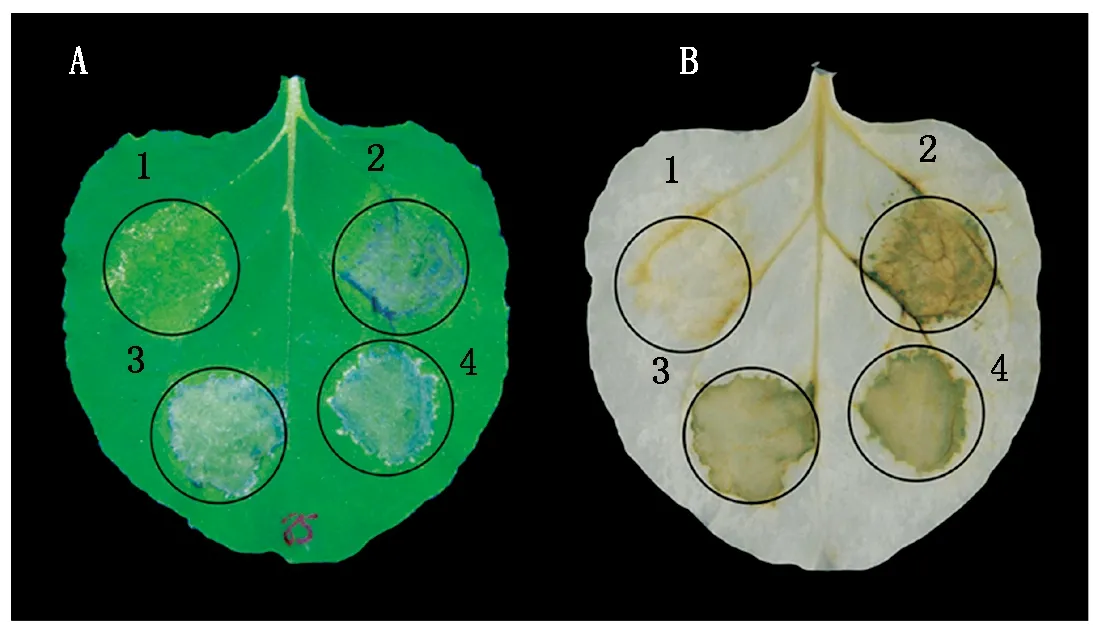
A.含有相应重组载体的农杆菌菌液处理注射 6 d 后的本氏烟表型观察;B.本氏烟叶片经过脱色处理后的表型观察。1.PVX;2.PVX-INF1;3.PVX-ChEP085;4.PVX-ChEP085-noSP。
2.5 效应子基因ChEP085的敲除及回补
本研究采用同源重组的方法对编码该蛋白的基因进行敲除,之后再将该基因回补,以验证该效应子的功能,敲除策略如图5所示。
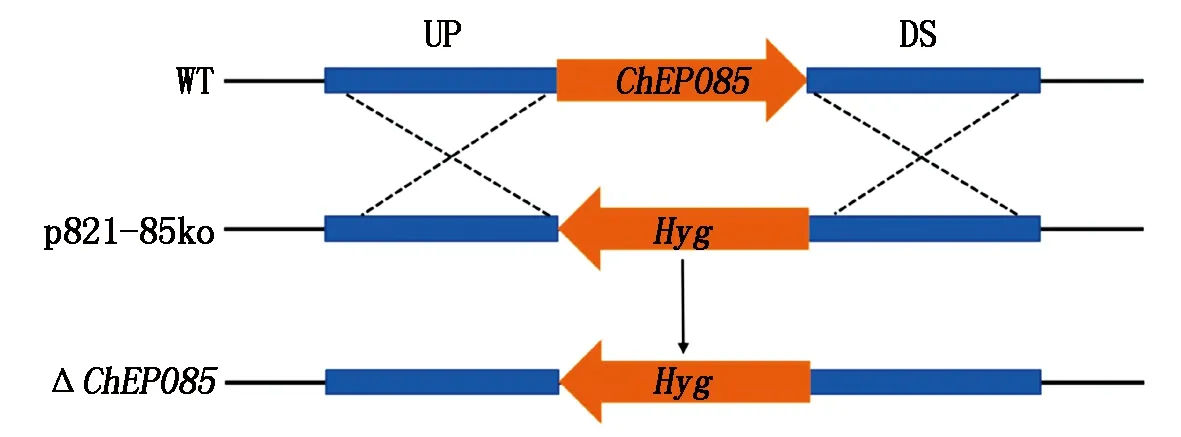
图5 ChEP085基因敲除策略Fig.5 Knockout strategy of gene ChEP085
以清水和希金斯炭疽菌野生型菌株基因组DNA为对照,使用3对引物对敲除突变体进行验证。使用ChEP085基因引物85-F和85-R进行扩增时,基因敲除突变体不能扩增到条带,而希金斯炭疽菌野生型菌株可扩增得到大小为675 bp的条带(图6-A);使用潮霉素基因引物Hyg-F和Hyg-R扩增时,基因敲除突变体可以扩增得到一条大小为865 bp的条带,而希金斯炭疽菌野生型菌株不能扩增到条带(图6-B);使用基因敲除引物85ko-F和85ko-R扩增时,基因敲除突变体可以扩增得到一条大小为2 515 bp的条带,而希金斯炭疽菌野生型菌株扩增得到一条大小为1 770 bp的条带(图6-C)。

A.引物85-F/R扩增PCR产物;B.引物Hyg-F/R扩增PCR产物;C.引物85ko-F/R扩增PCR产物。M.DL5000 Marker;1—4.ΔChEP085-1/-2/-6/-8 敲除转化子;5.双蒸水;6.野生型菌株。A.PCR products were amplified using primers 85-F/R;B.PCR products were amplified using primers Hyg-F/R;C.PCR products were amplified using primers 85ko-F/R.M.DL5000 Marker;1—4.ΔChEP085-1/-2/-6/-8 knockout mutants;5.ddH2O;6.Wild type.
本研究一共验证得到4株正确的基因敲除突变体,分别命名为ΔChEP085-1、ΔChEP085-2、ΔChEP085-6、ΔChEP085-8,之后再随机选取2个突变体ΔChEP085-2、ΔChEP085-8,以希金斯炭疽菌野生型菌株基因组DNA为对照,进行Southern Blot验证。由于选取探针位置在潮霉素基因上,故希金斯炭疽菌野生型菌株基因组没有杂交条带,而基因敲除突变体杂交得到一条大小为2 577 bp的条带,如图7所示,结果证明了ChEP085基因被成功敲除,且替换目的基因的潮霉素基因片段在基因敲除突变体中为单拷贝。后期选取ΔChEP085-8基因敲除突变体(后统称为ΔChEP085)进行了相关生物学性状的观察。
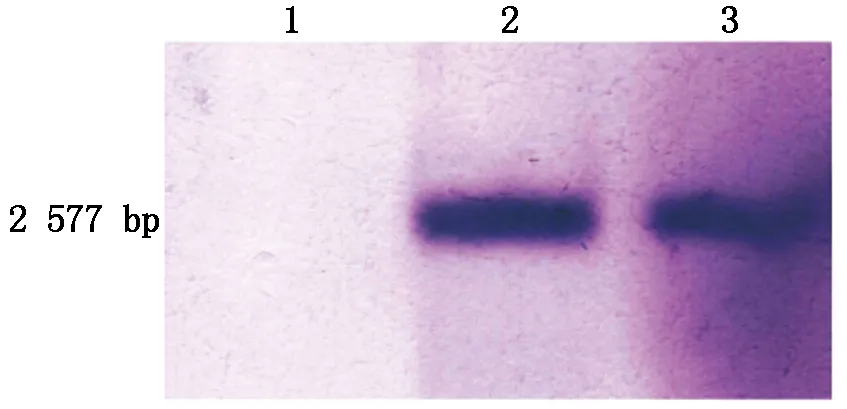
1.野生型菌株;2.基因敲除突变体ΔChEP085-2;3.基因敲除突变体ΔChEP085-8。1.Wild type;2.ΔChEP085-2 knockout mutant;3.ΔChEP085-8 knockout mutant.
回补突变体经过G418的初步筛选后,以希金斯炭疽菌野生型菌株和基因敲除突变体DNA为对照,使用2对引物对基因回补突变体进行验证:使用引物85-F和85-R扩增时,希金斯炭疽菌野生型菌株和基因回补突变体可以扩增得到一条大小为672 bp的条带,而基因敲除突变体不能扩增到条带(图8-A);使用引物G418-F和G418-R扩增时,野生型菌株和基因敲除突变体不能扩增到条带,只有基因回补突变体可扩增得到大小为715 bp的条带(图8-B)。最后得到4株验证正确的基因回补菌株,包括M12、2-13、8-7、8-9。后期选取M12回补突变体(后统称为CΔChEP085)进行了相关生物学性状的观察。

A.引物85-F/R扩增结果;B.引物G418-F/R扩增结果;M.DS2000 Marker;1.双蒸水;2.野生型菌株;3.ΔChEP085突变体;4.回补质粒p822-85hb;5—9(M12、2-13、8-5、8-7、8-9).回补转化子。
2.6 野生型菌株、ΔChEP085突变菌株及互补菌株基本生长情况的测定
菌丝生长5 d后(图9-A),观察菌落形态,同时测量菌落直径发现,野生型菌株、ΔChEP085突变菌株及互补菌株的菌落形态无显著差异,菌落直径也无显著差异(图9-B)。
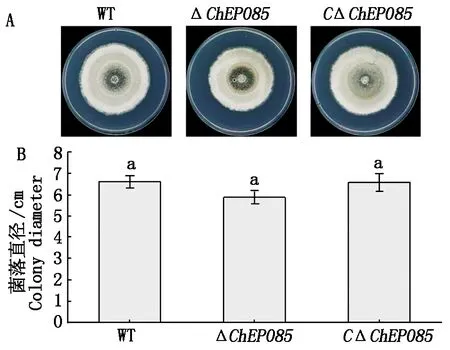
A.PDA 培养基上的菌落形态;B.菌落直径比较;图中数据为平均数±标准误。不同字母表示在 P<0.05 时差异显著。图10—11同。
2.7 野生型菌株、ΔChEP085突变菌株及CΔChEP085互补菌株产保量及致病力情况分析
为明确ChEP085基因对产孢量的影响,对希金斯炭疽菌野生型菌株、ΔChEP085突变菌株及互补菌株的产孢量进行了测定(图10),结果发现,ΔChEP085突变菌株的产孢量显著低于野生型和CΔChEP085(P<0.05)。说明ChEP085基因在希金斯炭疽菌产孢中起着重要的作用。

图10 野生型菌株、ΔChEP085突变菌株及CΔChEP085互补菌株的产孢量分析Fig.10 Analysis of conidia production of wild type,ΔChEP085 mutants and CΔChEP085 conplementary strains
此后,为研究该效应子对致病力的影响,分别将野生型、ΔChEP085和CΔChEP085菌株的孢子浓度调节到1.0×106个/mL,然后喷洒至寄主植物拟南芥叶片上,在27 ℃、湿度100%、12 h/12 h光照/黑暗交替条件下培养5 d后,再观察发病情况(图11-A)。根据叶片的发病面积,划分为不同的病级,并统计病情指数,结果发现,ΔChEP085突变菌株的病情指数为42.0±2.65,显著低于野生型90.0±6.7和CΔChEP085菌株87.7±2.52(P<0.05)(图11-B)。说明该效应子ChEP085在希金斯炭疽菌致病过程中起到了重要作用。
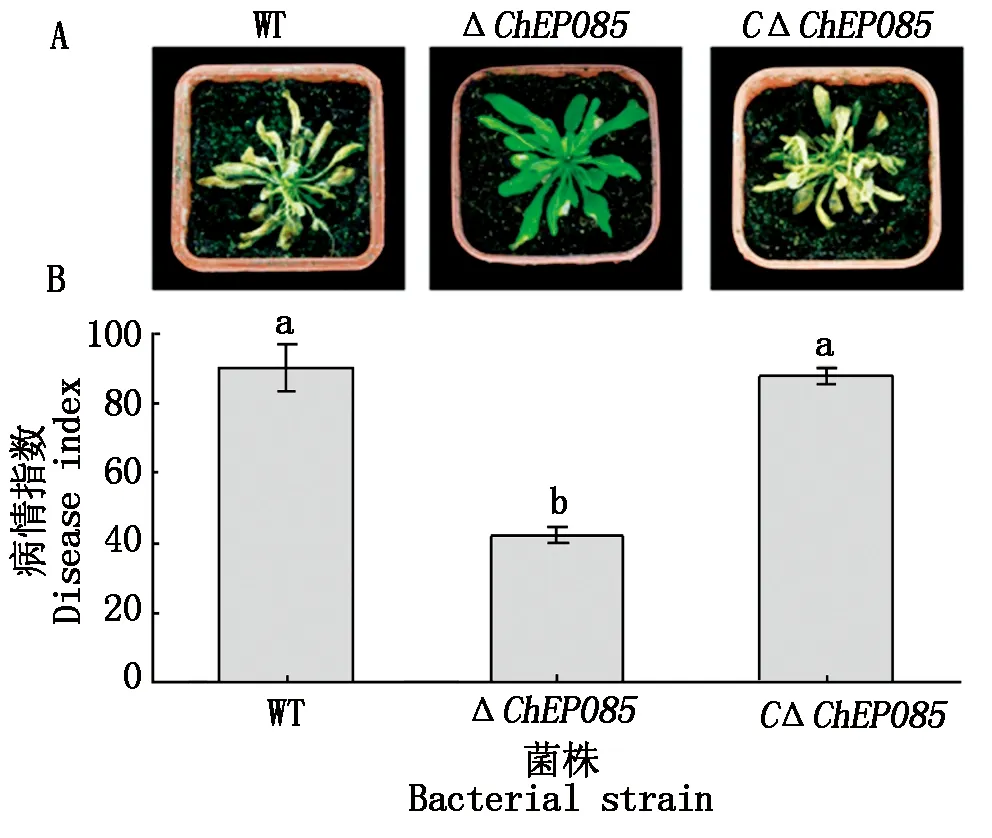
A.野生型、ΔChEP085突变菌株及CΔChEP085互补菌株孢子喷洒拟南芥5 d后,拟南芥的发病情况;B.对应的病情指数统计。
3 结论与讨论
近年来,随着越来越多的病原真菌基因组和转录组测序的完成,针对各种真菌效应子的研究也逐渐深入,炭疽菌属中效应子的功能也越来越多地被揭示。在平头炭疽菌(C.truncatum)中,效应子CtNUDIX在活体营养阶段后期表达,在烟草叶片中瞬时表达该基因能诱导类似过敏性反应(HR)的细胞死亡,过表达该基因导致病原菌失去致病力;胶孢炭疽菌(C.gloeosporioides)效应子CgDN3能抑制寄主HR反应,其敲除突变体丧失对寄主植物的侵染能力[19];黄瓜炭疽菌(C.orbiculare)的分泌蛋白NIS1能诱导本氏烟草细胞死亡,且这一坏死反应能在侵染后期被CgDN3所抑制[20],另一个效应子CoDN3能抑制NIS1诱导的烟草细胞坏死,表明其具有抑制ETI途径的功能[19-20],CoMC69对黄瓜炭疽菌成功侵染起关键作用[20];而在希金斯炭疽菌中,基于全基因组测序,为研究关键致病基因提供了条件,其中侵染早期阶段(附着胞穿透和活体营养阶段)有大量编码假定分泌效应子的基因被激活[5],这些效应子可能干扰或抑制植物免疫反应以促进病原菌的侵染。其中,效应子ChELP1和ChELP2抑制几丁质触发的寄主免疫反应,且ChELP1是希金斯炭疽菌发挥毒力所必需的效应子[21];候选效应子ChEC6和ChEC36集中分泌在附着胞孔处,而ChEC34、ChEC89则聚集在初生菌丝附近的界面体中[22]。
本研究基于本实验室前期的研究结果[16],借助烟草瞬时表达系统和qRT-PCR分析发现,ChEP085效应子能够稳定引起烟草坏死,并且在亚细胞定位试验中显示绿色荧光蛋白(即ChEP085与绿色荧光蛋白融合表达)聚集在细胞膜,ChEP085基因在整个侵染阶段保持较低表达量的同时,在侵染拟南芥后24 h表达量明显提高,说明编码候选效应子ChEP085的基因在希金斯炭疽菌侵染寄主的早期阶段(附着胞穿透和活体营养阶段)被激活,与此类似的是禾谷炭疽菌(C.graminicola)中,效应子Cgf1和CgEP1就是在活体营养阶段进行表达并帮助病原菌在寄主体内成功定殖的[23-24]。因此,效应子ChEP085很可能在此时对病原菌的成功侵染发挥着关键作用。本研究对编码ChEP085效应蛋白的基因进行敲除发现,该基因对于希金斯炭疽菌的生长和菌落形态几乎没有影响,但与野生型和CΔChEP085菌株相比,ΔChEP085突变体的产孢量及致病力均显著降低。说明ChEP085基因与希金斯炭疽菌的产孢能力和致病力密切相关。综上,效应子ChEP085在希金斯炭疽菌体内可能参与希金斯炭疽菌产孢的调控;在希金斯炭疽菌侵染过程中,ChEP085可能在活体营养阶段被大量分泌,定殖于寄主植物的细胞膜上,并抑制寄主植物的免疫反应,帮助病原菌侵入寄主植物。
