细胞焦亡在血管紧张素Ⅱ诱导的腹主动脉瘤形成中的作用研究
2022-05-11姚弈伟刘亚峰陈淦一王晓棣陈鑫
姚弈伟,刘亚峰,陈淦一,王晓棣,陈鑫
近年来,腹主动脉瘤(abdominal aortic aneurysm,AAA)已成为严重威胁公众健康的疾病。吸烟、男性、年龄(>60岁)、家族史、其他心血管疾病均可能是其发生的危险因素[1-3]。既往研究表明,AAA是一种慢性血管并发症,其病理特征为血管平滑肌细胞耗损[4],细胞外基质降解加速[5],肾素-血管紧张素系统活化[6-8],活性氧积累[9],炎性细胞浸润[10],从而导致主动脉壁弱化。然而,虽然炎症和细胞死亡是该病发生和发展的关键因素,但其具体调控机制尚不完全清楚。目前,除了有风险的开放手术或血管内介入治疗,尚无有效的药物来阻止AAA的进展。
动脉粥样硬化一直被认为是AAA发展的主要因素,越来越多的证据表明,细胞死亡和无菌性炎症在很多方面促进了AAA的进展[11-12]。细胞死亡基本上可分为程序性细胞死亡和非程序性细胞死亡,其中细胞焦亡作为一种促炎性的程序性细胞死亡已被证明在多种心血管疾病发展中具有特异性作用。既往研究表明,细胞焦亡通过促进血管壁弹性层的破坏,在AAA的进展中发挥重要作用[13]。研究发现,与非AAA患者相比,AAA患者血液循环中白细胞的NLRP3、Caspase-1、IL-1β mRNA表达水平升高,而NLRP3蛋白表达水平则降低[14]。另有研究也发现,AAA患者腹主动脉中Caspase-1蛋白和NLRP3 mRNA表达水平升高[15-16]。本研究旨在分析细胞焦亡在血管紧张素Ⅱ诱导的AAA形成中的作用,以期为AAA的药物治疗提供新的靶点和理论依据。
1 材料与方法
1.1 实验动物及细胞 本实验时间为2019年9月至2021年9月。动物实验均按照南京医科大学机构动物护理与使用委员会批准的指导方针进行。50只野生型小鼠购自南京大学模式动物研究所,均为8~12周龄C57BL/6小鼠,雄性,体质量20~25 g,饲养并繁殖于南京医科大学附属南京医院动物实验中心,实验期间小鼠可自由饮水、进食,照明采用自然昼夜光照,室温控制在21~23 ℃,空气相对湿度控制在45%~55%。小鼠主动脉血管平滑肌细胞(MOVAS)购自广州吉妮欧生物科技有限公司。
1.2 动物实验
1.2.1 小鼠AAA模型建立及腹主动脉超声检查 小鼠适应性饲养1周后称重并用耳标标记,按照抽签法随机分为对照组(n=24)和血管紧张素Ⅱ组(n=26)。所有小鼠吸入异氟烷麻醉,在肩胛骨中部皮下植入渗透微型泵(ALZET,模型2004,ALZA Corp,USA),注入0.9%氯化钠溶液(对照组)或血管紧张素Ⅱ(Sigma,A9525)(血管紧张素Ⅱ组),以1 mg·kg-1·min-1的剂量持续灌注28 d。28 d后采用超高分辨率小动物超声影像系统(visual-sonic,Canada,型号:Vevo 2100型,配备30 MHz换能器)进行腹主动脉超声检查,取腹主动脉纵切面进行测量。
1.2.2 腹主动脉组织切片的制备 灌注28 d后,记录小鼠体质量,过量注射苯巴比妥钠处死小鼠,仰卧位固定于小鼠解剖台。打开小鼠胸腔和腹腔,从心脏左心室灌注0.9%氯化钠溶液,持续至肝脏变白,彻底清洗残存血液,分离主动脉,在体式显微镜下分离动脉周围脂肪组织,尽可能去除干净而不损伤动脉,拍照留存。修剪并固定好检测所需的腹主动脉组织,放入包埋框中,流水低流量冲洗60 min以上,梯度乙醇脱水后再用二甲苯及石蜡浸润。固定完成后,将腹主动脉组织放入专用石蜡包埋模具内进行包埋,注意尽量避免产生气泡。预冷石蜡切片机后将石蜡块固定于夹座内,根据不同实验要求选择不同厚度(一般为5~10 μm)进行标本切片。将切片以45°倾斜角度放入45 ℃左右的恒温水箱表面,等到切片完全展平在恒温水中后(10~15 s)用镊子将切片一边拨到载玻片上,将载玻片垂直提起,并使用铅笔在载玻片末端的磨砂玻璃上写上样品的编号,放入55~60 ℃的烤箱内烘烤30~60 min或37 ℃晾干过夜,切片放入切片盒中保存在4 ℃冰箱中备用。
1.2.3 腹主动脉组织HE染色、马松三色染色及VVG染色 将石蜡切片放入烤箱内以55 ℃烘烤30 min,二甲苯浸润脱蜡后用梯度乙醇复水,甩干切片上的水分后浸泡在苏木素染液中10 min,用蒸馏水轻轻冲洗以清除切片上的浮色。后将切片浸入1%稀盐酸中,见组织由紫色变为粉红色即可,蒸馏水清洗,再浸泡于伊红染液中1 min,蒸馏水冲洗,梯度乙醇脱水后二甲苯浸泡,最后用中性树脂封固,封好的切片置于通风橱内吹干即可长期保存使用,切片在奥林巴斯SZ61显微镜下放大100倍观察腹主动脉组织管腔及动脉壁情况。
马松三色染色烤片及脱蜡水合过程同HE染色。将载玻片上的水分尽量甩干并用滤纸擦拭,用免疫组化笔在待测标本周围画圈,滴加1滴马松复合染色液染色5 min,蒸馏水冲洗后再滴加1滴磷钼酸染色5 min,甩干并擦干切片表面水分,直接滴加1滴苯胺蓝染色5 min,蒸馏水稍冲洗,滴加1滴分化液分化30~60 s,用蒸馏水稍冲洗后再滴加1滴分化液分化30~60 s。脱水及封固步骤同HE染色,切片在奥林巴斯SZ61显微镜下放大100倍观察腹主动脉组织弹力纤维破坏情况。
VVG染色烤片及脱蜡水合过程同HE染色。将载玻片上的水分尽量甩干并用滤纸擦拭,用免疫组化笔在待测标本周围画圈,滴加1滴Lugol碘液孵育5~10 min,流水冲洗5 min,再滴加1滴硫代硫酸钠处理3~5 min,流水冲洗5 min后用70%乙醇脱色1~3 min,滴加1滴醛品红染液染色5~10 min,70%乙醇浸洗2次,流水冲洗5 min,滴加1滴橙黄G染液染色1 s,流水冲洗5 min。脱水及封固步骤同HE染色,切片在奥林巴斯SZ61显微镜下放大200、400倍观察腹主动脉组织胶原纤维沉积情况。
1.2.4 免疫荧光染色观察腹主动脉组织细胞焦亡相关蛋白(NLRP3、GSDMD、Caspase-1、IL-18)表达情况 取材后的小鼠腹主动脉组织置入塑料小盒内,将OCT包埋剂适量浸没腹主动脉组织,放入液氮中,OCT包埋剂完全凝固后放入-80 ℃冰箱中贮存备用。在冰冻切片机内将腹主动脉组织切片,切片完成后,室温放置20~30 min,4 ℃多聚甲醛固定15~25 min,PBS洗涤5~10 min,共洗涤3次。在37 ℃下用3% H2O2孵育5~10 min以消除内源性过氧化物酶的活性,再用山羊工作血清室温封闭腹主动脉组织切片60 min,滴加一抗NLRP3(1∶100,AG-20B-0014-C100,Adipogen)、GSDMD(1∶100,ab219800,Abcam)、Caspase-1(1∶100,22915-1-AP,Proteintech)、IL-18(1∶100,ab71495,Abcam),将切片放在加入PBS的免疫组化湿盒,4 ℃孵育过夜。第2天先将免疫组化湿盒室温复温30 min,PBS洗涤5~10 min,共洗涤3次。在腹主动脉组织切片上滴加适宜浓度的免疫荧光二抗〔Alexa Fluor 488 chicken anti-rabbit IgG (H+L)(A21441,Invitrogen)、Alexa Fluor 488 chicken antimouse IgG(H+L)(A21220,Invitrogen)、Alexa Fluor 594 chicken anti-rabbit IgG (H+L)(A21442,Invitrogen)、Alexa Fluor 546F (ab') goat anti-mouse IgG (H+L)(11018,Invitrogen)〕,并置于专用暗盒中于37 ℃孵育30~60 min。二抗孵育结束后,PBS洗涤5~10 min,共洗涤3次。用Hoechst工作液(10 μg/ml)染核,避光室温静置3~5 min,PBS洗涤5~10 min,共洗涤3次,用甘油溶液封固,在奥林巴斯SZ61显微镜下放大100倍观察NLRP3、GSDMD、Caspase-1、IL-18蛋白表达情况。
1.3 细胞实验
1.3.1 DMEM及血管紧张素Ⅱ处理MOVAS及细胞总蛋白提取 将MOVAS接种于6孔细胞培养板中培养,倒置显微镜下观察细胞密度增殖达到70%时,更换不含FBS的培养基饥饿处理细胞24 h后分别加入DMEM(对照组)或血管紧张素Ⅱ(1 μmol/L)(血管紧张素Ⅱ组),培养24 h后收集细胞。弃去PBS上清液,提前将蛋白酶抑制剂(包括:磷酸化和非磷酸化)和RIPA裂解液按1∶100比例配置成混合液,然后向培养板中添加适量混合液,用挂子将培养板底部的MOVAS团吹打混匀呈悬液后将其转移至EP管中,于冰上放置30~60 min后裂解细胞结束,裂解期间每隔5 min需充分混匀EP管中的细胞悬液,时间20~40 s。细胞冰浴裂解结束后,12 000×g离心20 min(4 ℃)。离心结束后,用移液器将EP管中的上清液吸至新的EP管中,采用BCA法提取细胞总蛋白,实验独立重复10次。
1.3.2 Western blotting法检测MOVAS中NLRP3、GSDMD、Caspase-1、IL-18蛋白表达水平 蛋白裂解液经十二烷基硫酸钠(sodium dodecyl sulfate,SDS)-聚丙烯酰胺凝胶电泳(polyacrylamide gel electrophoresis,PAGE)处理,然后印迹到PVDF膜上,用5%的BSA封闭2 h。加入一抗〔NLRP3(1∶1 000,AG-20B-0014-C100,Adipogen)、GSDMD(1∶1 000,ab219800,Abcam)、Caspase-1(p20)(1∶1 000,22915-1-AP,Proteintech)、IL-18(1∶1 000,ab71495,Abcam)、GAPDH(1∶5 000,HRP-60004,Proteintech)〕,并在4 ℃孵育过夜。次日,加入抗兔IgG(1∶500,7074P2,cell signaling technology)或抗小鼠IgG(1∶500,bs-0296G-HRP,biss)并在室温下孵育2 h。洗涤后使用化学发光检测试剂(WBKLS0500,Millipore)显影,计算目标蛋白表达水平。
1.4 统计学方法 采用SPSS 14.0统计学软件进行数据分析。计量资料符合正态分布以(±s)表示,两组间比较采用成组t检验。以P<0.05为差异有统计学意义。
2 结果
2.1 腹主动脉超声检查及腹主动脉组织HE染色、马松三色染色、VVG染色结果 灌注28 d后,对照组小鼠均无动脉瘤形成,血管紧张素Ⅱ组小鼠发生动脉瘤,主要发生于腹主动脉的肾上区,以膨出和透壁血栓为特征,见图1。腹主动脉超声检查显示,血管紧张素Ⅱ组小鼠腹主动脉较对照组明显扩张,见图2。HE染色显示,血管紧张素Ⅱ组小鼠的腹主动脉管腔较对照组扩大,动脉壁变薄,见图3。马松三色染色和VVG染色显示,血管紧张素Ⅱ组小鼠弹力纤维降解,与AAA形成相关的胶原沉积明显增多,见图4~5。
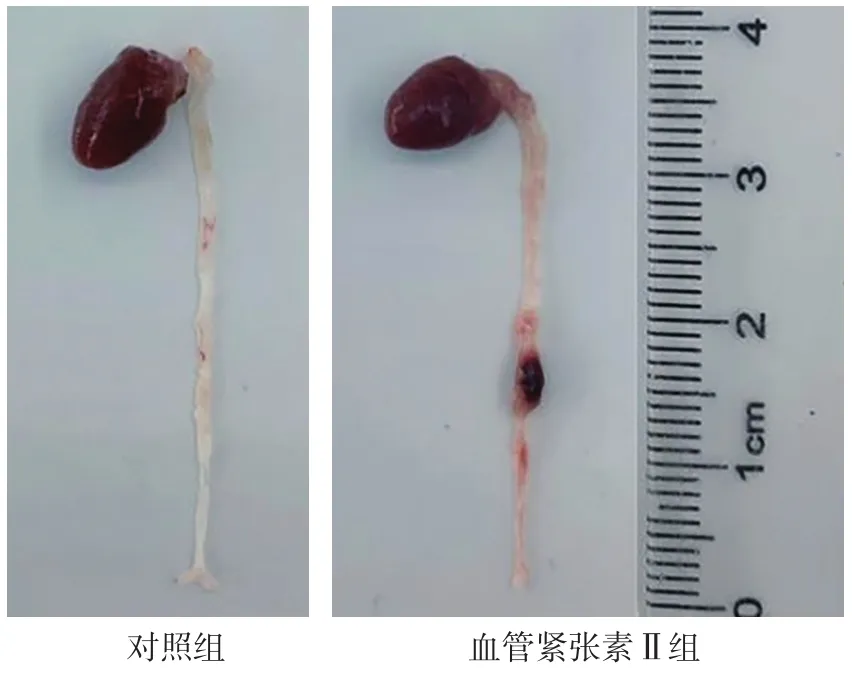
图1 对照组和血管紧张素Ⅱ组小鼠灌注28 d后腹主动脉大体形态Figure 1 General morphology of abdominal aorta of mice in control group and angiotensin Ⅱ group at 28 days after perfusion
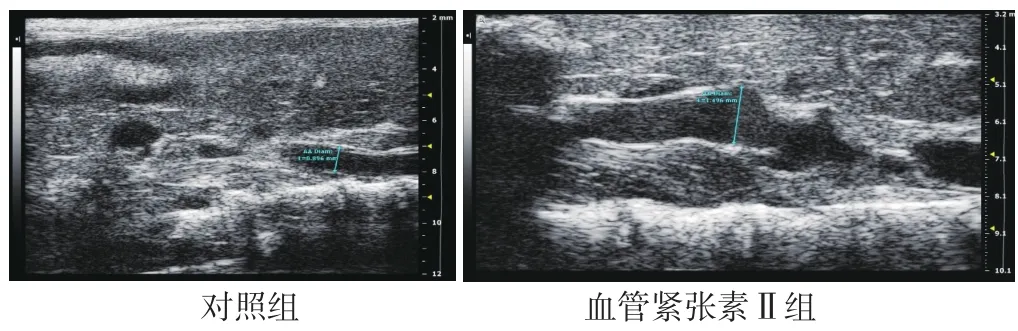
图2 对照组和血管紧张素Ⅱ组小鼠灌注28 d后腹主动脉超声检查结果Figure 2 Doppler ultrasound results of abdominal aorta of mice in control group and angiotensin Ⅱ group at 28 days after perfusionn
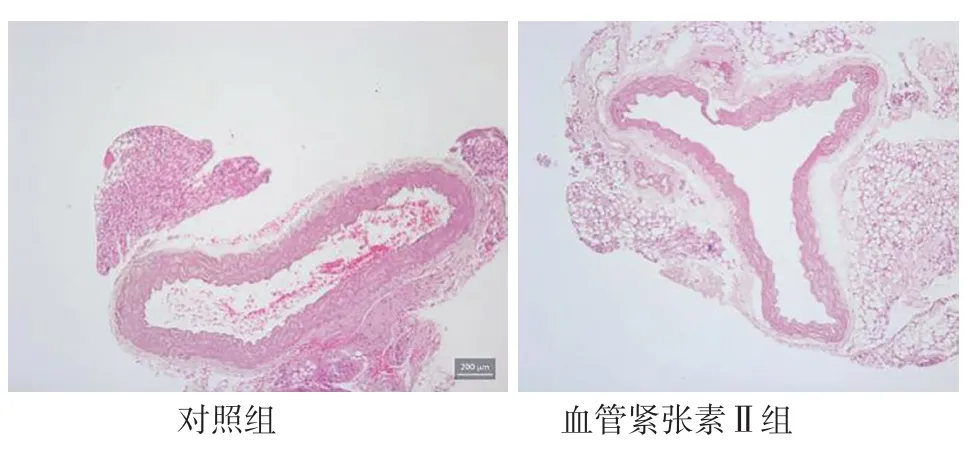
图3 对照组和血管紧张素Ⅱ组小鼠灌注28 d后腹主动脉组织HE染色结果(×100)Figure 3 Results of HE staining of the abdominal aorta of mice in control group and angiotensin Ⅱ group at 28 days after perfusion
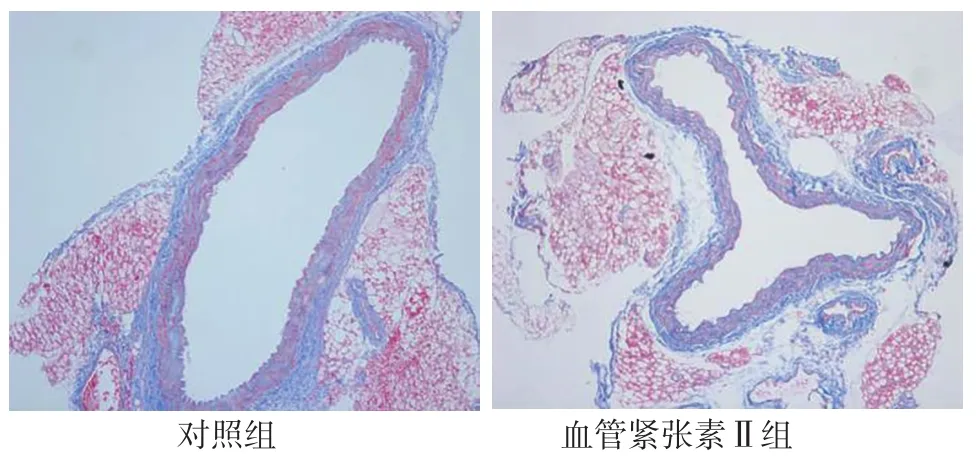
图4 对照组和血管紧张素Ⅱ组小鼠灌注28 d后腹主动脉组织马松三色染色结果(×100)Figure 4 Results of Masson staining of the abdominal aorta in control group and angiotensin Ⅱ group at 28 days after perfusion
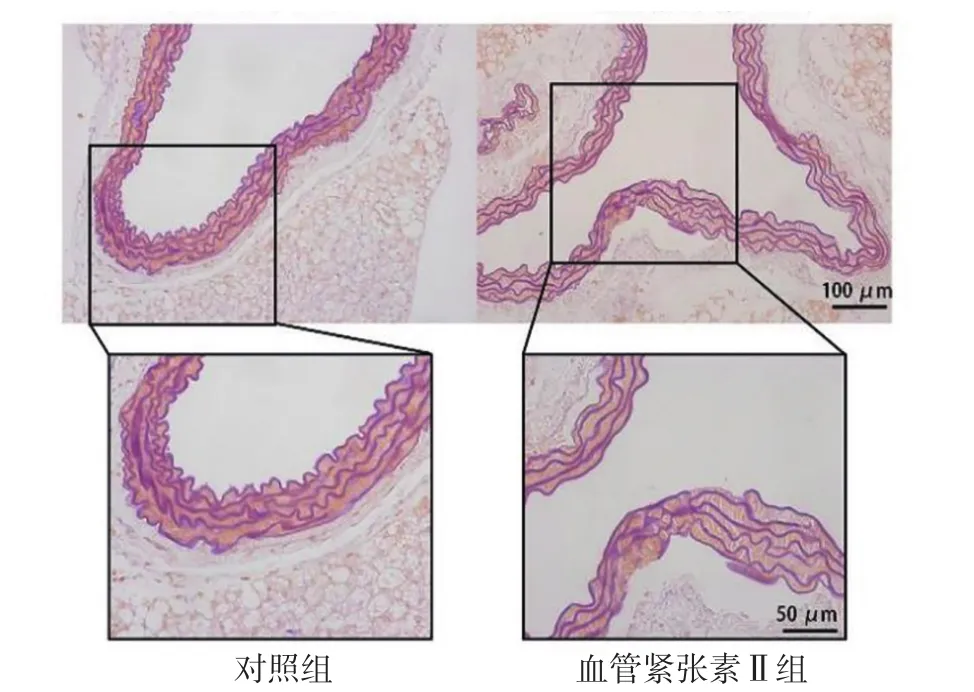
图5 对照组和血管紧张素Ⅱ组小鼠灌注28 d后腹主动脉组织VVG染色结果(×200、×400)Figure 5 Results of VVG staining of the abdominal aorta in control group and angiotensin Ⅱ group at 28 days after perfusion
2.2 免疫荧光染色观察腹主动脉组织NLRP3、GSDMD、Caspase-1、IL-18蛋白表达情况 免疫荧光染色显示,血管紧张素Ⅱ组小鼠腹主动脉组织NLRP3、GSDMD、Caspase-1、IL-18蛋白表达增加,见图6。
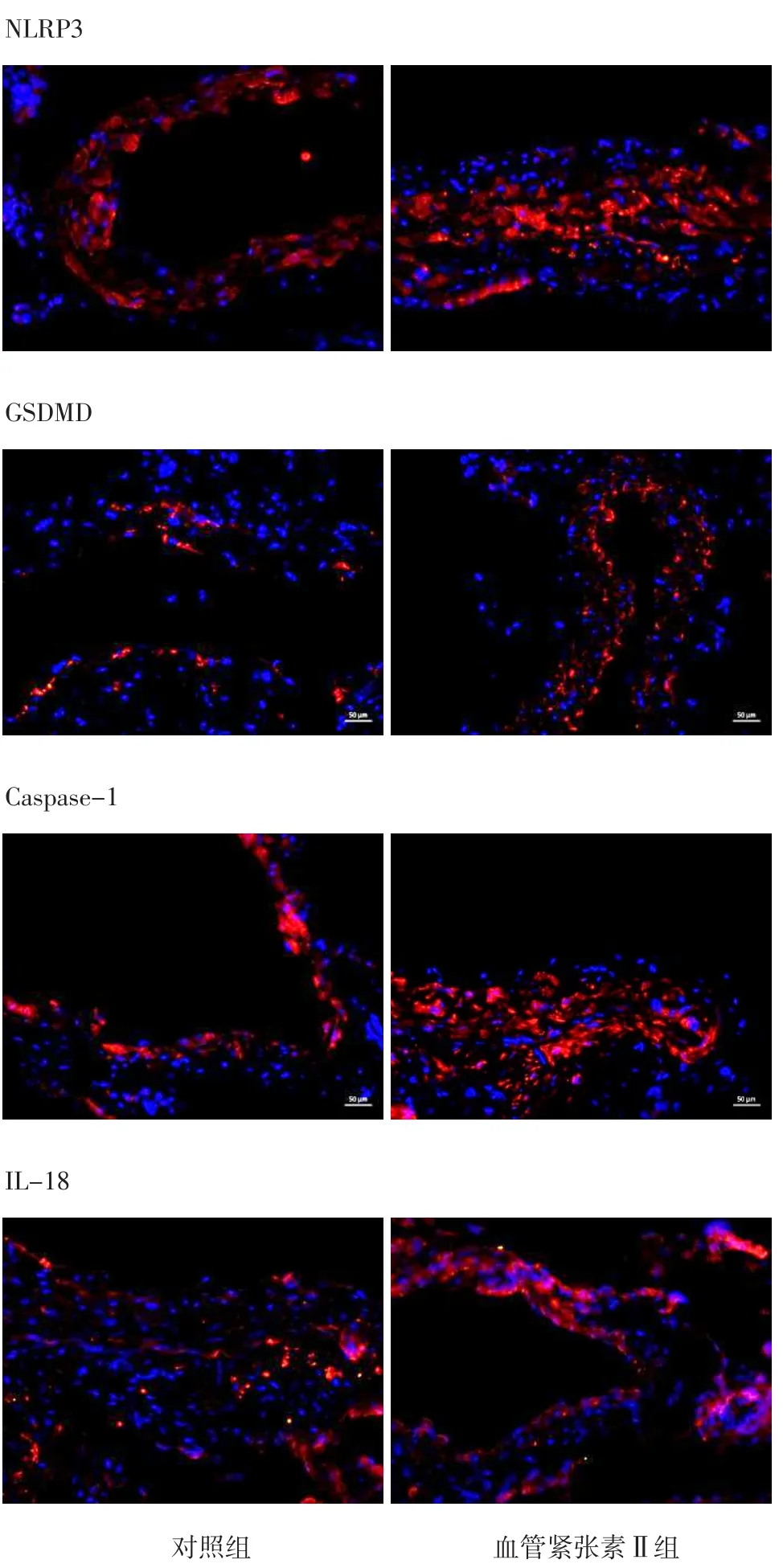
图6 对照组和血管紧张素Ⅱ组小鼠灌注28 d后腹主动脉组织NLRP3、GSDMD、Caspase-1、IL-18蛋白的表达情况(免疫荧光染色,×400)Figure 6 The expression of NLRP3,GSDMD,Caspase-1 and IL-18 proteins in the abdominal aorta of mice in control group and angiotensin Ⅱgroup at 28 days after perfusion
2.3 Western blotting法检测MOVAS中NLRP3、GSDMD、Caspase-1、IL-18蛋白表达水平 对照组和血管紧张素Ⅱ组MOVAS中IL-18蛋白表达水平比较,差异无统计学意义(P>0.05);血管紧张素Ⅱ组MOVAS中NLRP3、GSDMD、Caspase-1蛋白表达水平高于对照组,差异有统计学意义(P<0.05),见表1、图7。
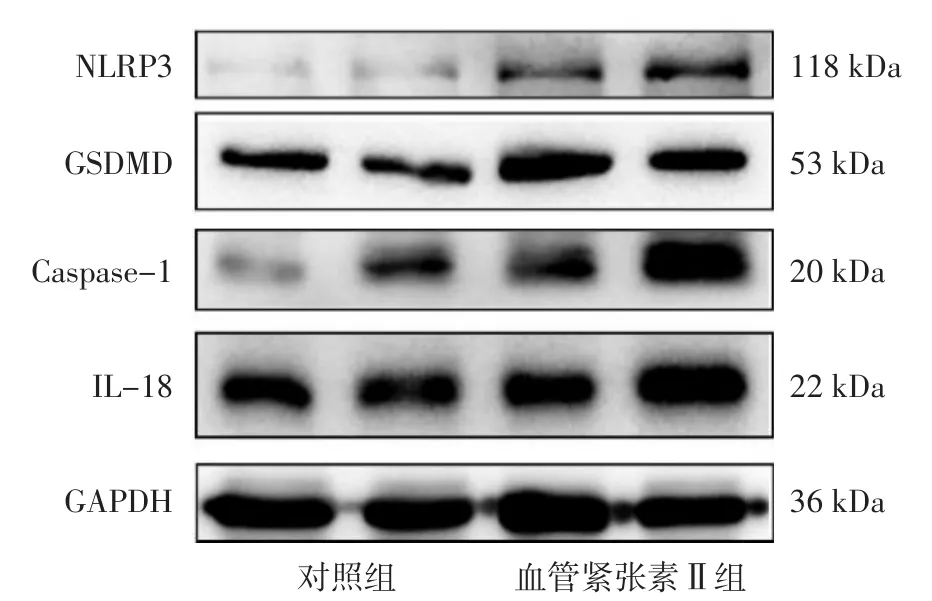
图7 Western blotting法检测对照组和血管紧张素Ⅱ组MOVAS中NLRP3、GSDMD、Caspase-1、IL-18蛋白表达水平Figure 7 Expression level of NLRP3,GSDMD,Caspase-1 and IL-18 proteins of MOVAS detected by Western blotting in control group and angiotensin Ⅱ group
表1 对照组和血管紧张素Ⅱ组MOVAS中NLRP3、GSDMD、Caspase-1、IL-18蛋白表达水平比较(±s,n=10)Table 1 Comparison of NLRP3,GSDMD,Caspase-1 and IL-18 protein expression levels in MOVAS between control group and angiotensin Ⅱgroup
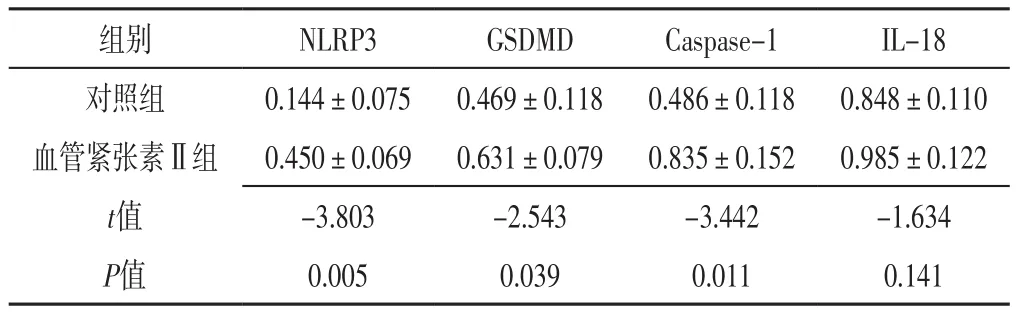
表1 对照组和血管紧张素Ⅱ组MOVAS中NLRP3、GSDMD、Caspase-1、IL-18蛋白表达水平比较(±s,n=10)Table 1 Comparison of NLRP3,GSDMD,Caspase-1 and IL-18 protein expression levels in MOVAS between control group and angiotensin Ⅱgroup
组别 NLRP3 GSDMD Caspase-1 IL-18对照组 0.144±0.075 0.469±0.118 0.486±0.118 0.848±0.110血管紧张素Ⅱ组 0.450±0.069 0.631±0.079 0.835±0.152 0.985±0.122 t值 -3.803 -2.543 -3.442 -1.634 P值 0.005 0.039 0.011 0.141
3 讨论
主动脉瘤表现为主动脉的永久性瘤样扩张,如果表现出破裂通常导致死亡。由于对分子机制和病理生理过程的不完全理解,经证实没有药物治疗可以预防任一类型主动脉瘤的扩张或破裂。既往研究强调慢性血管炎症过程与平滑肌细胞死亡之间有关,认为这是AAA的重要组织病理学特征[17-18]。这种慢性炎症被认为是由组织损伤和危险信号触发的无菌性炎症,而不伴有微生物感染。研究表明,动脉瘤直径与炎症浸润程度之间存在时间相关性,提示炎性细胞可能参与了动脉瘤壁的破坏,从而促进了AAA的扩张[19]。在侵入血管壁后,炎性细胞被认为能够合成多种蛋白酶,如基质金属蛋白酶(matrix metalloproteinase,MMP),这些蛋白酶能够降解结缔组织成分,并且使巨噬细胞向主动脉壁的浸润增加,从而使血管弹力纤维断裂,动脉壁变薄,管腔逐渐扩大[20],本研究观察到小鼠在血管紧张素Ⅱ刺激下动脉壁的变化与其一致。
细胞焦亡是一种伴有炎性反应的程序性细胞死亡,是导致血管平滑肌细胞缺失的主要原因之一。细胞焦亡由NLRP3、Caspases家族和GSDMD等蛋白质复合体相互作用完成[21]。细胞焦亡的形态表现为细胞膜孔的形成、细胞肿胀、破裂及炎性物质的释放[22]。这种损伤可以通过激活邻近细胞的模式识别受体而被放大和加重,导致促炎递质释放到细胞外[23]。平滑肌细胞的焦亡参与了AAA的形成,血管平滑肌细胞可迁移到血管内皮,在不同刺激下由收缩型向增殖型、合成型转变,产生胶原和细胞外基质[24]。NLRP3炎性小体由三部分组成:NLRP3、pro-Caspase-1和凋亡相关斑点样蛋白(apoptosis-associated speck-like protein containing a CARD,ASC)[25]。在病原体相关分子模式和损伤相关分子模式的触发下,NLRP3的pyrin结构域与ASC的pyrin结构域结合,进而通过卡片-卡片相互作用与前体Caspase-1结合,导致NLRP3炎性小体的组装[26]。Caspase-1被激活后,产生无生物活性的前体蛋白IL-1β和IL-18,并被裂解为具有生物活性的细胞因子,然后被分泌出细胞[27]。IL-1β和IL-18的分泌和成熟是GSDMD裂解所必需的,而GSDMD是细胞焦亡的执行者,可以导致细胞膜孔的形成,从而分泌炎性递质,进而触发细胞焦亡[22,28]。本研究分别通过动物实验及细胞实验检测了血管紧张素Ⅱ刺激下细胞焦亡相关蛋白的表达变化。在动物实验中,通过皮下植入渗透型微泵并注入血管紧张素Ⅱ以构建AAA模型,通过免疫荧光染色检测发现,血管紧张素Ⅱ灌注的野生型小鼠其细胞焦亡相关蛋白表达较对照组明显增加。在细胞实验中,在MOVAS中加入血管紧张素Ⅱ刺激24 h后检测其细胞焦亡相关蛋白表达水平,发现除了IL-18外其余蛋白表达水平较对照组均明显增加。上述结果表明,血管紧张素Ⅱ诱导的AAA模型小鼠中细胞焦亡的发生加剧,从而导致细胞膜孔的形成,引起细胞肿胀、破裂,炎性物质被释放到细胞外,加剧主动脉壁的无菌性炎性反应,进而导致主动脉发生瘤样扩张。
然而,本研究也存在一定的局限性。首先,血管紧张素Ⅱ输注建模是目前应用最广泛的诱导AAA模型的方法之一,但其不能模拟AAA的确切病理,还需使用其他广泛应用的诱导模型,如氯化钙。其次,本实验只检测了血管紧张素Ⅱ刺激后细胞焦亡相关蛋白表达变化,并未研究敲除或抑制这几种细胞焦亡相关蛋白后对AAA发生发展的影响,这也是今后进一步研究的方向。
综上所述,血管紧张素Ⅱ诱导的AAA形成与细胞焦亡密切相关,细胞焦亡可通过促进炎性细胞浸润导致血管壁弹性层被破坏,这在AAA的进展中发挥重要作用。
作者贡献:姚弈伟进行文章的构思与设计,研究的实施与可行性分析,撰写论文,统计学处理;姚弈伟、刘亚峰进行资料收集;姚弈伟、陈淦一进行资料整理;王晓棣进行论文的修订;陈鑫负责文章的质量控制及审校,对文章整体负责、监督管理。
本文无利益冲突。
