1,6-二磷酸果糖口服液对急性心肌梗死大鼠心肌细胞凋亡、氧化应激和能量代谢的影响及可能机制研究
2022-05-11王青伟李悦刘强刘业发夏昆丁荣晶
王青伟,李悦,刘强,3,刘业发,夏昆,4,丁荣晶
流行病学数据显示,近年来我国急性心肌梗死(acute myocardial infarction,AMI)患病率呈上升趋势[1],随着急诊再灌注治疗技术的推广,AMI急性期患者死亡率降低,但5年后心力衰竭发生风险仍高达15%~30%[2]。现代医学研究表明,心肌梗死后心肌缺血缺氧导致心肌细胞代谢异常,发生细胞凋亡、氧化应激和炎症,引起心肌细胞坏死和纤维化,进而导致左心室重构,而左心室重构是心肌梗死后心力衰竭的主要原因[3-4]。目前,控制左心室重构的药物主要针对心肌纤维化,包括β-受体阻滞剂和肾素-血管紧张素-醛固酮系统抑制剂。但也有研究发现,调节心肌能量代谢类药物可减轻心肌缺血缺氧[5-6]。1,6-二磷酸果糖(fructose-1,6-diphosphate,FDP)注射液在临床应用多年,大量研究证实其可以减轻缺血缺氧导致的心肌损伤[7-8],但FDP口服液是否具有上述作用尚未知。本研究旨在探究FDP口服液对AMI大鼠心肌细胞凋亡、氧化应激和能量代谢的影响及可能机制,以期为FDP口服液用于AMI后心肌保护提供参考依据。
1 材料与方法
1.1 实验动物 本实验时间为2020年12月—2021年6月。选取SPF级雄性SD大鼠20只,体质量200~220 g,20日龄,购于北京维通利华公司实验动物中心,动物许可证号:SCXK(京)2019-0010。
1.2 主要实验仪器与试剂
1.2.1 主要实验仪器 BL-420S型小动物生物功能实验系统、HX-100E型小动物呼吸机购自成都泰盟科技有限公司,石蜡切片机购自德国Leica,鼓风干燥箱(DHG-9055A)、电热恒温水浴槽购自上海一恒科学仪器有限公司,光学显微镜(Olympus,BX53)购自北京普瑞赛司仪器有限公司,超净工作台购自北京昌平长城空气净化设备工程公司,荧光酶标仪购自美国Thermo Scientific,微量加样器购自法国Gilson,脱色摇床购自海门市其林贝尔仪器制造公司,电泳仪购自北京百晶生物技术有限公司,低温离心机购自德国Sigma,SDSPAGE电泳系统、ChemiDoc MP化学发光成像系统购自美国Bio-rad,凝胶成像系统购自美国UVP。
1.2.2 主要实验试剂 FDP口服液购自北京华靳制药有限公司,HE染色试剂盒、Masson三色染色试剂盒、TUNEL凋亡检测试剂盒和DAB显色试剂盒购自北京索莱宝科技有限公司,蛋白提取液、蛋白酶抑制剂、BCA蛋白浓度测定试剂盒、SDS-PAGE预制胶套装试剂盒及二抗购自北京MDL,中等蛋白分子量marker购自北京Thermo,磷脂酰肌醇-3-激酶(phosphatidylinositol-3-kinase,PI3K)、磷酸化蛋白激酶B(phosphorylated protein kinase B,p-AKT)、β-actin抗体购自北京Bioss,聚偏氟乙烯(polyvinylidene fluoride,PVDF)膜(0.22 μm)购自美国Millipore,3MM 滤纸购自美国Whatman,ATP、丙二醛(malondialdehyde,MDA)及超氧化物歧化酶(superoxide dismutase,SOD)含量试剂盒购自南京建成生物工程研究所。
1.3 模型制备及分组 将大鼠适应性饲养1周后,根据CURAJ等[9]方法构建AMI模型:腹腔注射2%戊巴比妥钠(3 ml/kg)麻醉大鼠,经口气管插管并连接动物呼吸机辅助呼吸,在大鼠左侧胸壁第3~4肋间处备皮、开胸,暴露心脏,于左心耳根部下方2~3 mm处用6-0缝合线结扎左前降支。结扎后左心室前壁及心尖部变白,心电图提示ST段抬高,即AMI造模成功。术毕,形成胸腔负压,逐层关闭胸腔后肌肉注射2.5×104U青霉素以预防感染。将建模成功后存活24 h的12只大鼠随机分成模型组、FDP组,每组6只,术后第3天开始给药,其中FDP组予以FDP口服液1 ml灌胃,模型组予以等量0.9%氯化钠溶液灌胃,连续给药21 d。
1.4 观察指标及检测方法
1.4.1 HE染色检测心肌组织形态学特征 连续给药21 d后处死大鼠,在心脏梗死区的相同截面处切取心肌组织,并置于4%多聚甲醛中固定,PBS冲洗,梯度乙醇脱水,二甲苯透明,石蜡包埋,制成5 μm大小的石蜡切片。烘烤、二甲苯脱蜡、梯度乙醇脱水后,按常规方法进行HE染色,光镜下观察心肌组织形态学特征。
1.4.2 Masson染色检测心肌组织纤维化程度及心肌胶原面积 取石蜡切片,烘烤、二甲苯脱蜡、梯度乙醇脱水后,按照Masson染色试剂盒操作说明书进行处理,光镜下心肌纤维呈红色、胶原纤维呈蓝色,采用Image-Pro Plus 6.0软件进行图像分析。计算心肌胶原面积,心肌胶原面积(%)=胶原纤维面积/(胶原纤维面积+心肌纤维面积)×100%。
1.4.3 TUNEL染色检测心肌细胞凋亡率 取石蜡切片,烘烤、二甲苯脱蜡、梯度乙醇脱水后,按照TUNEL染色试剂盒操作说明书进行处理,其中绿色荧光细胞核为凋亡的心肌细胞,由4′,6-二脒基-2-苯基吲哚(4′,6-diamidino-2-phenylindole,DAPI)染的蓝色细胞核为总细胞,计算心肌细胞凋亡率,心肌细胞凋亡率=凋亡的心肌细胞数量/总心肌细胞数量×100%。
1.4.4 比色法检测心肌组织中ATP、SOD、MDA含量取左心室心肌组织并称重,按比例加入0.9%氯化钠溶液制成10%匀浆液,3 000 r/min离心10 min(离心半径16 cm),取上清液,按照试剂盒说明书,采用磷钼酸比色法检测ATP含量,采用黄嘌呤氧化酶比色法检测SOD含量,采用硫代巴比妥酸比色法检测MDA含量。
1.4.5 Western blotting法检测心肌组织中PI3K、p-AKT蛋白表达水平 提取心肌组织蛋白,采用BCA蛋白定量法测定蛋白浓度,蛋白定量为5 mg/ml,加蛋白上样Buffer,进行SDS-PAGE电泳。电泳结束后,将凝胶上分离到的蛋白条带通过转移电泳方式转移至PVDF膜。随后将转移好的膜(参考目的条带分子量大小)对照marker进行裁剪,封闭后在4 ℃环境下孵育相应的一抗(PI3K 1∶1 000;p-AKT 1∶2 000;β-actin 1∶1 000)过夜,随后在室温下孵育兔二抗2 h,最后进行显色和成像。以β-actin作为内参,采用Image J软件分析条带灰度值,即目标蛋白表达水平。
1.5 统计学方法 应用SPSS 24.0统计学软件进行数据处理。符合正态分布且方差齐的计量资料以(±s)表示,组间比较采用两独立样本t检验;不符合正态分布或方差不齐的计量资料以M(QR)表示,组间比较采用非参数检验。以P<0.05为差异有统计学意义。
2 结果
2.1 心肌组织形态学特征 HE染色结果显示,模型组大鼠心肌纤维排列紊乱,体积增大,间隙变宽;FDP组大鼠大部分心肌纤维排列较为整齐,间隙较为清晰,保持了心肌组织相对正常的结构和形态,见图1。
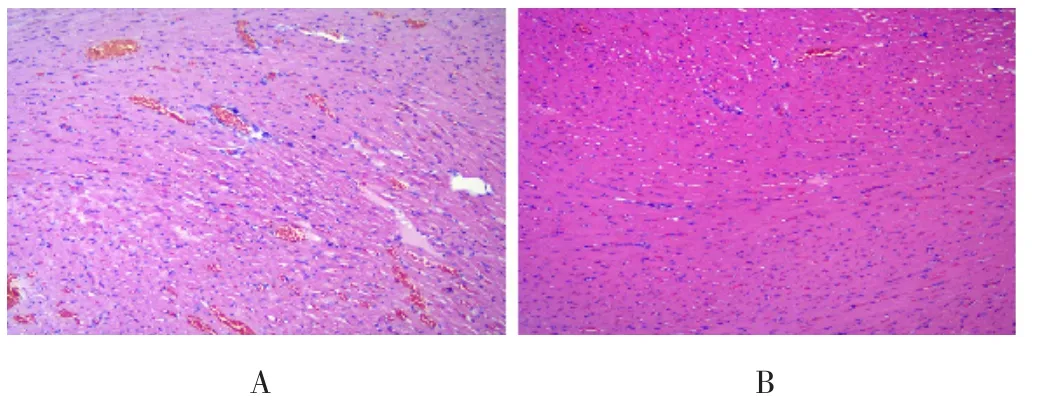
图1 HE染色检测模型组和FDP组心肌组织形态学特征(×100)Figure 1 Morphological characteristics of myocardium detected by HE staining in model group and FDP group
2.2 心肌组织纤维化程度、心肌胶原面积 光镜下,模型组大鼠心肌组织纤维化明显,可见岛状存活的心肌细胞;FDP组大鼠心肌梗死程度明显减轻,存活的心肌细胞增多,且与模型组大鼠相比,其心肌组织纤维化面积明显缩小,见图2。FDP组大鼠心肌胶原面积为(8.35±3.11)%,低于模型组的(24.97±11.30)%,差异有统计学意义(t=3.473,P<0.01)。

图2 Masson染色检测模型组和FDP组心肌组织纤维化程度(×100)Figure 2 Degree of myocardial fibrosis detected by Masson staining in model group and FDP group
2.3 心肌细胞凋亡率 FDP组心肌细胞凋亡率为(16.39±5.31)%,低于模型组的(35.68±8.34)%,差异有统计学意义(t=4.778,P<0.01),见图3。

图3 TUNEL染色检测模型组和FDP组心肌细胞凋亡率(×100)Figure 3 Apoptosis rate of cardiomyocyte detected by TUNEL staining in model group and FDP group
2.4 心肌组织中ATP、SOD、MDA含量 FDP组大鼠心肌组织中ATP、SOD含量高于模型组,心肌组织中MDA含量低于模型组,差异有统计学意义(P<0.05),见表1。

表1 模型组和FDP组心肌组织中ATP、SOD、MDA含量比较(n=6)Table 1 Comparison of ATP,SOD and MDA contents in myocardial tissue between model group and FDP group
2.5 心肌组织中PI3K、p-AKT蛋白表达水平 FDP组大鼠心肌组织中PI3K、p-AKT蛋白表达水平高于模型组,差异有统计学意义(P<0.001),见图4、表2。
表2 模型组和FDP组心肌组织中PI3K、p-AKT蛋白表达水平比较(±s,n=6)Table 2 Comparison of expression levels of PI3K and p-AKT protein in myocardial tissue between model group and FDP group
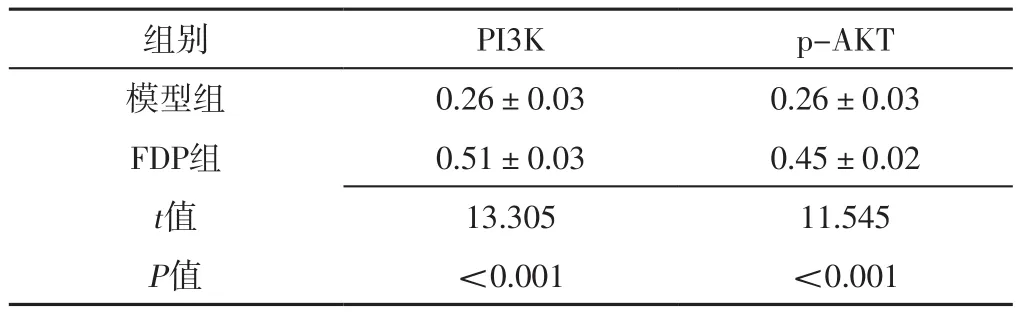
表2 模型组和FDP组心肌组织中PI3K、p-AKT蛋白表达水平比较(±s,n=6)Table 2 Comparison of expression levels of PI3K and p-AKT protein in myocardial tissue between model group and FDP group
注:PI3K=磷脂酰肌醇-3-激酶,p-AKT=磷酸化蛋白激酶B
组别 PI3K p-AKT模型组 0.26±0.03 0.26±0.03 FDP组 0.51±0.03 0.45±0.02 t值 13.305 11.545 P值 <0.001 <0.001

图4 Western blotting法检测模型组和FDP组心肌组织中PI3K、p-AKT蛋白表达水平Figure 4 Expression levels of PI3K and p-AKT protein in myocardial tissue detected by Western blotting method in model group and FDP group
3 讨论
AMI是急性心肌缺血缺氧导致的心肌坏死,具有高致死率、高致残率和医疗花费昂贵的特点[10]。自1990年以来,我国居民心肌梗死发病率逐年上升,并呈现年轻化趋势,已成为公共卫生问题和突出的社会问题[1]。虽然目前临床上有规范的药物治疗、急诊再灌注治疗方法,但心肌梗死后心力衰竭仍较常见,且与急性心肌缺血坏死的范围和缺血缺氧时间密切相关。因此,临床上迫切需要寻找新的方法来改善急性心肌缺血缺氧导致的心肌损伤,从而预防AMI后心力衰竭的发生。
FDP是醣酵解的中间产物,缺氧情况下其可提供外源性醣酵解的反应底物,可在一定程度上增加ATP产量[11-12]。有动物实验表明,心肌缺血时输入外源性FDP可避开两步耗能的磷酸化过程,即己糖激酶和磷酸果糖激酶催化反应直接刺激丙酮酸激酶,恢复被阻断的旁路代谢,产生比葡萄糖酵解多一倍的ATP,进而改善心肌缺氧状态下的能量代谢[13-14]。心肌组织中ATP含量的提高可以逆转缺血心肌细胞的异常代谢,降低心肌氧耗[15]。采用FDP注射液治疗缺血性心脏病已有20余年,研究表明,FDP注射液可防止AMI范围扩大,减轻缺血性心肌损伤及缺血再灌注引起的心肌损伤[7]。
由于FDP注射液需要静脉输注,使用不方便,故FDP口服液应运而生。FDP注射液和FDP口服液虽然是同一种药物,但受生物利用度影响,口服液的临床效果是否和注射液相同有待进一步研究。本研究结果显示,模型组大鼠心肌纤维排列紊乱,体积增大,间隙变宽;FDP组大鼠大部分心肌纤维排列较为整齐,间隙较为清晰,保持了心肌组织相对正常的结构和形态。光镜下,模型组大鼠心肌组织纤维化明显,可见岛状存活的心肌细胞;FDP组大鼠心肌梗死程度明显减轻,存活的心肌细胞增多,且与模型组大鼠相比,其心肌纤维化面积明显缩小。FDP组大鼠心肌胶原面积、心肌细胞凋亡率低于模型组,心肌组织中ATP含量高于模型组,表明FDP口服液可抑制AMI大鼠心肌纤维化及心肌细胞凋亡,改善心肌细胞能量代谢。
研究表明,心肌梗死时心肌缺血缺氧可产生过量的ROS,并使机体抗氧化能力降低[16]。本研究结果显示,FDP组大鼠心肌组织中SOD含量高于模型组,心肌组织中MDA含量低于模型组,表明服用FDP口服液后AMI大鼠抗氧化能力增强、心肌氧化损伤减轻。而降低AMI期间心肌组织氧化应激水平是延缓心肌细胞损伤、促进心肌细胞再生的关键。此外,ROS还可激活磷脂酶,降解膜磷脂,破坏线粒体结构,降低线粒体膜电位,导致线粒体肿胀和破裂,并将凋亡物质释放到细胞质中[16]。
研究表明,PI3K/AKT信号通路能通过抑制心肌细胞凋亡、促进心肌细胞生长、抑制炎症反应、促进血管新生、调节细胞内钙离子浓度、改善细胞能量代谢等抵抗心肌损伤,同时减缓心室重构和心力衰竭的发生[17-21];此外,PI3K/AKT/Nrf2信号通路的激活还可减轻脑缺血再灌注诱导的神经炎症、凋亡和氧化应激,而抑制此通路明显减弱了其抗氧化、抗炎和抗凋亡活性[22]。本研究结果显示,FDP组大鼠心肌组织中PI3K、p-AKT蛋白表达水平高于模型组,提示FDP口服液对AMI大鼠心肌细胞的保护机制可能有PI3K/AKT信号通路的参与,但还有待进一步验证。
综上所述,FDP口服液可抑制AMI大鼠心肌纤维化、心肌细胞凋亡、氧化应激,改善能量代谢,其机制可能与PI3K/AKT信号通路激活相关,这为减轻急性心肌缺血缺氧损伤和心肌保护提供了新的思路,但具体通路仍需要进一步实验证实。
作者贡献:丁荣晶进行文章的构思与设计,负责文章的质量控制及审校,对文章整体负责、监督管理;王青伟、夏昆进行研究的实施与可行性分析;王青伟、李悦、刘强、刘业发进行数据收集、整理、分析,结果分析与解释;王青伟、李悦负责撰写、修订论文。
本文无利益冲突。
