铁死亡在心肌缺血再灌注损伤中的作用及靶向治疗研究进展
2022-05-10彭石马茜钰张丹张兆元张锦
彭石 马茜钰 张丹 张兆元 张锦
(1.兰州大学第一临床医学院,甘肃 兰州 730000;2.兰州大学第一医院心内科 甘肃省心血管疾病重点实验室,甘肃 兰州 730000)
心肌缺血再灌注损伤(myocardial ischemia reperfusion injury,MIRI)是缺血性心脏疾病在恢复血供后需面对的问题之一,钙超载、氧化应激和线粒体功能障碍等多种病理机制参与MIRI的发生发展。铁死亡是铁离子依赖的,以脂质过氧化为特征的新型程序性细胞死亡,已被证明在MIRI过程中起重要作用,对铁死亡作用机制的研究和铁死亡调节剂的开发成为了治疗MIRI的新靶点。
1 铁死亡的分子机制
1.1 铁代谢与铁死亡
铁是细胞内各种生化过程中不可或缺的辅助因子,维持铁代谢的稳态对细胞生存至关重要。细胞内铁离子的运输和储存受到严格管控,循环中三价铁与转铁蛋白结合,通过转铁蛋白受体1(transferrin receptor 1,TfR1)介导的内吞作用摄入细胞,随即被金属还原酶前列腺六次跨膜蛋白3还原为二价铁,再经二价金属转运蛋白1(divalent metal transporter 1,DMT1)将其由内体转入细胞质内。细胞内的二价铁或以非活性形式储存于铁蛋白中,或构成不稳定铁池(labile iron pool,LIP),或氧化为三价铁后由膜铁转运蛋白1泵出细胞。铁代谢的失衡将会导致细胞内铁累积,铁的化学反应性及其通过芬顿反应产生羟自由基的能力,增加了细胞对铁死亡的敏感性[1]。
铁调节蛋白(iron regulatory protein,IRP)可依据体内和细胞中的铁水平与靶基因mRNA上的铁反应元件(iron responsive element,IRE)结合调控参与铁代谢基因的表达,维持铁稳态。IRP与IRE结合产生的效应取决于IRE的位置,当IRE位于靶基因mRNA的3’UTR中时,与IRP结合可稳定如TfR1和DMT1等靶基因;当IRE位于靶基因mRNA的5’UTR中时,与IRP结合则会抑制如膜铁转运蛋白1和铁蛋白等靶基因的翻译[2]。
选择性自噬货物受体核受体共激活因子4的表达受亚铁含量的负调节,其介导的铁蛋白降解是维持细胞内铁稳态的重要过程。铁蛋白自噬的过度激活可导致细胞内铁超载,增加细胞对铁死亡的敏感性[3]。
线粒体铁蛋白(mitochondrial ferritin,FTMT)是一种定位于线粒体的铁蛋白,在睾丸、心脏和大脑等具有活跃呼吸活动的细胞中表达,在肝脏和脾脏中不表达,提示FTMT与细胞氧化代谢活动有关,而与铁储存无关,可能通过调节线粒体LIP与胞质LIP之间的平衡,保护线粒体免受铁死亡引起的氧化损伤,FTMT过表达能保护果蝇神经元细胞免受铁死亡损伤[4]。
1.2 脂质过氧化与铁死亡
生物膜中的多不饱和脂肪酸(polyunsaturated fatty acid,PUFA)受到活性氧攻击时诱导脂质过氧化的发生,磷脂膜不饱和程度越高越易受到活性氧的攻击。PUFA在活性氧的作用下生成磷脂氢过氧化物(phospholipid hydroperoxide,PLOOH),PLOOH得不到及时清除而累积时,可与活性铁反应,生成烷氧自由基和过氧自由基,导致脂质过氧化级联放大,产生大量具有细胞毒性的4-羟基壬烯酸和丙二醛,破坏膜结构、蛋白质和DNA。依据活性氧的来源可将脂质过氧化分为非酶促氧化和酶促氧化两种。非酶促氧化由芬顿反应介导,酶促氧化主要由脂氧合酶和细胞色素P450氧化还原酶介导。脂氧合酶可通过对PUFA或含有PUFA的脂质的氧化作用推动铁死亡的发生发展。P450氧化还原酶能将还原型烟酰胺腺嘌呤二核苷酸磷酸提供的电子传递给下游的电子受体,剥夺PUFA中的氢或将三价铁还原为二价铁,促进脂质过氧化[2]。
长链酯酰辅酶A合成酶4(acyl-CoA synthetase long chain family member 4,ACSL4)可催化长链PUFA与辅酶A连接生成相应的脂酰辅酶A,合成含有较多PUFA的膜磷脂,敲除ACSL4对谷胱甘肽过氧化物酶4(glutathione peroxidase 4,GPX4)失活引起的铁死亡具有显著的抑制作用[5]。
胱氨酸谷氨酸反向转运体轻链xCT/谷胱甘肽(glutathione,GSH)/GPX4系统是细胞内重要的抗氧化系统,通过维持细胞内限速底物GSH含量,保证GPX4活性,发挥抗脂质过氧化作用。xCT把胱氨酸转入细胞,将其还原为半胱氨酸后用于GSH的合成。GSH直接影响GPX4的活性。GPX4不但限制活性氧的生成,还能催化PLOOH向磷脂氢氧化物转化,发挥抗氧化作用。当xCT/GSH/GPX4系统失衡,GPX4活性下降或表达缺失时,脂质过氧化加重,诱导铁死亡发生[6]。
此外,细胞中还存在独立于xCT/GSH/GPX4系统的酶和因子。铁死亡抑制蛋白1和二氢乳清酸脱氢酶分别位于细胞膜和线粒体内膜上,能将泛醌还原为二氢泛醌,抑制脂质过氧化和铁死亡。三磷酸鸟苷环化水解酶1的代谢产物四氢生物喋呤不但参与泛醌合成,还可作为自由基捕获抗氧化剂,增强磷脂对氧化应激的抵抗性[2]。
核转录因子红系2相关因子2(nuclear factor-erythroid 2-related factor 2,Nrf2)是铁死亡的负性调节因子,在细胞核中通过靶向抗氧化反应元件激活抗氧化应激基因的转录,维持代谢和氧化还原稳态。半胱氨酸连接酶和xCT等许多调控铁死亡的关键成分基因均是Nrf2的靶基因。敲除Nrf2后增加了细胞对铁死亡的敏感性[7]。此外,Nrf2还能通过参与铁代谢基因转录、促进铁储存和激活自噬蛋白等机制影响细胞内铁稳态[8]。
铁稳态和脂质过氧化是铁死亡发生的分子机制(图1),抗氧化系统的失衡以及随后的活性氧和脂质过氧化物的积累是铁死亡的生化特征。
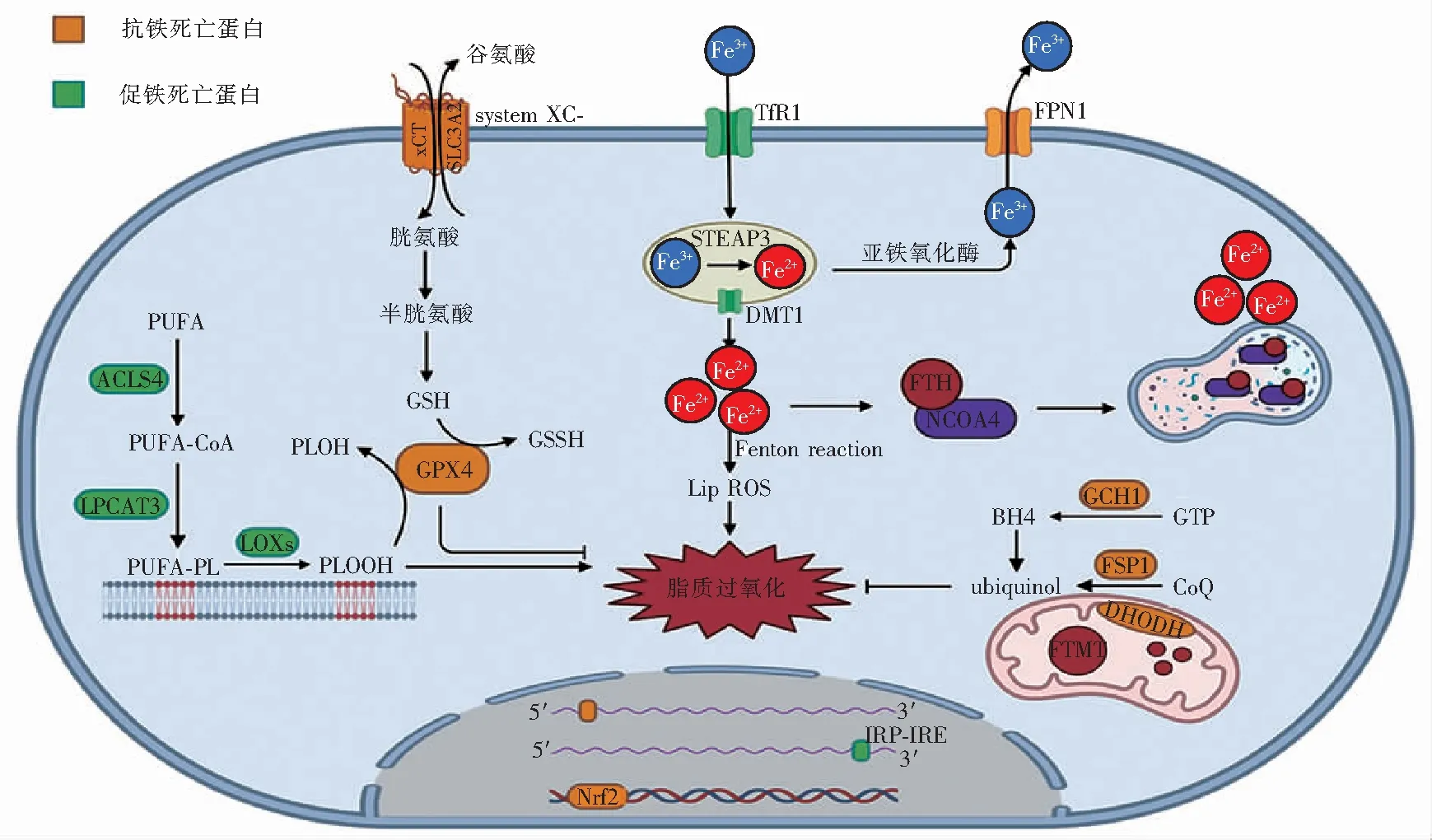
注:system Xc-,胱氨酸/谷氨酸反向转运体;SLC3A2,溶质载体家族3成员2;FPN1,膜铁转运蛋白1;PUFA-CoA,多不饱和脂肪酸脂酰辅酶A;PUFA-PL,多不饱和脂肪酸磷脂;PLOH,磷脂氢氧化物;LPCAT3,溶血卵磷脂胆碱酰基转移酶3;LOXs,脂氧合酶;GSSH,氧化型谷胱甘肽;STEAP3,前列腺六次跨膜蛋白3;Fenton reaction,芬顿反应;Lip ROS,脂质活性氧;FTH,铁蛋白重链;NCOA4,核受体共激活因子4;GTP,三磷酸鸟苷;GCH1,三磷酸鸟苷环化水解酶1;BH4,四氢生物喋呤;ubiquinol,二氢泛醌;FSP1,铁死亡抑制蛋白1;CoQ,辅酶Q;DHODH,二氢乳清酸脱氢酶。图1 铁死亡的分子机制
2 铁死亡在MIRI中的病理机制
血运重建是目前临床上治疗缺血性心肌病的主要措施,MIRI的存在使得治疗获益降低。氧化应激、炎症反应、钙超载以及能量代谢障碍等多种病理机制参与了MIRI的发生发展过程,诱发坏死、凋亡等多种类型的细胞死亡。缺血再灌注损伤的细胞中可见到铁沉积以及大量活性氧和脂质过氧化物的堆积,提示铁死亡也参与了缺血再灌注损伤[9]。
如前所述,铁代谢紊乱和脂质过氧化是铁死亡发生的基础机制。铁超载时,芬顿反应促进活性氧的生成,加剧脂质过氧化反应,导致细胞器损伤和细胞死亡。在对心肌梗死患者血运重建治疗后行磁共振成像检查和小鼠缺血再灌注模型中均证明了损伤心肌内存在高浓度的铁[10]。在氧化应激期间,铁蛋白转录和表达增加,通过储铁功能减少游离亚铁,减轻损伤。铁蛋白缺失的心肌细胞不仅出现铁代谢失衡,还降低了xCT的表达,使得GSH合成减少,显著增加了铁死亡的敏感性[11]。
PLOOH依赖xCT/GSH/GPX4系统的及时清除以阻止脂质过氧化的级联放大。然而心肌缺血时,GSH代谢途径受到抑制,GPX4转录表达下调[12];血供恢复后,心肌组织中ACSL4蛋白水平随着再灌注时间的延长而升高,PUFA合成增加,低水平的GPX4无法清除氧化应激作用下堆积的脂质过氧化物[13]。
此外,铁死亡通过影响线粒体功能、内质网应激、炎症反应和自噬等多种途径参与缺血再灌注损伤中的细胞死亡。线粒体作为细胞能量代谢的中心,是铁死亡脂质过氧化损伤的主要对象。活性氧不仅攻击线粒体膜,还能与线粒体中的铁反应,生成大量羟自由基,导致线粒体膜电位去极化、膜通透性孔开放、线粒体结构和功能破坏[14]。MIRI期间铁死亡可通过脂质活性氧、未折叠蛋白质反应和激活转录活化因子4-C/EBP同源蛋白途径触发内质网应激,内质网应激破坏细胞中的钙平衡,进一步引起线粒体钙超载,增加活性氧的生成[15]。缺血心肌可释放损伤相关分子模式,通过Toll样受体4/TIR结构域的接头分子/Ⅰ型干扰素通路促进中性粒细胞募集及黏附,再灌注时激活炎症级联反应,加重组织损伤。当抑制铁死亡或破坏Toll样受体4/TIR结构域的接头分子信号时,中性粒细胞则无法黏附[16]。自噬与铁死亡拥有许多共同调控的基因和信号通路,相互作用关系复杂,现有的研究结论不一,二者既可相互促进,也可相互拮抗,甚至相互独立。MIRI中自噬可促进铁死亡的发生发展,可能与自噬激活时铁蛋白的降解和脂质过氧化反应加剧有关。敲除自噬相关基因或运用巴弗洛霉素A1和氯喹等自噬抑制剂均能显著抑制铁死亡[17]。
3 MIRI铁死亡的靶向治疗
3.1 靶向铁代谢的药物
去铁胺属于铁螯合剂,可与细胞中的游离亚铁结合,调节铁含量,减轻脂质过氧化反应,抑制铁死亡的发生,对MIRI发挥保护作用。在经皮冠状动脉介入治疗再灌注前,静脉输注去铁胺可迅速降低心肌梗死患者的氧化应激水平,但对梗死面积无明显改善。然而去铁胺对线粒体铁的亲和性较差,水溶性强,具有一定的肾毒性,这限制了去铁胺的临床应用。另一种铁螯合剂右雷佐生可抑制铁死亡,已被批准用于预防阿霉素诱导的心肌病,但对MIRI的保护作用尚存争议[18]。
铁抑素-1是人工合成的铁死亡小分子抑制剂,可与铁形成复合物,降低细胞内不稳定的亚铁水平,减少脂膜过氧化损伤,减轻MIRI[19]。铁抑素-1还能通过抑制铁死亡,改善小鼠MIRI引起的心力衰竭[20]。
花青素-3-葡萄糖苷(cyanidin-3-glucoside,C3G)属于花青素家族中的一员,广泛分布于深色水果蔬菜中。C3G能减轻氧化应激和亚铁含量,有效抑制体内外铁死亡,减轻MIRI,缩小心肌梗死面积。其机制可能是下调TfR1表达,减少铁摄入,上调铁蛋白表达,促进铁储存,同时抑制自噬,恢复细胞抗氧化系统平衡[21]。具有多种生物活性的多酚白藜芦醇与C3G作用相似,能降低氧化应激水平和亚铁含量抑制氧糖剥夺/复氧模型中H9c2细胞的铁死亡,还可通过调节特异性去泛素化酶19介导的自噬途径抑制铁死亡[22]。
3.2 靶向脂质过氧化的药物
铁调素是肝细胞合成的铁稳态调节因子,在巨噬细胞、胆管上皮细胞、远端肾单位和心脏中均有表达。铁调素在心脏中的表达受缺氧和炎症反应调节,心肌梗死发生后,铁调素表达显著增加,调控细胞内铁蛋白和亚铁的水平,限制梗死面积的扩大。在离体大鼠心肌缺血再灌注模型中,铁调素处理组可见到氮氧化物生成减少,表明其可通过对抗氧化应激发挥保护作用[23]。
维持线粒体正常的结构和功能是保证细胞活力的关键。在阿霉素诱导的小鼠心肌细胞铁死亡中,线粒体靶向超氧化物清除剂MitoTEMPO能有效清除线粒体的脂质过氧化,抑制铁死亡。在小鼠MIRI中MitoTEMPO也能显著减轻线粒体损伤,减少细胞死亡和心功能障碍。而非靶向抗氧化剂不具心脏保护作用[20]。铁死亡小分子抑制剂Liproxstatin-1能降低线粒体膜电压依赖性阴离子通道1水平,减轻线粒体脂质过氧化损伤,同时恢复GPX4及GSH的表达,促进MIRI中的细胞存活[14]。
黄芩素是从黄芩中提取的黄酮类物质,对缺血再灌注损伤的心肌具有保护作用,作用机制涉及介导磷脂酰肌醇3激酶/丝氨酸-苏氨酸激酶/内皮型一氧化氮合酶通路保护血管内皮细胞,激活磷脂酰肌醇3激酶/丝氨酸-苏氨酸激酶通路抑制炎症和心肌细胞凋亡,抑制线粒体损伤介导的细胞凋亡等。黄芩素不仅减少GSH消耗,抑制GPX4降解,增加细胞抗脂质过氧化能力,还可通过抑制ACSL4减少PUFA生成,对抗铁死亡,保护心脏[24]。
3.3 潜在作用靶点
3.3.1 自噬
自噬是细胞内物质周转的保守过程。在心肌缺血期,自噬激活能及时提供营养物质和能量补偿,再灌注期适度自噬可有效清除损伤细胞器或蛋白质,降低活性氧伤害,而过度自噬则会导致细胞的过度分解和死亡。如前所述,MIRI中自噬与铁死亡相互促进,C3G和白藜芦醇作用机制的研究也证明了调控自噬依赖的铁死亡是减轻MIRI的可行方案。
胚胎致死性异常视觉样蛋白1(embryonic lethal-abnormal vision like protein 1,ELAVL1)参与血管生成和凋亡等细胞过程,因在糖尿病心脏病中发现敲除该基因后能减轻心肌梗死期间的炎症反应,推测其对心脏具有保护作用。小鼠发生MIRI期间,ELAVL1的转录被叉头框蛋白C1激活,结合并稳定Beclin-1 mRNA,当敲除ELAVL1基因后,铁死亡和自噬过程受到抑制,MIRI减轻。增强自噬可逆转ELAVL1基因敲除对铁死亡和MIRI的影响。抑制ELAVL1介导的自噬性铁死亡可能是治疗MIRI的新靶点[17]。
3.3.2 FTMT
FTMT的生理作用尚不明确,可能与调控细胞局部铁稳态有关。FTMT过表达不仅能对抗铁死亡诱导剂Erastin诱导的铁死亡,还因与重链铁蛋白高度同源,可能通过核受体共激活因子4介导的铁蛋白自噬调节铁死亡[25]。以FTMT为靶点调节铁死亡减轻MIRI还有待研究证明,但FTMT在脑缺血再灌注损伤[26]、阿霉素介导的心肌病[27]以及心肌急性力竭运动损伤[28]中的保护作用已得到相关研究证实。
3.3.3 生物钟基因
昼夜节律是指机体各种生命活动以24 h为周期的节律性变化。昼夜节律不仅与急性心肌梗死的发病和预后相关,还影响心肌对缺血再灌注损伤的耐受。生物钟基因组成昼夜节律反馈环路,Rev-erbα和PER2等生物钟基因表达变化已被证明参与MIRI。研究发现癌细胞系中生物钟基因ARNTL/BMAL1表达水平降低,阻断了缺氧诱导因子1α依赖的脂肪酸摄取过程,脂质过氧化加重,促进细胞发生铁死亡。由于ARNTL/BMAL1的下调是由货物受体p62介导的选择性自噬引起的,故该过程被称为时钟自噬[29]。当给予节律调节剂SR8278或自噬抑制剂氯喹等恢复ARNTL/BMAL1表达后,铁死亡受限。时钟自噬信号通路已在后续的动物体内实验中得到证实,为合理利用生物钟基因调节铁死亡防治MIRI提供了新的视角。但时钟自噬是否同样存在于心肌细胞中,以及生物钟基因在MIRI铁死亡过程中扮演怎样的角色还有待深入探讨。
3.3.4 其他
磷脂酰胆碱是生物膜和脂蛋白上的主要脂质成分,心肌缺血再灌注时被活性氧催化为氧化磷脂酰胆碱,氧化磷脂酰胆碱可诱导铁死亡加重MIRI。干预氧化磷脂酰胆碱是减轻MIRI期间铁死亡的潜在靶点[30]。
特异性去泛素化酶22过表达时可上调GSH水平,减少活性氧、脂质过氧化和铁的堆积,增强心肌细胞活力,还可通过SIRT1/xCT途径减轻铁死亡诱导的MIRI[31]。特异性去泛素化酶22还可能存在其他作用途径,针对特异性去泛素化酶22保护缺血再灌注心肌值得继续探索。
外泌体来源广泛,是细胞分泌的含有多种非编码RNA、蛋白质和脂质等活性物质的小膜泡。人骨髓间充质干细胞来源的外泌体中高度表达miR-23a-3p,可通过靶向DMT1抑制细胞铁死亡,改善心肌梗死[32]。
鉴于铁死亡在MIRI中的重要作用,以铁死亡为靶点开发铁死亡调节剂防治MIRI的策略具有广阔前景(图2)。

注:Fer-1,铁抑素-1;OxPC,氧化磷脂酰胆碱;Lip-1,Liproxstatin-1;USP22,特异性去泛素化酶22;ARE,抗氧化反应元件;ROS,活性氧;ERS,内质网应激;lipoperoxidation,脂质过氧化;USP19,特异性去泛素化酶19;NCOA4,核受体共激活因子4。图2 MIRI中铁死亡的调节靶点和药物
4 小结
尽管铁死亡在MIRI中的研究取得了相当的进展,但要以铁死亡作为MIRI治疗的靶点还面临着许多挑战:(1)铁是正常生命活动的重要元素,如何增强铁螯合剂的安全性;(2)抑制ACSL4和脂氧合酶等生物酶的促脂质过氧化作用时,怎样避免影响它们在其他组织中的作用;(3)MIRI具有一定的干预时间窗,铁死亡靶向治疗能否及时起效。铁死亡的发生发展涉及多种细胞器功能和病理生理过程,增加了作用靶点的选择难度和铁死亡抑制剂治疗效果的复杂性。相信随着未来对MIRI中铁死亡作用机制研究的加深,铁死亡靶向治疗将成为防治MIRI的新思路。