碳纳米材料在心血管治疗方面的应用与挑战
2022-05-10彭韵朴周珏珉
彭韵朴 周珏珉
(遂宁市中心医院心脏电生理室,四川 遂宁 629000)
心血管疾病(cardiovascular disease,CVD)是全球人类死亡的头号病因,《中国心血管健康与疾病报告2020》表明,2018年中国农村居民CVD死亡率为46.66%,城市为43.81%,高于肿瘤及其他疾病[1-2]。近20年来,碳纳米材料[包括石墨烯、碳纳米管(carbon nanotubes,CNT)、富勒烯、纳米金刚石及其衍生物]在生物医药领域的潜在应用价值,掀起了研究热潮。下面对碳纳米材料(carbon nanomaterials,CNMs)在CVD诊断治疗方面的应用和挑战进行综述,以期为CVD治疗提供先进、有效的途径。
1 CNMs结构特点
碳具有4个价电子,可通过spn(n=1,2或3)杂化轨道形成强共价键和弱π-π键,排列成零维(富勒烯)、一维(CNT)、二维(石墨烯)以及三维(金刚石)等不同碳同素异形体,具有独特的物理、电学和光学性质,如大的表面积、高的机械完整性以及优异的导电性和导热性,成为心血管治疗的最佳生物材料。
1.1 石墨烯
石墨烯是生物医学领域应用最广泛的碳同素异形体之一,具有二维层状平面结构,每个碳原子以0.142 nm的间隔排列在蜂窝状晶格中。石墨烯厚度为单个原子,弹性模量为0.5~1.0 Tpa,极限拉伸强度为130 GPa,结构中的长程共轭π键使其具有优异的力学、热学和电学性能。通常单层石墨片不能稳定存在,大量的石墨烯层通过弱范德华力连接组成石墨[3-4]。
石墨烯衍生物主要包括氧化石墨烯(graphene oxide,GO)、还原氧化石墨烯(reduced graphene oxide,rGO)和石墨烯量子点(graphene quantum dots,GQD)。疏水性和分散稳定性差等缺陷阻碍了天然石墨在生物医学领域的应用。通过改进的Hummers方法可制得GO,使其具有更优越的分散性。此外,GO纳米片边缘的开放羟基增加了其功能化能力、柔性加工性、两亲性和荧光猝灭能力,有助于创造出更好的复合材料。将GO还原去除含氧官能团,可得到还原态rGO,最大程度保留原始石墨烯的性质以及GO的亲水性,但合成过程为rGO带来很多缺陷,使其成为一种区别于两种碳材料的独特的碳同素异形体。通过自上而下法和自下而上法可制得GQD,它具有更优良的电学和光学性能。石墨烯类纳米材料拥有大量的官能团,如-COOH、-OH和-COC,通过共价或非共价与很多美国食品药品监督管理局批准的聚合物功能化,既能提高心脏细胞等靶细胞的特异性,又能减少毒性。
1.2 CNT
CNT是由石墨烯片制成的长而中空的圆柱形管状结构,具有较高的纵横比,直径为1~20 nm,长度可为数厘米。根据石墨烯片的层数,CNT可分为单壁碳纳米管(single-walled carbon nanotubes,SWCNT)和多壁碳纳米管(multi-walled carbon nanotubes,MWCNT)。SWCNT在电学上可进一步分为半导体单壁碳纳米管和金属单壁碳纳米管[5]。与SWCNT相比,MWCNT更容易实现功能化。原始的CNT水溶性差,具有高度聚集性。将CNT表面-OH、-COOH或-NH2等基团官能化能提高其在水中的溶解性和分散性,与生物相容性聚合物进一步官能化可解决毒性问题。
1.3 富勒烯
富勒烯是由六角环和五角环相连的石墨烯片组成的空心球形、椭球形或管状结构,分子组成为C2n(n为≥10的整数)。其中C60最常见,拥有30个碳碳双键,可通过氢化、氧化、卤化和光敏化等各种反应对其进行结构修饰,是理想的药物设计载体材料。C70呈卵形结构,分子中间多了一个六角形环带,降低了富勒烯笼的对称性,但理化性质与C60相似。此外,还发现了其他较小的亚稳物种,如C28、C36和C50,以及含有100个或更多碳原子的巨型富勒烯。
1.4 纳米金刚石
纳米金刚石颗粒呈球形或准球形,粒径范围为2~20 nm,比表面积大,兼具金刚石和纳米材料特性。与其他CNMs不同,纳米金刚石具有高度的生物相容性和相对安全性,因而在药物载体、生物成像和荧光探针等生物医药领域的应用价值日益凸显。
2 CNMs在心血管组织工程中的应用
2.1 药物/生物分子传递
新型纳米药物递送系统解决了传统方法生物利用度差、药物毒性大、靶向性缺乏以及给药频繁等问题。CNMs小粒径、高比表面积、优异的载药量以及易于表面功能化等优点使其成为有效的纳米药物/基因载药工具。图1展示了药物传递系统中常用的CNMs,及有效传递目标分子到心脏靶细胞的转运途径。
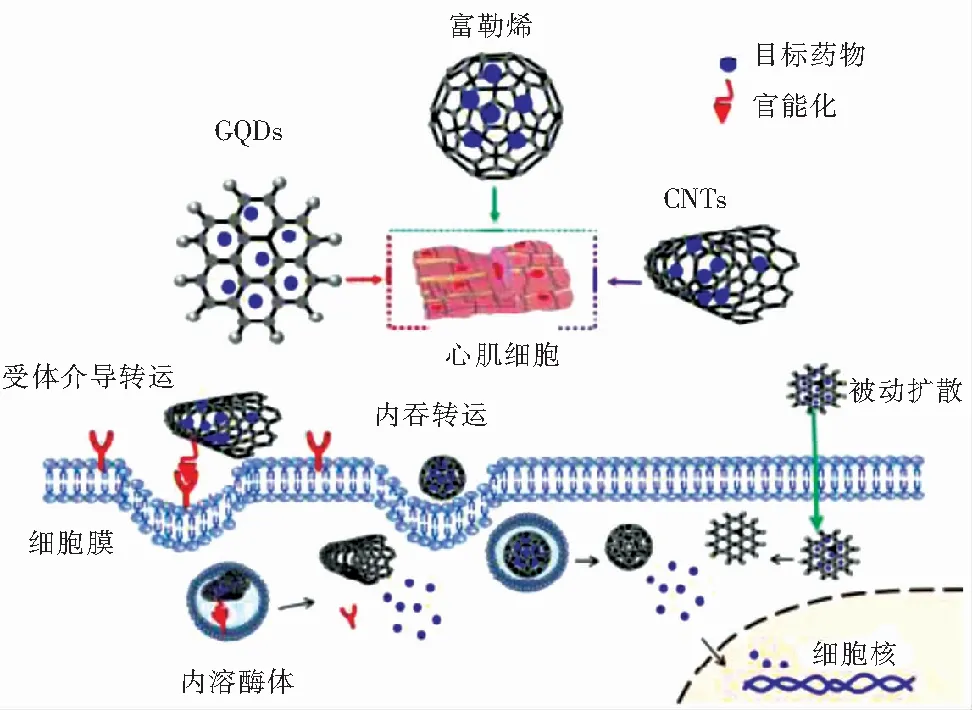
图1 CNMs作为载体将药物/基因导入心肌细胞的不同机制示意图
原始石墨烯载药能力有限,GO和rGO成为首选载体,功能化后石墨烯的毒性、靶向性和缓释性得到很好的改善。Kaya等[6]将厄贝沙坦装载到由rGO、透明质酸、明胶和聚环氧乙烷组成的导电聚合物膜上,能有效地控释药物。血管内皮生长因子(vascular endothelium growth factor,VEGF)可诱导缺血心肌组织的血管生成。Paul等[7]将聚乙烯亚胺功能化GO与VEGF-165促血管生成基因(DNAVEGF)结合成非病毒基因递送系统(fGOVEGF),并将其掺入低模量甲基丙烯酸明胶(methacrylic gelatin,GelMA)水凝胶中,用于急性心肌梗死(acute myocardial infarction,AMI)局部基因治疗。结果fGOVEGF/GelMA组AMI大鼠梗死周围区域的心肌毛细血管密度显著增加,瘢痕面积减少,表明fGOVEGF/GelMA基因治疗系统治疗缺血性心脏病具有可行性。
原始的CNT分散性差,载药量小,无法用作载药载体。采取掺杂等手段对CNT和药物进行功能化可有效改善药物在CNT表面的吸附,为缺血组织传送药物以促进血管生成。Masotti等[8]用聚乙烯亚胺/聚氨基胺树状大分子功能化CNT,能有效地传递miR-503并改善血管生成。此外,CNT还被用于涂层支架,防止支架内再狭窄。Ul Haq等[9]设计了一种聚丙烯酸包裹的SWCNT复合材料,与VEGF、血管生成素-1和内溶Tat肽制成纤维蛋白水凝胶,可改善再内皮化,阻止新生内膜的形成,防止损伤动脉段的狭窄。
直径约0.7 nm的稳定笼状分子,有助于富勒烯被动扩散到细胞和细胞核中,以调节细胞的生物学行为。Hao等[10]发现富勒烯-C60可改善大鼠心肌细胞特异性蛋白[心肌肌钙蛋白(cardiac troponin,cTn)T和α-肌节肌动蛋白]的表达,调节棕色脂肪干细胞增殖和心肌分化,这些发现对富勒烯在AMI治疗中的临床应用具有重要意义。
2.2 生物传感器
生物传感器可早期检测心脏生物标志物和连续监测CVD,以便及时治疗和保存心脏功能。由于低成本、高表面体体积比、较小尺寸以及独特的电学和光学特性,CNMs成为CVD诊断生物传感器的理想材料。AMI时,濒死的心肌细胞会释放肌红蛋白、肌酸激酶、脑钠肽和cTn等标志物,稳定而灵敏地检测这些标志物是CVD早期诊断的关键。Demirbakan等[11]制备了盐酸修饰超灵敏石墨纸电极,用cTnT抗体对其进行功能化,以检测人血清中cTnT水平,实现亚飞秒级检测。金属和纳米金属硫系化合物具有优异的电催化活性、机械刚度和快速电荷转移动力学,是掺杂或功能化石墨烯电极的理想材料,可提高心脏生物标志物的检测灵敏度和选择性。Chauhan等[12]将rGO与金属硫系化合物(四硒化钼,nMo3Se4)包埋在氧化铟锡涂层的玻璃电极中,并用牛血清白蛋白功能化以检测cTnI,比常用的氧化锆电极灵敏度提高9倍。
CNT表面附着生物活性分子能增加对心脏生物标志物的敏感性。Freitas等[13]开发了一种氨基功能化MWCNT基碳电极,用于人类血清cTnT水平检测,检测限为0.016 ng/mL,适于体外cTnT检测。不同的CNMs生物传感器具有独特的性能,Eissa等[14]比较了六种商用CNMs电极(碳、碳纳米纤维、MWCNT、SWCNT、原始石墨烯和GO)检测糖化血红蛋白水平的性能。尽管所有的电极对生物标志物均显示出良好的选择性和敏感性,但基于SWCNT的生物传感器的整体性能最好。未来需对CNMs介导的CVD诊断机制进行深入研究,以期为CVD的诊断和治疗提供最佳的商业化产品。
目前,碳纳米金刚石在心血管领域的应用主要集中在生物传感器的研发上。Gerstenhaber等[15]制备了荧光碳纳米金刚石-bitistatin(F-NDP-Bit)复合物,用于识别体内血管血栓。Wang等[16]设计了一种基于纳米金刚石和石墨烯结构的生物传感器,能检测到非常微小的肌红蛋白(0.01~1 000 pg/mL)。
2.3 组织工程学
石墨烯非凡的机械强度加上优异的导电性和超大的表面积等特性,可促进干细胞的增殖和分化。Nazari等[17]将还原的氧化石墨烯银(rGO-Ag)纳米粒子嵌入聚氨酯支架中,然后植入人心脏祖细胞,可提高人心脏祖细胞的存活率和生长率,并使心脏特异性基因GATA4、TBX18、cTnT和α-MHC的表达增强。可注射水凝胶为3D交联聚合物,为心肌细胞的生长和跳动提供了自然环境,其剪切变稀特性使其能将包裹的细胞安全地注射到受损心肌中,有效促进AMI的修复过程。Bao等[18]以聚乙二醇为交联剂,将三聚氰胺与巯基改性透明质酸交联,制备了一种软质可注射水凝胶,该水凝胶与GO结合后具有类似心肌的抗疲劳力学和电学性质。将导电水凝胶包裹于脂肪组织衍生基质细胞中,并注入AMI区后可使α-平滑肌肌动蛋白和间隙连接蛋白43表达改善。此外,射血分数、血管密度水平、梗死面积和纤维化程度均有显著改善。
CNT电化学稳定,可与电活性组织(如神经、心脏和骨组织)相互作用,与水凝胶和支架结合可创造出新型的导电结构用于心脏组织修复。Ahadian等[19]采用一种人造聚合物和导电CNT来模拟天然细胞外间质,制备了一种具有弹性的导电支架,将新生大鼠心肌细胞植入支架可提高细胞活力。Kharaziha等[20]将CNT嵌入明胶纳米纤维支架,不同浓度的CNT(0%~1.5%)能显著增强支架的导电性和韧性,同时保持了心肌细胞的活力,可潜在地用作心脏或神经元组织结构的移植物。
富勒烯-C60可用作支架增强剂,通过调节丝裂原活化蛋白激酶信号通路增强棕色脂肪干细胞的存活和增殖的能力[10],为富勒烯-C60通过细胞疗法或组织工程治疗AMI的潜在应用提供了证据。此外,富勒烯醇结合海藻酸钠水凝胶能有效保护棕色脂肪干细胞免受H2O2介导的活性氧的损伤,当注射到AMI大鼠的缺血区域时,复合物中棕色脂肪干细胞的存活率和保留率显著提高[21]。
2.4 免疫调节
AMI后,免疫细胞在心肌中浸润有助于心脏组织修复。石墨烯及其衍生物与聚合物的功能化可提高其生物相容性和对免疫细胞的免疫逃避能力。Malanagahalli等[22]研究了少层石墨烯对小鼠骨髓来源巨噬细胞的免疫调节作用,发现少层石墨烯通过被动扩散进入巨噬细胞后发挥免疫调节作用。巨噬细胞分为M1型与M2型,前者促进炎症并抑制细胞增殖,后者促进增殖和组织修复,将M1型极化为M2型的免疫疗法在心脏修复方面获得了极大的关注。Han等[23]制备了由GO、聚乙烯亚胺、聚乙二醇和叶酸组成的巨噬细胞靶向/极化氧化石墨烯复合物,与白介素-4基因特异性结合以促进M1到M2巨噬细胞的极化。在小鼠AMI模型中,巨噬细胞靶向/极化GO复合物的输送能使M1极化为M2巨噬细胞,同时改善活性氧清除特性,减轻纤维化,改善血管生成,保留心脏功能。
CNT固有的免疫原性限制了其在免疫调节方面的应用,需通过调整尺寸、改变理化性质和表面功能化等手段降低其免疫原性。CNT的功能化能增加吞噬细胞和其他细胞对CNT的识别。在一项研究[24]中,磷脂酰丝氨酸修饰的SWCNT被不同的吞噬细胞(即小鼠RAW264.7巨噬细胞、原代单核巨噬细胞、树突状细胞和大鼠脑小胶质细胞)所识别,磷脂酰丝氨酸结合蛋白Annexin V抑制了巨噬细胞的摄取,并改变了巨噬细胞的促炎和抗炎行为。
Bunz等[25]比较了富勒烯-多羟基-C60和N-乙基-聚氨基-C60对免疫活性细胞的影响,研究表明两种富勒烯对T细胞反应性无影响,但能激活巨噬细胞、树突状细胞或自然杀伤细胞等免疫系统的细胞。Suarez-Kelly等[26]评估了荧光纳米金刚石对先天免疫细胞的影响,实验表明荧光纳米金刚石能被吞噬免疫细胞(RAW264.7鼠巨噬细胞和人类单核细胞)摄取,并激活免疫细胞。目前,CNMs在免疫调节中的应用还非常有限,需开展更广泛的基础研究。
3 CNMs临床转化的挑战
纳米材料(尺寸1~100 nm)具有独特的理化性质或生物效应,使其在医药、化妆品和电子领域广泛使用。目前,超过50种含有纳米材料的药物产品被美国食品药品监督管理局批准用于临床,但纳米材料的安全性问题也非常值得关注。将CNMs引入CVD治疗还面临很多挑战,最主要为细胞毒性,包括活性氧生成、DNA损伤、溶酶体损伤、线粒体功能障碍以及细胞凋亡或坏死[27],毒性与粒径、形状、合成方法、表面化学、剂量和给药途径有关。Chen等[28]研究了不同浓度的GO对斑马鱼胚胎发育的影响,在当浓度达到100 mg/L时,GO使斑马鱼胚胎孵化减慢,体长缩短,心率和血流量改变,凋亡基因表达增加;浓度为10 mg/L以上时,毒性与GO的大小无关。有研究[29]探讨了C60水溶性衍生物C60(OH)16-18和3种水悬浮液(nC60/TTA,nC60/甲苯和nC60/aq)对斑马鱼胚胎的发育毒性,发现nC60/甲苯、nC60/aq和C60(OH)16-18分别在剂量38 mg/L、5 mg/L和50 mg/L下均未对斑马鱼胚胎发育产生毒性,nC60/TTA剂量为1.5 mg/L时可导致胚胎或幼鱼发育延迟,甚至造成部分斑马鱼心包囊水肿和畸形,表明制备过程以及结构均能影响富勒烯的生物毒性。
2019年,国际化学品秘书处(ChemSec)将CNT添加到SIN(需立即替换物质)列表中,原因是具有致癌性和生殖毒性[30]。此外,CNT对生物降解具有抗性,在水中的半衰期>60 d,在沉积物和土壤中的半衰期>180 d。CNT成为此列表中的首个纳米材料。因此,在产品中应避免使用CNT,并探索使用其他方法或可替代的纳米结构,以更低的风险提供类似的功能,这限制了CNT在药物递送、生物传感器、各种组织的组织工程应用中的应用,特别是心脏和大脑等敏感器官。
4 展望
CNMs被誉为21世纪的重要材料,在生物医学领域表现出巨大的应用潜力。生物安全性是决定它们能否投入临床应用的关键因素之一。目前对纳米药物的安全性评价多侧重体外细胞毒性,动物毒性评价报道较少。纳米药物在靶组织的毒性、对机体免疫系统的影响、对靶组织的致瘤性等方面尚需进行深入研究。在未来的安全性评价中应考虑对纳米材料在环境中的转归包括降解性和降解周期,纳米药物的靶向特征以及对不同生物体影响的差异等方面进行评价,建立完善的评价体系,推动纳米材料的进一步开发。
心肌血流减少和/或中断,可引起收缩性心肌细胞大量不可逆丧失,随后机体形成富含胶原蛋白的纤维化瘢痕组织快速修复受损心肌。但瘢痕组织不仅会降低心肌的收缩能力,还无法传导电流,最终会诱发心律失常和心力衰竭。目前可通过使用β受体阻滞剂、肾素-血管紧张素系统抑制剂等药物,通过激活抗炎通路和减少细胞凋亡来逆转心室重塑,不能完全解决心肌细胞丢失和收缩面积减少等根本性问题。此外,还可采用心脏移植手术治疗,但器官捐赠者的短缺和免疫排斥限制了其应用,亟待再生医学和心脏组织工程学的重大突破。未来利用导电CNMs开发出与心脏生物结构非常相似的导电结构,通过实验室培育心脏有可能成为CVD治疗的新方向和新途径。