不同干细胞来源的外泌体在缺血性心脏病中的促血管新生作用
2022-05-10肖轶余国龙
肖轶 余国龙
(中南大学湘雅医院,湖南 长沙 410008)
血管新生是指从血管床形成新的毛细血管的过程,是治疗缺血性疾病的关键[1]。目前缺血性疾病的治疗主要包括溶栓药物和手术,但这些方法不能重塑缺血区血管床和诱导血管新生。近年来,研究者们利用干细胞来诱导缺血性疾病的血管新生[2-3]。干细胞可通过分化成细胞和/或释放旁分泌因子来参与修复缺血区。然而,干细胞治疗仍有限制性,如伦理问题、技术问题、免疫原性和致癌性等[4]。越来越多的研究表明,来自干细胞的细胞外囊泡(extracellular vesicles,EVs)能促进缺血性疾病的治疗。其中,外泌体也属于EVs,通过转运各种血管生成因子到缺血组织来促进血管新生。血管新生可能通过两种机制发生,包括萌芽性血管新生和套入式血管新生。缺氧是诱发萌芽性血管新生的主要因素,而血流动力学改变则可诱发套入式血管新生。萌芽性血管新生是常见的血管新生方式,主要有两种细胞参与,包括内皮细胞和血管壁细胞(如平滑肌细胞或周细胞)[5-6](图1)。在血管新生过程中,基质金属蛋白酶首先降解细胞外基质,细胞外基质和血管内皮生长因子(vascular endothelial growth factor,VEGF)激活内皮细胞,这个过程通常被称为VEGF的刺激。在尖端细胞形成过程中,内皮细胞可能变成独特的形态,并伴有向细胞外基质发展的趋势。柄细胞是尖端细胞后的一种细胞,支持新生管的增殖和伸长。不同的刺激因子和信号分子可促进内皮细胞的增殖和迁移,从而使细胞形成发芽的小管。尖端细胞有助于新形成的管状物的伸长和引导。在管状物形成的过程中,新形成的小管相互融合,壁细胞如周细胞可促进新生毛细血管的稳定[5-8]。血管新生是否发生取决于促进和抑制血管生成的因素之间的平衡关系。增加促血管生成因子(如血管生成素、成纤维细胞生长因子、VEGF、转化生长因子-α和表皮生长因子)可诱导血管新生,但增加抗血管生成因子(如血管抑素、血栓软骨素-1/2、干扰素、内酯和胶原Ⅳ)可抑制血管生成[5-8]。
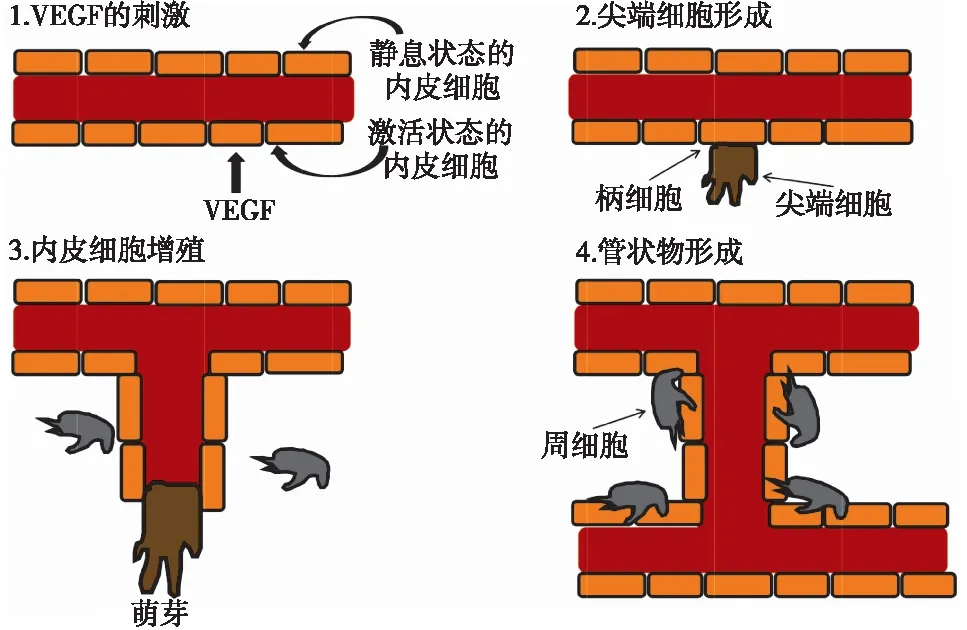
图1 萌芽性血管新生示意图
外泌体直径大小30~150 nm,在电镜下呈双层膜的茶杯状[9]。国际细胞外囊泡协会提出了“细胞外囊泡”这个术语,指的是从生物液和细胞条件培养基中分离出来的囊泡。EVs包括外泌体、微囊泡和凋亡小体(图2)。这些囊泡内含有多类型的生物分子,它们在细胞之间转移从而发挥生物学效应[10]。许多细胞包括正常细胞、肿瘤细胞和干细胞都可产生外泌体[11](图2)。外泌体是当不同的分子或复合物作用于多囊泡体上的内体分拣转运复合物,多囊泡体与质膜融合后产生的一类EVs。若在细胞内与溶酶体融合,则发生降解,与质膜融合后,以微囊泡形式排出细胞外。Rab GTP酶参与调节多囊泡体的细胞内运输。外泌体的内容物是由不同类型的分子组成,可能来源于高尔基体、细胞质或内体途径[11]。外泌体膜上有典型的标记物,如TSG101、Alix、整联蛋白和四肽类(如CD63、CD9和CD81)[11]。研究[12]表明,相比于干细胞,外泌体不仅能发挥治疗作用,还能避免许多风险。在此,归纳总结来自不同干细胞的外泌体在缺血性心脏病中的促血管新生作用及机制。
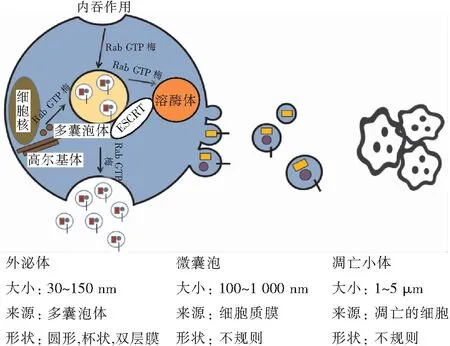
注:ESCRT为内体分拣转运复合物。图2 EVs的生物生成及其特点
1 不同干细胞来源的外泌体在缺血性心脏病中的血管新生作用
缺血性心脏病,是指各种因素引起的心脏氧供不足,心肌组织坏死和心功能异常。最常见的原因是冠状动脉的严重阻塞,临床治疗主要包括介入支架或外科搭桥。然而,这种方法适用于动脉直径>2 mm的患者,因此,动脉直径<2 mm的患者,以及有手术史、动静脉移植不足和冠状动脉病变等病史的患者仍需关注其他促血管新生的方法[13]。最新研究进展表明,干细胞来源的外泌体能促进缺血区血管新生,可能是一种治疗心肌缺血更有前途的方法(表1)。

表1 改善缺血性心脏病血管新生的干细胞来源的外泌体内容物
1.1 心脏肌球衍生细胞来源的外泌体
心脏肌球衍生细胞(cardiosphere-derived cells,CDCs)被认为是心脏祖细胞,能形成各种心脏细胞,包括内皮细胞、心肌细胞和平滑肌细胞[14]。研究表明,CDCs可诱导血管新生,改善心肌梗死动物模型的心功能[15]。后续发现,CDCs来源的外泌体(CDCs-Exo)也有相同的作用[16]。Gallet等[17]发现,在急性心肌梗死(actute myocardial infarction,AMI)猪模型中,心肌内注射CDCs-Exo可诱导缺血区血管新生,从而促进心肌修复。含有miR-146a的CDCs-Exo可减少心肌细胞的凋亡并增加心肌细胞的增殖。将这些外泌体注射到小鼠AMI模型的心脏组织中,显著促进了血管新生和心肌修复。Namazi等[18]发现,缺氧状态下的CDCs可释放出内含不同miRNAs的外泌体,这些外泌体含有高水平的miR-210、miR-130a和miR-126,能诱导人脐静脉内皮细胞(human umbilical vein endothelial cells,HUVECs)的血管新生。
1.2 心肌祖细胞和内皮祖细胞来源的外泌体
心肌祖细胞(cardiac progenitor cells,CPCs)和内皮祖细胞(endothelial progenitor cells,EPCs)可分别形成心肌细胞和内皮细胞。研究表明,缺氧微环境下的CPCs及其外泌体(CPCs-Exo)可促进血管新生和心肌修复[19]。CPCs-Exo内含丰富的miR-210,具有抑制心肌细胞凋亡、促进血管生成和改善心功能等保护作用[20]。过表达miR-322的CPCs-Exo可促进人内皮细胞的血管新生,其机制是通过增加活性氧来促进内皮细胞的迁移和毛细血管形成[21]。另外,研究[22]表明过表达骨钙素(osteocalcin,OCN)的EPCs来源的外泌体可通过激活OCN-GPRC6A通路来促进内皮细胞血管新生。
1.3 胚胎干细胞来源的外泌体
Khan等[23]将胚胎干细胞(embryonic stem cells,ESCs)来源的外泌体注射到小鼠AMI模型的心肌组织内,结果表明心肌中新生血管密度明显增加。来自人ESCs衍生的CPCs-Exo移植到小鼠AMI模型有心脏保护作用。进一步研究[24]表明,外泌体移植的心肌中有927个基因上调,其中大部分与心脏功能有关。同样,在小鼠缺血再灌注损伤模型中,从人ESCs衍生的间充质干细胞(mesenchymal stem cells,MSCs)来源的外泌体通过促进磷酸化丝氨酸/苏氨酸激酶(p-Akt)和磷酸化糖原合酶激酶3β(p-GSK-3β)的表达可减少梗死面积,促进血管新生和心肌修复[25]。
1.4 CD34+细胞来源的外泌体
研究[26]表明,CD34+细胞来源的外泌体(CD34+-Exo)可促进内皮细胞的存活和增殖,有利于血管新生。Mackie等[27]发现,CD34+-Exo内含高水平的Sonic Hedgehog(Shh)蛋白,可改善心肌梗死缺血区血管新生和心功能。
1.5 MSCs来源的外泌体
MSCs来源的外泌体(MSCs-Exo)可被内皮细胞摄取,从而促进血管新生。Teng等[28]发现在心肌梗死动物模型中注射MSCs-Exo可增加新生血管密度。研究[29]表明,过表达CXCR4的MSCs-Exo可激活心肌细胞内Akt信号通路,从而抑制心肌细胞的凋亡,并增加VEGF的表达和血管新生。在大鼠心肌梗死模型中,这些外泌体通过诱导血管新生、减少梗死面积和增加心脏功能来促进心肌梗死后的恢复[29]。Vrijsen等[30]通过体外和体内试验表明,骨髓MSCs-Exo可通过激活ERK/Akt信号通路来促进内皮细胞的迁移和新生血管的形成。另有研究[31]表明,脐带MSCs-Exo能上调内皮细胞内Bcl-2家族蛋白的表达,从而增加内皮细胞的迁移和新生血管的形成。Wang等[32]研究认为,在大鼠AMI模型上,与骨髓和脂肪来源的MSCs-Exo相比,子宫内膜来源的MSCs-Exo能更有效地增加新生微血管密度。这些外泌体中含有丰富的miR-21,可通过激活PTEN/Akt通路发挥心脏保护作用。另外,研究[33]发现MSCs-Exo可转运miR-30b到HUVECs,靶向调节DLL4,从而发挥血管新生作用。最新研究[34]发现,在缺氧条件下,骨髓MSCs-Exo可通过转移高迁移率族蛋白B1到HUVECs,通过JNK/HIF-1α途径促进血管新生。
1.6 诱导多能干细胞来源的外泌体
诱导多能干细胞(induced pluripotent stem cells,iPSCs)在组织再生领域具有重要作用。iPSCs是通过将体细胞重新编码为类似胚胎的多能状态而产生的,具有不同的分化特征。iPSCs和其外泌体(iPSCs-Exo)通过诱导内皮细胞迁移和血管新生,在心力衰竭的治疗中具有积极的作用。例如,当iPSC-Exo被注入心肌梗死小鼠的心脏时,其增加了梗死区和边界区毛细血管的再生[35]。iPSCs衍生的CPCs-Exo能促进HUVECs迁移和血管新生。此外,这些外泌体的治疗能显著提高左室射血分数和减少左室容积,有助于恢复心功能[36]。
2 优势和限制
外泌体在缺血性心脏病的应用中具备很多优势。研究者们[37]可通过不同的方式,如细胞工程或预处理母体细胞,改变外泌体内容物,将特定的生物分子传递到靶细胞。另一个优势是外泌体本身的生物特质,可使其成为生物成分和药物的天然纳米载体。因此,外泌体未来有望应用于个性化医疗。此外,外泌体的移植,尤其是MSCs-Exo,是相对安全和非肿瘤源性的,甚至异体来源也不会产生免疫排斥。尽管如此,目前在外泌体的定义、分离和应用方面仍有一些限制。一些研究可能未使用国际细胞外囊泡协会更新的外泌体指南。EVs的大小甚至标记都可能重叠,这可能会影响结果,所以研究者可能会无意中使用外泌体这个术语。另外,当研究者使用不同的方法来分离外泌体也会影响到实验的结果。此外,不同的外泌体给药方式对于治疗效果至关重要。尽管研究者已研究了不同的给药方法来将外泌体送入靶组织,但究竟哪一种给药方式获益更多仍需更多的研究数据来支持[4]。
3 总结
大量研究表明干细胞来源的外泌体具有促血管新生的潜力,可参与治疗缺血性心脏病,但这些研究大多是在临床前进行的,临床研究仍有待继续推进。外泌体治疗虽然有优势,但也有一些局限,未来需更多研究来解决,包括分离方式、给药方法及保存条件等,最终使得外泌体治疗能应用于临床。