HBVX区A1762T/G1764A突变对肝癌HepG2细胞自噬的影响
2022-05-10于飞杨育华赵阳通讯作者:黄天壬
于飞?杨育华?赵阳?通讯作者:黄天壬

摘要:目的:探究HBV X区A1762T/G1764A突变对人肝癌HepG2细胞自噬的影响。方法:体外培养人肝癌 HepG2细胞;将HepG2细胞随机分为慢病毒空白载体(阴性对照)组、HBX-wt(野生型)组,HBX-A1762T/G1764A(实验)组。实时荧光定量 PCR(RT-qPCR)法检测各组细胞 LC3B、P62、Beclin-1的表达情况;蛋白印迹分析法检测各组细胞LC3B、Beclin-1、P62蛋白的表达情况。结果:与阴性对照组和HBX-wt组相比,HBX-A1762T/G1764A组LC3B、Beclin-1基因表达水平升高(P <0.05),P62水平降低(P<0.05);与阴性对照组和HBX-wt组相比,HBX-A1762T/G1764A组LC3B、Beclin-1蛋白表达水平升高(P <0.05),P62蛋白表达水平降低(P<0.05)。结论:HBV X区 A1762T/G1764A双突变可能调控了肝癌HepG2激活了细胞自噬的发生。HBV X区 A1762T/G1764A突变可能是HBV所致HCC诊断和治疗的潜在靶点。
关键词:肝癌,HBV,HBX 区A1762T/G1764A突变,自噬
【中图分类号】R575 【文献标识码】A 【文章编号】1673-9026(2022)10--02
肝细胞癌(hepatocellular carcinoma, HCC简称肝癌)是世界最常见的恶性肿瘤之一。在全球范围内,已有20多亿人感染了乙肝病毒,全球HCC病例中大约53%与HBV感染有关[1]。一些报道也表明,乙肝病毒的遗传特征,包括乙肝病毒的基因型和特定的基因突变,与肝细胞癌的发生有关[2-5]。HBx由HBV的X开放阅读框编码,在肝癌的发生过程中起着至关重要的作用。有研究表明, HBV X区A1762T/G1764A突变是肝细胞癌发生的独立危险因素[6]。HBV X 区的A1762T/G1764A突变为有差异的热点突变,差异有统计学意义[7]。
自噬是一种保守的过程,通过这种过程,细胞质物质包括错误折叠的蛋白质、受损的细胞器和各种入侵的病原体被移除,以维持细胞内环境的稳定[8]。有研究表明,HBx可以直接与第III类磷脂酰肌醇3-激酶I(PtdIns3K)结合,增强PtdIns3K的酶活性,并在Huh7.5细胞中诱导病毒DNA复制的自噬[9]。本研究在体外建立了人肝癌细胞HBX突变模型,以探讨HBV X区A1762T/G1764A突变对人肝癌HepG2细胞株自噬的影响,为肝癌治疗提供可能的新靶点。
1 材料与方法
1.1主要材料与试剂
人肝癌HepG2细胞株,课题组前期购买。特级澳洲胎牛血清、DMEM高糖型细胞培养基:美国Gbico公司。逆转录试剂盒以及qRT-PCR试剂盒:日本TaKaRa 公司。慢病毒表达载体HBX-A1762T/G1764A突变组、HBx野生型组、阴性对照组。HBX、PI3K、AKT、mTOR基因引物:上海生工生物工序股份有限公司。乙型肝炎病毒X多克隆抗体:美国Abcam公司。beta-Actin Rabbit mAb、LC3B Rabbit mAb、P62 Rabbit mAb、Beclin-1 Rabbit mAb:美国CST公司。
1.2 细胞分组和转染
HepG2细胞用含10%胎牛血清的DMEM高糖型细胞培养基培养。取对数生长期细胞接种于6孔板中。待细胞密度约为30%-50%时,按慢病毒使用说明书进行转染。实验分组:(1)转染慢病毒空白载体的阴性对照组(NC),转染含HBX野生基因型序列的野生型组(WT),转染含HBX野生基因序列发生A1762T/G1764A位点联合突变的实验组(EG)。
1.3 RT-qPCR实验检测HBX、LC3B、P62、Beclin-1的表达
按照Trizol试剂盒说明书提取各组细胞总RNA,逆转录得cDNA,然后按照qRT-PCR试剂盒说明进行PCR扩增。PCR反应条件为:95 °C变性10min,60°C退火 30s、72 °C延伸 40min,共40个循环。以GAPDH为内参,2-ΔΔCt法计算HBX、LC3B、P62、Beclin-1表达水平。引物序列见表1。
x
1.4 Western blot检测HBx、LC3B、P62、Beclin-1蛋白表达
收集各组细胞,加入RIPA裂解液提取各组细胞总蛋白。取30μg蛋白样品行SDS?PAGE凝胶电泳,转膜、快速封闭液封闭后,加入一抗HBx、LC3B、P62、Beclin-1、β-actin (1∶1 000),4℃摇床孵化过夜;次日洗膜后加入1∶2000稀释的山羊抗兔IgG作为二抗,室温孵化1 h,TBST洗涤后,加入ECL显色发光,凝胶成像仪成像。以为β-actin内参,Image J软件测定蛋白灰度值,计算各组各蛋白相对表达量。
1.5 统计学方法
以统计学软件GraphPad Prism 8.0分析实验数据并进行绘图,计量资料以平均数±标准差() 描述,多组间比较使用单因素方差分析,进一步两组间比较行LSD-t检验,当P<0.05时,差异有统计学意义。
2 結果
2.1 HepG2细胞慢病毒转染验证
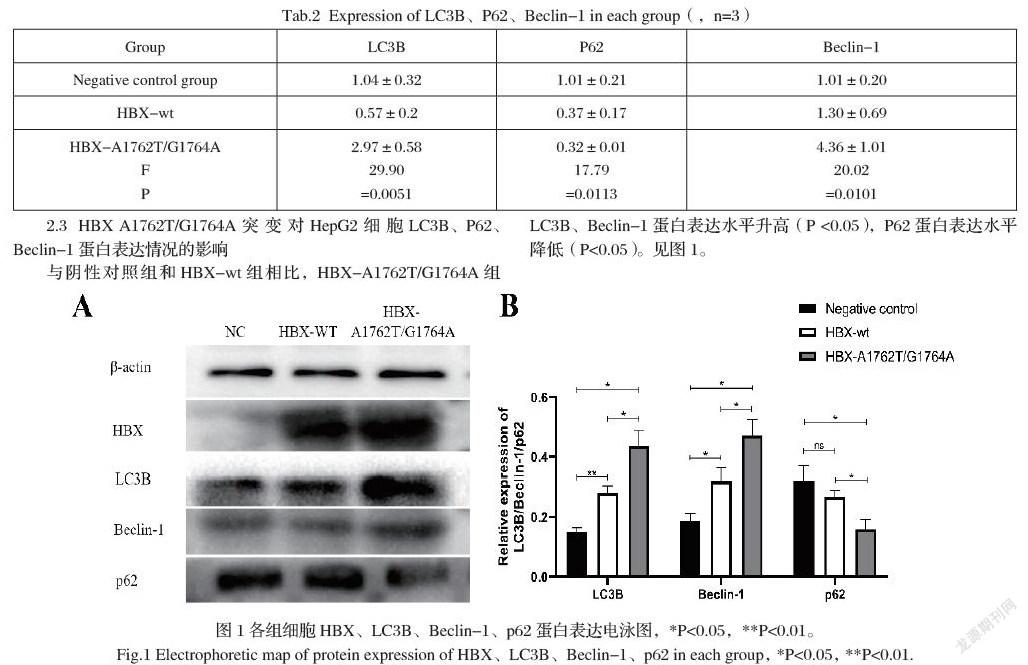
将提取的总蛋白进行Western blot分析,结果如图1所示:阴性对照转染组未见任何条带,而HBX-wt、HBX-A1762T/G1764A组在相对分子质量约为17KD处存在显著条带,见图1。以上结果说明成功构建了HepG2细胞模型。
2.2 HBX突变对HepG2细胞LC3B、P62、Beclin-1基因表达的影响
与阴性对照组和HBX-wt组相比,HBX-A1762T/G1764A组细胞LC3B、Beclin-1基因表达水平升高(P <0.05),P62基因表达水平降低(P<0.05),见表2。
2.3 HBX A1762T/G1764A突变对HepG2细胞LC3B、P62、Beclin-1蛋白表达情况的影响
与阴性对照组和HBX-wt组相比,HBX-A1762T/G1764A组LC3B、Beclin-1蛋白表达水平升高(P <0.05),P62蛋白表达水平降低(P<0.05)。见图1。
3 讨论
乙肝病毒感染仍然是一个主要的公共卫生问题,在世界范围内造成显著的发病率和死亡率。约20亿人,即世界人口的三分之一,有过去或现在感染过乙肝病毒的血清学证据,目前约有3.5亿人持续感染[2]。慢性乙肝可导致慢性活动性肝炎、肝硬变和肝癌[3]。因此,探究HBV在HCC发生发展中的作用及机制,并在此基础上寻找有效的措施防治HCC尤为重要。
自噬是一种分解代谢过程,通过引导陈旧/受损的细胞器(如线粒体)、蛋白质聚集体和病原体进行溶酶体降解来维持细胞的动态平衡。溶酶体分解的产物(例如氨基酸和脂肪酸)被回收,并通过溶酶体膜运输到细胞质中。这些代谢物可以在蛋白质和三磷酸腺苷的生产中重复使用[10]。在新陈代谢压力或营养供应不足的时期,自噬迅速上调,以维持能量生产,并为基本的细胞功能提供基石。同样,缺乏葡萄糖或氨基酸或暴露在低氧环境中的细胞依赖自噬生存[11-12]。自噬缺陷导致蛋白质在肝脏中积累,导致肝脏肿大、肝细胞死亡和肝功能衰竭[13]。HBV感染能够诱导肝细胞自噬反应,但诱导自噬反应的关键位点及具体是抑制还是激活作用目前处于探索之中。本研究发现,与阴性对照组、HBX-wt组相比,HBX-A1762T/G1764A组HepG2细胞LC3B、Beclin-1基因表达水平升高(P <0.05),P62基因表达水平降低(P<0.05)。与此同时HBX-A1762T/G1764A组LC3B、Beclin-1蛋白表达水平升高(P <0.05),P62蛋白表达水平降低(P<0.05)。提示HBX的A1762T/G1764A双突变可能在HepG2细胞的自噬过程中起到促进作用,从而在HBV所致的HCC中起到了一定的作用。
综上所述 HBV X区A1762T/G1764A突变可能通过促进HepG2细胞的自噬,影响了肝癌细胞的细胞学功能,从而可能促进HCC的发生发展。
参考文献:
1.Lee WM. Hepatitis B virus infection. N Engl J Med. 1997;337(24): 1733–45.
2.Baptista M, Kramvis A, Kew MC. High prevalence of 1762(T) 1764(A)mutations in the basic core promoter of hepatitis B virus isolated from black Africans with hepatocellular carcinoma compared with asymptomatic carriers. Hepatology. 1999;29(3):946–53.
3.Kao JH, Chen PJ, Lai MY, et al. Hepatitis B genotypes correlate with clinical outcomes in patients with chronic hepatitis B. Gastroenterology.2000;118(3):554–9.
4.Kao JH, Chen PJ, Lai MY, et al. Basal core promoter mutations of hepatitis B virus increase the risk of hepatocellular carcinoma in hepatitis B carriers. Gastroenterology. 2003;124(2):327–34.
5.Yu MW, Yeh SH, Chen PJ, et al. Hepatitis B virus genotype and DNA level and hepatocellular carcinoma: a prospective study in men. J Natl Cancer Inst.2005;97(4):265–72.
6.Yang HI, Yeh SH, Chen PJ, et al. Associations between hepatitis B virus genotype and mutants and the risk of hepatocellular carcinoma. J Natl Cancer Inst. 2008 Aug 20;100(16):1134-43. doi: 10.1093/jnci/djn243. Epub 2008 Aug 11.
7.郑丹,邓伟,黄天壬,等.广西壮族自治区肝癌高发区HBV基因型、BCP/前C区突变与肝癌相关性的研究[J].中华流行病学杂志,2015,36(07):725-729.
8.Mizushima, N.; Komatsu, M. Autophagy: Renovation of Cells and Tissues. Cell 2011, 147, 728–741.
9.Sir, N.; Tian, Y.; Chen, W.-L.; et al. The early autophagic pathway is activated by hepatitis B virus and required for viral DNA replication. Proc. Natl. Acad. Sci. USA 2010, 107, 4383–4388.
10.Rabinowitz, J. D., and White, E. (2010) Autophagy and metabolism.Science 330,1344–1348
11. Marx, J. (2006) Autophagy: is it cancers friend or foe? Science 312,1160–1161
12.Rouschop, K. M., van den Beucken, et al. (2010) The unfolded protein response
protects human tumor cells during hypoxia through regulation of the autophagy genes MAP1LC3B and ATG5. J. Clin. Invest. 120,127–141
13.Komatsu, M., Waguri, S., Ueno, T., et al.(2005) Impairment of starvation-induced and constitutive autophagy in Atg7-deficient mice. J. Cell Biol. 169,425–434
基金項目:广西自然科学基金资助(编号:2019GXNSFDA245001)
