胰岛素通过Akt和Erk信号通路对甲状腺乳头状癌细胞的增殖作用
2022-05-08姚侃男盛晓理姚定国
姚侃男 盛晓理 姚定国
2009年6月《Diabetologia》报道了4项糖尿病的流行病学研究,强调了甘精胰岛素增加癌症风险率的潜在联系。胰岛素及胰岛素类似物是治疗糖尿病的重要手段,与胰岛素受体和胰岛素样生长因子1类受体相结合,通过信号转导发挥作用,涉及多条通路。胰岛素和胰岛素样生长因子I(insulin-like growth factor-I,IGF1)属肽类家族激素,既可与胰岛素受体结合,又能交叉结合于IGF1R,激活磷脂酰肌醇 3 激酶(phosphatidylinositol 3-kinase,PI3K)/蛋白激酶 B(protein kinase B,PKB)(又称 Akt)通路和细胞外调节蛋白激酶(extracellular regulated protein kinases,ERK)信号通路,促使细胞增殖、抗细胞凋亡[1-2]。Akt信号通路与多种癌细胞增殖等均有相关性[3-5]。IGF1R属于酪氨酸激酶受体家族,不仅广泛分布在正常组织细胞表面,在肿瘤细胞表面也存在高表达,是某些类型细胞转化表型形成的前提,也是肿瘤发展、侵袭的必要条件[6-8]。本实验旨在探索比较胰岛素及其类似物对PTC-1s细胞增殖作用的影响。
1 材料与方法
1.1 实验材料 (1)细胞株:甲状腺乳头状癌细胞(papillary thyroid carcinoma-1 cells,PTC-1s),由比利时Institute of Interdisciplinary Research 提供。(2)药品与试剂:RPMI Medium 1640、胎牛血清,购自美国 Gibco公司。生物合成人胰岛素注射液(诺和灵R),购自诺和诺德(中国)制药有限公司。甘精胰岛素注射液(来得时),购自赛诺菲(北京)制药有限公司。
1.2 实验步骤 (1)PTC-1s细胞培养:将胎牛血清10 mL加入到90 mLRPMI Medium 1640中,混匀配置成100 mL细胞完全培养液。以胎牛血清:DMSO=9∶1配置细胞冻存液,现配现用。PTC-1s细胞培养于含5%CO2的37 ℃恒温培养箱中。①细胞换液:换液前,将细胞完全培养液置于室温环境中预温30 min,之后使用1 mL移液枪吸弃旧培养基,使用2 mL PBS冲洗1遍后加入新鲜细胞完全培养液,每2 d换液1次。②细胞传代:待细胞长至80%融合后,吸弃旧培养液,加入2 mL PBS冲洗1次后,加入1 mL含0.02%EDTA的胰酶,置于37 ℃培养箱中消化1 min,待倒置显微镜下观察细胞变圆或细胞间隙变大,加入含10%胎牛血清的RPMI Medium 1640培养液2 mL中止消化,使用1 mL移液枪轻柔吹打混匀,于25 ℃环境中使用离心机以800 r/min离心5 min,弃上清,加入恢复室温的新鲜细胞完全培养液重新悬浮,分装入新的干净培养瓶中,一般按照1∶2或1∶3的比例进行传代。③细胞冻存:将离心生长状态良好的细胞加入1 mL细胞冻存液,使用移液器轻柔吹打,均匀后置于1.8 mL细胞冻存管中,每2小瓶冻一管,封口膜封好管口,标记后置于细胞程序性降温盒中,迅速放置-80 ℃冰箱降温冷冻后,转存于液氮罐中以备用。④细胞复苏:将冻存于液氮罐中的细胞取出,迅速放入37 ℃电热恒温水槽中,不断晃动冻存管,于1 min内将细胞解冻,使用移液器将冻存管中的细胞悬液转移至15 mL离心管中,于25 ℃环境中以800 r/min离心5 min,弃上清,加入恢复室温的新鲜完全培养液重悬细胞,分装入新的干净培养瓶中。轻轻晃匀细胞后置于含 5%CO2的37 ℃恒温培养箱中。(2)建立IGF1R低表达PTC-1s细胞组模型。①构建针对人IGF1R基因的RNA干扰慢病毒载体:病毒LV-IGF1RRNAi(44818-1)由上海吉凯构建,设计SiRNA靶点,合成单链DNA oligo,退火后形成双链DNA,通过T4 DNA连接酶,连接慢病毒载体,取产物加入到感受态细胞转化,PCR鉴定实验后,送测序验证,质粒抽提。②病毒包装:慢病毒包装由上海吉凯完成,其提供对应的病毒上清。慢病毒载体系统由三质粒组成,分别是pGC-LV载体、pHelper 1.0载体和pHelper 2.0载体。pGC-LV载体中含有HIV的基本元件5'LTR和3'LTR,带有GFP标记,用于RNA干扰。pHelper 1.0载体中包含HIV病毒的gag基因,其作用主要是编码病毒的结构蛋白;pol基因,编码病毒特异性的酶;rev基因是调节gag和pol基因表达。pHelper2.0载体中存在单纯疱疹病毒来源的VSV-G 基因,编码病毒包装所需的包膜蛋白。三种质粒载体分别进行高纯度无内毒素抽提,均转染293T细胞,转染8 h,更换为完全培养基,培养48 h后,收集富含慢病毒颗粒的细胞上清液,对其浓缩后得到高滴度的慢病毒浓缩液。③病毒滴度测定:将293T细胞铺板于96孔板,每个孔加4×104个细胞,加液量100 μL,培养箱培养24 h。在10个无菌的Ep管中分别加入90 μL的无血清培养基。取待测定的病毒原液10 μL加入到第1个管中,混匀后取10 μL加入到第2个管中,继续相同的操作直到最后1管。选取所需的细胞孔,吸去90 μL培养基,丢弃,加入90 μL稀释好的病毒溶液,放入培养箱培养24 h后,加入完全培养基100 μL,4 d后观察荧光表达情况,病毒的滴度等于带有荧光的细胞数除以病毒原液量。④慢病毒感染:取对数生长期的PTC-1s细胞,胰酶消化后,完全培养基制成约3×104个/mL细胞悬液,接种到6孔培养板中,继续培养至细胞密度20%/孔,按MOI=10(滴度为1×108 TU /mL的病毒,加入1 μL病毒液)加入病毒,在含5μg /mL Polybrene的ENi.S中感染病毒,感染后16 h左右更换为常规培养基继续培养,感染后72 h左右,荧光显微镜观察GFP的表达情况,取感染效率>80%者进入下游实验。⑤逆转录多聚酶链反应(RT-PCR)检测IGF1R基因敲减效率:收集部分感染细胞,未处理细胞作对照组,Trizol法提取各组细胞的总RNA,逆转录反应使用Oligo dT合成第一链,在20μL反应体系中加入2 μg总cDNA。引物序列:上游为TGCGTGAGAGGATTGAGTTTC,下游为CTTATTGGCGTTGAGGTATGC,扩增产物为269(bp)。内参照GAPDH上游为TGACTTCAACAGCGACACCCA',下游为CACCCTGTTGCTGTAGCCAAA。退火温度均为55 ℃。在同一条件下,每次PCR以GAPDH为内参照。表达丰度以相对NC组样品目的基因的相对表达水平表示。(3)建立IGF1R正常表达PTC-1s细胞组模型:①构建RNAi 阴性对照慢病毒载体:RNAi 阴性对照慢病毒(LV-NC-GFP)载体由上海吉凯构建。基因信息:Scramble 序列,核心系列:TTCTCCGAACGTGTCACG。②病毒包装:同建立IGF1R低表达PTC-1s细胞组模型。③病毒滴度测定:同建立IGF1R低表达PTC-1s细胞组模型。④慢病毒感染:同建立IGF1R低表达PTC-1 s细胞组模型。⑤逆转录多聚酶链反应(RT-PCR)检测IGF1R基因表达:同建立IGF1R低表达PTC-1s细胞组模型。(4)药物配置及分组干预:①细胞分组:两类细胞各分为三组。IGF1R正常表达PTC-1s组细胞(NC)分为空白对照组(NC-CON)、人胰岛素组(NCHI)和甘精胰岛素组(NC-IG);IGF1R低表达PTC-1s组(RNAI)分为空白对照组(RNAI-CON)、人胰岛素组(RNAI-HI)和甘精胰岛素组(RNAI-IG)。根据前期实验结果,将药物干预浓度设置10 IU/L。②药物浓度配置:干预药物分别用细胞完全培养液进行稀释,每5 mL细胞完全培养液中加入5 μL原始浓度药物,得到100 IU/L的人胰岛素或甘精胰岛素,混匀后取上述浓度药物0.5 mL加入5 mL细胞完全培养液中,得到10 IU/L的终浓度药物。(5)细胞增殖能力检测:取生长状态良好的对数生长期细胞,加胰酶消化离心,用细胞完全培养液进行重悬,用细胞计数板计数,调整细胞密度为 2.5×104/mL,取200 μL细胞悬液接种于96孔板中;将3组细胞随机分别放入孔板中,每组4复孔;将含细胞的96 孔板置于细胞板振荡器上快速振荡10 s,倒置显微镜下观察每个孔细胞单个分布均匀后,静置于含5%CO2的37 ℃恒温培养箱中培养24 h,待细胞贴壁后,用200 μL移液枪吸弃旧培养液。空白对照组加入200 μL细胞完全培养液,人胰岛素组和甘精胰岛素组分别加入200 μL稀释至10 μL/L的胰岛素。每块细胞板置于培养箱中分别培养18、24、36、48、72 h后,每孔加10 μL CCK8试剂,于培养箱中孵育60 min。最后,将96孔板置于酶标仪中,通过测波长450 nm 光密度(optical density,OD)可检测活性细胞。(6)细胞蛋白质提取:取生长对数期生长状态良好的细胞,根据前面实验结果,选取72 h干预时间的细胞,用细胞刮铲刮尽培养瓶底部的细胞,用移液器将刮离的细胞转移至 1.5 mL EP管中,预冷PBS洗3遍,4 ℃离心机离心收集细胞;每2×106个细胞加入50 μL 细胞裂解液,移液枪吹打混匀后,置于冰上裂解 30 min,每隔10 min于振荡器上高速振荡1次,裂解完毕,于4 ℃离心机中以 13,300 r/min离心15 min沉淀细胞碎片,用100 μL移液枪吸取上层无色透明上清液,即为所需的细胞总蛋白,-80 ℃冰箱保存备用。(7)蛋白浓度测定:采用BCA法。①配制工作溶液:将BCA试剂、Cu试剂以50∶1体积混合,配制WR工作试剂,室温下呈嫩绿色。②标准蛋白溶液配制:4,000 μg/mL BSA原液用双蒸水进行倍比稀释,即20 μL BSA原液中加入30 μL双蒸水,得到50 μL的1,600μg /mL BSA标准稀释液,从中取25 μL连续倍比稀释,得到1,600、800、400、200、100、50、25μg /mL BSA 标准溶液各25 μL。③蛋白测定:将上述25 μL的BSA标准溶液和每组25 μL蛋白待测品分别与 200 μL WR工作试剂混合,得到225 μL最终反应液。37 ℃温育30 min,测定562 nm OD值。(8)免疫沉淀:根据上述蛋白浓度,吸取部分体积蛋白,用预冷的RIPA裂解液(弱)将蛋白稀释至1 μg/ μL,每管1,000 μL,把混合液转移至1.5 mL EP 管中;再以体积比1∶100加入IGF-1 Receptorβ抗体,做好标记,封口膜封好EP管管口,摇床上缓慢摇晃过夜。准备 Protein G Agarose珠子,于离心机中以14,000 r/min瞬时离心10 s,用RIPA裂解液(弱)洗涤2次,并用裂解液将珠子调成50%的体积浓度,过程中减掉枪头枪尖部分,避免珠子沾壁以及破坏琼脂糖珠;每1 mg蛋白抗体混合液中加入20 μL洗涤后的Protein G 琼脂糖珠悬浮液,4 ℃,摇床上慢摇2 h;14,000 r/min瞬时离心10 s,收集沉淀琼脂糖珠-抗体-蛋白复合物,用预冷的PBS洗3次;加入60 μL的2×Laemmli 上样缓冲液,沸水煮5 min;离心收集上清液,即蛋白样品,-80 ℃冰箱保存备用。(9)Western Blot分析目的蛋白水平:①试剂配置:5% BSA封闭液,SDS-PAGE电泳凝胶。②SDS-PAGE电泳:取细胞蛋白样本与3×Red Loading Buffer 混合,100 ℃煮沸5 min后迅速置冰上;根据所测蛋白样品浓度,计算含40 μg蛋白的溶液体积为上样体积(根据条带清晰度可适当上调或下调上样量,控制在30~50μg);将玻璃板和胶一起放入电泳槽,电泳槽中由内到外倒入足够电泳液,两手分别捏住梳子的两端,竖直向上将其轻轻拔出,用10 μL移液枪吸取蛋白样品或Marker,枪头插至加样孔中,垂直缓慢加入样品,待样品完全沉入加样孔底部后再缓慢撤出移液枪,连接电泳仪和电泳槽,注意正负极打开电源;电泳时,浓缩胶电压设置为60 V,分离胶90 V,时间约2 h,待酚红进入分离胶的底部时,关闭电源。③转膜:在通风柜内,将剪好的PVDF膜(4 cm×7 cm)置于甲醇中浸泡处理10 min,再于转移缓冲液中浸泡10~15 min以去除过多的甲醇;加适量转移缓冲液于操作盘中,并放入转膜夹、海绵垫、玻棒、滤纸和上述的PVDF膜;将转膜夹打开使黑面水平置于最底层,上面依次垫一张海绵垫滤纸,浸泡于转膜液中,用玻棒擀去气泡,轻柔撬开玻璃板后,刮去浓缩胶,剥下分离胶,置于转移缓冲液中浸泡数分钟,分解分离胶中的SDS;将胶盖于滤纸上,与滤纸对齐,用玻棒擀去气泡,使用PVDF 膜盖于胶上并除去气泡,在膜上盖滤纸并除去气泡;最后,盖上另一海绵垫后,合紧夹子,避免膜和胶之间产生气泡,将夹子放入转膜槽中,槽中继续加满转移缓冲液,将转膜槽置于冰块中,250 mA转膜2 h。④免疫反应:转膜后的膜用TBST漂洗2次,然后转移至含有封闭液的封闭盒中;室温下脱色摇床上慢摇2 h;用封闭液稀释一抗,稀释倍数为:β-actin Rabbit mAb(1∶1,000)、p-Akt Antibody(1∶1,000)、Phospho-p-Akt(Ser473)Antibody(1∶1,000)、p44/42、MAPK(p-Erk1/21/2)Antibody(1∶1,000)、Phosphop44/42MAPK(p-Erk1/21/2)(thr202/Tyr204)Antibody(1∶1,000)、IGF-1 Receptor βAntibody(1∶1,000);从封闭液中取出膜,将膜正面朝向管腔卷曲置入15 mL离心管中,与一抗稀释液充分接触,4 ℃层析柜中慢摇过夜;室温条件下用TBST液在脱色摇床上洗3次,10 min/次,去除膜上残留的未结合一抗;同上述方法准备二抗稀释液(稀释倍数为 1∶5,000),二抗与膜充分接触,室温下孵育2 h;室温条件下采用TBST液在脱色摇床上洗3次,10 min/次,将化学发光HRP显影试剂盒中A、B两种试剂在EP 管内等体积混合,现配现用,避光保存;将膜置于凝胶成像系统暗室中,将显影剂滴加在PVDF膜上,启动机器曝光;使用Quantity One软件进行量化分析蛋白表达水平,以β-actin蛋白水平作为等量蛋白上样内部参照标准;目的蛋白磷酸化水平=磷酸化目的蛋白条带灰度值/相应总蛋白条带灰度值×100%。(10)RT-PCR检测:①CDKN1B表达检测:收集细胞(6孔板80%细胞密度),2,000 r/min离心5 min,去上清,细胞沉淀中加入1 mL Trizol,充分混匀后室温静置5 min,然后转移至新的1.5 mL EP 管中;使用Promega M-MLV 试剂盒反转录获得cDNA,引物序列:上游为TAATTGGGGCTCCGGCTAACT,下游为TGCAGGTCGCTTCCTTATTCC,扩增产物为116(bp)。内参照GAPDH上游为TGACTTCAACAGCGACACCCA,下游为CACCCTGTTGCTGTAGCCAAA。退火温度均为55 ℃。同一条件下,每次PCR以GAPDH为内参照,表达丰度以相对NC组样品目的基因的相对表达水平表示。②BCL2L11表达检测:实验步骤同CDKN1B表达检测,引物系列:上游为ATCCCCGCTTTTCATCTTTATG,下游为TCTCCAATACGCCGCAACTCT,扩增产物为243(bp)。以上各实验重复3次。
1.3 统计学方法 采用SPSS 20.0 统计软件。计量资料符合正态分布以(±s)表示,组间比较采用单因素方差分析或LSD 检验。以P<0.05 为差异有统计学意义。
2 结果
2.1 各组IGF1R正常表达PTC-1s细胞药物干预不同时间的活细胞OD值(450 nm)比较 药物干预24 h时,NC-HI组和NC-IG组相较于NC-CON组具有明显的促细胞增殖作用,并且NC-IG组的促细胞增殖作用明显强于NC-HI组,差异有统计学意义(P<0.001)。药物干预至48 h、72 h,与空白对照组相比,NC-HI组和NC-IG组仍能表现出促细胞增殖作用,与NC-CON组比较差异有统计学意义(P<0.05),但NC-HI组与NC-IG组之间的差异无统计学意义(P>0.05)。由此可见,人胰岛素和甘精胰岛素对IGF1R正常表达PTC-1s细胞的促细胞增殖作用呈时间依赖性,且甘精胰岛素作用更强。见表1。
表1 各组IGF1R正常表达PTC-1s细胞药物干预不同时间的活细胞OD值(450 nm)比较(±s)
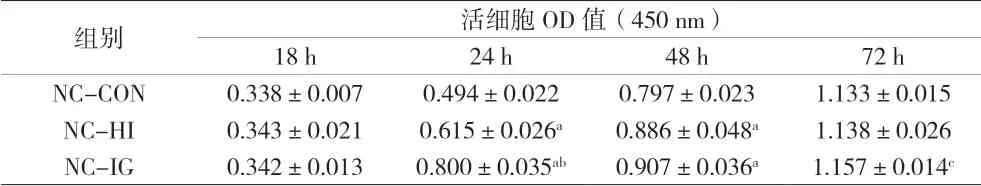
表1 各组IGF1R正常表达PTC-1s细胞药物干预不同时间的活细胞OD值(450 nm)比较(±s)
注:与同时间点NC-CON组比较,cP<0.05,aP<0.001;组间比较,bP<0.001
组别 活细胞OD值(450 nm)18 h 24 h 48 h 72 h NC-CON 0.338±0.007 0.494±0.022 0.797±0.023 1.133±0.015 NC-HI 0.343±0.021 0.615±0.026a 0.886±0.048a 1.138±0.026 NC-IG 0.342±0.013 0.800±0.035ab 0.907±0.036a 1.157±0.014c
2.2 各组IGF1R低表达PTC-1s细胞药物干预不同时间的活细胞OD值(450 nm)比较 药物干预干预18、24、48、72 h,RNAI-HI组和RNAI-IG组的活细胞OD值与RNAI-CON组比较,差异均无统计学意义(P>0.05),见表2。由此可见,人胰岛素和甘精胰岛素均不能促使IGF1R低表达PTC-1s细胞增殖。
表2 各组IGF1R低表达PTC-1s细胞药物干预不同时间的活细胞OD值(450 nm)比较(±s)
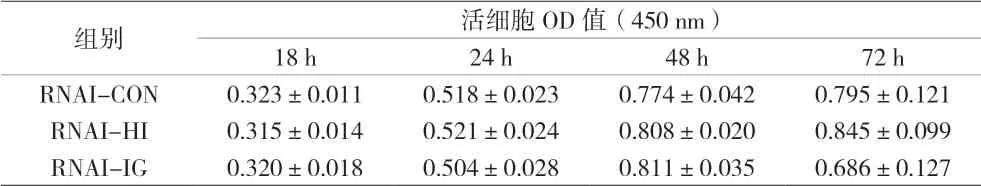
表2 各组IGF1R低表达PTC-1s细胞药物干预不同时间的活细胞OD值(450 nm)比较(±s)
组别 活细胞OD值(450 nm)18 h 24 h 48 h 72 h RNAI-CON 0.323±0.011 0.518±0.023 0.774±0.042 0.795±0.121 RNAI-HI 0.315±0.014 0.521±0.024 0.808±0.020 0.845±0.099 RNAI-IG 0.320±0.018 0.504±0.028 0.811±0.035 0.686±0.127
2.3 各组IGF1R正常表达和低表达PTC-1s细胞药物干预 24 h后的p-Akt水平比较 药物干预 24 h后,NC-HI组和NC-IG组的p-Akt水平都高于NC-CON组,差异有统计学意义(P<0.001)且NC-IG组高于NC-HI组,差异有统计学意义(P<0.05),说明人胰岛素和甘精胰岛素均能明显促使IGF1R正常表达PTC-1s细胞内Akt磷酸化,甘精胰岛素的促Akt磷酸化作用强于人胰岛素。药物干预24 h后,RNAI-HI组和RNAI-IG组的p-Akt水平与RNAI-CON组比较,差异均无统计学意义(P>0.05),说明人胰岛素和甘精胰岛素均不能促使IGF1R低表达PTC-1s细胞内Akt磷酸化。见图1和表3。
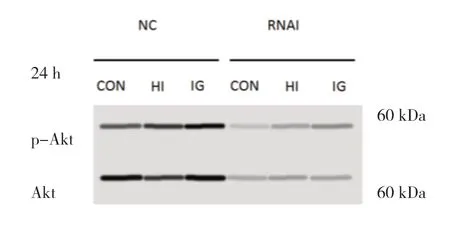
图1 药物干预 24 h后各组IGF1R正常表达和低表达PTC-1s细胞内的Akt磷酸化水平
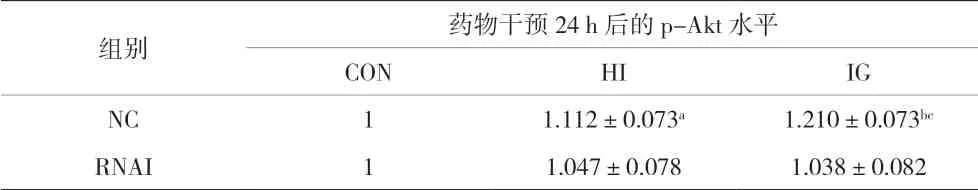
表3 各组IGF1R正常表达和低表达PTC-1s细胞药物干预24 h后的p-Akt水平比较
2.4 各组IGF1R正常表达和低表达PTC-1s细胞药物干预24 h的p-Erk1/2水平比较 药物干预 24 h后,NC-HI组和NC-IG组IGF1R正常表达PTC-1s细胞内的p-Erk1/2水平均高于NC-CON组,差异有统计学意义(P<0.05),且NC-HI组高于NC-IG组,差异有统计学意义(P<0.001),说明人胰岛素和甘精胰岛素均能使IGF1R正常表达细胞内Erk1/2磷酸化,且人胰岛素的促Erk1/2磷酸化作用强于甘精胰岛素。药物干预 24 h后,RNAI-HI组和RNAI-IG组的p-Erk1/2水平与RNAICON组比较,差异均无统计学意义(P>0.05),说明人胰岛素和甘精胰岛素均不能促使IGF1R低表达PTC-1s细胞内Erk1/2磷酸化。见图2和表4。
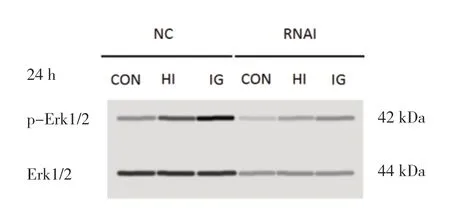
图2 药物干预24 h各组IGF1R正常表达和低表达PTC-1s细胞内的Erk1/2磷酸化水平
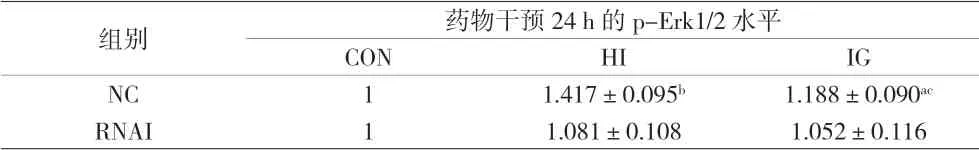
表4 各组IGF1R正常表达和低表达PTC-1s细胞药物干预24 h的p-Erk1/2水平比较
3 讨论
有研究表明,体内高胰岛素水平可能造成糖尿病患者甲状腺结节或者肿瘤的发生率提高[9-11]。多项研究显示,胰岛素有明显的促细胞增殖作用,而且甘精胰岛素可促进多种肿瘤细胞的增殖及转移[12],甘精胰岛素比人胰岛素具有更强的促有丝分裂作用[13]。KURTZHAL等[14]研究发现,在人骨肉瘤细胞中,四种胰岛素类似物和人胰岛素均有促细胞增殖作用,并且甘精胰岛素的促有丝分裂效应是人胰岛素的8倍。本研究分别使用常规人胰岛素和甘精胰岛素注射液体外干预人甲状腺乳头状癌 PTC-1s细胞株,均表现出促甲状腺乳头状癌细胞增殖作用。人胰岛素与甘精胰岛素促细胞增殖作用的差异,在IGF1R正常表达与低表达PTC-1s细胞中的表现不同。在胰岛素干预下,IGF1R正常表达PTC-1s 细胞增殖明显,提示胰岛素通过IGF1R促进细胞增殖,并且甘精胰岛素的促细胞增殖作用明显强于人胰岛素。在IGF1R正常表达PTC-1s 细胞实验中,笔者发现Akt信号通路和Erk信号通路都被人胰岛素和甘精胰岛素激活,并且在Akt磷酸化过程中以甘精胰岛素作用为主,而Erk磷酸化则以人胰岛素作用较为显著,因此两条通路效应可能存在交叉作用,以甘精胰岛素的细胞增殖作用较为显著。IGF1R低表达PTC-1s细胞实验中,Akt信号通路和Erk信号通路均不能被激活,这与IGF1R低表达PTC-1s细胞中IGF1R基因敲减相符合。
综上所述,人胰岛素和甘精胰岛素均能通过激活IGF1R细胞内Akt和Erk信号通路,促进甲状腺乳头状癌细胞增殖。
