槲皮素对胶原诱导性关节炎小鼠Toll样受体4/核因子-κB信号通路的影响
2022-04-29谢延平李艳宝
谢延平,李艳宝
类风湿性关节炎为多种因素引起的机体自身免疫反应而导致的一种自身免疫性疾病,主要表现为滑膜炎、关节腔积液、血管翳形成、炎细胞浸润、骨和软骨组织破坏等。类风湿性关节炎发病机制复杂,免疫反应在其发病中发挥重要作用,Toll样受体(TLRs)可识别内外源性炎性反应分子信号刺激,并将其导入细胞内,导致核因子-κB(NF-κB)等活化,介导多种炎性细胞递质释放,从而引起炎症反应的发生[1-2],因此抑制类风湿性关节炎TLRs/NFκB信号通路可抑制其关节炎症反应,从而发挥对类风湿性关节炎的治疗作用。槲皮素具有免疫调节、抗炎、清除氧自由基、抗氧化、抗凋亡等作用[3],可通过抑制TLRs/NF-κB 信号在多种炎症反应性疾病中发挥作用[4]。本研究自2020 年1—7 月建立胶原诱导性关节炎小鼠模型,观察槲皮素对其关节软骨组织中TLR4/NF-κB 信号通路的影响,探讨槲皮素对类风湿性关节炎的可能作用机制。
1 材料与方法
1.1 实验动物、主要试剂实验动物:无特定病原体(specific pathogen free,SPF)、6~8 周龄、雌雄各半、体质量22~26 g、C57BL/6(H-2b)小鼠50 只,实验小鼠购自河北省实验动物中心,小鼠许可证号:SCVK(冀)2014-0015。实验动物经本院动物伦理委员会审批,受到动物伦理协会监督。主要试剂:槲皮素(纯度>98%)(程度普菲德生物技术有限公司,批号JOT-10049),牛Ⅱ型胶原(批号5032)、完全弗氏佐剂(批号F5949)、不完全弗氏佐剂(批号F5597)、兔抗鼠Toll样受体4(TLR4)多克隆抗体、兔抗鼠肿瘤坏死因子受体相关因子6(TRAF6)多克隆抗体、兔抗鼠髓样分化因子88(MYD88)多克隆抗体、兔抗鼠NF-κB p65 多克隆抗体(美国Sigma 公司),荧光定量聚合酶链反应(PCR)试剂盒、BCA 蛋白定量试剂盒、反转录(RT)试剂盒、(美国Ebioscience公司)等。
1.2 建立动物模型将牛Ⅱ型胶原溶解于0.01 mmol/L 冰醋酸中,制成4 g/L 牛Ⅱ型胶原溶液;将配置的牛Ⅱ型胶原溶液和等体积的完全弗氏佐剂混合,使用匀浆器在冰浴中充分乳化,制成牛Ⅱ型胶原乳剂用于造模;将配置的牛Ⅱ型胶原溶液和等体积的不完全弗氏佐剂混合,在冰浴中充分乳化,用于激发。将50 只C57BL/6 小鼠采用随机数字表法分为对照组(C 组)10 只和模型组40 只。模型组小鼠建立关节炎模型小鼠:第1天,在每只小鼠尾根部多点皮下注射牛Ⅱ型胶原/完全弗氏佐剂混合乳剂150µL,其中含牛Ⅱ型胶原0.3 mg;第10 天,每只小鼠尾根部多点注射牛Ⅱ型胶原/不完全弗氏佐剂混合乳剂50µL,其中含牛Ⅱ型胶原0.1 mg,建立胶原诱导的关节炎小鼠模型。对照组小鼠尾根部注射等量生理盐水。
1.3 分组及处理建模后14 d,对模型组小鼠进行关节炎评分,其中关节炎评分≤4 分者5 只,予以剔除,关节炎评分>4 分者35 只,从中采用随机数字表法取30 只,根据随机数字法分为模型组(M 组)、槲皮素组(Q 组)和甲氨蝶呤组(MTX 组),每组10 只小鼠。将200 mg 槲皮素溶解到5% CMC-Na 溶液40 mL 中制成混悬液,Q 组小鼠给予槲皮素[5]50 mg/kg腹腔注射,每3天1次,共3周;经3 mg浓度50 g/L 甲氨蝶呤溶解到30 mL 生理盐水中制成浓度为0.1 g/L溶液,MTX 组小鼠给予甲氨蝶呤0.5 mg/kg 腹腔注射,每3 天1 次,共3 周。C 组和M 组小鼠腹腔注射等量生理盐水。
1.4 视觉模拟评分法进行关节炎评分治疗结束后进行评分,评分标准[6]:关节无红肿为0 分,趾关节出现红肿为1 分,趾关节和足趾出现肿胀为2 分,踝关节以下出现肿胀为3 分,包括踝关节在内出现肿胀为4分。
1.5 采集标本关节炎评分结束后麻醉处死小鼠,从双侧踝关节以上1 cm 处截断,取双侧踝关节,一侧踝关节用于苏木精-伊红(HE)染色,另一侧踝关节用于蛋白质印迹法(Western blotting)和荧光定量PCR检测。
1.6 HE 染色将小鼠踝关节用多聚甲醛固定,经EDTA 脱钙、乙醇脱水、二甲苯透明、石蜡包埋等制备踝关节石蜡标本,将石蜡标本切除厚5µm 切片,经常规HE 染色,显微镜下观察踝关节病理形态学变化情况。并对踝关节HE 染色图片进行关节病理评分(由2 名高级别病理学专家进行评分):从滑膜炎、血管翳、骨破坏三个方面进行评分,评分标准:滑膜炎:根据幻魔细胞层数分为0~5 分:<3 层滑膜细胞为0 分,3~5 层滑膜细胞为1 分,6~10 层滑膜细胞为2分,10~20层滑膜细胞为3分,20~30层滑膜细胞为4 分,30 层以上滑膜细胞为5 分;血管翳:根据血管翳多少分为0~5 分,0 分为无血管翳生成,5 分为有大量增殖的血管翳形成;骨破坏:无骨侵蚀为0分,小面积骨侵蚀为1 分,清楚的软骨侵蚀为2 分,骨侵蚀波及软骨下骨为3 分,大面积软骨和骨侵蚀为4分,明显软骨和骨骨量丢失为5分。
1.7 Western blotting 测定软骨组织中TLR4、TRAF6、MYD88、NF-κBp65 蛋白水平取出小鼠踝关节软骨,用RIPA 裂解液裂解细胞提取关节软骨总蛋白,BCA 法测定关节软骨组织蛋白浓度,经上样、电泳、转膜,用脱脂牛奶封闭1 h,加入一抗:兔抗鼠TLR4 多克隆抗体、兔抗鼠TRAF6 多克隆抗体、兔抗鼠MYD88 多克隆抗体、兔抗鼠NF-κBp65 多克隆抗体过夜孵育,一抗稀释比例1∶300,以β-actin 为内参照,加入二抗孵育1 h,二抗稀释比例1∶5 000,化学发光剂显影,Image J 软件分析蛋白条带灰度值。TLR4、TRAF6、MYD88、NF-κBp65 蛋白水平以各蛋白条带灰度值/β-actin条带灰度值表示。
1.8 荧光定量RT-PCR 测定软骨组织中TLR4、TRAF6、MYD88、NF-κBp65 mRNA 水平取踝关节软骨组织,采用Trizol 提取踝关节软骨组织总RNA,将RNA 逆转录为cDNA,采用荧光定量RTPCR 测定软骨组织中TLR4、TRAF6、MYD88、NFκBp65 mRNA 水平,反应条件:95 ℃5 min,94 ℃10 s、56 ℃30 s、72 ℃30 s,共40 个循环。以2-ΔΔCt表示软骨组织中TLR4、TRAF6、MYD88、NF-κBp65 mRNA 水平。以GAPDH 为内参。各引物序列见表1。

表1 引物序列
1.9 统计学方法采用SPSS 20.0 统计软件进行统计学分析。计量资料以±s表示,组间比较采用t检验或单因素方差分析,多组间两两比较采用LSD法,P<0.05为差异有统计学意义。
2 结果
2.1 各组小鼠体质量和足掌肿胀厚度比较与C组比较,M组、Q组和MTX组小鼠体质量均有不同程度减轻,M 组小鼠体质量与C 组比较差异有统计学意义(P<0.05),其他各组小鼠之间体质量差异无统计学意义(P>0.05)。与C 组比较,M 组足掌肿胀厚度升高(P<0.05);与M 组比较,Q 组和MTX 组足掌肿胀厚度降低(P<0.05);Q 组足掌肿胀厚度稍高于MTX组,但差异无统计学意义(P>0.05)。见表2。
表2 各组小鼠体质量和足掌肿胀厚度比较/±s
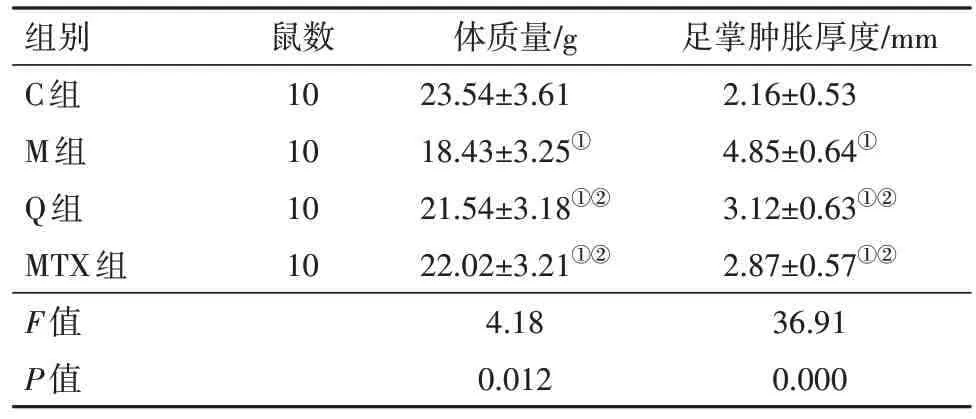
表2 各组小鼠体质量和足掌肿胀厚度比较/±s
注:①与C组比较,P<0.05,②与M组比较,P<0.05。
组别C组M组Q组MTX组F值P值鼠数10 10 10 10体质量/g 23.54±3.61 18.43±3.25①21.54±3.18①②22.02±3.21①②4.18 0.012足掌肿胀厚度/mm 2.16±0.53 4.85±0.64①3.12±0.63①②2.87±0.57①②36.91 0.000
2.2 各组小鼠关节组织病理形态学变化比较各组小鼠关节HE 染色显示:C 组小鼠关节正常,无骨和软骨破坏,无浆细胞和淋巴细胞浸润,滑膜组织排列规则;M组小鼠关节滑膜细胞排列紊乱、层数增多,滑膜组织增生,呈栅栏样或乳头样突起,滑膜组织中有新生血管和血管翳形成,见大量炎细胞浸润,骨和软骨组织破坏;Q 组和MTX 组小鼠关节滑膜增生不明显,炎细胞浸润及骨和软骨组织破坏较轻。
与M 组比较,Q 组和MTX 组病理评分(骨破坏评分、血管翳评分、滑膜炎评分及总分)明显降低(P<0.05);Q 组病理评分(骨破坏评分、血管翳评分、滑膜炎评分及总分)稍高于MTX 组,但差异无统计学意义(P>0.05)。见表3。
表3 各组小鼠关节组织病理评分比较/(分,±s)
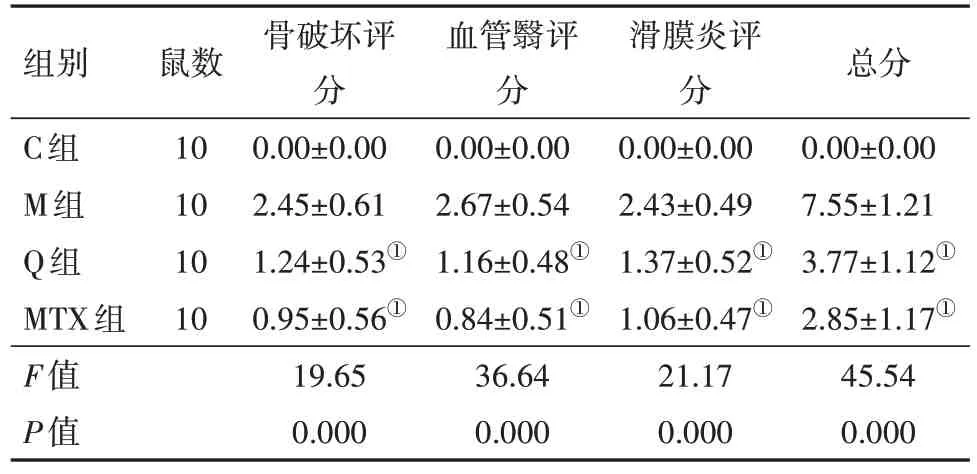
表3 各组小鼠关节组织病理评分比较/(分,±s)
注:①与M组比较,P<0.05。
组别C组M组Q组MTX组F值P值鼠数10 10 10 10骨破坏评分0.00±0.00 2.45±0.61 1.24±0.53①0.95±0.56①19.65 0.000血管翳评分0.00±0.00 2.67±0.54 1.16±0.48①0.84±0.51①36.64 0.000滑膜炎评分0.00±0.00 2.43±0.49 1.37±0.52①1.06±0.47①21.17 0.000总分0.00±0.00 7.55±1.21 3.77±1.12①2.85±1.17①45.54 0.000
2.3 各组小鼠关节炎评分比较 C 组小鼠双侧后足关节正常,无肿胀;M组小鼠双侧后足关节颜色变红、肿胀明显;Q 组和MTX 组小鼠双侧后足关节肿胀明显减轻。关节炎评分Q 组(1.57±0.82)分和MTX 组(1.23±0.85)分与M 组(5.61±1.06)分比较,明显降低(P<0.05);Q 组关节炎评分稍高于MTX 组,但差异无统计学意义(P>0.05)。
2.4 各组小鼠软骨组织中TLR4、TRAF6、MYD88、NF-κBp65 蛋白水平比较与C 组比较,M组软骨组织中TLR4、TRAF6、MYD88、NF-κBp65 蛋白水平升高(P<0.05);与M 组比较,Q 组和MTX 组软骨组织中TLR4、TRAF6、MYD88、NF-κBp65 蛋白水平降低(P<0.05);Q 组和MTX 组软骨组织中TLR4、TRAF6、MYD88、NF-κBp65 蛋白水平差异无统计学意义(P>0.05)。见图1,表4。
表4 各组小鼠软骨组织中TLR4、TRAF6、MYD88、NF-κB p65蛋白水平比较/±s
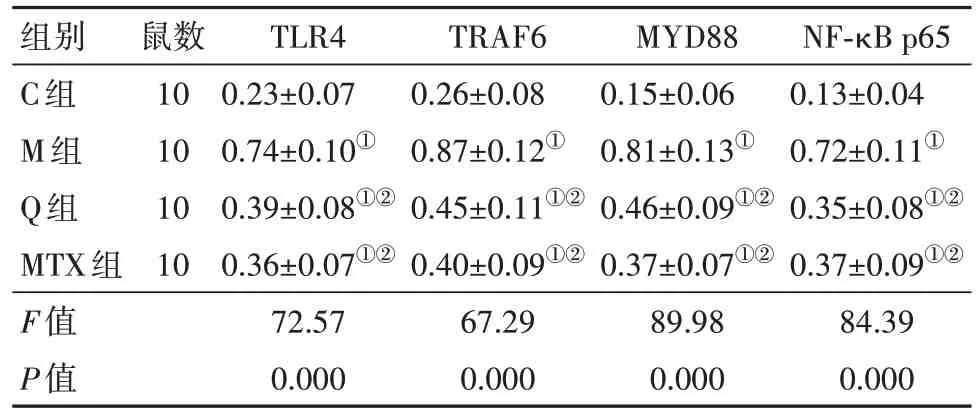
表4 各组小鼠软骨组织中TLR4、TRAF6、MYD88、NF-κB p65蛋白水平比较/±s
注:TLR4 为兔抗鼠Toll 样受体4,TRAF6 为兔抗鼠肿瘤坏死因子受体相关因子6,MYD88为兔抗鼠髓样分化因子88,NF-κB p65为核因子-κB p65。①与C组比较,P<0.05。②与M组比较,P<0.05。
组别C组M组Q组MTX组F值P值鼠数10 10 10 10 TLR4 0.23±0.07 0.74±0.10①0.39±0.08①②0.36±0.07①②72.57 0.000 TRAF6 0.26±0.08 0.87±0.12①0.45±0.11①②0.40±0.09①②67.29 0.000 MYD88 0.15±0.06 0.81±0.13①0.46±0.09①②0.37±0.07①②89.98 0.000 NF-κB p65 0.13±0.04 0.72±0.11①0.35±0.08①②0.37±0.09①②84.39 0.000

图1 蛋白质印迹法测定各组软骨组织中TLR4、TRAF6、MYD88、NF-κBp65蛋白水平
2.5 各组软骨组织中TLR4、TRAF6、MYD88、NFκBp65 mRNA 水平比较与C 组比较,M 组软骨组织中TLR4、TRAF6、MYD88、NF-κBp655 mRNA 水平升高(P<0.05);与M组比较,Q组和MTX组软骨组织中TLR4、TRAF6、MYD88、NF-κBp655 mRNA 水平降低(P<0.05);Q 组和MTX 组软骨组织中TLR4、TRAF6、MYD88、NF-κBp655 mRNA 水平差异无统计学意义(P>0.05)。见表5。
表5 各组软骨组织中TLR4、TRAF6、MYD88、NF-κB p655mRNA水平比较/±s
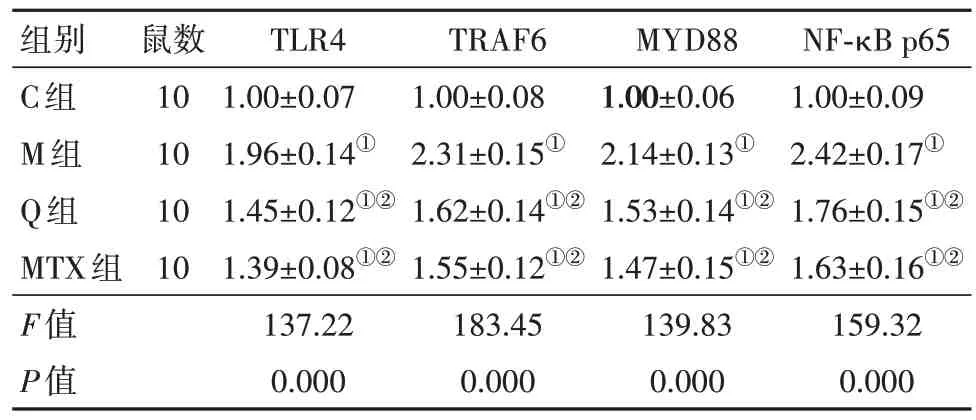
表5 各组软骨组织中TLR4、TRAF6、MYD88、NF-κB p655mRNA水平比较/±s
注:TLR4 为兔抗鼠Toll 样受体4,TRAF6 为兔抗鼠肿瘤坏死因子受体相关因子6,MYD88为兔抗鼠髓样分化因子88,NF-κB p65为核因子-κB p65。①与C组比较,P<0.05。②与M组比较,P<0.05。
组别C组M组Q组MTX组F值P值鼠数10 10 10 10 TLR4 1.00±0.07 1.96±0.14①1.45±0.12①②1.39±0.08①②137.22 0.000 TRAF6 1.00±0.08 2.31±0.15①1.62±0.14①②1.55±0.12①②183.45 0.000 MYD88 1.00±0.06 2.14±0.13①1.53±0.14①②1.47±0.15①②139.83 0.000 NF-κB p65 1.00±0.09 2.42±0.17①1.76±0.15①②1.63±0.16①②159.32 0.000
3 讨论
研究发现TLRs 信号通路在类风湿性关节炎的发病中具有重要作用[7],类风湿性关节炎TLR4/NF-κB信号通路激活,参与关节炎的炎症反应过程[8]。胶原诱导性关节炎模型为常用的类风湿性关节炎模型,本文通过建立胶原诱导性关节炎小鼠模型,研究发现胶原诱导性关节炎小鼠足掌肿胀明显,关节炎评分和关节病理评分升高,TLR4、TRAF6、MYD88、NF-κBp65 蛋白和mRNA 水平升高。TLRs在免疫系统中可识别外源性病原相关分子以及内源性分子导致的炎症分宜、组织损伤,并将病原相关分子的刺激信号通过跨膜结构导入细胞内,活化NF-κB 等转录因子,产生复杂的级联信号反应;NFκB 的活化可介导白细胞介素-1、肿瘤坏死因子ɑ 等炎性介质的表达,引起炎症介质的合成及释放,炎症介质进一步活化淋巴细胞,趋化激活中性粒细胞,启动免疫反应;MYD88为TLR4反向信号转导通路,为TLR4 信号通路中的关键分子,可传递正向信息;TLR4 通过MYD88 激活各种炎性因子[9]。TRAF6 可与MYD88 结合,产生一连串级联反应,并通过激活I-κB 激酶复合体在应激、炎症反应中发挥重要作用[10]。NF-κB 为炎症反应的核心调控因子,由2类亚基形成的二聚体,常见的形式为p65/p50或p65/p65;正常情况下,正反馈和负反馈精细调节NF-κB 的活化,使其活化处于适当水平;未活化的NF-κB分布在细胞质中,可被趋化因子、生长因子及炎症因子等激活,激活的NF-κB 通过信号通路导致异质性蛋白I-κB 磷酸化,并进一步降解,时I-κB 和NF-κB解离,NF-κB移位到细胞核内,与DNA相应靶基因位点结合,启动前炎症介质及炎症相关酶类的转录程序,引起大量炎症细胞浸润到炎症部位,加重炎症反应的发生[11-12]。因此本研究结果表明胶原诱导性关节炎小鼠关节炎的发生与TLR4/NF-κB 信号通路关系密切,TLR4/NF-κB信号通路激活在胶原诱导性关节炎的发生中发挥重要作用。
槲皮素在植物的花、叶和果实中广泛存在,为饮食中主要的生物类黄酮类化合物,具有抗炎、免疫调节、抗氧化等作用[13-14]。对类风湿性关节炎、骨性关节炎等具有良好的缓解作用[15-17]。槲皮素可通过抑制TLR4/NF-κB 信号通路发挥生物学活性[18],如槲皮素通过抑制TLR4/NF-κB 信号通路缓解脂多糖诱导的肾损伤[19];通过TLR4/NF-κB 信号通路缓解重症急性胰腺炎相关性肺损伤[20]。介于TLR4/NF-κB信号通路在类风湿性关节炎的发病中发挥重要作用,槲皮素可通过TLR4/NF-κB 信号通路发挥生物学作用,因此推测槲皮素可能通过TLR4/NF-κB信号通路抑制类风湿性关节炎的炎症反应,本文对其研究,发现胶原诱导性关节炎小鼠给予槲皮素处理可降低足掌肿胀厚度,降低病理评分和关节炎评分,降低软骨组织中TLR4、TRAF6、MYD88、NFκBp65蛋白和mRNA 水平。因此本研究结果表明槲皮素可能通过抑制TLR4/NF-κB 信号通路抑制胶原诱导性关节炎小鼠的炎症反应,从而对其发挥保护作用。
综上所述,槲皮素可能通过抑制TLR4/NF-κB信号通路抑制类风湿性关节炎的炎症反应,从而发挥对类风湿性关节炎的保护作用。
