三种镰孢菌对不同苜蓿品种致病性的比较研究
2022-04-25刘东霞宋连昭杨志敏刘贵河
刘东霞, 杨 莉, 宋连昭, 杨志敏, 王 芳, 刘贵河*
(1. 河北北方学院, 河北 张家口 075000; 2. 张家口市草原监理站, 河北 张家口 075000; 3. 河北省张家口市农业科学院, 河北 张家口075000)
苜蓿(Medicagosativa)是广泛栽培的多年生豆科优质牧草,素有“牧草之王”的美誉,其不仅含有丰富营养物质,而且抗逆性强,可以改良土壤特性,具有良好的生态效益、经济效益和社会效益[1]。随着苜蓿种植面积的增加和种植年限的延长,苜蓿根腐病已成为致使苜蓿植株衰落和产量下降的首要病害。20世纪70~80年代,加拿大阿尔伯塔的平河地区和不列颠哥伦比亚省苜蓿种植区根腐病发病严重,其中受害面积达68%[2]。1991和2003年,美国内华达州和犹他州出现苜蓿根腐病。2009—2010年,美国的威斯康星州和明尼苏达州发现苜蓿根腐病,其中7个种植区受害严重[3-4]。我国自1991年首次报道根腐病以来,先后在新疆、黑龙江、甘肃、内蒙古等地陆续有报道[5-8]。据在新疆苜蓿根腐病的调查,根腐病可造成苜蓿死亡率高达60.08%~73.45%,已经成为限制新疆苜蓿生产的主要因素[5]。1999年,黑龙江省8个地市的紫花苜蓿种植区普遍发生根腐病,严重地块发病率高达92%[6]。近几年甘肃草业异军突起,苜蓿已成为主导产业,苜蓿根腐病发病日趋严重。甘肃定西2003年5月份根腐病发病率高达43%[7]。2013年鄂尔多斯苜蓿越冬死亡率和苜蓿根腐病发生严重,给当地苜蓿生产造成严重损失[8]。根腐病对紫花苜蓿生长的各个时期均可造成严重危害,主要导致根的中柱腐烂,根颈和根中部变空,根系分枝数减少,侧根大量腐烂死亡,使其固氮能力降低,寿命和利用年限明显缩短[9-10]。据研究报道,可引起该病的病原已有30种,其中镰孢菌15种,其他病原真菌12种,细菌2种,线虫1种[4,6,7]。我国幅员辽阔,不同地区气候和环境条件差异较大,致使各地区病原菌种类多样[11]。2001年陈雅君等对黑龙江省紫花苜蓿根腐病进行了调查和研究,确定了引发苜蓿根腐病的优势致病菌为镰孢菌和丝核菌[6,12]。甘肃省引起苜蓿根腐病的病原主要是茄镰孢(F.solani)、串珠镰孢(F.moniliforme)、尖孢镰孢(F.oxysporum)、锐顶镰孢(F.acuminatum)和半裸镰孢(F.semitectum)[7,13]。在甘肃武威市首次报道了厚垣镰孢菌(F.chlamydosporum)可引起苜蓿根腐病[4]。内蒙古赤峰市引起苜蓿根腐病的主要病原为拟枝孢镰孢菌(F.sporotrichioide)[14],临河的优势致病菌为三线镰孢菌(F.tritinctum)和茄镰孢菌(F.solani)[15]。通过对河北廊坊及山西阳高县根腐病调查和病原的分子检测,发现河北廊坊根腐病优势致病菌为三线镰孢菌(F.tritinctum),山西阳高县采样区的优势致病菌为茄镰孢菌(F.solani)和层出镰孢菌(F.proliferatum)。其中,首次报道层出镰孢菌是可引起苜蓿根腐病的病原菌[15]。魏然等对北疆苜蓿根腐病病原进行分子检测,发现立枯丝核菌(Rhizoctoniasolani)、木贼镰孢菌(F.equiseti)、锐顶镰孢菌(F.acuminatum)、茄镰孢菌(F.solani)和尖孢镰孢菌(F.oxysporum)在病株样品中普遍存在,是北疆地区苜蓿根腐病的主要致病菌[16]。引起苜蓿根腐病的病原菌则以镰孢菌为主(Fusariumspp.),其中尖镰孢(Fusariumoxysporum)、茄镰孢(F.solani)和燕麦镰孢(F.avenaceum)等被认为是侵染根部的真菌中的优势菌种[12-16]。本研究采用菌液接种和菌饼接种两种感染方式探究茄镰孢(F.solani)、尖孢镰孢(F.oxysporum)和木贼镰孢(F.equiseti)3种镰孢菌对苜蓿的致病性,并分析病原菌的病原特征及侵染过程,旨在为综合防治苜蓿根腐病提供理论依据。
1 材料与方法
1.1 试验材料
本研究所用的BF1(F.equiseti)、BF28(F.oxysporum)、BF36-2(F.solani)3个菌株由中国农业大学植物保护学院提供,所有菌株分离自2016年在河北省张家口农科院试验基地采集的苜蓿根腐病样品,采用常规组织分离法进行病原分离和纯化,利用基于DGS(引物CNL12/CNS1)的分子生物学方法进行鉴定[17],菌株来源见表1。苜蓿品选择河北坝下广泛种植的品种金黄后(秋眠级2~3)、阿尔冈金(秋眠级2)、WL343(秋眠级4)及南方广泛种植的WL525(秋眠级8)苜蓿品种。
1.2 试验地点
苜蓿根腐病病菌侵染试验在河北北方学院组培室进行。
1.3 试验方法
1.3.1供试镰孢菌的生物学特性研究 为了使菌株接种量和所用菌丝菌龄保持一致,本研究正式进行之前将3个供试菌株接种于PDA平板(培养皿直径为9 cm)上,在25℃光照培养箱中培养10 d后备用[18]。
将3个供试菌株分别重新接种于新的PDA平板上,观测并比较不同菌株菌落的形态、生长情况以及产孢量。利用直径为6 mm的无菌打孔器取菌落边缘长势均匀的菌饼,接种于PDA平板中央,每处理重复3次,放于25℃光照培养箱中培养,培养5 d后,利用十字交叉法测定菌落的直径,并观察菌丝的颜色和形态。培养10 d后,每个培养基平板中加入10 mL无菌水,用无菌毛笔刷轻轻刷擦菌丝,使孢子充分混入无菌水中,再用移液枪从中吸取5 mL注入100 mL容量瓶中,用无菌水定容。将孢子悬浮液滴在血球计数板(25格×16格)上,利用普通光学显微镜观察测定各个培养基平板中菌株的产孢量,重复3次,取其平均值即为产孢量,每个菌株设置3个重复[18]。产孢量的计算公式如下:

(1)
1.3.2镰孢菌菌液接种致病性观测 试验为紫花苜蓿品种和病菌种类两个因素,紫花苜蓿品种分别为金皇后、阿尔岗金、WL525、WL343。菌种分别为BF1(F.equiseti)、BF28(F.oxysporum)、BF36-2(F.solani)。将供试菌种接种到经过灭菌消毒处理的固体PDA培养基中,放入25℃光照培养箱进行培养。
分别从4个供试苜蓿品种中选取籽粒饱满的健康种子,将种子于无菌水中浸泡24 h,用75%的乙醇浸泡30 s,再用0.1%的HgCl处理10 min[19]。然后接种于MS培养基中,每瓶接种20粒苜蓿种子,每个品种接种20瓶,将接种好的组培瓶放入25℃,光照14 h/黑暗10 h的光照培养箱中,培养20 d,待长出完整的叶片和根系后进行病原接种侵染试验。
利用1 cm的无菌打孔器从BF1、BF28、BF36-2三种菌落边缘打取长势均匀的菌饼置于无菌培养皿中,然后用移液枪移入5 mL PDB(马铃薯葡萄糖水)液体培养基,用毛笔将表面的孢子及菌丝体刷至液体培养基中,使其充分落入液体培养基中,再将液体培养基菌液分别接种到金皇后、阿尔冈金、WL525、WL343苜蓿无菌苗组培瓶中,共12个处理,每个处理重复3次。对苜蓿组培苗的感病情况进行观察记录。
1.3.3菌饼接种致病性观测 菌种及苜蓿组培苗的培养同菌液接种方法。利用1 cm的无菌打孔器从BF1、BF28、BF36三种菌落边缘打取长势均匀的菌饼倒置于无菌金属网盘中央,再将金属网盘分别置于金皇后、阿尔冈金、WL525、WL343苜蓿无菌苗组培瓶的顶部。共12个处理,每个处理重复3次。观察并记录苜蓿组培苗的感病情况。幼苗感病率的计算公式如下:

(2)
从接种菌饼的处理中取出不同感染程度的苜蓿,用刀片从感病苜蓿叶片、根部或根颈部切取材料制成临时玻片放于普通光学显微镜下观察苜蓿组织感染状况及病原特征。
1.4 数据处理方法
试验记录的数据用SPSS软件进行方差分析,比较不同水平之间的差异,多重比较采用LSD法。
2 结果与分析
2.1 供试镰孢菌菌落直径及产孢量比较
供试镰孢菌的菌落直径及产孢量统计结果见表2。结果表明,尖孢镰孢菌株BF28的菌落直径较大,达到5.45 cm。茄镰孢菌株BF36-2和木贼镰孢菌株BF1菌落直径较小,分别为4.68 cm和4.67 cm,三个菌种在菌落直径上差异不显著。尖孢镰孢BF28与茄镰孢BF36-2在PDA培养基上都能产生镰刀状孢子,其中,BF28产孢量最多,BF36-2次之,BF1产生的孢子量较少。3种镰孢菌产孢量存在显著差异(P<0.05)。

表2 三种镰孢菌菌落直径与产孢量统计
2.2 三种镰孢菌的菌落形态特征观察
不同菌种外部形态、颜色等存在较大差异(图1)。BF28菌落表面气生菌丝稀疏,无色呈羊毛状,质地均匀,表面有明显的轮状,边缘较整齐,颜色与中心颜色不一致,较透明,菌落为规则的圆形。BF36-2菌落正面气生菌丝为白色或乳白色呈致密的毡状,表面粗糙干燥,有明显的白色轮状,边缘粗糙淡黄色,与中心颜色不一致,不透明,菌落为规则圆形。BF1菌落正面菌丝繁茂呈致密的丝柔状,粉色,菌落厚,边缘粗糙,与中心颜色不一致,有部分呈淡粉色近白色,不透明,菌落近圆形。
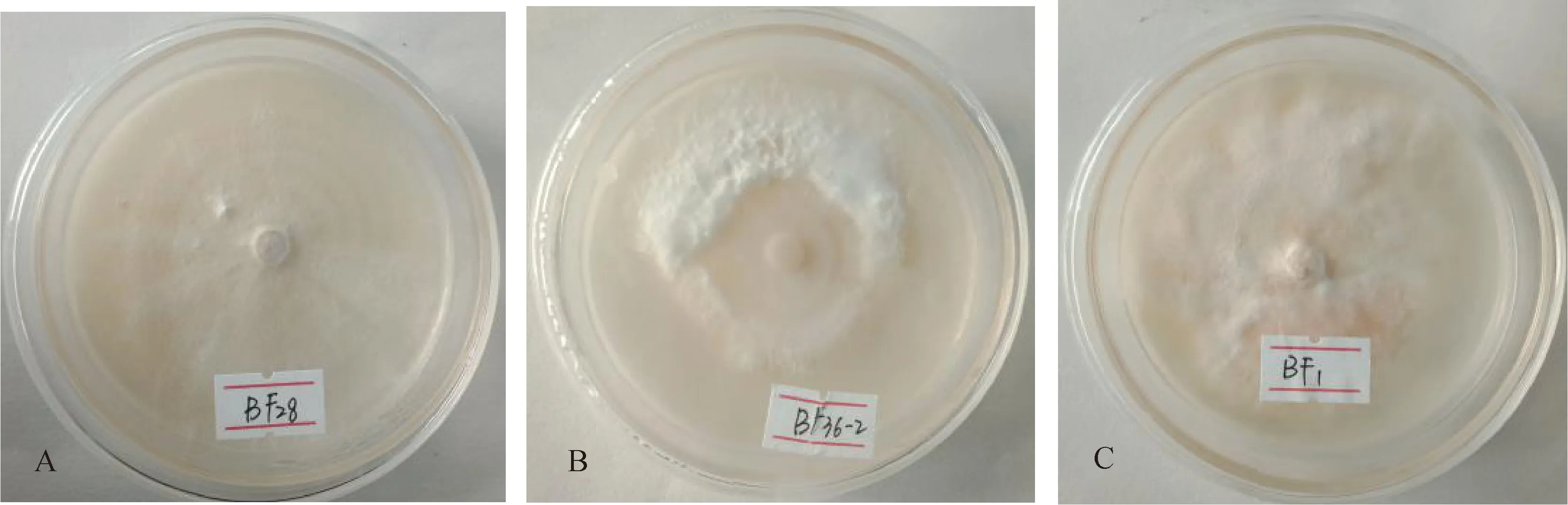
图1 3种菌株的菌落形态特征图
2.3 菌液接种的苜蓿组培苗感病率
苜蓿组培苗菌液接种后感病较快,接种3 d后,各个处理的培养基上均出现明显菌丝,BF1菌丝体分布不均匀,菌丝聚集于根系附近(图2A),而BF28和BF36-2菌丝均匀分布在培养基上。苜蓿植株也开始出现感病症状,根系褐化。有相关研究表明,当病原菌的生长环境适宜时,距离寄主根部很近或与根部直接接触的镰孢菌病原分生孢子受到根冠细胞分泌的碳或氮等营养物质的刺激,开始萌发形成芽管或菌丝[20]。

图2 菌液接种后感病苜蓿症状
接种5 d后BF28和BF36-2处理病原菌菌丝布满整个培养基(图2D和图2E),BF1菌丝除了在苜蓿根系处密集分布外,菌丝也遍布整个培养基(图2B和图2C),苜蓿根系表现出明显的感病症状,地上部症状不明显。接种一周后,所有处理菌丝体密布培养基表面,形成较厚的毛毡层,苜蓿植株体表现出明显的感病症状,叶片失绿,黄化,萎蔫,根系严重褐化,植株倒伏。接种11 d后所有处理的植株全部倒伏,腐烂,植株被菌丝包埋(图2F、图2G、图2H)。苜蓿各品种之间未见显著差异(P>0.05)。
2.4 菌饼接种的苜蓿组培苗感病率
苜蓿单株感病特征见图3。从图3A与图3B的外部形态观察到感病苜蓿植株出现根颈缢缩、腐烂、主根皮层变色腐烂,分枝减少,病部呈褐色或红褐色等症状,而地上部分在发病初期并未表现明显的感病症状,后期地上部则出现生长不良,植株矮小,细弱,叶片由外向内逐渐变黄,茎干萎蔫,之后整株倒伏,最终枯死。

图3 病株根腐病症状
苜蓿组培苗接种菌饼后,菌丝体垂直向下生长。14 d以后,接种BF28各个处理的培养基上均出现明显菌丝团,被菌丝包围的植株感病症状明显,根颈褐化腐烂,叶片出现黄色病斑,植株倒伏(图4A)。BF36接种的WL343苜蓿品种培养基上出现菌丝团(图4B),而其他三个苜蓿品种未出现菌丝体。BF36接种的WL525苜蓿品种虽然培养基上未出现菌丝体,但苜蓿植株表现出明显的感病症状,主要表现为苜蓿根颈部及植株基部茎节严重褐化,上部叶片失绿黄化(图4C)。BF1各处理未出现菌丝团,苜蓿感病症状不明显。接种1个月后,接种BF1的各处理培养基上未出现菌丝团,苜蓿植株开始出现感病症状,根颈部褐化甚至腐烂,叶片也出现黄色病斑。

图4 菌饼接种后感病苜蓿症状图
接种BF28及BF36的处理于接种14 d统计其感病植株,计算感病率;接种BF1的处理于接种30天后统计其感病植株,并计算感病率,统计结果见图5。结果表明,供试的三种菌株的感病率存在显著性差异(P<0.05)。其中,菌株BF28对苜蓿侵染致病最为严重,各苜蓿品种感染率均在70%以上;菌株BF36-2对苜蓿的侵染致病程度仅次于BF28菌株,感染率在50%~70%之间;菌株BF1的侵染致病程度较前两种小,感染率在40%以下。菌种的致病性与菌落直径及其产孢能力有关,产孢量大的菌种,菌落直径也较大,繁殖能力强,致病性也较强。

图5 菌饼接种方式下三种镰孢菌株对苜蓿的感染率
2.5 苜蓿感病部位解剖结构观察
为进一步了解病菌的侵染过程,对感病植株的叶片和根部进行了组织切片观察。侵染初期,苜蓿病叶组织周围存在大量厚垣孢子,大孢子分生出小孢子,附着在叶片组织表面,通过伤口或气孔侵入,并沿着细胞间隙不断向深层组织蔓延,厚垣孢子受到叶肉细胞的挤压,形成了许多不规则厚垣孢子(图6A,图6B)。或者小孢子萌发形成菌丝或芽管,伸入叶肉组织,并向叶肉组织释放细胞壁溶解物,致使叶肉细胞分解,形成溃烂病斑(图6C)。
侵染中后期,厚垣孢子快速分生,形成大量厚垣孢子,集聚于叶肉组织中(图6D),并萌发形成大量菌丝(图6E),菌丝在叶肉组织中形成纵横交错的网络结构,叶肉细胞叶绿体受损,叶片失绿,在叶片组织中积累了大量的黄褐色病原菌代谢物,致使叶片褐化腐烂(图6F)。

图6 病叶组织切片
从图7A至图7F的苜蓿根系组织切片中可以看出,发病初期镰孢菌的厚垣孢子或菌丝体侵入苜蓿根颈部的表皮组织,致使苜蓿根颈表皮组织产生褐色坏死斑。随着时间的推移,厚垣孢子或菌丝体不断分生并向组织内部入侵至根的中柱层,导致根部中柱腐烂变为深褐色,根颈和根中部变空。随着菌丝的快速繁殖,根部布满菌丝,使得根系表层出现白色霉菌层。病原侵入根部致使维管束内的导管与筛管组织被破坏,使根系失去吸收水分与营养物质的能力,不能为植株地上部分提供生长所需水分与营养,根颈变色溢缩,植株出现生长不良,矮小等症状。失去水分的茎干则渐渐变软萎蔫,叶片逐渐黄化,严重者则出现整株倒伏,枯死现象。

图7 病株根部组织切片
3 讨论
不同苜蓿品种对镰刀菌的抗性不同,主要与苜蓿的秋眠等级、抗寒性及根系特点有关。丁守彦[21]和李敏权[22]分别对不同苜蓿品种抗病性进行鉴定,得出苜蓿品种间抗病性差异显著,筛选出德里兰德、新疆大叶、苜蓿王、草原2号、阿尔冈金、图牧2号和甘农2号等抗性较强的品种。Michand在加拿大魁北克省用适合于当地的14个紫花苜蓿品种进行的抗镰孢菌根腐病研究,结果显示,所有品种都感染了根腐病,品种间抗病性差异显著,抗寒品种根腐烂程度要比中等抗寒品种轻[23]。邓蓉对不同来源的19个苜蓿品种的抗病性研究,也得出相似结论,苜蓿对根腐病的抗性与苜蓿的秋眠特性有关,秋眠数高的品种抗病性强,秋眠数低的品种易感染根腐病[24]。而本研究中,不同秋眠级苜蓿品种间抗病性差异不显著。陈雅君等认为选育根系生长迅速、侧根发达、能有效地制造和贮存糖类及其他养分、忍耐逆境能力强的紫花苜蓿品种可有效地减轻和控制根腐病的发生[12]。本研究的四个苜蓿品种在根系类型上存在较大差异,四个苜蓿品种在致病力方面未发现显著差异,可能是由于侵染阶段处于幼苗阶段,根系之间的差异还没有表现出来。另外,选择的品种较少,代表性不够,不同品种对镰孢菌的抗性还有待进一步研究。
有关镰孢菌入侵过程研究较少,目前研究认为,病菌能够成功侵染寄主植物最关键的是寄主与病原物的信号识别。病菌入侵阶段,根系分泌物为根际微生物提供所需的能源,影响病原菌的定植和生长,从而导致根际微生物的数量和种群结构发生变化[25]。杨瑞秀的研究表明,甜瓜根系分泌物中酚酸物质对尖孢镰孢菌菌丝生长和孢子萌发有不同程度的促进作用,丁香酸、阿魏酸、肉桂酸、苯甲酸与尖孢镰孢菌的协同作用比较明显[25]。根系分泌物还对不同镰孢菌有选择性,相关研究表明,番茄根系分泌物能促进茄镰孢分生孢子的萌发[26],而对尖镰孢的生长几乎没有选择性[27]。本研究也得出类似的结论,苜蓿根系分泌物对木贼镰孢BF1具有亲和性,侵染初期菌丝在苜蓿根系附近聚集。而苜蓿分泌物对尖孢镰孢和茄镰孢不具有亲和性,根系附近没有菌丝的聚集,而是均匀的分布在整个培养上。Herman等利用GFP基因标记甜瓜尖镰孢,发现接种1~2 d病原菌在甜瓜根毛聚集,其认为根系分泌的碳氮营养有关,在距离根系较近的分生孢子受到根根冠细胞分泌的碳、氮营养的刺激,开始萌发产生大量的芽管和菌丝[28]。根系分泌物对病原菌的选择和促进作用使得病原菌首先在根系中定植和生长。在本研究中,菌饼接种于组培瓶顶部,菌丝先接触到苜蓿叶片,但苜蓿出现感病症状则是从苜蓿根颈部开始,而且根部症状更为明显,这可能也与苜蓿根系分泌物对镰孢菌有选择亲和性有关。孙惠芳等研究了茄镰孢菌对铁皮石斛的致病性,结果表明茄镰孢对石斛根部的致病性比叶部更为严重,症状更为明显,与本研究的结果一致[29]。
在不同栽培基质及接菌方式下,镰孢菌的侵染速度和引起发病程度不同。Charest等通过原位显微技术研究水培条件下番茄尖镰孢菌侵染寄主的过程,发现接种1 d后菌丝就能侵入根部,侵染速度比土培条件下快,在土壤中孢子需要时间感受到根生长的信号,然后萌发,再到根表面,而水培的菌丝或孢子直接接触根表面[30]。在本研究中,在不同的接菌方式下,以菌液方式接种的无菌苗处理3天便出现了感病症状,5 d菌丝布满培养基表面,接种11 d所有接种的无菌苗处理全部倒伏,腐烂;而以菌饼方式接种的无菌苗14 d时才出现感病症状。分析其原因,可能是菌液方式下的湿度要明显大于菌饼中的湿度,环境湿度越大越有利于菌丝的生长,根颈表面会迅速产生白色霉层;菌饼置于培养瓶的瓶口距植物培养基有一定距离,孢子及菌丝需要经过一定时间的生长、繁殖才能掉落到底部培养基上,进而感知根系信号的诱导而萌发。病原菌侵染苜蓿试验常采用米粒法、浸根法、注射法等接菌方法,大都模拟了土壤环境。本研究菌饼接种采用金属网架法,则模拟了大气环境条件下镰孢菌的入侵过程。
寄主植物与病原菌之间相互作用体系较为复杂,关于镰孢菌侵染过程的研究主要集中在细胞壁降解酶和寄主植物防御酶上[31-33]。一方面,病原菌要突破细胞壁进入植物体,首先需要分泌细胞壁降解酶,通过酶解植物多糖来破坏和分解细胞壁,以提供病原菌自身营养并促进其对寄主组织的侵入和扩展[31]。目前,已研究发现的细胞壁降解酶十余种。主要包括羧甲基纤维素酶、多聚半乳糖醛酸酶、果胶甲基半乳糖醛酸酶和β-葡萄糖苷酶。不同的镰孢菌之间,在同一培养条件下,产生的同种细胞壁降解酶活性差异很大,其中强致病菌株接骨木镰孢和燕麦镰孢菌在植物体内培养条件下,细胞降解酶的活性较高,而弱致病菌株拟枝镰孢菌和拟丝孢镰孢菌产生的细胞壁降解酶活性较低[34]。在本研究中通过解剖构造观察,发现木贼镰孢BF1通过菌丝或厚垣孢子在根、叶部细胞间隙中扩展,而寄主植物细胞较为完整,组织机体的损伤较小。而受尖孢镰孢BF28侵染的叶片组织则出现了较为严重的细胞壁解离,组织溃烂。这可能与致病菌株产生的细胞壁降解酶的种类和活性有关。曹丽霞的研究也表明,不同的镰孢菌对苜蓿的致病性存在较大差异,茄镰孢和尖孢镰孢致病性较强[35]。另一方面,植物受病原菌或毒素侵染后,为抵抗病原菌的侵入和危害,体内自发产生应激防御机制,并伴随着一些列生理生化变化,如体内防御酶的变化。防御酶通常被作为对真菌和细菌病害的防御作用的抗性指标。马静芳等报道,苜蓿根腐病抗性强的品种丙氨酸解氨酶的活性高于感病品种,可用该酶的活性指标来测定品种的抗病性[36]。病原菌侵入寄主植物后,毒素可以降低植物体内防御酶的活性,导致活性氧过量积累,从而对寄主细胞造成破坏[37]。不同病原菌对植物组织破坏解离程度不同,可能与病原菌对植物体内防御酶活性的改变有关。
有些病原菌在致病过程中会分泌一些毒性物质,而这些有毒物质会通过改变细胞间的营养、细胞膜的透性而使得细胞的代谢紊乱、活力降低、液泡破裂,最终导致细胞死亡,植物表现出萎蔫、坏死和病斑。已报道的镰孢菌毒素有多种,主要包括单端孢霉烯族化合物、玉米赤霉烯酮、丁烯酸内酯、串珠镰刀菌素、伏马菌素等[31,38-40]。台莲梅等用2个浓度的尖镰孢菌粗毒素处理大豆胚根,结果表明,毒素处理后,胚根细胞质壁分离;质膜、线粒体膜、核膜、液泡膜局部断裂;细胞壁变形、断裂、有的细胞解体[41]。毒素滤液对苜蓿种子萌发和胚根生长具有明显抑制作用,并对苜蓿幼苗具有很强的致萎性[32,42]。关于镰孢菌产生的毒素类型、致毒力以及其与侵染过程中寄主组织受损程度之间的相关关系还有待进一步研究。
4 结论
尖孢镰孢和茄镰孢菌丝生长快,菌落直径大,产孢量大,致病性强。菌液接种苜蓿组培苗感病快,菌饼接种方式感病较慢。根颈部感病快,感病程度严重。病原菌从根或根颈部入侵,根部组织腐烂坏死,进而叶片腐烂,倒伏,最终整株死亡。不同菌种侵染途径及与根系的互作机制不同,木贼镰孢BF1菌丝在根系附近聚集;而尖孢镰孢BF28及茄镰孢BF36-2则菌丝在培养基上均匀分布。菌种与根系的互作机理还有待进一步研究。
