竹节香附素A通过PI3K/Akt/mTOR信号通路对人宫颈癌HeLa细胞增殖和凋亡的影响
2022-04-23张娟李雪蒋浩黄晓萍
张娟 李雪 蒋浩 黄晓萍

【摘要】目的 观察竹节香附素A(RDA)对人宫颈癌HeLa细胞增殖和凋亡的影响,并探讨其作用机制。方法 分别使用0、5、10、20及40μmol/L的RDA干预HeLa细胞48 h,CCK-8实验测定细胞增殖率,计算半抑制浓度(IC50),确定药物浓度。流式细胞术检测细胞凋亡,蛋白免疫印迹法检测细胞中B细胞淋巴瘤2家族蛋白(Bcl-2)、Bcl-2相关x蛋白(Bax)、活化胱天蛋白酶-3(Cleaved-caspase-3)、磷酸化磷脂酰肌醇3激酶(p-PI3K)、磷酸化蛋白激酶B(p-Akt)、磷酸化哺乳动物雷帕霉素靶蛋白(p-mTOR)的蛋白表达水平。将HeLa细胞分为4组,即空白对照组、胰岛素样生长因子-1(IGF-1)组、RDA组和联合用药组,檢测及比较各组细胞增殖率、凋亡率和p-PI3K、p-Akt和p-mTOR蛋白相对表达量。结果 随着RDA浓度的增加,HeLa细胞的增殖率降低、凋亡率升高(P均< 0.05),Bax、Cleaved-caspase-3蛋白相对表达量升高(P均< 0.05),Bcl-2、p-PI3K、p-Akt、p-mTOR蛋白相对表达量降低(P均< 0.05);IGF-1激活PI3K/Akt/mTOR信号通路后,RDA仍然能抑制HeLa细胞增殖(P均< 0.05),降低p-PI3K、p-Akt、p-mTOR蛋白相对表达量(P均< 0.05)。结论 RDA可能通过抑制PI3K/Akt/mTOR信号通路对人宫颈癌HeLa细胞产生抑制增殖与促进凋亡的效果。
【关键词】竹节香附素A;HeLa细胞;宫颈癌;细胞凋亡;PI3K/Akt/mTOR信号通路
【Abstract】Objective To investigate the effect of Raddeanin A (RDA) on the proliferation and apoptosis of cervical cancer HeLa cells and to explore the possible mechanism. Methods HeLa cells were cultured in vitro and treated with RDA at a concentration of 0, 5, 10, 20, and 40 μmol/L for 48 h. Cell proliferation rate was determined by CCK-8. The half-maximal inhibitory concentration (IC50) was calculated to determine the drug concentration. Flow cytometry was used to detect cell apoptosis, and western blot was employed to detect the expression levels of Bcl-2, Bax, Cleaved-caspase-3, p-PI3K, p-Akt, and p-mTOR proteins. Hela cells were divided into four groups: control group, IGF-1 group, RDA group and combined treatment group. The proliferation rate, apoptosis rate, relative expression levels of p-PI3K, p-Akt and p-mTOR proteins were detected and compared among different groups. Results The proliferation rate of HeLa cells was significantly declined, whereas the apoptosis rate was significantly elevated with the increasing concentration of RDA (both P < 0.05), the relative expression levels of Bax and Cleaved-caspase-3 proteins were significantly up-regulated (both P < 0.05), whereas those of Bcl-2, p-PI3K, p-Akt and p-mTOR proteins were significantly down-regulated (all P < 0.05). After the activation of PI3K/Akt/mTOR signaling pathway by IGF-1, RDA could still inhibit the proliferation of HeLa cells and down-regulate the relative expression levels of p-PI3K, p-Akt and p-mTOR proteins (all P < 0.05). Conclusion RDA can inhibit the proliferation and promote the apoptosis of cervical cancer HeLa cells by suppressing the PI3K/Akt/mTOR signaling pathway.
【Key words】Raddeanin A; HeLa cell; Cervical cancer; Apoptosis; PI3K/Akt/mTOR signaling pathway
宫颈癌在全球女性常见恶性肿瘤中居第四位,在发展中国家常见恶性肿瘤中居第二位[1]。当前的治疗策略包括手术切除、化学治疗和放射治疗,但疗效均有限[2]。如何预防与治疗宫颈癌是全球医学工作者们共同关注的课题。竹节香附素A(RDA)是从常用的传统中草药海葵中提取的一种活跃三萜皂苷,通过抑制肿瘤细胞增殖和血管生成产生抗肿瘤活性,同时能诱导多种肿瘤细胞凋亡,如大肠癌细胞、胃癌细胞和肝癌细胞[3]。磷脂酰肌醇3激酶/蛋白激酶B/ 哺乳动物雷帕霉素靶蛋白(PI3K/Akt/mTOR)信号通路是一条常见的细胞信号通路,由于mTOR能调节细胞代谢活动,因此被作为抑制肿瘤细胞生长的靶点。有研究者发现,RDA可能通过激活p38MAPK通路和抑制mTOR活化诱导胃癌细胞凋亡[4]。RDA在宫颈癌中未有相关报道。因此,本研究探究RDA对人宫颈癌HeLa细胞增殖和凋亡的影响,并初步探讨其可能的作用机制。
材料与方法
一、主要材料
人宫颈癌HeLa细胞,购自中国科学院典型培养物保藏委员会细胞库。RDA,纯度≥98%,购自上海源叶生物科技有限公司,批号20190203;胰岛素样生长因子-1(IGF-1),纯度≥98%,货号PHG0078,购自美国Gibco公司。
二、主要试剂和仪器
高糖DMEM培养基、胎牛血清,均购自美国Gibco公司;B细胞淋巴瘤2家族蛋白(Bcl-2)抗体、β-actin抗体、Bcl-2相关X蛋白(Bax)抗体、活化胱天蛋白酶-3(Cleaved-caspase-3)抗体、mTOR抗体、PI3K抗体、Akt抗体、羊抗兔二抗均购自艾博抗(上海)贸易有限公司。
BA400Digital数码三目摄像显微镜为麦克奥迪实业集团有限公司产品,Image-Pro Plus 6.0圖像分析软件为美国Media Cybernetics公司产品,SpectraMAX Plus384酶标仪为美谷分子仪器有限公司产品,Cytoflex流式细胞仪为美国贝克曼库尔特公司产品。
三、方 法
1.细胞培养
将已经冻存HeLa细胞株快速在37 ℃下解冻后,加入适量高糖DMEM完全培养基(10%胎牛血清+0.5%青链霉素双抗),调整细胞密度为1×106/mL,在37 ℃、5%CO2的培养箱中连续培养72 h,中途更换完全培养基2~3次,然后进行传代备用。
2.实验分组
浓度筛选试验:将细胞分成5组(0、5、10、20和40 μmol/L),药物干预48 h。机制检测试验:将细胞分为空白对照组、IGF-1组(100 ng/L)、RDA组(20 μmol/L)与联合用药组(IGF-1 100 ng/L+RDA 20 μmol/L),各组药物均干预48 h。
3. CCK-8法检测细胞增殖率
待HeLa细胞培养至生长对数期,加入胰蛋白酶进行消化,使用完全培养基制成单细胞悬液,将细胞密度调整为5×104/L,每孔取100 μL细胞悬液加入到96孔细胞培养板中,每孔加入100 μL完全培养基,置于37 ℃、5%CO2的培养箱中培养24 h。待细胞完全生长贴壁后弃去培养基,使用磷酸盐缓冲液清洗2次。将RDA溶于完全培养基,调整终浓度为0、5、10、20和40 μmol/L,每孔加入200 μL含RDA培养基,置于37 ℃、5%CO2的培养箱中培养48 h。药物干预48 h后,每孔加入10 μL CCK-8溶液,继续在培养箱培养2 h,然后使用酶标仪测定在450 nm波长下的吸光度值(A),以0 μmol/L浓度的吸光度为对照值,根据公式计算培养48 h的细胞增殖率,并计算半抑制浓度(IC50),每组3个复孔,结果取平均值。
细胞增殖率(%)=×100%
4.流式细胞术检测细胞凋亡
将处于生长对数期的HeLa细胞用完全培养基制成1×106/mL的细胞悬液,每孔取1 mL细胞悬液加入6孔板中,37 ℃、5%CO2条件下培养24 h使细胞生长贴壁,分别按照前述步骤分组培养HeLa细胞48 h,使用流式细胞仪检测细胞凋亡情况。每组3个复孔,凋亡结果取平均值。
5.蛋白免疫印迹法检测各蛋白表达水平
分别按照前述步骤分组培养HeLa细胞48 h,然后收集细胞行蛋白免疫印迹法检测细胞中Bcl-2、Bax、Cleaved-caspase-3、磷酸化-PI3K(p-PI3K)、p-Akt、p-mTOR蛋白的表达量,并计算蛋白相对表达量。每组3个复孔,蛋白表达结果取平均值。
四、统计学处理
使用SPSS 25.0分析数据。统计数据使用 表示,多组间均数比较采用单因素方差分析,多重比较采用Dunnett-t检验;析因设计资料组间比较采用析因设计方差分析,交互效应有统计学意义时采用LSD-t检验分析单独效应,P < 0.05表示差异具有统计学意义。
结果
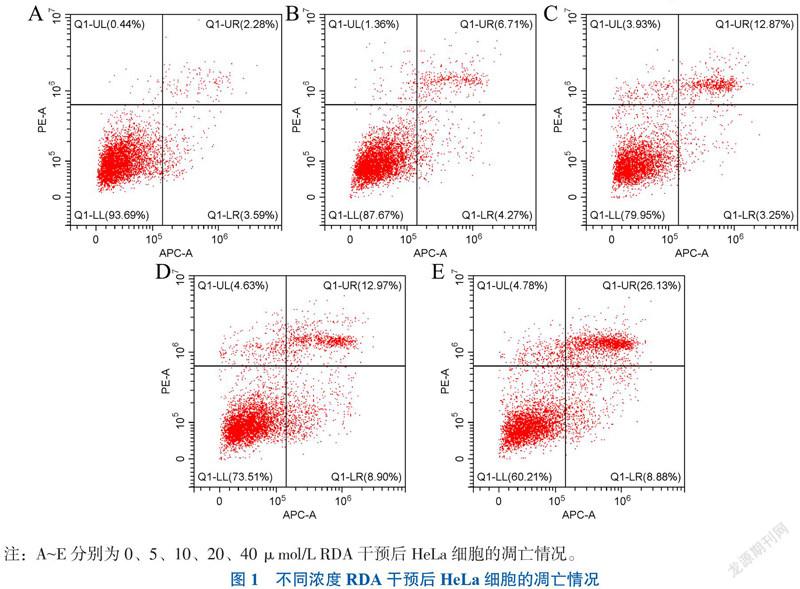
一、不同浓度RDA对HeLa细胞凋亡的影响
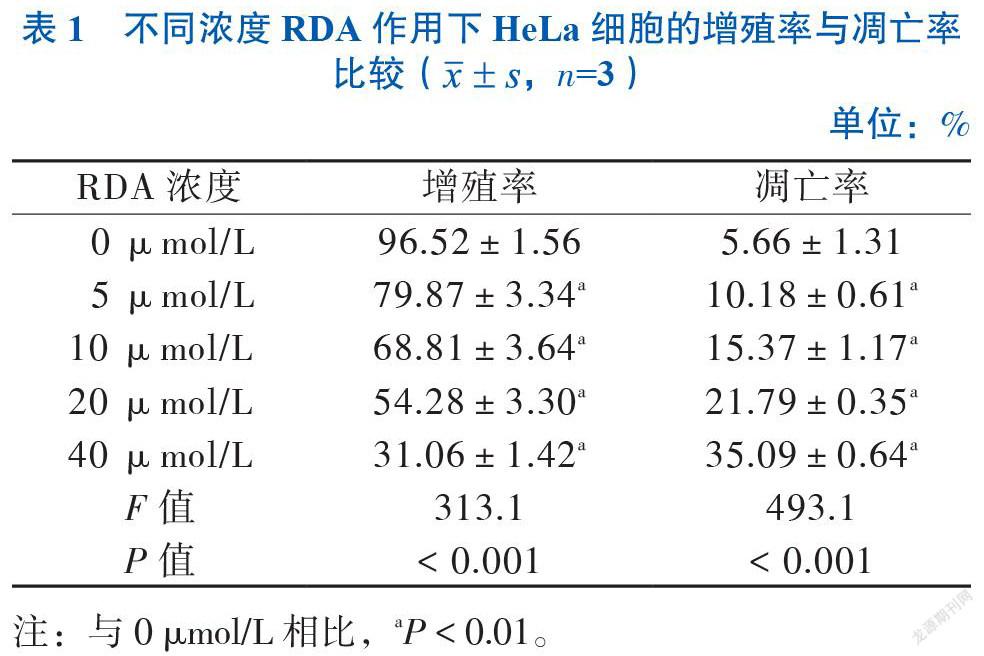
CCK-8结果显示,与0 μmol/L组相比,5 μmol/L 浓度以上RDA对HeLa细胞有抑制作用(P < 0.05),抑制程度与RDA浓度呈正相关,IC50为20.90 μmol/L;细胞凋亡结果显示,5 μmol/L浓度以上RDA对HeLa有促进凋亡的作用(P < 0.05),凋亡程度与RDA浓度呈正相关,见图1、表1。
二、不同浓度RDA对HeLa细胞凋亡相关蛋白的影响
蛋白免疫印迹检测显示,与0 μmol/L组相比,20、40 μmol/L组中Bax和Cleaved-caspase-3的表达量均升高,Bcl-2的表达降低(P均< 0.05),0、5 μmol/L RDA对HeLa中Bcl-2、Bax、Cleaved-caspase-3凋亡蛋白表达无明显影响,10 μmol/L RDA对Cleaved-caspase-3蛋白表达无明显影响(P均> 0.05),见图2、表2。
三、RDA对HeLa细胞PI3K/Akt/mTOR信号通路的影响
蛋白免疫印迹检测显示,与0 μmol/L组相比,10、20和40 μmol/L组3种蛋白磷酸化表达量均降低(P均< 0.05)。5 μmol/L组3种蛋白磷酸化表达量有降低趋势,但p-Akt和p-mTOR与0 μmol/L组比较差异无统计学意义(P均> 0.05),见图2、表3。综合前述结果,采用40 μmol/L的RDA进行后续实验。
四、激活PI3K/Akt/mTOR通路后RDA对HeLa细胞的影响
检测与析因分析结果显示,IGF-1和RDA对细胞增殖率与凋亡率的主效应均有统计学意义,两者的交互作用对细胞增殖率(F = 11.028,P = 0.006)与凋亡率(F = 48.494,P < 0.001)有影响;估算边际平均值后发现RDA对细胞增殖率与凋亡率影响明显,见表4。
与空白对照组相比,IGF-1组细胞增殖率与凋亡率无明显变化(P > 0.05),RDA组与联合用药组细胞的增殖率下降,凋亡率上升(P < 0.05);与IGF-1组相比,RDA组与联合用药组细胞的增殖率下降,凋亡率上升(P < 0.05),RDA组抑制Hela细胞增殖与促进凋亡的效果比联合用药组更明显(P < 0.05),见表5、图3。
五、激活PI3K/Akt/mTOR信号通路后RDA对HeLa细胞中该信号通路蛋白表达的影响
析因分析结果显示,IGF-1和RDA对p-PI3K(F = 72.804,P < 0.001;F = 23.819,P = 0.001)、 p-Akt(F = 36.510,P < 0.001;F = 5.317,P < 0.001)、p-mTOR(F = 45.504,P < 0.001;F = 11.982,P = 0.009)的主效应均有统计学意义,两者的交互效应对p-PI3K、p-Akt、p-mTOR无影响(F = 0.272,P = 0.616;F = 1.291,P = 0.289;F = 0.013,P = 0.912),估算平均边际值后发现RDA对p-PI3K、p-Akt、p-mTOR影响明显,见表6。故主要解析各因素的主效应作用,其中IGF-1与RDA对HeLa细胞的PI3K/Akt/mTOR信号通路影响均有统计学意义,IGF-1对PI3K/Akt/mTOR信号通路为激活效应,而RDA对PI3K/Akt/mTOR信号通路表现抑制效应,见表7、图4。
讨论
研究表明,RDA可在体外抑制多种肿瘤细胞的生长,如肝癌、乳腺癌、胃癌及卵巢癌等,说明RDA有着强大的抗肿瘤活性[5]。由此推测RDA对宫颈癌可能有一定的抗癌作用。本研究采用人宫颈癌HeLa细胞进行体外试验,从细胞凋亡率和PI3K/Akt/mTOR信号通路等方面探讨RDA对人宫颈癌细胞的抑制作用。研究结果显示,5~40 μmol/L的RDA对HeLa细胞均有抑制作用,且抑制效果与RDA浓度呈正相关,初步显示RDA对HeLa细胞具有明显的抑制效果。
Caspase是一组在细胞凋亡过程起关键作用的酶,而Bcl家族在抑制Bcl-2或促进Bax导致细胞死亡的途径中也起着关键作用[6-7]。本研究显示,5~40 μmol/L的RDA能对HeLa细胞产生促凋亡作用,且作用随RDA浓度的升高而增强,同时,20~40 μmol/L的RDA能使HeLa細胞中的Bcl-2蛋白表达降低,Bax和Cleaved-caspase-3蛋白表达升高,这说明RDA不仅对HeLa细胞既有抑制增殖作用,也有促进凋亡作用。
PI3K/Akt/mTOR信号通路广泛存在于多种细胞信号转导通路中,是目前恶性肿瘤研究的热点之一[8]。该通路在肿瘤细胞的能量代谢、细胞增殖、侵袭能力、细胞凋亡和细胞周期等生理活动中发挥重要作用[9-10]。PI3K/Akt/mTOR信号通路在许多人类恶性肿瘤(包括宫颈癌)中异常激活[11]。p-Akt和p-mTOR蛋白在50%~53%的宫颈腺癌中均有表达,说明这2种蛋白磷酸化过表达可能是导致宫颈癌的原因之一[12-13]。本研究显示,使用RDA干预HeLa细胞后,p-PI3K、p-Akt和p-mTOR这3种蛋白的相对表达量均降低,且抑制作用随RDA浓度的升高而增强。由此说明,RDA能通过抑制PI3K/AKT/mTOR信号通路,降低HeLa细胞增殖率。
IGF-1通过活化Akt激活下游信号通路,是胞外信号调节激酶1/2(ERK1/2)和PI3K/Akt通路的强效刺激因子[14-15]。有研究者发现,IGF-1促进多种肿瘤细胞的有丝分裂、转移和抗凋亡,有助于肿瘤细胞的维持和促进肿瘤的进展[16]。因此本研究探讨在PI3K/Akt/mTOR信号通路激活的环境下,RDA是否能发挥同样的抗癌效果。结果显示,IGF-1和RDA存在交互作用,RDA的单独效应随IGF-1变化,说明RDA可能对IGF-1诱导细胞增殖与抑制细胞凋亡的效果有抑制作用。与IGF-1组相比,联合用药组能明显降低细胞增殖率且提高细胞凋亡率,但效果不如单用RDA,说明在IGF-1的干预下,RDA仍然能发挥抑制肿瘤细胞生存的效果。进一步研究发现,IGF-1和RDA的交互作用并没有对p-PI3K、p-Akt和p-mTOR蛋白相对表达量产生影响,说明IGF-1此时的作用只是单纯的PI3K/Akt/mTOR信号通路激动剂,并未对RDA产生直接影响。与空白对照组相比,IGF-1组的p-PI3K、p-Akt和p-mTOR蛋白相对表达量升高,说明IGF-1激活了HeLa细胞中的PI3K/Akt/mTOR信号通路。而RDA能降低IGF-1干预后p-PI3K、p-Akt和p-mTOR蛋白相对表达量,说明无论PI3K/Akt/mTOR信号通路是处于正常状态还是异常激活状态,RDA都能抑制HeLa细胞中PI3K/Akt/mTOR信号通路中PI3K、Akt和mTOR蛋白的磷酸化,从而诱导HeLa细胞死亡,阻止肿瘤细胞的增殖。
综上所述,RDA能对人宫颈癌HeLa细胞产生抑制增殖与促进凋亡的作用,其作用机制是通过抑制PI3K/Akt/mTOR信号通路,降低p-PI3K、 p-Akt和p-mTOR蛋白的表达,产生抗癌的效果。
参 考 文 献
[1] Bray F, Ferlay J, Soerjomataram I, et al. Global cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA Cancer J Clin, 2018, 68(6):394-424.
[2] Wang L, Liu Y, Zhou Y, et al. Zoledronic acid inhibits the growth of cancer stem cell derived from cervical cancer cell by attenuating their stemness phenotype and inducing apoptosis and cell cycle arrest through the Erk1/2 and Akt pathways. J Exp Clin Cancer Res, 2019, 38(1): 93.
[3] Wang Z, Shen J, Sun W, et al. Antitumor activity of Raddeanin A is mediated by Jun amino-terminal kinase activation and signal transducer and activator of transcription 3 inhibition in human osteosarcoma. Cancer Sci, 2019, 110(5): 1746-1759.
[4] Teng Y H, Li J P, Liu S L,et al. Autophagy protects from raddeanin A-induced apoptosis in SGC-7901 human gastric cancer cells. Evid Based Complement Alternat Med, 2016, 2016: 9406758.
[5] Meng C, Teng Y, Jiang X. Raddeanin A induces apoptosis and cycle arrest in human HCT116 cells through PI3K/AKT pathway regulation in vitro and in vivo. Evid Based Complement Alternat Med, 2019, 2019: 7457105.
[6] Xue G, Zou X, Zhou J Y, et al. Raddeanin A induces human gastric cancer cells apoptosis and inhibits their invasion in vitro. Biochem Biophys Res Commun, 2013, 439(2): 196-202.
[7] 邱杰洪, 张昌林, 李田. 间充质干细胞条件培养基对HPV18型阳性人子宫颈癌HeLa细胞凋亡的影响. 新医学, 2021, 52(4): 278-282.
[8] 陈凤霞. 宫颈癌病情进展过程中PI3K/AKT/mTOR信号通路的变化及靶基因的探究. 海南医学院学报, 2018, 24(19): 1757-1761.
[9] Sechler M, Cizmic A D, Avasarala S, et al. Non-small-cell lung cancer: molecular targeted therapy and personalized medicine-
drug resistance, mechanisms, and strategies. Pharmgenomics Pers Med, 2013, 6: 25-36.
[10] Asati V, Mahapatra D K, Bharti S K. PI3K/Akt/mTOR and Ras/Raf/MEK/ERK signaling pathways inhibitors as anticancer agents: structural and pharmacological perspectives. Eur J Med Chem, 2016, 109: 314-341.
[11] Dong P, Hao F, Dai S, et al. Combination therapy Eve and Pac to induce apoptosis in cervical cancer cells by targeting PI3K/AKT/mTOR pathways. J Recept Signal Transduct Res, 2018, 38(1): 83-88.
[12] Gao Y, Ma C, Feng X, et al. BF12, a novel benzofuran, exhibits antitumor activity by inhibiting microtubules and the PI3K/Akt/mTOR signaling pathway in human cervical cancer cells. Chem Biodivers, 2020, 17(3): e1900622.
[13] 張艳, 刘耀基, 侯桂琴, 等. mTOR通路增强宫颈癌紫杉醇耐药细胞株HeLa/PTX对紫杉醇的敏感性. 沈阳药科大学学报, 2019, 36(3): 254-260.
[14] Renna M, Bento C F, Fleming A, et al. IGF-1 receptor antagonism inhibits autophagy. Hum Mol Genet, 2013, 22(22): 4528-4544.
[15] Tang W, Feng X, Zhang S, et al. Caveolin-1 confers resistance of hepatoma cells to anoikis by activating IGF-1 pathway. Cell Physiol Biochem, 2015, 36(3): 1223-1236.
[16] Teng J A, Wu S G, Chen J X, et al. The activation of ERK1/2 and JNK MAPK signaling by insulin/IGF-1 is responsible for the development of colon cancer with type 2 diabetes mellitus. PLoS One, 2016, 11(2): e0149822.
(收稿日期:2021-05-10)
(本文编辑:林燕薇)
