氧化锆多孔表面显微形貌对成骨细胞增殖及分化的影响
2022-04-14马全诠葛兮源孙玉春谢秋菲
王 铮,丁 茜,2△,高 远,马全诠,张 磊△,葛兮源,孙玉春,4,谢秋菲
(1.北京大学口腔医学院·口腔医院修复科,国家口腔医学中心,国家口腔疾病临床医学研究中心,口腔数字化医疗技术和材料国家工程实验室,口腔数字医学北京市重点实验室,国家卫生健康委员会口腔医学计算机应用工程技术研究中心,国家药品监督管理局口腔生物材料重点实验室,北京 100081; 2. 佛山(华南)新材料研究院,广东佛山 528000; 3. 北京大学口腔医学院·口腔医院中心实验室,北京 100081; 4. 北京大学口腔医学院·口腔医院口腔医学数字化研究中心,北京 100081)
氧化锆陶瓷材料因其具有良好的美学效果、生物相容性及化学稳定性,在口腔医学中得到了广泛的应用[1-2],且与相同表面粗糙度的纯钛相比,氧化锆表面菌斑附着较少[3-4],是一种有一定前景的钛种植体替代品,但是,目前的主流观点为,氧化锆种植体失败率显著高于钛种植体,表面粗糙的氧化锆种植体早期骨结合速度和骨结合强度也低于钛种植体,表面显微形貌是主导因素[5-7]。大颗粒喷砂加酸蚀是钛种植体表面处理的主流技术之一,能形成由多级孔隙构成的网状粗糙结构;而氧化锆表面经喷砂酸蚀处理,形成的粗糙结构相对表浅,未形成多孔结构[8]。既往研究表明,多孔结构表面可从生物学和生物力学两方面促进种植体的骨结合,维持骨结合的长期稳定性[9-10],因此,构建表层多孔结构有望进一步提升氧化锆种植体的骨结合性能。
多孔氧化锆陶瓷的现有制备技术以添加造孔剂、涂层为主。在氧化锆坯体中加入造孔剂,通过升华、化学浸出或烧结等方式将其去除,可形成具有不规则孔隙的多孔陶瓷,该方法会改变氧化锆的内部结构,可能降低氧化锆的弯曲强度[11- 12]。通过表面浸涂[13-14]、熔融溅射[15]等技术可在氧化锆表面形成多孔涂层,从而不影响氧化锆的内部结构。孔隙率、孔径、孔的分布及几何形状等微观结构特征是影响多孔陶瓷生物学效应的重要因素[16-18],但以上多孔陶瓷制备方法均无法有效控制孔隙参数。
3D打印是一种高度可定制的技术,通过逐层累加材料将三维数据实体化,能够高精度制造复杂形状的陶瓷生坯,为现有的多孔陶瓷制备问题提供了一种解决思路[18],其中光固化成型(stereolithography, SLA)技术适用于各种光固化树脂基的非金属材料,成形精度较高,能够较好地实现表层孔隙结构可控的多孔氧化锆试件的加工,且在表面制作工艺上更为简便,试件加工完成后无需再进行表面粗化处理[18-20],然而采用3D打印技术获得多孔表面氧化锆及其生物学效应的相关研究尚为少见。
本研究拟采用造孔工艺和SLA 3D打印两种不同的加工方式在氧化锆陶瓷表面形成多孔结构,探讨氧化锆多孔表面显微形貌对小鼠胚胎成骨细胞前体细胞MC3T3-E1细胞增殖和分化的影响,为优化氧化锆种植体表面提供参考。
1 资料与方法
1.1 实验材料和仪器
1.1.1主要材料及试剂 切削用氧化锆材料(锆持DU RZIR)购自中新棠国业科技有限公司,3D打印氧化锆材料购自中国博力迈三维打印公司,小鼠胚胎成骨细胞前体细胞 MC3T3-E1细胞(产品编号:339285)购自北京北纳创联生物技术研究院,磷酸盐缓冲液、达尔伯克氏改良伊格尔培养基(Dulbecco’s modified Eagle medium, DMEM)培养基、胎牛血清、青链霉素购自美国Gibco公司,0.25%(质量分数)胰蛋白酶购自美国Hyclone公司,反转录试剂盒购自日本TAKARA公司,实时荧光定量试剂盒购自美国Roche公司,细胞增殖-毒性检测试剂盒(cell counting kit-8, CCK-8)购自日本Dojindo公司,RNA提取剂Trizol、地塞米松、维生素C、β-甘油磷酸钠购自美国Sigma公司。
1.1.2主要仪器和软件 氧化锆烧结炉购自德国WIELAND公司,烧结炉(KSL-1700X)购自中国科晶公司,SLA陶瓷打印机(CSL-100)由中国博力迈三维打印公司提供,Keyence 3D 激光显微形貌测量显微镜(VK-X100)购自日本基恩士公司,扫描电镜(scanning electron microscope, SEM, Merlin)购自德国Zeiss公司,接触角测量仪购自德国Dataphysics公司,能量色散X射线仪(D/max 2500)购自日本 Rigaku公司,酶联免疫检测仪购自美国Bio-Rad Laboratories公司,实时荧光定量聚合酶链式反应仪(real-time quantitative polymerase chain reaction,Q-PCR,GeneAmp PCR System 2400型)购自美国ThermoFisher公司,Solidworks 软件购自美国SolidWorks公司,切削软件(ZENOTEC MINI)购自德国WIELAND公司,Materialise Magics 21.0软件购自比利时Materialise公司,SPSS 26.0软件购自美国芝加哥IBM公司。
1.2 氧化锆材料
切削组氧化锆材料组成成分为:氧化锆(ZrO2+HfO2+Y2O3)≥99%,其中氧化钇(Y2O3)约占5.15%。3D打印组氧化锆浆料由氧化锆材料及光敏树脂预混液混合而成。
1.3 氧化锆圆盘试件的制备及分组
根据加工方式及表面结构将氧化锆圆盘试件分为以下4组:(1)切削终烧结组(milled sintering group, M-Ctrl): 在Solidworks软件中设计直径15 mm、厚度2 mm的圆盘试件STL格式,导入切削软件,使用切削组氧化锆材料切削加工获得初氧化锆圆盘,用7 000目砂纸抛光后放入烧结炉,10 ℃/min升温至300 ℃并保持5 min,10 ℃/min升温至900 ℃,3 ℃/min升温至1 300 ℃,4 ℃/min升温至1 507 ℃并保持120 min,后自然降温。(2)切削多孔组(milled porous group, M-Porous):使用干压成型工艺在切削组氧化锆材料中添加直径为300 μm的聚甲基丙烯酸甲酯(polymethyl methacrylate,PMMA)造孔剂,添加量为粉体干重3%(质量分数),切削成型的试件放入烧结炉中,升温条件同M-Ctrl组,最终升温至1 520 ℃并保持120 min,后自然降温。(3)3D打印终烧结组(3D printed sintering group, 3D-Ctrl):应用与M-Ctrl组相同的圆盘试件STL格式,在Materialise Magics 21.0软件中排序得到SLC文件,使用3D打印氧化锆浆料通过SLA陶瓷打印机打印获得氧化锆试件素坯,清洗试件、真空干燥机干燥24 h后放入烧结炉,升温至850 ℃保持60 min去除有机物,升温至1 200 ℃保持60 min,升至1 500 ℃保温120 min,最后3 ℃/min降至室温。(4)3D打印多孔组(3D printed porous group, 3D-Porous):应用Solidworks软件在试件表面设计400 μm孔隙直径、50%孔隙率、互相连通的多孔结构,生成具有多孔表面的圆盘试件STL格式,使用3D打印氧化锆浆料通过SLA陶瓷打印机获得多孔表面氧化锆试件素坯,将其置于超声震荡机内以异丙醇为溶剂震荡10 s,然后利用空气压缩机吹出多孔内残留浆料,清洗干净后放入真空干燥机干燥24 h后烧结,烧结条件同3D-Ctrl组。所有圆盘试件(图1)直径为15 mm,厚度为2 mm。所有试件依次用丙酮、无水乙醇、去离子水各超声清洗30 min,高温(121.3 ℃)、高压(104.43 kPa)灭菌消毒。

M-Ctrl, milled sintering group; M-Porous, milled porous group; 3D-Ctrl, 3D printed sintering group; 3D-Porous, 3D printed porous group.图1 氧化锆试件Figure 1 Zirconia disks
1.4 表面显微形貌分析
各组试件运用3D 激光显微形貌测量显微镜测量多孔试件表面的孔隙尺寸,包括孔隙直径、孔深度及孔间距,计算两种终烧结组表面及两种多孔组孔间平整部位的粗糙度Ra值,即轮廓算术平均偏差。选取表面无明显加工缺陷的、不重复的10个区域进行激光扫描并计算,取平均值作为该试件的孔隙尺寸参数及表面粗糙度参数值。
每组取2个试件用SEM观察表面显微形貌,明确氧化锆试件的表面微观特征。
1.5 表面亲水性测量
每组取3个试件用接触角测量仪测量试件表面接触角,在试件表面滴1 μL蒸馏水,10 s后测量其静态接触角,进行3次独立实验,取平均值。
1.6 表面化学成分测量
用能量色散X射线衍射仪测量各组试件表面元素百分比,每组取2个样本,各测3次,取平均值。
1.7 细胞培养
MC3T3-E1细胞培养于完全DMEM培养基[含10%(体积分数)胎牛血清、105IU/L青霉素和100 mg/L链霉素]中,放入37 ℃、5%(体积分数)CO2的培养箱中培养,每2天换液,倒置显微镜观察,待细胞层长至约80%(体积分数)时传代。
1.8 细胞铺展
各组试件消毒后置于24孔板内,每孔接种MC3T3-E1细胞3×104个。分别在接种后的第1、7天中止培养,每孔加入4%(质量分数)多聚甲醛固定,梯度乙醇脱水后,SEM观察细胞形态。
1.9 细胞增殖活性测量
按第1.8小节方法接种MC3T3-E1细胞1×105个,在接种后的第1、3、5天使用CCK-8试剂盒进行细胞增殖活性的检测,用酶标仪测量450 nm波长处光密度反映各组细胞的增殖活性,每组每个时间点重复测量3次。
1.10 细胞分化能力检测
在各组试件表面接种MC3T3-E1细胞(3×104个/孔), 培养2天后更换分化诱导培养液(含10 mmol/L β-甘油磷酸钠、5×10-5mol/L 维生素C、10-7mol/L地塞米松的DMEM培养液),分化诱导14 d后中止培养。加入Trizol试剂裂解细胞,提取细胞总RNA并测定RNA浓度。
提取D260 nm/D280 nm比值在 1.8~2.0 之间的细胞总RNA,并根据各组RNA浓度,分别计算RNA体积。反转录条件:37 ℃ 15 min,85 ℃ 5 s。将各组RNA反转录为cDNA。最后利用Q-PCR仪进行扩增反应,扩增反应条件:95 ℃ 15 s,60 ℃ 60 s,共40个循环。以GAPDH为内参,用各目标基因2-ΔΔCt值表示各目标基因mRNA的相对表达水平,实验重复测定3次,引物序列见表1。

表1 实时荧光定量PCR引物序列Table 1 Real-time PCR primer sequence
1.11 统计学分析
采用SPSS 26.0软件,使用K-S检验分析数据的正态性,Levene检验分析数据的方差齐性;若数据符合正态分布且方差齐,则采用样本均数t检验比较两组多孔氧化锆试件表面孔隙参数,并采用单因素方差分析比较多组间差异,多组间比较差异有统计学意义后采用SNK法进行两两比较;若数据符合正态分布但方差不齐,则采用Kruskal-Wallis非参数检验比较多组差异,多组间比较差异有统计学意义后采用秩和检验进行两两比较,以P<0.05为差异有统计学意义。
2 结果
2.1 表面显微形貌分析
两种多孔氧化锆试件表面孔隙参数见表2,3D-Porous组孔径及孔深度均显著大于M-Porous组(P<0.05)。3D-Porous组孔分布较均匀,孔间距约(349.87±12.43) μm,而M-Porous组孔随机分布,部分孔相互融合,故未测量孔间距。

表2 多孔氧化锆试件表面孔隙参数Table 2 Surface pore size of porous zirconia disks
M-Ctrl组的表面粗糙度Ra值为(0.47±0.07) μm,显著低于其他各组(P<0.05), 3D-Porous组孔间平整表面粗糙度最大,为(1.21±0.26) μm(P<0.05)。M-Porous孔间粗糙度和3D-Ctrl组表面粗糙度分别为(0.68±0.10) μm、(0.61±0.07) μm,两组间差异无统计学意义(P>0.05)。
SEM下可见,M-Ctrl和M-Porous组晶粒尺寸较3D-Ctrl和3D-Porous小,且更为均匀。M-Ctrl和3D-Ctrl组表面均较为平整;3D-Porous组较M-Porous组孔分布更均匀,形状规则(图2)。

M-Ctrl, milled sintering group; M-Porous, milled porous group; 3D-Ctrl, 3D printed sintering group; 3D-Porous, 3D printed porous group.图2 用扫描电镜观察氧化锆试件表面形貌Figure 2 Scanning electron microscope images of zirconia disks
2.2 表面亲水性
使用接触角测量仪测量试件表面亲水性,试件表面接触角均小于90°,其中M-Porous组及3D-Ctrl组表面接触角分别为 73.83°±5.34°、72.7°± 2.72°,两组间差异无统计学意义(P>0.05), 且均显著大于M-Ctrl组(68.33°±3.70°),P<0.05。3D-Porous组因其表面孔径大,孔分布均匀,蒸馏水接触试件表面后完全浸入孔中,接触角为0。
2.3 表面化学成分
氧化锆表面元素主要为锆(60%~66%)和氧(20%~26%),还含碳、钇,未见其他杂质元素,各组间表面元素组分差异无统计学意义(P>0.05)。
2.4 细胞铺展
SEM下可见培养1 d后细胞黏附在各试件表面并开始铺展(图3)。在M-Ctrl和3D-Ctrl组试件表面,细胞铺展均较为平坦,而在M-Porous及3D-Porous组试件表面,细胞有较长伪足伸展,在孔内及孔壁处也可见大量细胞附着。培养7 d后,所有试件表面上的细胞汇合并紧密排列,细胞的个体形态难以区分。在M-Porous组试件表面,致密的细胞层能够覆盖一些孔径较小的孔,而3D-Porous组孔径较大,在孔内部可见汇集的细胞层。

M-Ctrl, milled sintering group; M-Porous, milled porous group; 3D-Ctrl, 3D printed sintering group; 3D-Porous, 3D printed porous group.图3 扫描电镜观察培养不同时间后氧化锆试件表面MC3T3-E1细胞形态Figure 3 Scanning electron microscope images of MC3T3-E1 cells on zirconia discs after incubation for 1 and 7 days
2.5 细胞增殖实验
培养1 d时,M-Ctrl组试件表面细胞数量显著少于其余各组(P<0.05)。3 d时M-Ctrl组试件表面细胞数量最少,M-Porous组试件表面细胞数量最多,与其余各组间的差异均有统计学意义(P<0.05)。培养5 d时M-Porous及3D-Porous组试件表面细胞数量显著高于M-Ctrl及3D-Ctrl组(P<0.05),而两者间的差异无统计学意义(P> 0.05,图4)。
2.6 细胞分化能力检测
细胞分化培养第14天3D-Porous组ALP、Colla1、Runx2、OCNmRNA的相对表达量均显著低于M-Ctrl及3D-Ctrl组(P<0.05)。M-Porous组Colla1、Runx2、OCNmRNA的相对表达量均显著高于3D-Porous组(P<0.05), 但ALPmRNA的相对表达量两者间差异无统计学意义(P>0.05)。M-Ctrl组Runx2 mRNA的相对表达量显著高于3D-Ctrl组(P<0.05,图5)。
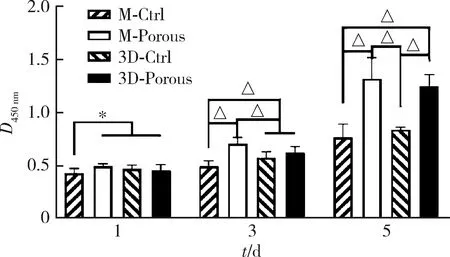
M-Ctrl, milled sintering group; M-Porous, milled porous group; 3D-Ctrl, 3D printed sintering group; 3D-Porous, 3D printed porous group. Four groups comparison: 1 d, H=31.834, P < 0.001; 3 d, F=54.633, P < 0.001; 5 d, H=44.859, P < 0.001. *P<0.05, △P < 0.001.图4 MC3T3-E1细胞的增殖情况Figure 4 Cell proliferation of MC3T3-E1 cells after 1, 3 and 5 days
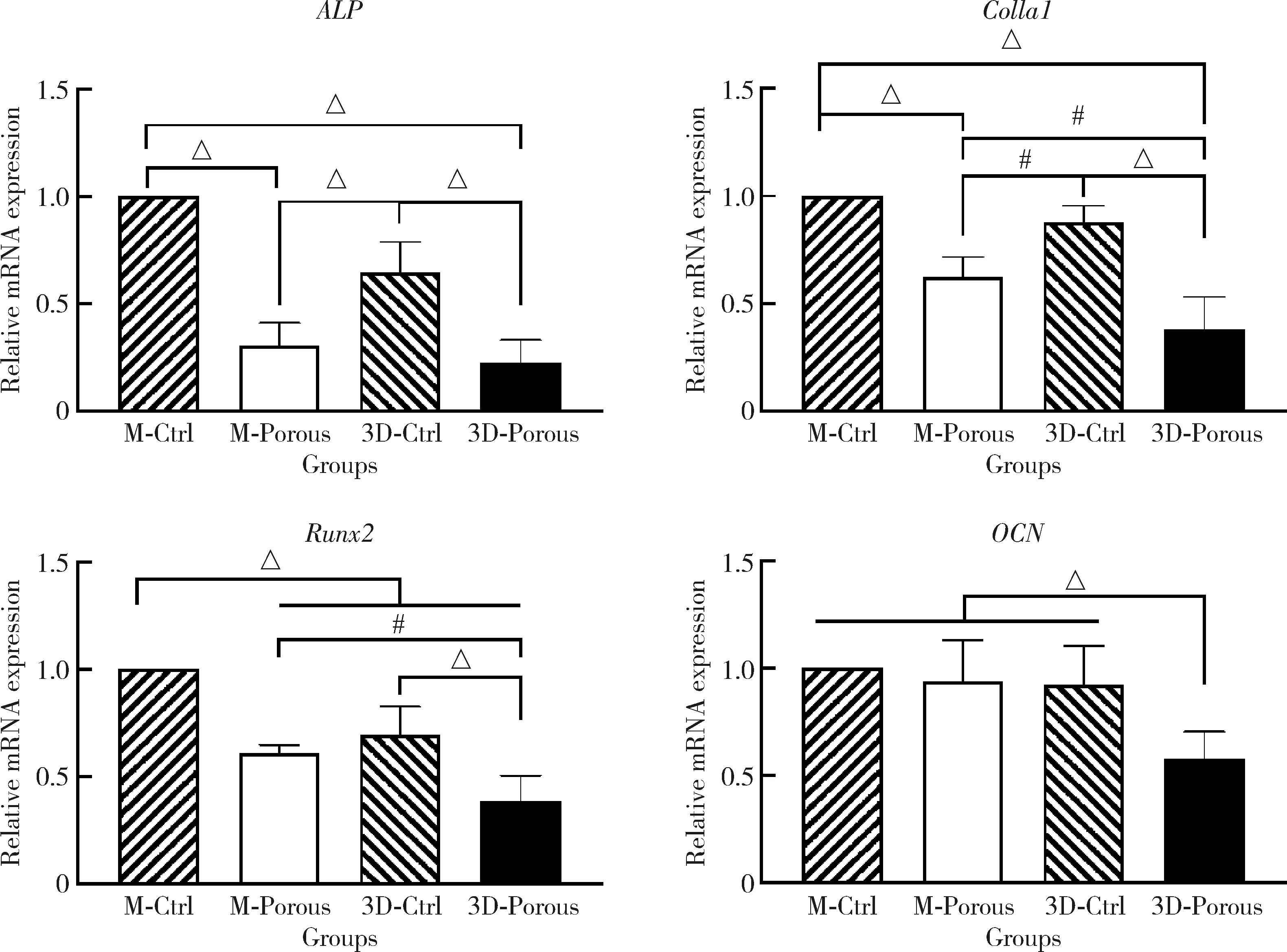
Relative gene expression of osteogenic differentiation proteins ALP, Colla1, Runx2 and OCN in MC3T3-E1 cells. M-Ctrl, milled sintering group; M-Porous, milled porous group; 3D-Ctrl, 3D printed sintering group; 3D-Porous, 3D printed porous group. Four groups comparison: ALP, H=61.635, P<0.001; Colla1, H=49.518, P<0.001; Runx2, H=55.728, P<0.001; OCN, H=38.236, P<0.001. #P<0.01, △P < 0.001.图5 MC3T3-E1细胞中ALP、Colla1、Runx2及OCN mRNA的表达Figure 5 Relative mRNA expression of ALP, Colla1, Runx2 and OCN in MC3T3-E1 cells
3 讨论
本研究采用造孔工艺和SLA 3D打印两种不同的加工方式在氧化锆表面形成多孔结构,探讨了氧化锆多孔表面结构对MC3T3-E1细胞铺展、增殖和分化的影响。添加造孔剂法形成的多孔试件其孔径大小及分布不规则,3D打印多孔试件实现了设计的多孔结构,孔分布均匀,孔与孔之间相互连通。两种多孔形貌均能促进MC3T3-E1细胞的增殖及黏附,但对其成骨向分化有一定抑制作用。
评估多孔种植体的主要参数包括孔隙率、孔径、孔与孔之间的相互连通及孔的几何形状,这些参数对种植体的生物学性能起到关键作用[16-17]。多数研究认为,对于多孔生物材料而言,有利于骨结合的最佳孔隙率应大于50%,且孔径在100~500 μm之间有利于血管形成、成骨细胞迁移及矿化骨的形成,而孔与孔之间相互连通的结构能够促进细胞、蛋白质和营养物质的交换[17, 21-24],因此,本实验设计400 μm孔隙直径、50%孔隙率、互相连通的表层多孔结构,通过SLA技术加工获得多孔表面氧化锆,并进一步研究氧化锆多孔表面对MC3T3-E1细胞增殖及分化能力的影响。
氧化锆材料表面的细胞反应始于黏附,随后是铺展,进而增殖[25]。本实验中SEM下可观察到细胞在M-Porous及3D-Porous组表面的铺展和伪足形成均好于M-Ctrl及3D-Ctrl组,且在两组孔内也可观察到细胞的黏附,细胞增殖结果也验证了在细胞培养3、5 d后两组表面的细胞数量显著高于M-Ctrl及3D-Ctrl组,证明氧化锆多孔表面可显著促进细胞的黏附及增殖,主要原因在于多孔结构增大了细胞与试件表面的接触面积[26]。本研究结果显示,细胞培养3 d时M-Porous组细胞数量最多,而5 d时M-Porous与3D-Porous组试件表面细胞增殖数量差异无统计学意义。影响M-Porous及3D-Porous组间细胞增殖的因素可能有表面成分、制备方式、表面形貌及孔隙参数等,表面化学元素分析检测显示两者间表面成分差异无统计学意义,因此,表面成分对本研究结果的影响可能不占主导地位,而不同的制备方式导致M-Porous组与3D-Porous组表面形貌显著不同,两组表面的多孔结构在孔隙直径、形状及深度上均有显著差异,并且不同制备方式导致不同组表面粗糙度及亲水性存在差异,这些均会对细胞的增殖产生影响。多数研究表明,表面粗糙度的增大有利于增加细胞黏附的面积,促进细胞的黏附和增殖[27]。随着孔径增大,成骨细胞的增殖数量增加[28-29]。Kapat等[29]发现大孔径、高孔隙率的钛支架能够促进细胞增殖,原因可能是随着孔径的增大,整个支架形成了高度连通的结构,更适合细胞的稳定和增殖。关于孔几何形状的研究相对较少,据Bael等[23]研究报道,在孔径分别为500和1 000 μm的三角形、矩形及六边形的多孔结构表面培养人骨膜源性细胞,发现1 000 μm孔径三角形多孔表面细胞的增殖数量最高,孔隙形状导致细胞在角落中更密集地分布,因此大孔径的非圆孔能够促进细胞增殖。针对本项研究而言,同M-Porous组相比,3D-Porous组粗糙度较大,且平均孔径及孔深度更大,但5 d时细胞增殖情况两组间差异无统计学意义,这可能与孔隙形状有关,3D-Porous组为圆形孔,而M-Porous组孔形状不规则,部分区域存在大孔径的多边形孔洞,可能对细胞增殖产生促进效应。
ALP、Colla1、Runx2和OCN4种基因是反映成骨不同阶段的重要指标,本实验中检测这4种基因以反映MC3T3-E1细胞的分化情况,结果显示与M-Ctrl及3D-Ctrl组相比,M-Porous及3D-Porous组的相对基因表达水平均较低,表明本实验中氧化锆试件的多孔表面不利于MC3T3-E1细胞的早期分化,这可能是由于细胞增殖同分化之间的相互协调关系,有学者认为成骨细胞增殖和分化呈负相关,当增殖活性高时,分化活性降低[30-31]。M-Porous组Colla1、Runx2、OCNmRNA的相对表达量均显著高于3D-Porous组,不同制备方式形成的多孔表面之间,不同孔隙参数、表面形貌及粗糙度均可能影响细胞的成骨向分化。有研究表明孔径大小对细胞增殖和分化的影响不同,Kapat等[29]认为小孔径有利于细胞黏附和分化,而大孔径有利于细胞增殖。Lv等[32]比较了孔径为640 μm(孔隙率为73%)和1 200 μm(孔隙率为81.9%)两组钛支架表面人间充质干细胞的分化情况,结果表明640 μm组支架表面ALP和OCNmRNA的相对表达量更高,这与本实验中结果相似,同3D-Porous组相比,M-Porous组平均孔径较小,试件表面细胞分化能力强。Rezaei等[33]通过固态激光蚀刻在氧化锆试件表面形成微纳多级粗糙结构,通过体外培养大鼠骨髓来源的成骨细胞及大鼠体内实验证明,同终烧结表面相比,微纳多级粗糙结构可显著增强骨结合效果。也有研究显示通过选择性渗透蚀刻技术在氧化锆表面形成的纳米多孔结构可显著提高骨结合率[34]。此外,Wang等[31]发现与未酸蚀的支架相比,酸蚀后具有纳米尺度结构的钛支架上ALP活性更高,因此,若将表面微米尺度的多孔结构与纳米尺度结构相结合有望进一步促进MC3T3-E1细胞的成骨向分化。
既往研究表明,3D打印陶瓷材料机械强度较低,但近年来通过改进3D打印工艺,采用SLA技术加工的氧化锆弯曲强度可达(1 154±182) MPa[35]。影响多孔氧化锆试件机械性能的因素包括氧化锆材料本身的性能及孔隙参数,如孔径、孔间距及孔隙率等,研究表明高孔隙率的氧化锆支架材料抗压强度降低,但两者之间不一定是线性关系[36];Seuba等[37]发现总孔隙率对多孔氧化锆抗压强度的影响最大,孔径及孔间距对强度也有一定影响,孔径越小,抗压强度越高。氧化锆表面的多孔结构会降低试件的机械强度,但通过合理设计可以得到兼顾多孔结构和机械强度的氧化锆试件。为了增强多孔氧化锆试件的机械强度,本研究设计了表层多孔、下方实心致密结构的氧化锆STL格式,通过SLA技术加工获得氧化锆试件及种植体,后续研究将进一步探究表面多孔结构对氧化锆试件及种植体强度的影响。
本研究对氧化锆多孔表面生物学性能进行了初步探索,结果显示氧化锆表面多孔形貌能促进MC3T3-E1细胞的增殖及黏附,但对其成骨向分化有一定抑制作用,其中切削多孔表面的细胞分化能力优于3D打印多孔表面,该结果受多因素影响,后续可进一步探索不同细胞、不同孔隙直径以及复合纳米结构的多孔表面氧化锆的生物学效应。
