微创不同深度分次大剂量肺表面活性物质治疗早产儿呼吸窘迫综合征的价值研究
2022-04-02毕雷黄培禄闭雪兰
毕雷 黄培禄 闭雪兰
【摘要】 目的:探究微創不同深度分次大剂量肺表面活性物质治疗早产儿呼吸窘迫综合征的价值。方法:选取钦州市妇幼保健院2020年3月-2021年4月60例早产儿呼吸窘迫综合征患儿为研究对象,以随机数字表法分为对照组、观察组,各30例。对照组应用肺表面活性物质常规方式给药治疗,观察组应用持续呼吸道正压通气下微创微管不同深度分次大剂量肺表面活性物质治疗。比较两组患儿给药前及给药后1、12 h呼吸功能[吸入氧气浓度分数(FiO2)、呼气末正压(PEEP)]、并发症(血氧饱和度下降、药物反流、心动过缓、颅内出血、气胸、支气管发育不良)发生率、死亡率、预后情况(用药后12 h胸片Ⅱ级以上、二次使用肺表面活性物质、72 h内有创机械通气占比)、康复指标(用氧时间、住院时间、住院费用)。结果:给药前,两组PEEP、FiO2水平比较,差异均无统计学意义(P>0.05);给药后1、12 h,观察组PEEP、FiO2水平均较对照组更低(P<0.05);观察组并发症发生率为13.33%,较对照组40.00%更低(P<0.05);观察组死亡率为0,与对照组3.33%比较,差异无统计学意义(P>0.05);观察组用药后12 h胸片Ⅱ级以上、二次使用肺表面活性物质、72 h内有创机械通气占比分别为13.33%、3.33%、3.33%,均较对照组的36.67%、26.67%、20.00%更低(P<0.05);观察组用氧时间、住院时间均较对照组更短,住院费用较对照组更低(P<0.05)。结论:对于早产儿呼吸窘迫综合征患儿,应用微创不同深度分次大剂量肺表面活性物质治疗,可改善其呼吸功能、改善肺功能状态、降低二次肺表面活性物质使用频率、缩短康复用时,降低并发症发生率。
【关键词】 早产儿呼吸窘迫综合征 肺表面活性物质 给药方式
Study on the Value of Minimally Invasive Treatment of Respiratory Distress Syndrome in Preterm Infants with High-dose Pulmonary Surfactant in Different Depths/BI Lei, HUANG Peilu, BI Xuelan. //Medical Innovation of China, 2022, 19(07): 00-005
[Abstract] Objective: To explore the value of minimally invasive treatment of respiratory distress syndrome (RDS) in premature infants with high-dose pulmonary surfactant in different depths. Method: From March 2020 to April 2021, 60 cases of premature infants with respiratory distress syndrome in Qinzhou Maternal and Child Health Hospital were selected as the research objects. They were randomly divided into control group and observation group, with 30 cases in each group. The control group was treated with conventional administration of pulmonary surfactant, and the observation group was treated with high-dose pulmonary surfactant at different depths with minimally invasive microtubules under continuous positive airway pressure ventilation. The respiratory function [fractional inspired oxygen concentration (FiO2), positive end expiratory pressure (PEEP)] before and 1 h and 12 h after administration, the incidence of complications (decrease of blood oxygen saturation, drug reflux, bradycardia, intracranial hemorrhage, pneumothorax and bronchial dysplasia), mortality, prognosis (proportion of chest radiograph above grade Ⅱ 12 h after administration, proportion of secondary use of pulmonary surfactant, proportion of invasive mechanical ventilation within 72 h), rehabilitation indicators (oxygen consumption time, hospitalization time and hospitalization expenses) were compared between the two groups. Result: Before administration, there were no significant differences in the levels of PEEP and FiO2between the two groups (P>0.05); 1 and 12 h after administration, the levels of PEEP and FiO2in the observation group were lower than those in the control group (P<0.05); the incidence of complications in the observation group was 13.33%, which was lower than 40.00% in the control group (P<0.05); the mortality of the observation group was 0, there was no significant difference compared with 3.33% of the control group (P>0.05); the proportion of chest radiograph above grade Ⅱ 12 h after administration, secondary use of pulmonary surfactant and invasive mechanical ventilation within 72 h in the observation group were 13.33%, 3.33% and 3.33% respectively, which were lower than 36.67%, 26.67% and 20.00% in the control group (P<0.05); compared with the control group, the oxygen consumption time and hospitalization time of the observation group were shorter, and the hospitalization expenses of the observation group were lower (P<0.05). Conclusion: For premature infants with respiratory distress syndrome, the application of minimally invasive treatment with high-dose of pulmonary surfactant in different depths can improve its respiratory function, improve the state of pulmonary function, reduce the frequency of secondary use of pulmonary surfactant, shorten the rehabilitation time, and reduce the incidence of complications.gzslib202204021530[Key words] Respiratory distress syndrome of premature infants Pulmonary surfactant Mode of administration
First-authors address: Qinzhou Maternal and Child Health Hospital, Guangxi, Qinzhou 535099, China
doi:10.3969/j.issn.1674-4985.2022.07.001
随着近年来二胎政策开放,二胎高龄自然孕产妇、试管婴儿辅助怀孕高龄产妇逐渐增多,早产儿出生率逐渐上升。受早产儿肺部功能发育状态影响,早产儿呼吸窘迫综合征发病率逐渐提升,死亡率较高[1]。肺表面活性物质(PS)不足为该病主要发病原因,需在辅助通气治疗基础上联合PS治疗,以促进患儿肺功能发育,改善其肺功能状态[2]。常规PS给药方法为气管插管-使用肺表面活性物质-拔管使用持续呼吸道正压通气(INSURE),但在给药期间患儿自主呼吸暂停,可能会增加其肺功能损伤及有创呼吸机使用频率。微创PS给药可保证患儿治疗期间呼吸功能稳定,但在PS大剂量给药期间可能会发生药物反流、气道堵塞等情况,因此目前在微创PS给药中多为小剂量给药,但难以满足临床治疗需求[3]。为保证给药效果、避免药物不良反应,考虑使用大剂量分次给药以满足治疗效果,但目前关于微创不同深度分次PS给药研究较少。为此,本次研究选取钦州市妇幼保健院2020年
3月-2021年4月60例早产儿呼吸窘迫综合征患儿为研究对象,探究微创不同深度分次PS给药临床价值。
1 资料与方法
1.1 一般资料 选取本院2020年3月-2021年4月60例早产儿呼吸窘迫综合征患儿为研究对象,以随机数字表法分为对照组、观察组,各30例。纳入标准:(1)均符合早产儿呼吸窘迫综合征诊断标准[4];(2)无严重先天性疾病;(3)孕妇未使用过糖皮质激素治疗;(4)患儿血流动力学稳定。排除标准:(1)合并严重呼吸、循环等系统障碍,需接受持续性机械通气治疗;(2)出生后即实施气管内插管;(3)使用PS后仍需气管内插管辅助通气时间≥6 h;(4)研究期间退出。该研究经医院伦理委员会批准。患儿家长对研究知情同意。
1.2 方法 PS(商品名:固尔苏,生产厂家:意大利凯西制药公司,批准文号:注册证号H20080429,规格:1.5 mL︰120 mg)用药剂量标准为200 mg/kg;給药前药品预热,以5 mL无菌注射器抽取全部药物后备用;给药前清理呼吸道,保持呼吸道通畅。对照组(肺表面活性物质常规方式给药治疗):仰卧位,直接喉镜暴露声门,插入气管导管,确定导管位置(插入深度为刚到气管插管下口)后,使用胶布将导管与患儿上唇固定,接复苏囊正压通气,将已抽取好药物的注射器连接5.5号头皮针,以30°~40°刺入气管插管内,沿气管插管下行继续进针至针头2/3或完全进入,缓慢推注PS,同时予复苏囊正压通气。给药完毕后再予复苏囊正压通气5 min,拔除气管导管,重新予经鼻持续气道正压通气(nCPAP)辅助通气。观察组采用微创不同深度分次PS给药:使用6FG胃管给药,患儿始终保持在nCPAP无创辅助通气下,取仰卧位,用无菌剪剪掉有侧孔的胃管前端4 cm,将胃管与吸取猪肺表面活性物质的注射器连接;直接喉镜暴露声门,使用Magill钳将胃管插入声门,确认插管深度(插入深度为刚到气管插管下口+1.5 cm),并在上唇固定,移除喉镜,保持患儿口闭合以保证nCPAP的呼气末正压维持在6 cmH2O及以上;将已抽取好药物的注射器连接在胃管末端,1 min内缓慢推注一半剂量的PS(100 mg/kg),向外退出一部分胃管,使其深度为气管插管下口时,以45°左侧卧位1 min内缓慢推注剩余一半剂量的PS,用注射器推1 mL空气到胃管以确保药物完全注入气管内。药物注射完后,拔除胃管,继续nCPAP无创辅助通气。两组患儿给药后,若吸入氧气浓度分数(FiO2)>0.5时症状无明显缓解或持续加重,或频繁呼吸暂停,或血氧饱和度不能维持88%以上,则间隔6~12 h二次给药,用药剂量不变。
1.3 观察指标及评价标准 (1)比较两组给药前、给药后1、12 h呼吸功能,包括FiO2、呼气末正压(PEEP);(2)比较两组出生后28 d期间并发症发生率,包括血氧饱和度下降、药物反流、心动过缓、颅内出血、气胸、支气管发育不良发生率;(3)比较两组出生后28 d期间死亡率;(4)比较两组预后情况,包括用药后12 h胸片Ⅱ级(支气管充气征,背景为弥漫性不张肺泡,可见清晰充气树枝状支气管影)以上、二次使用肺表面活性物质、72 h内有创机械通气占比;(5)比较两组康复指标,包括用氧时间、住院时间、住院费用。
1.4 统计学处理 研究数据以SPSS 24.0统计分析,以(x±s)、率(%)表示计量、计数资料,采用t、χ2检验;当P<0.05时,则组间比较差异有统计学意义。
2 结果
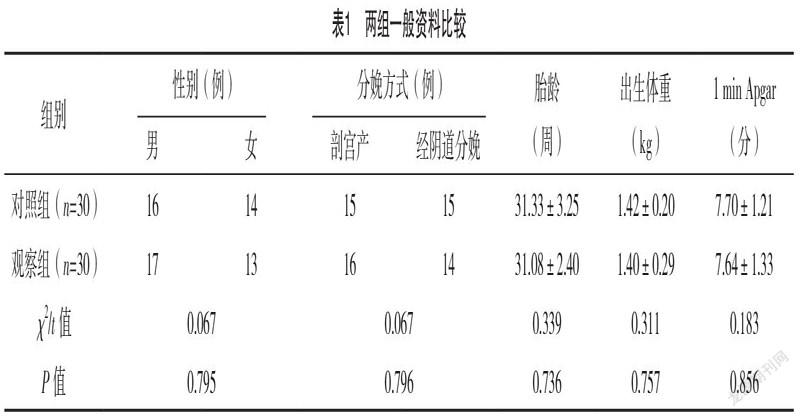
2.1 两组一般资料比较 两组间一般资料相近,差异均无统计学意义(P>0.05),具有可比性,见表1。
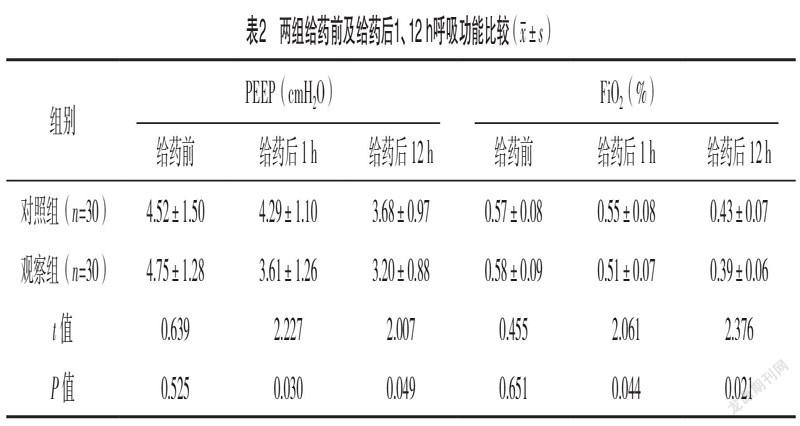
2.2 两组给药前及给药后1、12 h呼吸功能比较 给
药前,两组PEEP、FiO2水平比较,差异均无统计学意义(P>0.05);给药后1、12 h,观察组PEEP、FiO2水平均较对照组更低(P<0.05)。见表2。
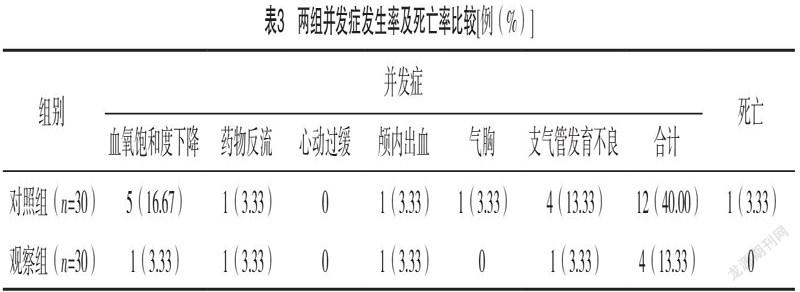
2.3 两组并发症发生率及死亡率比较 观察组并发症发生率为13.33%,较对照组40.00%低(χ2=5.455,P=0.020);观察组死亡率为0,与对照组3.33%比较,差异无统计学意义(χ2=1.017,P=0.313)。见表3。gzslib2022040215302.4 两组预后情况比较 观察组用药后12 h胸片Ⅱ级以上、二次使用肺表面活性物质、72 h内有创机械通气占比分别为13.33%、3.33%、3.33%,均较对照组的36.67%、26.67%、20.00%更低(P<0.05),见表4。
2.5 两组康复指标比较 观察组用氧时间、住院时间均较对照组更短,住院费用较对照组更低(P<0.05),见表5。
3 讨论
PS为肺泡Ⅱ型上皮细胞分泌的脂蛋白,分布于肺泡液体分子层表面,具降低肺泡表面张力、减少吸气阻力,防止肺萎缩及肺不张[5-6]。在对早产儿呼吸窘迫综合征患儿治疗中,应用机械通气治疗辅助呼吸同时应用PS,可改善患儿自主通气能力,促进其肺功能恢复,缩短其康复时间,改善预后[7-8]。
INSURE为早产儿呼吸窘迫综合征主要治疗方法,但在治疗期间由于需要气管插管、正压通气,影响患儿稳定呼吸功能状态,影响患儿自主呼吸与呼吸机运动同步性,增加患儿未成熟肺组织及呼吸道黏膜损伤,增加后期支气管肺发育不良发生风险[9]。微创PS给药可在患儿持续性通气状态下完成给药,与INSURE相比,可避免影响患儿呼吸节律性,保持其呼吸频率稳定,降低其肺功能损伤[10-11];但在微创PS给药期间,小剂量PS可靠无创呼吸机压力及自主呼吸将药物送入气道,但大剂量给药时,受无创呼吸机压力微弱,药物送入气道难度较大,且易诱发气道堵塞、药物反流,引发呼吸暂停,影响给药质量,影响患儿自主通气恢复能力[12];同时相同深度微管一次注入大剂量PS时可能会诱发血氧饱和度下降、颅内出血、脑室周围白质软化等并发症[13]。小剂量给药可降低药物反流、气道堵塞风险,但PS小剂量用药难以满足临床治疗需求[14]。
微创不同深度分次PS给药,主要目的為,在第一次深度时在右支气管内使用半量药物,可保证给药时左侧支气管通畅性,避免发生完全气道堵塞;第二次给药时,采用正常气管插管深度,此时PS给药剂量为一般用药剂量,属小剂量用药,可提升给药安全性,保证患儿在用药治疗期间处于气道通畅状态,避免因气道堵塞发生心动过缓、血氧饱和度下降等情况,同时可保证PS给药总剂量,满足药物剂量需求,促进患儿肺功能恢复[15-16]。
本次研究中,对观察组患儿实施微创不同深度分次PS给药治疗,与常规给药方式相比,给药后1、12 h PEEP、FiO2水平显著低于对照组,考虑原因为,患儿呼吸功能紊乱状态下,会出现呼吸浅快、肺部通气能力下降、血氧饱和度下降情况;应用微创不同深度分次PS给药治疗,可帮助患儿在稳定呼吸运动状态下接受PS治疗,并通过不同深度分次给药,可在满足PS给药剂量同时,不影响患儿肺部通气能力,可帮助患儿稳定恢复其肺功能,达到降低PEEP、FiO2之效[17]。研究结果发现,观察组并发症发生率较对照组低,死亡率均与对照组相近,考虑原因为,在应用微创不同深度分次PS给药治疗,可避免单次大剂量给药时对患儿通气能力影响,减少因气道堵塞引发的并发症发生率,并随患儿通气质量改善,可进一步减少颅内出血、脑室周围白质软化发生率,降低并发症发生率;但本次研究结果未见两组患儿死亡率之间差异性,考虑原因可能与病例数量较少有关[14,18]。研究结果发现观察组用药后12 h胸片Ⅱ级以上、二次使用肺表面活性物质、72 h内有创机械通气占比均较对照组低,且康复指标均优于对照组,考虑原因为,在观察组患儿治疗期间,可维持其肺功能稳定,促进患儿肺部功能发育,改善患儿肺功能,减少PS治疗次数,缩短机械通气时间及住院治疗时间,达到改善预后之效[19]。
综上,在早产儿呼吸窘迫综合征治疗中,应用微创不同深度分次PS给药治疗,与应用INSURE治疗相比,可改善患儿呼吸功能、降低并发症发生率、缩短康复用时、降低二次肺表面活性物质使用频率,效果显著。
参考文献
[1]闫俊梅,黄辉,李倩倩,等.2007-2016年极低和超低出生体质量儿921例临床回顾性分析[J].儿科药学杂志,2019,25(2):17-21.
[2]刘慧强,刘芳,暴丽莎,等.微创应用肺表面活性物质治疗早产儿呼吸窘迫综合征的多中心临床研究[J].中华儿科杂志,2020,58(5):374-380.
[3]田静,张焕新,田金徽,等.不同剂量牛肺表面活性剂治疗新生儿呼吸窘迫综合征疗效的荟萃分析[J].药学服务与研究,2019,19(4):275-279.
[4]曹芳.欧洲早产儿呼吸窘迫综合征治疗共识指南——2010年更新版[J].安徽医药,2010,14(12):1525-1530.
[5]杨楠,崔红,徐俊梅.呼吸窘迫综合征早产儿发生支气管肺发育不良的危险因素及呼吸道疾病随访分析[J].中国儿童保健杂志,2019,27(10):60-63.
[6]田夏,朱贺,韩晟.动物源性肺表面活性剂治疗新生儿呼吸窘迫综合征的Meta分析[J].临床药物治疗杂志,2020,18(11):27-31.
[7]曹文才.牛肺泡表面活性剂联合大剂量氨溴索治疗新生儿呼吸衰竭的疗效研究[J].药物评价研究,2019,42(3):537-540.
[8]林玲,彭好.肺泡表面活性物质在新生儿呼吸窘迫综合征中的微创应用[J].中华实用儿科临床杂志,2019,34(23):1834-1837.
[9]张馨月.早期或延迟使用持续气道正压通气对早产儿呼吸窘迫的影响:Cochrane系统综述[J].中华围产医学杂志,2021,24(2):146.
[10]余鹏程,黄晓群.HFOV联合牛肺表面活性剂对新生儿胎粪吸入综合征血气指标的影响[J].中国实用医药,2019,14(36):15-18.
[11]邱静,尹彬,刘汉玲,等.大剂量注射用牛肺表面活性剂联合BiPAP通气对新生儿呼吸窘迫综合征氧合指数及机械通气的影响[J].海南医学,2019,30(3):345-349.
[12]周陈荣,徐巧岚,刘立铭,等.经细导管注入固尔苏联合气道正压通气治疗早产儿呼吸窘迫综合征的疗效研究[J].中国医学装备,2019,16(1):83-87.
[13]郭明,尚志忠,孙娟,等.微创肺表面活性物质治疗早产儿呼吸窘迫综合征的随机对照研究[J].中国小儿急救医学,2021,28(4):316-320.
[14]林蔷,黎巧茹,陈简.不同剂量肺表面活性物质对晚期早产/足月新生儿呼吸窘迫综合征患儿的临床研究[J].中国临床药理学杂志,2020,36(6):20-22.
[15]高继生,李军,王伟,等.肺表面活性物质联合BiPAP对早产儿呼吸窘迫综合征患儿血清HMGB-1、MIF-1及BMP-7的影响[J].现代生物医学进展,2019,19(23):106-109,133.
[16]马俊苓,宁超,田秀英,等.侵入性较小的肺表面活性物质使用技术治疗早产儿呼吸窘迫综合征研究进展[J].中华实用儿科临床杂志,2019,34(16):1273-1276.
[17]周镇光,张勇明,汪桂美.珂立苏联合鼻塞持续气道正压通气治疗新生儿呼吸衰竭的临床分析[J].中国现代药物应用,2019,13(17):1-3.
[18]张佩,夏世文,祝华平,等.经胃管微创注入肺表面活性物质技术治疗新生儿呼吸窘迫综合征的效果[J].中国医药导报,2020,17(6):101-104,120.
[19]陈云,陈信.微创肺表面活性物质运用技术治疗早产儿呼吸窘迫综合征疗效观察[J].中华全科医学,2020,18(3):22-24,58.
