“抗性淀粉-肠道菌群-代谢产物”营养轴的研究进展
2022-04-01何书琪童铭瑶雷素珍曾红亮
何书琪,童铭瑶,雷素珍,张 怡,2,*,曾红亮,2,3,*
(1.福建农林大学食品科学学院,福建 福州 350002;2.福建省特种淀粉品质科学与加工技术重点实验室,福建 福州 350002;3.中爱国际合作食品物质学与结构设计研究中心,福建 福州 350002)
抗性淀粉(resistant starch,RS)作为一种新型膳食纤维,具有易获取、低热量、易饱腹、难消化、血糖生成指数低等特点,被广泛应用于代餐食品和保健食品中[1]。肠道微生物与宿主之间通过相互制约和相互依存形成复杂而健康的肠道微生态,进而调节机体健康[2]。在胃和小肠中难以消化的RS在到达结肠后被结肠中多种微生物利用从而产生短链脂肪酸(short chain fatty acids,SCFAs),并对人体健康有促进作用,如减轻炎症、降低结肠癌风险和改善肠道屏障功能[3];此外,肝脏和肠道中产生的胆汁酸(bile acids,BAs)也被证明与肠道疾病及代谢性疾病有关。研究发现,RS的结构可以影响肠道微生物的增殖,改变肠道微生物组成进而影响SCFAs和BAs等物质的代谢,从而对机体健康产生影响;此外,利用菌群发酵RS可使淀粉结构发生不同程度的变化进而影响肠道菌群组成和代谢物质的生成[4-5],相关研究发现,RS可降低厚壁菌门与拟杆菌门丰度比值,增加双歧杆菌属、瘤胃球菌属、拟杆菌属等的相对丰度,从而促进丙酸、乙酸等代谢物的产生,并在微生物群和代谢物的综合作用下,共同提升RS的抗肥胖、缓解代谢综合征和肠屏障功能。研究人员基于此构建了“RS-肠道菌群-代谢产物”营养轴,系统地描绘RS、肠道菌群和代谢产物三者的关系(图1),揭示RS调控肠道菌群介导代谢产物的产生从而改善机体健康的作用机制[6]。本文总结了RS调节肠道菌群影响代谢产物的相关机制及其对代谢性疾病(如肥胖、高脂血症和2型糖尿病等)的影响。
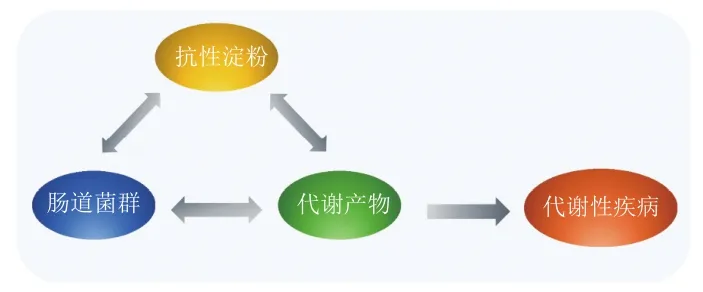
图1 “RS-肠道菌群-代谢产物”营养轴示意图Fig. 1 Schematic diagram of the “resistant starch-intestinal florametabolite” nutrition axis
1 抗性淀粉与肠道微生物概述
淀粉是由天然的、丰富的、可再生的生物大分子组成,一般含有直链淀粉和支链淀粉。它作为食物的主要成分,对食物的营养、质地和消化具有重要影响,在食品配料的封装、组织工程材料、涂层等方面具有广泛的应用前景[7]。由于部分淀粉在小肠内无法被全部或部分消化吸收,因此,人们根据淀粉在小肠内的生物可利用性将淀粉分为快速消化淀粉(ready digestible starch,RDS)、缓慢消化淀粉(slowly digestible starch,SDS)和抗消化淀粉。其中,抗消化淀粉又称RS,是一种新型膳食纤维,被定义为“不能被健康人体小肠所消化吸收但能被大肠菌群利用的淀粉及其降解产物[8]”。RS在马铃薯、小麦、玉米、莲子、大米、香蕉等食物中天然存在,可分为5 类:物理包埋淀粉(physically trapped starch,RS1)、未糊化的天然淀粉颗粒(resistant starch granules,RS2)、回生淀粉(retrograded starch,RS3)、化学改性淀粉(chemically modified starch,RS4)、淀粉-脂质复合物(starch-lipid complex,RS5)[9]。
肠道微生物组成主要包括厚壁菌门、拟杆菌门、放线菌门和变形杆菌门[10]。RS可以被肠道微生物发酵产生SCFAs、乳酸、琥珀酸等代谢产物进而发挥益生作用[11]。相关研究发现,肠道微生物利用RS产生的酸和酶会侵蚀和水解淀粉颗粒结构,使淀粉颗粒出现裂缝、孔洞、片状等结构,这些结构可以保护肠道有益菌从而促进其增殖[12]。肠道微生物可以利用RS作为底物生产多种代谢物(包括SCFAs、乳酸等),而RS也会在发酵过程中影响微生物组成和肠道代谢物。SCFAs具有促进机体健康的作用,如改善炎症、维持葡萄糖稳态、提高免疫力[13]、降低患结肠癌风险和和改善肠道屏障功能等[14];BAs分为初级BAs和次级BAs,对保持肠道菌群健康、平衡脂肪和碳水化合物代谢具有重要作用。肠道菌群可以通过影响BAs代谢来调节BAs的结构和数量,而BAs可以通过干扰肠道细菌膜的完整性来改变肠道菌群的结构和数量[15];此外,有研究发现肠道菌群可以通过调节BAs从而改善大肠癌[16]、肥胖[17]、高脂血症[18]、糖尿病[19]等疾病。
2 抗性淀粉对肠道菌群的调节作用
不可消化的碳水化合物(如RS等)可作为发酵底物被肠道菌群利用并诱导肠道发生各种变化[5],如促进肠道内有益菌(如拟杆菌、长双歧杆菌[20]、梭状芽孢杆菌、乳酸杆菌[10]等)的增殖和抑制有害菌(如肠球菌、大肠杆菌[21]等)的生长,起到调节肠道菌群平衡的作用,从而预防肠道疾病、改善肠道健康及调节机体免疫力等[8],RS经肠道菌群发酵后形成的粗糙结构可保护肠道有益菌免受SCFAs分泌所造成肠道pH值下降的影响,同时酸化的肠道环境可抑制病原菌的生长(图2)。因此可认为结构粗糙的RS有利于有益菌生长从而影响代谢产物及发挥益生作用。
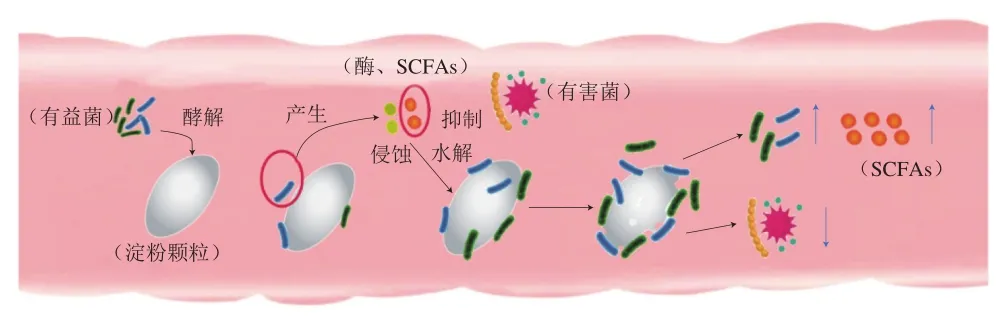
图2 肠道菌群利用淀粉破坏淀粉表观结构示意图Fig. 2 Schematic diagram of the destruction of starch apparent structure by intestinal microflora
不同类型的RS在肠道微生物发酵中会表现出不同调节肠道微生态的方式。如RS2有利于双歧杆菌、瘤胃球菌、直肠真杆菌、拟杆菌和放线菌的生长;RS3能提高瘤胃球菌、直肠真杆菌、阿托普菌、双歧杆菌和梭菌(IV、IX、XV、XVI、XVII)的丰度,但会抑制梭菌XIVa的生长;RS4能增加拟杆菌、放线菌的数量[22]。RS与肠道微生物组成的关系如表1所示。被肠道微生物发酵后的高粱RS表现出促进乳酸杆菌和双歧杆菌增殖和抑制大肠杆菌生长的结果,且该研究表明高粱RS可以改善大鼠因高脂饮食引起的脂质代谢紊乱、肥胖和肠道菌群失调[23]。Zeng Hongliang等[24]对莲子RS的研究发现,摄入中、高剂量的莲子RS显著促进了乳酸杆菌、双歧杆菌、瘤胃球菌和梭菌属等淀粉利用菌及产丁酸菌的增殖,也提高了乙酸、丙酸、丁酸等SCFAs的产量,同时抑制了引起结肠炎等肠道疾病的理研菌科和紫单胞菌科的生长,因此改变了小鼠粪便细菌群落的结构。玉米RS增加了厚壁菌门与拟杆菌门数量,促进了双歧杆菌和乳酸杆菌的增殖,同时抑制了大肠杆菌的生长,也促进了SCFAs的生成[25]。因此,RS的摄入可调节肠道菌群结构,促进有益菌的增殖,抑制有害菌的生长。
许多研究证实了肠道有益菌的增殖与RS表观结构有关。项丰娟等[9]利用高直链玉米淀粉与棕榈酸形成的复合物制备RS5,将RS5发酵液接种至人粪便中进行体外发酵,并与RS2进行比较。结果表明,RS5对双歧杆菌、乳杆菌和拟杆菌的增殖效果较RS2更好,RS2对肠杆菌、肠球菌和产气荚膜杆菌的抑制效果较弱,而RS5对这3 种致病菌生长的抑制效果较强,这主要是因为RS2具有较完整的淀粉颗粒结构;因此乳杆菌和双歧杆菌对其利用率低,而颗粒较粗糙的RS5能很好地保护有益菌并使其大量繁殖,且肠道微生物发酵RS5产生大量的有机酸造成发酵液pH值显著降低,形成酸化的大肠环境,从而抑制了肠道有害菌的生长,而粗糙的RS5表面结构很好地保护了有益菌,使其能够抵抗低pH值环境。该结论与Zeng Hongliang等[24]的研究结果一致,其研究结果表明,体积分数20%乙醇溶液沉降的莲子RS颗粒表面较体积分数30%乙醇溶液沉降的莲子RS粗糙,更能被微生物迅速利用,从而保护益生菌并促进其增殖。综上,颗粒粗糙程度高的RS可较好保护肠道有益菌抵抗酸化的肠道环境从而有利于其增殖并改变肠道微生物群落结构。

表1 肠道菌群发酵淀粉后的代谢产物及微生物组成变化Table 1 Changes in metabolites and microbial composition after starch fermentation by intestinal microflora
3 菌群发酵后抗性淀粉的结构变化
3.1 菌群发酵后抗性淀粉的表观结构
RS经微生物发酵后,微生物产生的酸和酶等物质会逐渐侵蚀颗粒,造成颗粒表观结构的破损,如颗粒断裂、腐蚀、孔洞、颗粒尺寸变小等,从而促进了酶与颗粒表明的结合,吸引更多微生物聚集并附着在颗粒周围。近几年的研究发现,自然发酵造成淀粉颗粒破裂主要是归因于微生物群中的优势菌群,如双歧杆菌属、拟杆菌属、乳酸杆菌属、瘤胃球菌属、普氏粪杆菌等淀粉利用菌和丁酸产生菌,研究人员将优势菌群单独或混合发酵淀粉发现,其对淀粉颗粒的破坏程度均大于自然发酵,这主要是因为自然发酵前期菌群丰度大,但起作用的优势菌种生长较慢,而将优势菌株单一或混合发酵,在相同发酵时间内,产生的酸和酶不仅能破坏无定形区域,还能通过孔道水解内部淀粉链[26-28]。因此,采用单一或混合优势菌属发酵RS对淀粉表观结构造成的破坏程度强于自然发酵。
马铃薯、香蕉、莲子、玉米等食物中天然存在RS[29],这些RS颗粒在扫描电子显微镜下呈现出较光滑平整的表观结构,但在肠道菌群的发酵下,颗粒的表观结构逐渐发生侵蚀破坏,且单一菌、混合菌和自然发酵RS会造成淀粉颗粒表面不同程度的破坏。图3为不同发酵方式的RS表观结构。Reyes等[12]的研究发现,随着发酵的进行,玉米淀粉(约含17.33%RS[30],RS2)颗粒表面逐渐被侵蚀,并附着大量保加利亚乳杆菌,同时产生的淀粉酶和乳酸水解破坏淀粉颗粒结构导致颗粒尺寸变小。Li Nannan等[28]将乳酸菌和酵母菌混合发酵大米淀粉(约含18%RS[31],RS2),与自然发酵比较发现,单一乳酸菌发酵严重破坏大米淀粉颗粒,乳酸菌和酵母菌混合发酵发现表面破裂程度较单一菌发酵轻微,而自然发酵的淀粉颗粒表面基本保持平整。这与寇芳等[26]的研究结果相似,自然发酵前期对颗粒结构造成主要破坏作用的优势菌属生长缓慢,导致颗粒表面侵蚀破坏程度较轻。Zeng Hongliang等[24]利用双歧杆菌和保加利亚乳杆菌分别发酵体积分数20%和30%乙醇溶液沉降的莲子RS(lotus seed resistant starch,LRS3)24 h后在扫描电子显微镜下观察发现,与未发酵RS光滑完整的表面相比,发酵RS颗粒表面都呈现出更不规则且布满裂痕和鳞片状的结构,且发酵后的淀粉颗粒更加粗糙和疏松。该结论与Xu Yihan等[32]的研究结果一致,植物乳杆菌CGMCC 14177发酵生马铃薯淀粉(约含4.44%RS[33],RS2)后使其表面出现明显小洞和凹陷,且培养基pH值持续下降。Zhao Tong等[34]将小麦淀粉进行自然发酵发现,在整个发酵过程中,淀粉培养基pH值不断下降,发酵淀粉颗粒表面出现斑点和裂痕,且随着发酵的进行,斑点逐渐变大,裂痕也更深,导致颗粒变形破裂,说明了淀粉颗粒在发酵过程中受到微生物及其代谢产物的侵蚀和破坏。因此可认为,随着发酵的进行,淀粉酶和有机酸不断产生并破坏侵蚀淀粉颗粒结构,导致淀粉表观结构粗糙、疏松,出现孔洞、裂缝等。
3.2 菌群发酵后抗性淀粉的晶体结构
目前,大量研究表明RS经肠道微生物发酵后均未改变其晶体类型(表2),且由于微生物发酵产生的酸或酶会先利用结构并不致密的无定形区域,造成无定型结构数量降低,结晶区的长支链淀粉被酸或酶水解成中间及短支链淀粉,从而使结晶度提高。但发酵到一段时间后,结晶度会呈现下降的趋势,这主要是因为在发酵初期无定形区域首先受到微生物发酵产生淀粉酶的攻击,从而使结晶度增加,但随着无定形区域含量不断减少,结晶度不断增加,继续发酵使颗粒结构逐渐破坏,造成结晶区暴露在淀粉酶和酸的共同作用下,最终导致结晶度下降;此外,自然发酵的结晶度略高于单一菌发酵和混合菌发酵。
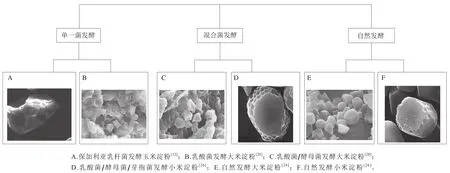
图3 单一菌发酵、混合菌发酵和自然发酵后淀粉颗粒的表观结构Fig. 3 Apparent structure of starch granules after pure culture fermentation, mixed culture fermentation and natural fermentation by intestinal microflora
表2中保加利亚乳杆菌发酵的玉米淀粉(约含17.33%RS[30],RS2),晶体类型不变,在15.12°、17.17°、18.05°和23.0°都出现了强度峰,且结晶度在发酵后由原来的(32.88±2.12)%增加到(37.32±0.96)%,说明发酵虽然没有改变玉米淀粉的A型晶体结构,但增加了结晶度,继续发酵到24 h,结晶度降低到(37.32±0.96)%,说明发酵前期,酶先利用了无定形区域,造成结晶度增加,继续发酵造成颗粒结构逐渐破坏,结晶区暴露在淀粉酶和酸的共同作用下,最终导致结晶度下降[12]。植物乳杆菌发酵的生马铃薯淀粉(约含4.44%RS[33],RS2)也表现出相似的结果[32](表2)。有研究认为这与无定形区结构不致密、易受到酶的攻击有关[24]。故单一菌发酵RS不足以改变其内部晶体结构,但发酵过程中产生的酶和酸容易先利用淀粉颗粒的无定形区域,导致结晶度改变。
在混合菌发酵RS的研究中,研究人员利用乳酸菌和酵母菌混合发酵大米淀粉(约含18% RS[31],RS2),通过X射线衍射分析发现,发酵前后均呈现出A型和V型晶体特征,混合发酵使淀粉的结晶度降低(表2),这可能是由于A型淀粉晶体是由单斜晶胞构成的,含有短程螺旋和螺旋间水分子,它们通过分子间和分子内氢键结合在一起,因此菌株能有效破坏大米淀粉的氢键网络,从而破坏淀粉结晶,且该研究中自然发酵相较于混合发酵和单一菌发酵的结晶度更高[28]。高梁淀粉(约含22.21% RS[35],RS2)和小麦淀粉(约含5.5% RS[36],RS2)自然发酵期间,晶体类型不变,优势菌种代谢产生的有机酸或酶水解破坏无定形区域,同时使结晶区外侧底物短支链淀粉降解,使支链淀粉的短支链聚合度降低,结晶区相对比例增加,导致结晶度增加。小麦淀粉发酵期间,结晶度呈先增加后减小的循环规律,但总体是呈增加趋势[29,34]。因此,淀粉颗粒在发酵期间,由于无定形区域受到酸或酶的利用,造成结非结晶区数量减少,结晶区数量增加,但发酵到一定时间后,结晶区暴露在酸和酶的共同作用下导致结晶度下降,但总体结晶度呈上升趋势。
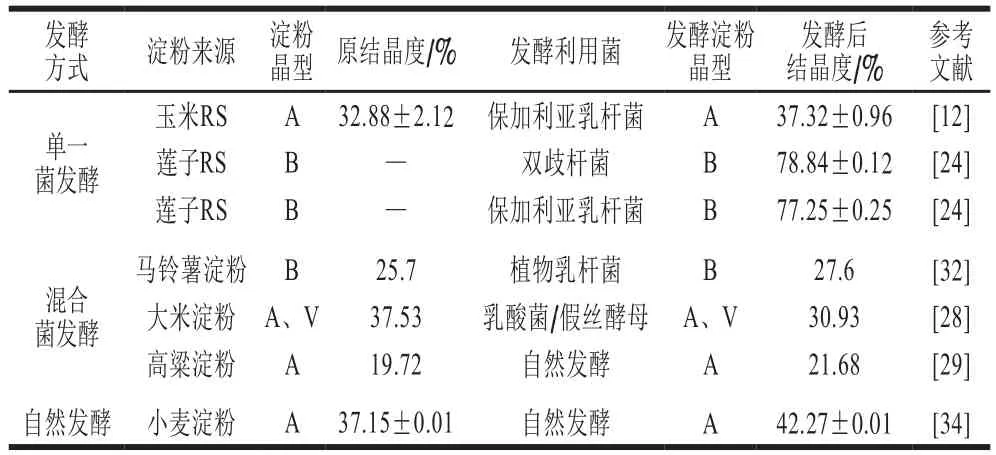
表2 淀粉的结晶类型与结晶度Table 2 Crystallization types and crystallinity of starch
3.3 菌群发酵后抗性淀粉的分子结构
微生物在发酵淀粉后产生的酸和酶会利用淀粉颗粒的无定形区域,即非晶区(包括短程有序和长程无序区域),通过颗粒的孔道进入内部结构,水解支链或直链淀粉链,形成小分子物质,从而被微生物利用,且长支链淀粉也会被水解成短支链淀粉以及脱支的支链淀粉,从而造成重均、数均分子质量发生变化,吸收峰减弱或部分消失。由于支链淀粉较直链淀粉更容易受到酸和酶的水解作用影响,且自然发酵初期优势菌种生长较缓慢,产酸和酶的作用较弱,故单一菌发酵和混合发酵降解直链淀粉的作用较自然发酵强。此外,发酵能减弱官能团区吸收峰强度,但不改变峰位,指纹区的吸收峰也会减弱甚至消失,且单一菌发酵和混合发酵的吸收峰强度较自然发酵低,另外,微生物发酵还能增加淀粉分子的内部有序程度和双螺旋程度[24]。
不同菌群发酵RS后的分子结构变化如表3所示。淀粉发酵后根据分子质量可以分为I区(主要含支链淀粉)和II区(含大部分直链淀粉及少部分支链淀粉),多分散系数(重均相对分子质量(Mw)/数均相对分子质量(Mn))越接近于1,样品的组分越单一,数值越大说明样品的组分越复杂[27]。寇芳等[27]利用植物乳杆菌、酿酒酵母菌分别单一发酵小米淀粉(约含2.9% RS[37],RS2),发现植物乳杆菌发酵小米淀粉后,支链淀粉和直链淀粉被水解成小分子物质并由微生物利用,从而导致Mw和Mn均降低,此外,I区的Mw/Mn增加,II区的Mw/Mn减少(表3),这是因为I区的支链淀粉分子链发生水解、断裂或脱支使分子链长短发生变化,导致组分变复杂,而II区的直链淀粉主要被水解成小分子物质,组分变单一。有研究发现单一菌发酵后淀粉的Mw/Mn均小于自然发酵,且单一菌发酵和自然发酵的Mw/Mn均低于未发酵[38]。由此说明,发酵使淀粉组分变单一,且由于单一菌发酵能更快产生淀粉酶,使长支链淀粉及部分直链淀粉水解成小分子物质,增加中间及短支链淀粉含量,从而改变淀粉组分。Zhao Tong等[34]对小麦淀粉(约含5.5%RS[36],RS2)进行自然发酵发现,淀粉的Mw和直链淀粉含量均降低,这可能是因为酸和酶的共同作用导致直链和支链淀粉的降解,存在于无定形区域的长支链淀粉则被水解成短支链淀粉。这与Batista等[39]的研究结果一致。此外,寇芳等[26]利用乳酸菌、酵母菌和芽孢菌混合发酵小米淀粉(约含2.9% RS[37],RS2),结果表明混合发酵的I区Mw和Mn高于自然发酵,II区的Mw和Mn则低于自然发酵。其原因可能是自然发酵初期优势菌种生长缓慢,所产生的酶只能破坏无定型结构,使直链淀粉水解,而混合发酵由于产酸和酶的作用较强,且不仅能破坏无定形区域,还能通过孔道水解结晶区外侧的部分支链淀粉为短支链淀粉及小分子物质;因此,混合发酵水解直链淀粉更多,导致I区Mw和Mn较大,II区Mw和Mn最小。

表3 淀粉的分子结构特征Table 3 Molecular structural characteristics of starch after pure culture fermentation, mixed culture fermentation and natural fermentation by intestinal microflora
在傅里叶变换红外光谱图中有官能团区(4 000~1 300 cm-1)和指纹区(1 300~400 cm-1),其中指纹区可表征淀粉分子短程有序结构,当指纹区图谱部分消失时,表明淀粉颗粒的短程有序结构遭到破坏[40]。寇芳等[40]利用乳酸菌单一发酵和自然发酵小米淀粉(约含2.9% RS[37],RS2)的研究中发现,乳酸菌单一发酵后2 931 cm-1和2 062 cm-1处的C—H伸缩振动峰以及1 648 cm-1处的C=O振动吸收峰位置没有发生变化,说明单一乳酸菌发酵并不能改变官能团区峰位,但减弱了吸收峰强度,而单一乳酸菌发酵后1 368.38~1 154.00 cm-1及527.54~438.01 cm-1处的吸收峰消失,自然发酵后1 368.38~1 154.00 cm-1处吸收峰强度减弱,且傅里叶变换红外光谱图中显示单一乳酸菌发酵的吸收峰强度较自然发酵低,说明单一菌发酵产生的淀粉酶和有机酸会破坏淀粉颗粒表面和无定型结构,并通过淀粉颗粒的孔道进入淀粉内部,逐渐水解淀粉,使化学键发生改变,最终导致淀粉短程有序结构被破坏,指纹区图谱部分消失,而自然发酵对淀粉颗粒的破坏程度弱,因此吸收峰减弱但并未消失。此外,Li Nannan等[28]利用乳酸菌、酵母菌和芽孢杆菌混合发酵小米淀粉(约含2.9% RS[37],RS2),结果也表明自然发酵吸收峰强度高于混合发酵。
傅里叶变换红外光谱图中R1 047 cm-1/1 022 cm-1和R995 cm-1/1 022 cm-1分别用来描述RS的有序程度和双螺旋程度[24]。Reyes[12]和Zeng Hongliang[24]等对单一菌发酵RS的研究结果一致,都表明在发酵过程中,随着无定形区和亚晶区结构数量的减少,RS的有序结构和双螺旋结构数量增加,说明不致密的无定形区域会首先被微生物产生的酶破坏。Zhao Tong等[34]对小麦淀粉(约含5.5% RS[36],RS2)进行自然发酵,发现随着发酵时间的延长,R1047cm-1/1022cm-1和R995 cm-1/1 022 cm-1均增加,说明发酵过程中产生的短链淀粉分子相互聚集形成有序的微晶,使分子有序度增加。
4 抗性淀粉与肠道短链脂肪酸互作的研究
由前述可知,肠道微生物可利用RS产生SCFAs、淀粉酶、气体等物质[41],所产生的SCFAs和酶会破坏淀粉颗粒结构,使其变得粗糙疏松,而这些粗糙的结构以及RS可促进肠道有益菌的增殖,从而产生大量的SCFAs[42],且不同的优势菌群对SCFAs的产生影响不同。此外,不同肠道菌群可共培养从而显著促进SCFAs产生,其中,乳酸可作为微生物发酵的中间代谢产物为其他菌群生长提供能量,且乳酸、乙酸和丙酸可被肠道菌群协同发酵转化为丁酸[22,43-44]。因此,RS可通过含量和结构变化调节肠道菌群群落结构,进而影响SCFAs的产生,且肠道菌群之间的共生及SCFAs之间的转化也会影响SCFAs含量和组成的变化,从而对机体代谢性疾病起到一定的改善作用。
4.1 RS调控肠道菌群介导SCFAs产生
乳酸杆菌、双歧杆菌、拟杆菌等可利用RS产生SCFAs,被称为淀粉利用菌,瘤胃球菌科、毛螺菌科、梭菌属等不仅能利用RS产生SCFAs,同时还可以发酵乳酸和丙酸产生丁酸,因此被称为丁酸产生菌[4]。肠道中最丰富的SCFAs是乙酸、丙酸、丁酸;其中,乙酸含量最高,其次是丙酸,丁酸含量最少[45]。由前述RS结构与肠道菌群之间的关系可知,RS粗糙的颗粒结构有利于肠道有益菌的增殖,且随着小鼠摄入RS含量的增加,乳酸杆菌和双歧杆菌数量也增加[46],从而促进了乙酸、丙酸和丁酸等SCFAs含量的增加[25](表1);因此,RS的摄入可促进淀粉利用菌的增加从而使SCFAs含量增加。由此说明,RS的含量和结构可影响肠道菌群群落结构,进而影响SCFAs的产生。
Lee等[47]对小鼠补充酶促修饰板栗淀粉后,发现拟杆菌属显著增加,进而促进乙酸的产生。白永亮等[48]研究乳酸杆菌对香蕉RS(RS2)的发酵特性时发现,香蕉RS可显著增加乳酸杆菌的数量,说明香蕉RS有利于乳酸杆菌的增殖,且其可作为乳酸杆菌的碳源被利用。因此可推测,肠道菌群的种类可影响产生SCFAs的类型,即肠道优势菌属,如双歧杆菌属、拟杆菌属、乳酸杆菌属、瘤胃球菌属、普氏粪杆菌等淀粉利用菌和丁酸产生菌会影响肠道SCFAs的组成,同时RS的种类也会影响肠道菌群群落的结构,如结肠微生物中的布氏瘤胃球菌降解RS能力最强,尤其是对RS3,因其偏爱α-(1,4)-糖苷键连接的低聚糖[49],此外,布氏瘤胃球菌主要发酵产物为乙酸,与直肠杆菌共培养可协同促进乙酸和丁酸产生[50]。杨玥熹等[44]研究外源肠道菌群发酵玉米RS对SCFAs产生的影响时发现,在含RS2培养基中单一添加嗜酸乳杆菌后,乙酸含量显著增加,而单一添加双歧杆菌则显著增加了丙酸、丁酸含量,当混合添加嗜酸乳杆菌和青春双歧杆菌时,产乙酸、丙酸和丁酸效果比单独发酵好。Zeng Hongliang等[24]的研究发现,随着LRS3剂量的增加和处理时间的延长,乳酸和丙酸含量呈先增加后减少的趋势(表1),且乳酸只能检测到较低浓度,而丁酸产生菌和乳酸产生菌(双歧杆菌、嗜酸乳杆菌等)共培养时,乳酸产生菌可发酵碳水化合物底物产生乳酸、单糖等中间代谢产物,为丁酸产生菌提供能量,促进其生长和丁酸产生[51]。因此,乳酸产量低可能是因为在发酵初期乳酸由直肠菌群(如双歧杆菌、乳酸杆菌等)利用RS产生,并为其他菌群提供能量,供其生长繁殖,且在发酵后期还会被丁酸产生菌发酵转化为丁酸[52]。于卓腾等[53]也报道了部分产丁酸菌可利用丁酰辅酶A:乙酸辅酶A将乙酸作为碳源产生丁酸。由此可知,肠道菌群可共生促进产酸,SCFAs的产生不仅受RS和菌群的影响,还与菌群共生和SCFAs互作有关。
4.2 RS通过SCFAs改善机体代谢性疾病
结肠中的微生物可发酵膳食纤维产生SCFAs,SCFAs可通过刺激L细胞上G蛋白偶联游离脂肪酸受体2(free fatty acid receptor 2,FFAR2)来释放胰高血糖素样肽-1(glucagon-like peptide-1,GLP-1),从而增加饱腹感,减少食物摄入,起到抗肥胖作用,而丙酸具有最高的FFAR2亲和力[54],且丙酸可通过促进脾脏或固有层T调节细胞的扩增和白细胞介素(interleukin,IL)-10的产生来改善胶原性关节炎病症和减轻炎症[55]。此外,SCFAs还可下调与脂肪形成有关的基因表达,增强与脂质有关的转运蛋白的表达,从而起到改善非酒精性脂肪肝并控制肥胖[56]。相关研究发现,荞麦RS通过改善肠道菌群失调从而抑制炎症,改善胆固醇水平升高和葡萄糖代谢异常[57];马铃薯RS的摄入增加了双歧杆菌、瘤胃球菌、拟杆菌、阿克曼菌的相对丰度,从而促进了乙酸、丙酸和其他代谢物的产生,并在微生物群及其代谢物的共同作用下起到抗肥胖、缓解代谢综合征和肠屏障的作用[6]。由此可知,RS可通过调控肠道菌群从而影响SCFAs的产生,起到改善机体代谢性疾病的作用。值得一提的是,糖尿病目前的发生率非常高,而普氏粪杆菌是一种典型的丁酸产生菌,可产生丁酸,且丁酸可作为一种组蛋白去乙酰化酶抑制剂,促进β-细胞的分化、增殖和改善胰岛素抵抗[58]。因此,对于糖尿病等代谢性疾病可通过增加患者肠道内产丁酸菌等数量从而起到改善病情的作用。
5 抗性淀粉调节肠道菌群影响胆汁酸代谢的研究
许多研究表明,RS可结合BAs并将其从体内排出,从而阻止BAs被重新吸收,而RS结合BAs的能力与RS表面粗糙程度、含量、颗粒的有序程度和双螺旋结构呈正相关[57,59-60]。高浓度BAs会破坏肠道有益菌膜的完整性,而RS由于自身粗糙的结构可保护BAs利用菌,进而提高这些细菌对BAs的耐受性[57],此外,利用BAs的细菌还可通过分泌胆盐水解酶(bile salt hydrolase,BSH)使结合型BAs去结合后再经脱羟生成次级BAs,并由RS包裹并排出体外,减少BAs的重吸收,促进BAs代谢,减少血液中胆固醇含量[51]。因此,RS的含量和结构不仅影响RS结合能力和BAs排泄,还可影响BAs利用菌的增殖,进而影响BAs代谢。而BAs代谢发生在肠-肝轴中,因此,RS可通过调节肠道菌群改变BAs代谢,从而起到改善肥胖、肝病、糖尿病等代谢性疾病的作用。
5.1 BAs的合成与分类
BAs作为微生物发酵产生的一类重要代谢产物,是由肝脏中的胆固醇经胆固醇7α-羟化酶(cholesterol 7α-hydroxylase,CYP7A1)的催化而成的一类小分子物质,这些物质被肠道微生物群进一步代谢并激活肠道、肝脏和外周组织的受体,进而调节机体代谢过程(包括脂质的消化、吸收和能量代谢等)[61]。初级BAs通过两种途径在肝脏中合成,一种是由CYP7A1催化的7α-羟基胆固醇引导的经典途径;另一种是胆固醇27α-羟化酶(CYP27A1)催化的替代途径。如图4所示,胆固醇在肝脏中分解成初级游离型BAs,主要包括胆酸(cholic acid,CA)和鹅去氧胆酸(chenodeoxycholic acid,CDCA),而啮齿动物则产生CA和鼠胆酸(muricholic acid,MCA),之后这些初级游离型BAs可与甘氨酸(glycine,G)和牛磺酸(taurine,T)结合成初级结合型BAs[59],通过胆汁盐输出泵分泌到胆汁中,并储存在胆囊[62],直到人体进食后再释放到十二指肠中[63],少量进入肠腔中的BAs经肠道菌群的BSH去结合形成游离的BAs,再经脱羟形成次级BAs,包括脱氧胆酸(deoxycholic acid,DCA)、LCA等[61],这一过程中,肠道菌群的细菌膜可能受到BAs的干扰,而RS的摄入可保护肠道有益菌免受BAs的破坏,并且RS还可包裹BAs并将其排出体外。大约95%的胆汁分泌的BAs是以结合BAs的形式在回肠末端通过钠依赖BAs转运体被重吸收,经门静脉回到肝脏[59]。
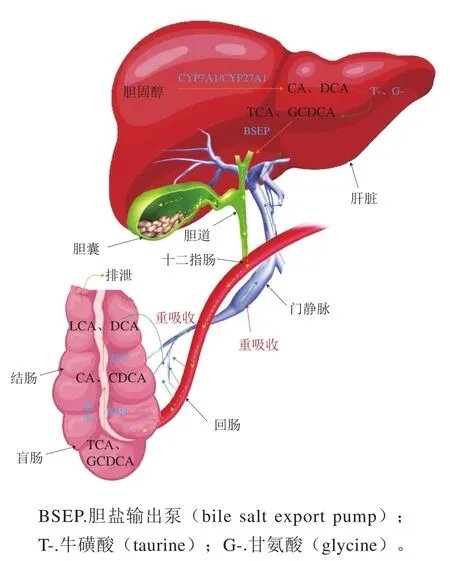
图4 BAs肠肝循环Fig. 4 Bile acid of intestinal liver circulation
5.2 RS调控肠道菌群影响BAs代谢
RS在肠道中可与BAs结合,且随RS含量及颗粒粗糙程度的增加,对BAs的结合能力也越高,从而包裹BAs将其排出体外,而RS的颗粒结构可保护有益菌免受高浓度BAs的破坏,从而促进利用BAs的有益菌增殖,进而影响次级BAs代谢。
Aribas等[62]的研究表明,15%、20%和25%的RS均可与BAs结合并将其从体内排泄,且结合能力随RS含量增加而增加,与其他组相比,25%的RS使意大利面条具有较好的BAs结合能力,且能更好地促进胆固醇分解成其他BAs从而降低血液胆固醇。Xu Jiangbin等[64]采用脉冲高压灭菌引起淀粉糊化,导致RS含量、相对结晶度和双螺旋结构含量均显著降低,淀粉颗粒聚集,颗粒表面积减少,从而限制了淀粉与BAs的结合。因此,淀粉颗粒有序结构含量的减少使BAs结合能力降低。相关研究也发现具有双螺旋结构的RS可以包裹BAs并将其排出体外,且BAs还可以通过RS表面的裂纹进入淀粉内部[59]。有研究发现,由于脱氧胆酸分子存在两个羟基,因此可与天然豌豆RS中的羟基形成较强的相互作用从而结合,并随粪便排出,使血液胆固醇含量降低[57]。由此可推测,RS可与BAs特异性结合,双羟基BAs与RS的结合能力较高,且RS表面越粗糙、含量越高、有序结构和双螺旋结构越多,RS与BAs结合能力越高,从而抑制BAs重吸收,增加粪便中的BAs排泄,减少血液胆固醇。
有研究发现,拟杆菌属可以分泌BSH参与BAs代谢,阿克曼菌可以减轻小鼠肥胖,并参与次级BAs的合成[65]。Lei Suzhen等[15]的研究发现,LRS促进了可能利用BAs的乳杆菌增殖,并抑制了潜在有害细菌(如肠球菌和葡萄球菌)的生长,且在高浓度胆盐条件下,LRS组的微生物多样性增加,说明RS含量可促进BAs利用菌的增殖。体积分数20%乙醇溶液沉降的LRS3比体积分数30%乙醇溶液沉降的LRS3表面更粗糙,而较粗糙的表面有助于双歧杆菌和乳杆菌黏附在淀粉表面,从而保护益生菌,提高其在高BAs浓度的不利环境中的耐受性[25]。Bang等[5]的研究表明,马铃薯淀粉(RS2)能够促进阿克曼菌、萨特氏菌、Turicibacter等的丰度增加,同时,肠道中T-LCA、G-LCA等次级BAs的数量也增加,硫酸化胆酸(cholic acid-sulfate,CA-S)、TCA、MCA等初级BAs的数量降低(表1)。因此认为,RS能够促进BAs利用菌增殖,从而产生BSH,使结合型BAs去结合并转化为次级BAs,这些次级BAs(如LCA)可被RS包裹排出体外,从而促进BAs代谢和降低血液胆固醇。此外,有研究发现,肠道菌群可能通过降低T-MCA的水平以及促进回肠中法尼醇X受体依赖性成纤维细胞生长因子15的表达来抑制CYP7A1和BAs的合成[66]。因此,RS的含量和结构可影响BAs利用菌的增殖,进而影响次级BAs的产生,从而调节BAs的结构和合成。
5.3 RS通过BAs改善机体代谢性疾病
大量研究表明,BAs可通过G蛋白偶联BAs受体5或G蛋白偶联受体119途径增加L细胞环磷酸腺苷和激活蛋白激酶A,诱导GLP-1和多肽YY激素释放,从而减少进食量,延缓胃动力,增加胰岛素分泌[67],改善糖尿病。此外,BAs可增加脂蛋白脂酶活性从而促进血浆甘油三酯的清除,还可减少肝脏糖异生[68]。除此之外,BAs还可通过激活法尼醇X受体和固醇调节元素结合蛋白1c途径调节脂肪生成,抑制极低密度脂蛋白的产生,从而改善非酒精性脂肪肝[69]。综上所述,RS可通过含量和结构的变化影响肠道菌群群落结构,尤其是促进利用BAs细菌的增殖,进而改变BAs的代谢并起到改善机体健康的作用。因此,在改善机体代谢性疾病和肠道功能方面,利用RS改变肠道BAs谱是一种有效的方法。
6 结 语
近年来,人们对RS结构及其发酵特性作了广泛的研究,发现RS作为新型膳食纤维可以被肠道菌群利用进而调控肠道代谢物发挥益生作用,且RS可以利用自身结构特性促进益生菌增殖并影响代谢产物。本文以“RS-肠道菌群-代谢产物”营养轴为基础,从RS调控肠道菌群群落结构、菌群发酵后RS颗粒结构变化及RS介导SCFAs产生和BAs代谢4 个方面探讨了RS调控肠道菌群介导代谢产物从而改善机体健康的作用机制,为饮食调控机体健康提供理论依据。
但目前关于“RS-肠道菌群-代谢产物”营养轴对肠道健康、代谢性疾病等的作用机制仍需进一步探究。如RS-肠道菌群-BAs之间的分子机制、RS调控肠道菌群介导SCFAs转化的分子机制、RS介导BAs转化的生化途径等仍需进一步探讨。此外,RS在高血脂、高血糖、肥胖等代谢性疾病中与BAs、SCFAs相互作用的分子机制有待更深入的研究。
