CCL20通过ERK通路促进食管鳞癌细胞迁移和侵袭
2022-03-31南红星禹刘丽王良海
南红星,禹刘丽,王良海
食管癌作为全球病死率排名第6位的恶性肿瘤,每年有近51万例患者死亡[1],其中约一半为中国患者[2]。食管鳞癌是国内食管癌的主要病理亚型,随着生活条件的改善和医疗水平的提高,食管鳞癌患者的病死率有所降低,但转移性食管鳞癌患者的预后仍不理想[3]。转移成为食管鳞癌患者预后差的主要原因之一,寻找食管鳞癌转移发生的潜在机制,对提高食管鳞癌患者的生存有积极意义。趋化因子是一类小细胞因子,可以诱导特异细胞趋化转移,一系列趋化因子被报道参与肿瘤的恶性进展[4-5],其中CCL20不仅在黑色素瘤、结直肠癌等恶性肿瘤转移过程中发挥作用[4,6],还在多种肿瘤中高表达,并且和肿瘤分级以及患者的累积生存时间密切相关[7]。但是CCL20在食管鳞癌中的研究却很少,该研究探讨CCL20对食管鳞癌细胞恶性的影响,并初步探索了CCL20的作用机制。
1 材料与方法
1.1 材料人食管鳞癌细胞株:ECA109和EC9706来源于中国科学院生物化学与细胞生物学研究所。主要试剂: RMPI 1640培养液和超敏ECL底物发光试剂盒购自于美国Thermo Fisher公司,G418药物及Western blot实验试剂购自中国索莱宝科技有限公司,胎牛血清生产于以色列 Bioind公司,ERK、NF-κB、STAT3 和AKT信号通路抑制剂购自美国Selleck公司,CCK8试剂购自北京北仁化学科技有限公司,Transwell小室及Matrigel 基质胶购自美国Corning公司,CCL20抗体(1 ∶1 000,# ab9829)购自英国Abcam抗体公司,p-ERK1/2(1 ∶1 000,#4370) 抗体及ERK1/2(1 ∶1 000,#4695)抗体购自美国CST公司,所有使用质粒均合成于中国吉玛公司,引物由上海生工生物工程有限公司合成。
1.2 方法
1.2.1细胞培养与转染 使用含1%青-链霉素和10%胎牛血清的1640培养基培养ECA109和EC9706细胞。含有CCL20的质粒和靶向CCL20的shRNA(shCCL20)质粒使用Lipofectamine 2000转染进细胞,CCL20过表达组为转染了CCL20质粒的细胞,CCL20干扰组是转染了shCCL20质粒的细胞,转染空载体的细胞为对照组。转染后使用浓度为500 ng/L的G418 药物筛选转染细胞,之后通过 Western blot或者实时定量PCR实验验证转染效果。
1.2.2蛋白提取与Western blot实验 使用含1%蛋白酶和磷酸酶抑制剂的RIPA裂解液冰上裂解细胞20 min,4 ℃条件下13 000 r/min离心20 min,取离心上清测浓度。电泳到蛋白分离开,用半干转仪器转膜,室温摇床封闭膜2 h后,于4 ℃结合一抗过夜。二抗结合2 h后洗膜曝光。
1.2.3实时定量PCR 提取总RNA,逆转录,PCR扩增后,检测CCL20 mRNA的表达水平,β肌动蛋白作为对照,使用的引物序列CCL20 F:5′-GCGAA TCAGAAGCAAGCAACT-3′, R:5′-TTGGATTTGCGC ACACAGAC-3′;β-actin F:5′-AAGGATTCCTATGTGG GCGAC-3′,R:5′- CGTACAGGGATAGCACAGCC-3′。
1.2.4Transwell 迁移与侵袭实验 上室加细胞悬液200 μl,迁移实验接种细胞数目为3×104个/孔,侵袭实验接种细胞数目为1.5×104个/孔,下室为含20%胎牛血清的1640培养基,胎牛血清作为化学诱导物。迁移实验培养时间为1 d,侵袭实验培养时间为2 d。侵袭实验的小室需要用45 μl 稀释的基质胶包被。Transwell迁移和侵袭实验小室置于200×放大率的镜下,随机拍取至少5张结晶紫染色细胞图片,计数后统计分析。
1.2.5CCK8实验 铺96孔板后,于0、24、48和72 h时每孔加入CCK8试剂10 μl,放回培养箱2 h后,酶标仪检测各孔吸光度。
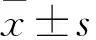
2 结果
2.1 过表达CCL20对食管鳞癌细胞运动能力的影响
2.1.1建立CCL20过表达细胞株 与对照组细胞比较,过表达CCL20的ECA109细胞和EC9706细胞表达的CCL20蛋白增多,表示CCL20过表达细胞株成功建立。见图1。
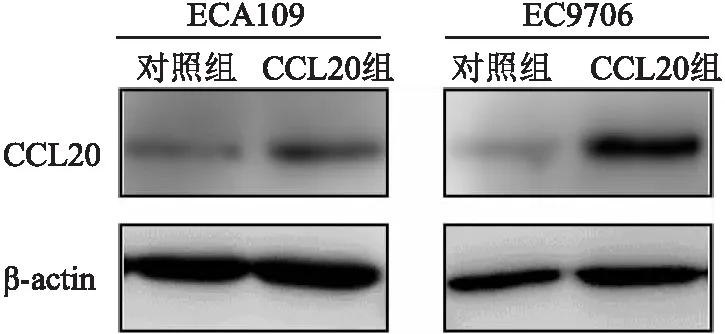
图1 Western blot 实验检测过表达CCL20后ECA109和EC9709细胞中CCL20蛋白的表达情况
2.1.2CCL20对食管鳞癌细胞迁移的影响 与对照组细胞比较,过表达CCL20的ECA109细胞和EC9709细胞迁移穿过聚碳酯膜的细胞数目增多[(49.73±23.02)个vs(178.80±36.79)个][(108.40±25.16)个vs(43.40±8.52)个],差异有统计学意义(t=5.15、4.239,P<0.01、<0.05),表明过表达CCL20增加食管鳞癌细胞迁移能力。见图2。
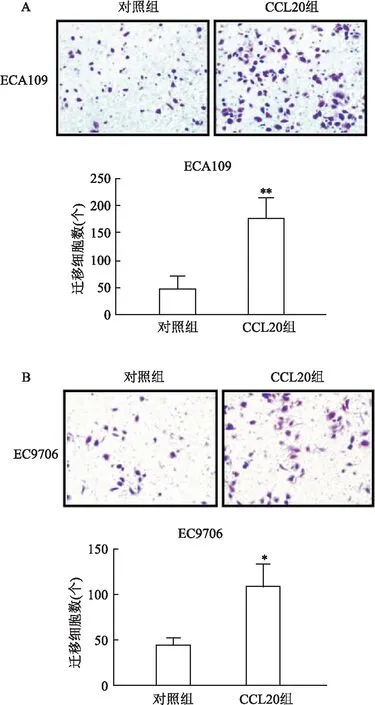
图2 过表达CCL20对食管鳞癌细胞迁移的影响 ×200
2.1.3CCL20对食管鳞癌细胞侵袭的影响 与对照组细胞比较,过表达CCL20的ECA109细胞和EC9709细胞侵袭穿过Transwell膜的细胞数目增多[(160.70±14.64)个vs(38.13±14.85)个][(251.20±34.02)个vs(67.47±11.04)个],差异有统计学意义(t=10.17、8.901,均P<0.001),表明过表达CCL20增加食管鳞癌细胞侵袭能力。见图3。

图3 过表达CCL20对食管鳞癌细胞侵袭的影响 ×200
2.2 CCL20对食管鳞癌细胞增殖的影响过表达CCL20的ECA109和EC9706细胞吸光度在24 h(0.380±0.024)(0.316±0.012),48 h(0.768±0.014)(0.462±0.005)和72 h(1.496±0.133)(0.858±0.031)时,与对照组细胞吸光度24 h(0.344±0.012)(0.286±0.009),48 h(0.657±0.009)(0.447±0.004)和72 h(1.323±0.0587)(0.7886±0.0386)比较,差异无统计学意义(t=2.264、 11.680、 2.067,均P>0.05)(t=3.450、3.984、2.431,均P>0.05),提示CCL20对食管鳞癌细胞的增殖无明显影响。见图4。
图4 CCK8实验检测过表达CCL20后对食管鳞癌细胞增殖的影响
2.3 干扰CCL20对食管鳞癌细胞运动能力的影响
2.3.1建立CCL20干扰细胞株 靶向CCL20的3组shRNA(shCCL20#1、2、3)均能降低EC9706细胞中的CCL20 mRNA的表达水平,尤其shCCL20#3组干扰效率最高。见图5。
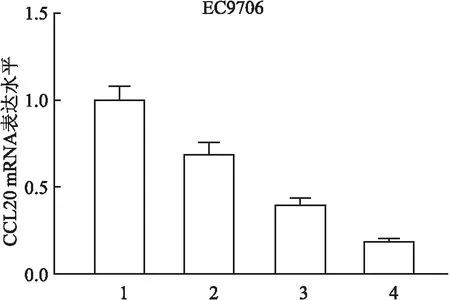
图5 实时定量PCR实验显示不同shCCL20质粒的干扰效果
2.3.2干扰CCL20表达对食管鳞癌细胞迁移侵袭的影响 与对照组细胞比较,干扰CCL20表达的EC9706细胞迁移和侵袭穿过Transwell聚碳酯膜的细胞数目均降低[(75.67±9.74)个vs(28.20±4.74)个][(81.00±13.67)个vs(24.57±8.36)个],差异有统计学意义(t=7.590、6.101,均P<0.01),提示干扰CCL20表达后食管鳞癌细胞迁移侵袭能力下降。见图6。
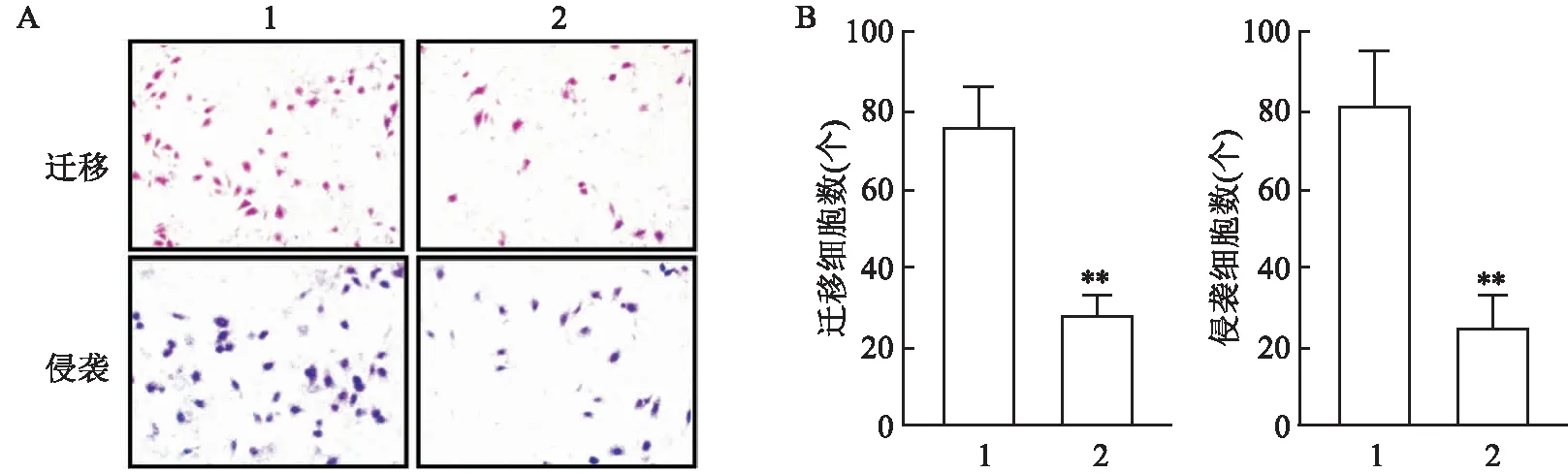
图6 干扰CCL20表达对食管鳞癌细胞迁移和侵袭能力的影响 ×200
2.4 CCL20的下游通路探讨
2.4.1抑制ERK通路对食管鳞癌细胞迁移侵袭的影响 ERK1/2特异性抑制剂(SCH772984)(1 μmol/L)处理EC9706细胞1~2 d后, 与CCL20组比较,CCL20+抑制剂组迁移和侵袭通过Transwell小室膜的细胞数目减少[(208.30±42.13)个vs(83.00±21.82)个][(212.70±72.53)个vs(53.43±9.93)个],差异有统计学意义(t=4.575、3.769,均P<0.05)。四组间差异有统计学意义(F=18.94、17.22,P<0.001),见图7。
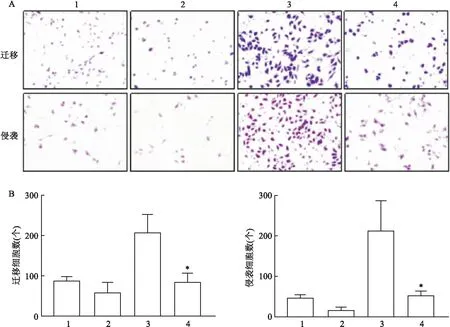
图7 抑制ERK通路对食管鳞癌细胞迁移侵袭能力的影响 ×200
2.4.2过表达或者干扰CCL20对ERK蛋白的影响 与对照组细胞比较,过表达CCL20的 EC9706细胞中ERK1/2蛋白磷酸化激活水平增加,干扰CCL20表达后, ERK1/2蛋白的磷酸化激活水平下降。见图8。
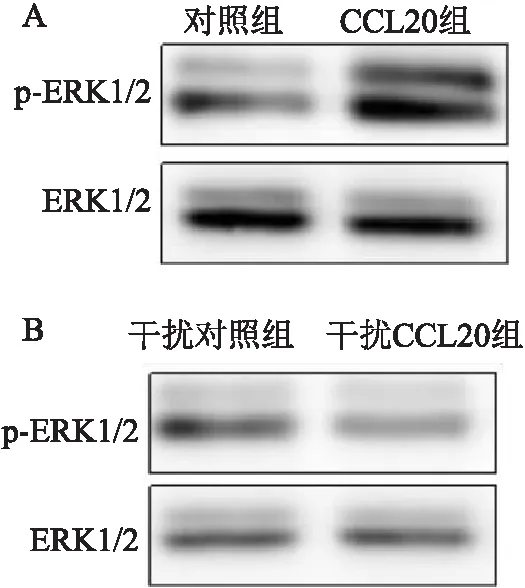
图8 过表达或者干扰CCL20对ERK蛋白的影响
3 讨论
转移和复发一直是食管鳞癌患者死亡的主要原因,关于肿瘤转移的研究很多,然而至今也不能完全阐明肿瘤转移的分子机制。但是肿瘤细胞的转移和趋化因子有密切关系,趋化因子可以通过招募特异型免疫细胞进入肿瘤微环境[8],为肿瘤细胞转移定植后的存活提供支持,还可以促进肿瘤的恶性进展。
CCL20和其它趋化因子一样,可以介导免疫细胞的趋化转移,在肿瘤免疫过程中发挥作用。有研究[9]报道CCL20可以招募Treg细胞增强结直肠癌的化疗抵抗,在食管鳞癌中,CCL20可以招募Treg细胞促进食管鳞癌的进展,并且CCL20表达高的患者的预后更差[10]。另外,CCL20在多种肿瘤中作为危险因子促进肿瘤的进展,例如促进喉癌细胞的增殖和转移[11],在乳腺癌中促进肿瘤细胞侵袭和迁移[12]。但是未发现CCL20与食管鳞癌转移的相关研究,本研究对CCL20在食管鳞癌细胞中的作用及其潜在的分子机制进行了初步探索,发现过表达CCL20后,食管鳞癌细胞的迁移和侵袭能力增强,干扰CCL20的表达可以抑制食管鳞癌细胞迁移和侵袭,表明CCL20可以增强食管鳞癌细胞的运动能力,增加食管鳞癌细胞的转移潜能。为了寻找CCL20促进食管鳞癌细胞运动的下游信号通路,本研究检测了ERK信号通路特异性抑制剂(SCH772984,1 μmol/L)处理对食管鳞癌细胞侵袭迁移的影响,结果ERK1/2特异性通路抑制剂处理显著降低了食管鳞癌细胞的迁移和侵袭能力,这意味着CCL20可能是通过ERK通路促进食管鳞癌细胞迁移和侵袭。为了验证实验结果,Western blot实验检测了过表达CCL20后ERK1/2蛋白的变化,发现过表达CCL20后,ERK1/2蛋白的磷酸化水平增加,干扰CCL20的表达后,ERK1/2的磷酸化水平降低,这些结果表明过表达CCL20后,ERK通路异常激活,干扰CCL20后,ERK通路的激活受到抑制,进一步印证了CCL20通过激活ERK通路促进食管鳞癌细胞迁移和侵袭的实验结果。本研究增加了人们对食管鳞癌转移潜在机制的了解,提示CCL20可能在食管鳞癌转移过程中发挥重要作用,为食管鳞癌患者的治疗提供了新的方向。
