基于网络药理学与实验研究探讨β-葡聚糖治疗S180腹水瘤的作用机制
2022-03-30杨文卿姜涛程路峰新疆医科大学药学院乌鲁木齐8300新疆医学动物模型研究重点实验室乌鲁木齐8300
杨文卿,姜涛,程路峰*(. 新疆医科大学药学院,乌鲁木齐 8300;. 新疆医学动物模型研究重点实验室,乌鲁木齐 8300)
近年来,癌症的发病率逐年升高[1]。有研究发现2018年全球新发癌症人数达1810万,我国占24%(约430万)[2]。目前对于肿瘤的治疗以免疫治疗与靶向治疗为主,但治疗过程中易产生耐药、副作用大等问题[3]。
天然多糖为结构多样的生物大分子,从不同的植物、动物以及微生物中分离得到,在抗氧化[4]、抗凝血[5]、抗肿瘤[6]及刺激免疫[7]等方面表现出良好的活性。多种食用菌多糖已在体内外体现出明显的抗肿瘤及免疫调节作用[8-9]。本研究利用网络药理学方法,以β-葡聚糖与腹水瘤作为研究对象,预测相关靶点及通路,并建立相关模型对其进行实验验证,以阐述其抗肿瘤的作用机制。
1 材料
1.1 软件与数据库
β-葡聚糖靶点的预测:Swiss Target Prediction数据库(http://www.swisstargetprediction.ch);疾病靶点的获取:Geen Cards数据库(https://www.genecards.org);OMIM数据库(https://omim.org)。靶点间相互作用关系分析:String网站(https://string-db.org)。相关关系图的绘制:Draw Veen网站(http://bioinfornatics.psb.ugent.be/webtools/Veen/)。互作网络图的绘制:Cytoscape 3.8.0软件。相关通路分析:R Studio 3.6.3软件。
1.2 细胞株与实验动物
S180细胞(中乔新舟细胞库);C57小鼠,雌鼠体质量20~23 g;雄鼠体质量28~31 g,SPF级[新疆医科大学实验动物中心,合格证编号:SCXK(新)2018-0002]。
1.3 试药
β-葡聚糖(S24487,上海源叶);顺 铂(IC0440,索莱宝公司);胎牛血清(FBS10099-141,Gibco);RPMI1640培养基(AE29163439,Hyclone);双抗链霉素混液(Gibco);二甲基亚砜(DMSO,Sigma);小鼠白细胞介素(IL)-2、IL-4、IL-6、肿瘤坏死因子-α(TNF-α)、γ干扰素(IFN-γ)酶联免疫吸附(ELISA)试剂盒(钰博生物有限公司)。Bcl-2、Bax、Caspase-3、VEGF、JAK2、STAT3兔抗小鼠抗体(Abcam);山羊抗兔二抗(Bioss,bs-40295G-HRP)。
1.4 仪器
光学显微镜、3-18K离心机(Sigma);蛋白电泳仪及转印仪(Bio-Rad);凝胶图像分析软件。
2 方法
2.1 β-葡聚糖及腹水瘤疾病靶点预测
采用Swiss Target Prediction对β-葡聚糖作用靶点进行预测,使用Geen Cards与OMIM数据库预测腹水瘤疾病靶点。
2.2 β-葡聚糖抗肿瘤作用靶点预测与Network网络图的构建
将上述β-葡聚糖作用靶点与抗肿瘤相关靶点导入Veen数据库进行交互分析,将药物作用靶点与Veen图中交集靶点导入Cytoscape 3.8.0,获得药物-疾病-靶点相互作用网络图。
2.3 蛋白互作、GO与KEGG分析
将交互靶点导入String数据库,将得到的蛋白互作关系网导入Cytoscape软件,得到PPI互作图。使用R Studio对所有预测靶点进行GO与KEGG富集分析,获得目的靶点参与关键通路的信息。
2.4 β-葡聚糖对S180细胞活性的影响
取对数生长期的S180细胞接种于96孔板中,每孔5000个细胞,培养2 h后,加入不同浓度的β-葡聚糖,每组设置5个复孔,同时设定空白对照组。药物分别作用24、48 h后,每孔加入10 μL的CCK-8,孵育1.5 h,使用酶标仪于450 nm处测定光密度值(OD)。根据公式记录β-葡聚糖对S180细胞的抑制率。抑制率(%)=[(OD对照孔-OD实验孔)/(OD对照孔-OD空白孔)]×100%。
2.5 动物模型的建立
取对数生长期S180细胞,调整细胞密度为7×105个·mL-1,于每只小鼠皮下接种0.2 mL细胞悬液,并对小鼠荷瘤情况进行观察及记录,接种部位出现实体瘤并伴随腹部肿大则提示造模成功。
2.6 分组及给药
取80只造模成功的荷瘤小鼠,适应环境饲养1周后随机分为正常组,模型组,顺铂组,β-葡聚糖低(50 mg·kg-1)、中(100 mg·kg-1)、高(200 mg·kg-1)剂量组。正常组与模型组灌胃等体积的蒸馏水,顺铂组按照0.2 mg·kg-1的剂量腹腔注射顺铂,β-葡聚糖组按照对应剂量灌胃给药。隔日给药,1次·d-1。连续给药3周,每周根据动物体质量情况调整给药体积。
2.7 观察指标
2.7.1 测定各组小鼠的抑瘤率及脾脏指数 给药21 d后,眼球取血,颈椎脱臼法处死小鼠。检测各组小鼠的抑瘤率及脾脏指数。抑瘤率(%)=[(模型组肿瘤质量-实验组肿瘤质量)/模型组肿瘤质量]×100%,脾脏指数=脾脏质量/体质量。
2.7.2 小鼠血清中IL-2、IL-4、IL-6、TNF-α、IFN-γ的含量 采小鼠眼球静脉血,放置6 h,使血清充分析出,1500 r·min-1离心10 min,收集血清。参照ELISA试剂盒说明书方法测定小鼠血清中IL-2、IL-4、IL-6、TNF-α、IFN-γ的含量。
2.7.3 蛋白印迹法(Western blot)测定小鼠瘤组织中Bax、Bcl-2、VEGFA、JAK2、STAT3蛋白的表达 将瘤组织加入液氮,研磨粉碎。通过增量法称定质量,按照每1 mg添加10 μL的比例添加裂解液(RIPA∶PMSF=100∶1),置于冰上裂解30 min。裂解后于4℃、12 000 r·min-1离心10 min,取上清液,采用BCA蛋白定量试剂盒进行蛋白定量。取高温变性后的蛋白质(20 μg/lane),采用8%SDS聚丙烯酰胺凝胶分离,转移至PVDF膜上,使用5%脱脂奶粉封闭2 h,用1×TBST清洗3次,每次10 min,一抗4℃孵育过夜;加入辣根过氧化物酶标记的二抗避光孵育2 h;曝光、显影、定影。用凝胶图像分析软件分析各条带光密度值,以β-actin为内参照,目的蛋白相对表达量以目的蛋白与β-actin光密度比值表示。
2.8 统计学处理
采用SPSS 22.0软件进行统计分析,计量资料以均数±标准差(±s)表示,组间比较采用单因素方差分析,以P<0.05为差异有统计学意义。
3 结果
3.1 β-葡聚糖作用靶点及腹水瘤靶点预测结果、药物-疾病-靶点相互作用网络图的构建
分别从数据库中获取β-葡聚糖的作用靶点33个与腹水瘤疾病靶点3116个。将上述靶点导入Veen数据库进行交互分析(见图1A),获得交集靶点12个用于本实验的后续研究。将药物作用靶点与Veen图中交集靶点导入Cytoscape 3.8.0,获得药物-疾病-靶点相互作用网络图,涉及DRD1、VEGFA、FGF2、HPSE、CDK1等12个交集靶点,见图1B。

图1 药物-靶点Veen图(A)与药物-疾病-靶点网络图(B)Fig 1 Drug-target veen diagram(A) and drug-disease-target network diagram(B)
3.2 蛋白互作、GO及KEGG分析
将交互基因导入String数据库,分析获得VEGFA、STAT3、FGF2、HSP90AA1等8个靶点的相互作用关系,见图2A。使用R Studio对交集靶点进行GO及KEGG富集分析,GO分析得到MAPK激酶的正向调控、内皮细胞趋化性的调节、蛋白激酶活性的激活、血管生成的正向调节、中肾小管形态的发生等生物过程与化学诱导活性、生长因子受体结合、成纤维细胞生长因子受体结合以及热休克蛋白结合等分子功能,见图2B、2C。通路富集分析得到癌症中的蛋白多糖、EGFR酪氨酸激酶抑制剂、钙信号通路、PI3K-Akt通路、MAPK信号通路、TH17细胞分化通路及HIF-1信号通路等15条通路,见图2D。

图2 蛋白互作网与GO、KEGG分析Fig 2 Protein interaction network and GO,KEGG analysis A.蛋白互作网络图(protein interaction network);B.生物过程图(bioprocess);C.细胞组成图(cell composition);D.分子功能图(molecular function)
3.3 生物学验证
3.3.1β-葡聚糖对S180细胞活性的影响 如图3所示,与对照组相比,各剂量β-葡聚糖作用24 h对S180细胞均无直接抑制作用。

图3 不同浓度β-葡聚糖对S180细胞活性的影响Fig 3 Effect of different concentrations of β-glucan on S180 cell
3.3.2β-葡聚糖对S180荷瘤小鼠肿瘤生长的影响
如表1所示,与模型组比较,各给药组均有显著的抑瘤作用。其中顺铂组抑瘤作用最强,抑瘤率达到64.76%;β-葡聚糖给药组抑瘤率伴随着给药剂量的增加呈上升趋势。
3.3.3β-葡聚糖对S180荷瘤小鼠脾脏指数的影响如表1所示,与空白组比较,模型组脾脏指数显著升高(P<0.01);与模型组比较,各剂量β-葡聚糖给药组脾脏指数均显著降低(P<0.01)。
表1 β-葡聚糖对S180荷瘤小鼠肿瘤生长及脾脏指数的影响( ±s,n=8)Tab 1 Effect of β-glucan on tumor growth and spleen index of S180 tumor-bearing mice ( ±s,n=8)

表1 β-葡聚糖对S180荷瘤小鼠肿瘤生长及脾脏指数的影响( ±s,n=8)Tab 1 Effect of β-glucan on tumor growth and spleen index of S180 tumor-bearing mice ( ±s,n=8)
注:与空白组比较,**P<0.01;与模型组比较,##P<0.01。Note:Compared with the blank group,**P<0.01;compared with the model group,##P<0.01.
组别 瘤质量/g 抑瘤率/% 脾脏指数/(mg·g-1)空白组 - - 3.81±0.57模型组 5.54±0.82 - 9.09±1.37**顺铂组 1.95±0.42## 64.76 5.25±1.01##低剂量组 4.64±0.45# 16.28 5.91±1.32##中剂量组 4.14±0.48## 25.32 6.57±1.03##高剂量组 3.04±0.47## 45.14 6.66±1.18##
3.3.4β-葡聚糖对S180荷瘤小鼠相关细胞因子的影响 如表2所示,与空白组比较,模型组小鼠血清中IL-2、IL-4水平明显降低(P<0.01)。与模型组比较,顺铂组及β-葡聚糖各给药组IL-2、IL-4、TNF-α、IFN-γ水平具有上升趋势,IL-6水平具有下降趋势。
表2 β-葡聚糖对S180荷瘤小鼠细胞因子的影响( ±s,n=8)Tab 2 Effect of β-glucan on cytokines in S180 tumor-bearing mice ( ±s,n=8)
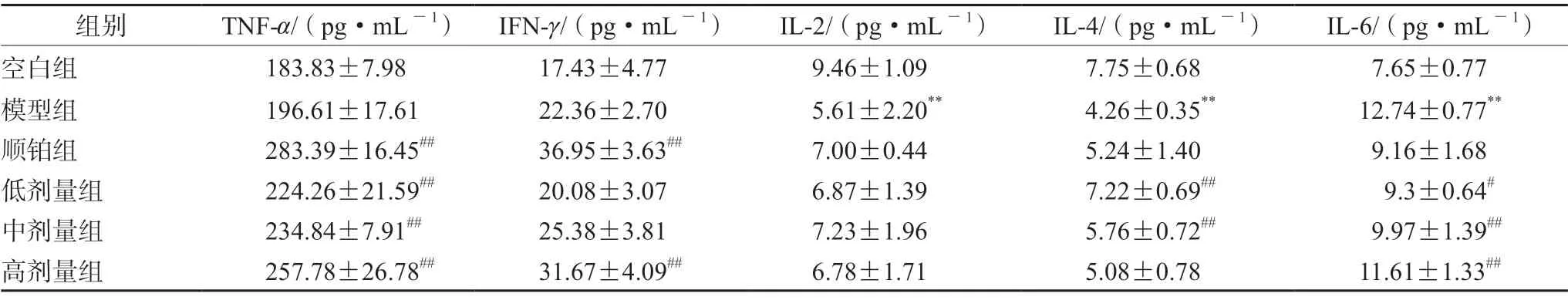
表2 β-葡聚糖对S180荷瘤小鼠细胞因子的影响( ±s,n=8)Tab 2 Effect of β-glucan on cytokines in S180 tumor-bearing mice ( ±s,n=8)
注:与空白组比较,**P<0.01;与模型组比较,#P<0.05,##P<0.01。Note:Compared with the blank group,**P<0.01;compared with the model group,#P<0.05,# #P<0.01.
组别 TNF-α/(pg·mL-1) IFN-γ/(pg·mL-1) IL-2/(pg·mL-1) IL-4/(pg·mL-1) IL-6/(pg·mL-1)空白组 183.83±7.98 17.43±4.77 9.46±1.09 7.75±0.68 7.65±0.77模型组 196.61±17.61 22.36±2.70 5.61±2.20** 4.26±0.35** 12.74±0.77**顺铂组 283.39±16.45## 36.95±3.63## 7.00±0.44 5.24±1.40 9.16±1.68低剂量组 224.26±21.59## 20.08±3.07 6.87±1.39 7.22±0.69## 9.3±0.64#中剂量组 234.84±7.91## 25.38±3.81 7.23±1.96 5.76±0.72## 9.97±1.39##高剂量组 257.78±26.78## 31.67±4.09## 6.78±1.71 5.08±0.78 11.61±1.33##
3.3.5β-葡聚糖对Bax、Bcl-2、VEGFA、JAK2、STAT3蛋白表达的影响 如图4所示,与模型组比较,顺铂组与β-葡聚糖各给药组均能使Bax蛋白的表达上调,使Bcl-2、VEGFA、JAK2以及STAT3蛋白的表达下调。
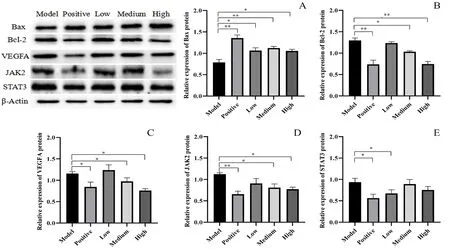
图4 Bax(A)、Bcl-2(B)、VEGFA(C)、JAK2(D)、STAT3(E)蛋白的相对表达量(P<0.05,P<0.01)Fig 4 Relative expression of Bax(A),Bcl-2(B),VEGFA(C),JAK2(D),and STAT3(E)protein(P<0.05,P<0.01)
4 讨论
作为真菌细胞壁含量最高的多糖[10],β-葡聚糖可对肿瘤细胞进行有效攻击而对正常细胞无杀伤作用[11]。天然多糖因其治疗效果显著且毒副作用较轻而受到关注[12]。有研究表明,β-葡聚糖作为一种高效的生物应答物能够提高机体免疫力[13]。因此本实验观察β-葡聚糖在体内外对S180腹水瘤的疗效,并进一步明确其作用机制。
本文通过对已有数据集分析β-葡聚糖可能作用于腹水瘤的靶点,获得12个潜在靶点,对其进一步分析明确交集靶点涉及VEGFA、STAT3等8个靶点;从GO与KEGG富集结果来看,β-葡聚糖可能通过干预MAPK激酶的正向调控、内皮细胞趋化性的调节、蛋白激酶活性的激活、血管生成的正向调节,调控PI3K-Akt、EGFR、MAPK等信号通路发挥作用。
本研究发现高剂量β-葡聚糖对S180荷瘤小鼠的抑瘤作用较好,抑瘤率为45.14%。本实验选择了能够反映细胞及体液免疫的脾脏指数[14]进行考察,发现各剂量β-葡聚糖给药组均可降低脾脏指数。提示其抗肿瘤机制可能与对机体免疫器官的保护作用相关。
在肿瘤发生发展过程中,T淋巴细胞会释放出多种细胞因子。细胞因子TNF-α、IFN-γ、IL-2、IL-4及IL-6可以结合自身相对应的受体调节细胞的生长、分化并对免疫应答过程进行调控[15]。其中,TNF-α含量在一定的范围内可对受损的组织起到修复作用,但当其浓度异常升高时,也会对组织造成一定的损伤[16]。体内实验研究表明,β-葡聚糖能够升高小鼠血清中TNF-α含量,可能与增加血清中肿瘤坏死因子含量从而发挥抗肿瘤作用有关。IFN-γ由活化的Th细胞与NK细胞产生,可以促进Th1细胞的生长发育,对于免疫调控也具有一定的影响[17]。β-葡聚糖能升高小鼠血清中IFN-γ水平,可能与其可促进机体产生相应的免疫因子相关。IL-2可促进T细胞的生长,在抑制肿瘤细胞生长的特异性免疫反应中扮演重要角色。IL-4作为具有生物学活性的细胞因子,可以通过少量的分泌对人体起到保护作用,在感染以及肿瘤的治疗中发挥作用。但当其分泌量较大时,将会促进肿瘤的发生发展。IL-6最初被作为一种炎症因子被人们所认识,之后越来越多的研究发现IL-6在癌症患者的体内还可作为“促瘤因子”发挥促瘤效应[18]。
有研究发现肿瘤细胞凋亡过程中紊乱的发生与肿瘤的产生密切相关,多种基因共同调控肿瘤细胞的凋亡过程,例如促凋亡基因、抑制凋亡基因及凋亡效应基因等[19]。Bcl-2家族在凋亡的过程中扮演着重要的角色,以具有对抗凋亡的Bcl-2蛋白以及促进凋亡的Bax蛋白为代表。当Bcl-2表达过高时,可以抑制细胞凋亡;但Bcl-2表达不足,Bax表达过量时,体内的Bax同源二聚体占据优势,会促进细胞凋亡[20]。在本实验中,相较于模型组,各给药组的Bcl-2蛋白表达量均降低,Bax蛋白表达量均升高,以顺铂组最为明显,高、中剂量的β-葡聚糖次之。
JAK-STAT信号通路经上游细胞因子产生刺激,而对下游包括Bcl-2、Bax及VEGF等靶基因进行调控并参与细胞增殖、分化、凋亡、血管生成等生物学过程[21]。VEGF作为生理和病理性血管生成所必需的促血管生成因子在肿瘤的发生发展中扮演着重要的角色[22]。STAT3作为信号转导子和转录激活蛋白家族成员之一,其异常激活可上调VEGF的表达[23]。网络药理学预测结果表明,VEGF、STAT3靶点在β-葡聚糖治疗腹水瘤中发挥重要作用。Western blot结果提示,相较于模型组,小剂量β-葡聚糖给药组对其抑制作用不显著,而β-葡聚糖中、高剂量组均能降低JAK2、STAT3以及VEGFA蛋白的表达量,并能显著抑制肿瘤的生长。
联合作用靶点分析发现VEGFA、JAK、STAT3与多条通路密切相关,表皮生产因子通路中的VEGF/JAK/STAT3靶点与凋亡抑制基因Bcl2及促癌基因Bax的蛋白表达情况如图5所示。

图5 PI3K-Akt及EGFR富集通路图Fig 5 PI3K-Akt and EGFR enrichment pathway
一方面,β-葡聚糖通过影响JAK与Bcl-2蛋白相对表达量调控PI3K-Akt通路,改善腹水瘤小鼠炎症状态;另一方面,β-葡聚糖通过下调VEGFA、JAK2、STAT3蛋白表达水平及IL-6表达水平,上调IFN-γ、IL-2、IL-4水平,影响EGFR信号通路,从而抑制小鼠腹水瘤组织的表皮生长因子通路,发挥抗肿瘤作用,且β-葡聚糖还通过降低Bcl2和升高Bax的蛋白表达水平,抑制腹水瘤组织中肿瘤细胞的生长。
综上所述,β-葡聚糖可能是通过影响JAK2/STAT3/VEGF等靶点,参与调节PI3K-Akt、EGFR等通路,从而发挥促进肿瘤凋亡的作用。
