膜分离技术与传统工艺联合对山茱萸皂苷的分离纯化
2022-03-30黎叶凡朱华旭唐志书刘红波宋忠兴姬莎莎陕西中医药大学陕西中药资源产业化省部共建协同创新中心陕西咸阳712083秦药特色资源研究与开发国家重点实验室培育陕西省创新药物研究中心陕西咸阳712083南京中医药大学江苏省植物药深加工工程研究中心江苏省中药资源产业化过程协同创新中心南京210023
黎叶凡,朱华旭,唐志书*,刘红波,宋忠兴,姬莎莎(1. 陕西中医药大学/陕西中药资源产业化省部共建协同创新中心,陕西 咸阳 712083;2. 秦药特色资源研究与开发国家重点实验室(培育)/陕西省创新药物研究中心,陕西 咸阳 712083;3. 南京中医药大学/江苏省植物药深加工工程研究中心/江苏省中药资源产业化过程协同创新中心,南京 210023)
传统山茱萸皂苷分离纯化大多使用化学沉淀法、正丁醇萃取法、重结晶法、分馏法,传统纯化方法存在效率低、步骤繁琐,重复性差、纯化周期长,一些方法有机溶剂残留严重等缺点,无法应用于大量皂苷的分离纯化。大孔吸附树脂为一种常用的纯化手段,具有吸附解吸速度快、吸附容量大、容易再生、使用寿命长等优点,现已被广泛应用于皂苷的分离和富集。
膜分离技术(membrane separation technology,MST)是一门分离新技术。利用“筛分”效应实现大分子与小分子分离,具有效率高、污染小、节省能源等优点,已广泛应用于食品、医药、环境等多个领域,成为当今分离科学中最重要的手段之一。MST主要利用相对分子质量的差异达到分离的目的,对皂苷的分离纯化有非常重要的应用价值。目前已经应用 MST 对绞股蓝皂苷、三七叶苷、油茶皂苷、胡芦巴总苷等多种皂苷类成分进行了分离纯化,且显示出良好的效果。
本试验将传统大孔树脂吸附的分离纯化工艺与现代MST联合,以过膜前后皂苷含量、除杂率、回收率、指标成分转移率、膜污染程度为评价指标,综合评价不同孔径的微滤膜、超滤膜,不同种类大孔树脂对山茱萸皂苷的适用性。以大孔树脂的饱和吸附量、吸附率、解吸率评价大孔树脂污染程度。
1 材料
1.1 仪器
N-1300型旋转蒸发仪(上海爱郎仪器有限公司);UV-2600型紫外可见分光光度计(日本岛津公司);调温型电热套(北京科伟永兴仪器有限责任公司);电热恒温水浴锅(上海科恒实业发展有限公司);SHZ-D(Ⅲ)型循环水式真空泵(巩义市予华仪器有限责任公司);Sartorius CPA225D型电子分析天平(德国赛多利斯科学仪器有限公司,精度:十万分之一);Scout型电子天平(奥豪斯仪器常州有限公司,精度:百分之一);LNG-HFM-101型实验室膜分离设备(上海朗极膜分离设备工程有限公司);Waters 2695 HPLC高效液相色谱仪(美国Waters 公司);KQ-300DE型数控超声波清洗器(昆山市超声仪器有限公司);DHG-9202-3型红外线恒温鼓风干燥箱(金坛区华城敏科实验仪器厂);YKF-150型制水机(杭州华新净水有限公司)。
1.2 试药
山茱萸药材购自陕西兴盛德药业有限公司,经陕西中医药大学刘世军教授鉴定符合2020年版《中国药典》有关质量规定;人参皂苷Re(批号:110754-202028,供含量测定用)、马钱苷(批号:111640-201808,供含量测定用)对照品(中国食品药品检定研究院);莫诺苷、獐牙菜苷、山茱萸新苷对照品(批号分别为121768-202014、111396-201911、111345-201908,供含量测定用,上海源叶生物科技有限公司);PVDF微滤膜(0.1 μm,0.22 μm,0.45 μm)、PES超滤膜(100 kDa,50 kDa,30 kDa,10 kDa,5 kDa)(美 国Biomax公司);乙腈(色谱纯,霍尼威尔贸易上海有限公司);磷酸(色谱纯,天津市天士力化学试剂有限公司);甲醇、香草醛、高氯酸、冰醋酸均为分析纯;HPD-600、HPD-300、D-101、H-103、AB-8、NKA-9型大孔树脂(西安蓝深特种树脂有限公司);水为自制超纯水。
2 方法与结果
2.1 山茱萸皂苷的测定
精密称取人参皂苷 Re对照品2 mg,加甲醇溶解并定容至10 mL量瓶中,作为对照品溶液。精密吸取对照品溶液0、0.2、0.4、0.6、0.8、1 mL于具塞试管中,水浴加热挥干溶剂,精密加入新鲜配制的 5% 香草醛-冰醋酸溶液0.2 mL、高氯酸0.8 mL,振摇混匀后于60℃ 水浴加热15 min取出,冰水冷却2 min后,加冰醋酸 5 mL摇匀,静置5 min。溶液在400~800 nm范围内扫描,对照空白试剂,测得人参皂苷Re的最大吸收波长为540 nm,故选择540 nm为测定波长。以吸光度(A
)为纵坐标,人参皂苷 Re质量浓度(C
)为横坐标,绘制标准曲线。计算得标准曲线回归方程:A
=20.826C
-0.1222,R
=0.9997。结果表明,人参皂苷Re在5~30 μg·mL与吸光度呈良好的线性关系。2)结果枝上有花芽,能开花结果。按其长短和特性可分为混合枝、长果枝、中果枝、短果枝、花束状果枝。①混合枝。长度在20 cm以上,中上部侧芽全部是叶芽,枝条基部几个侧芽为花芽。②长果枝。长度15~20 cm,除顶芽及其邻近几个侧芽为叶芽外,其余侧芽均为花芽。③中果枝。长度5~15 cm,除顶芽为叶芽外,侧芽全部为花芽。④短果枝。长度5 cm以下,除顶芽为叶芽外,其余芽全部为花芽。⑤花束状果枝。一种极短的结果枝,年生长量很小,仅1~2 cm,节间很短,除顶芽为叶芽外,其余均为花芽,围绕在叶芽周围。以上几类结果枝因品种、树龄、树势不同,所占比例也不同。
2.2 皂苷的提取工艺流程
称取山茱萸饮片适量,将药材粉碎后加入圆底烧瓶,加10倍量70%乙醇加热回流提取2次,每次2 h,冷却过滤,合并滤液,离心弃沉淀得上清液,上清液减压浓缩至无醇味,加6倍量蒸馏水混合均匀,即得山茱萸水溶液,备用。山茱萸水溶液用MST进行纯化精制,再使用传统大孔树脂吸附工艺进一步纯化。
2.3 指标成分转移率的测定
2.3.1 色谱条件色谱柱Ultimate XB-C(250 mm×4.6 mm,5 μm);PDA二极管阵列检测器;柱温30℃;体积流量1.0 mL·min;检测波长240 nm;进样量10 μL;梯度洗脱条件见表1。
表1 HPLC梯度洗脱条件
Tab 1 Gradient elution conditions of HPLC
时间/min A. 0.3%磷酸/% B. 乙腈/%1 90 10 5 86 14 9 84 16 12 83 17 15 72 28 18 66 34 25 90 10
2.3.2 对照品溶液的配制 精密称取经五氧化二磷干燥至恒重的莫诺苷、马钱苷、獐牙菜苷、山茱萸新苷对照品各9.98、9.97、9.96、9.97 mg,置10 mL量瓶中,加80%甲醇至刻度,摇匀,即得质量浓度各为0.998 mg·mL、0.997 mg·mL、0.996 mg·mL、0.997 mg·mL的莫诺苷、马钱苷、獐牙菜苷、山茱萸新苷对照品储备液。
2.3.3 混合对照品溶液的配制 取獐牙菜苷对照品储备液0.5 mL置于10 mL量瓶中,加80%甲醇至刻度,摇匀,得0.05 mg·mL獐牙菜苷对照品溶液。取獐牙菜苷对照品溶液1 mL、取马钱苷对照品储备液0.6 mL、莫诺苷对照品储备液0.8 mL、山茱萸新苷对照品储备液0.1 mL置于10 mL量瓶中,得混合对照品溶液。
2.3.4 供试品溶液的制备 分别精密量取各供试品溶液1 mL,置于蒸发皿中,水浴蒸干溶剂,加80%甲醇溶解,置于10 mL量瓶中,加80%甲醇定容至刻度,摇匀,经0.22 μm滤膜过滤,即得供试品溶液。
2.3.5 线性关系考察 精密吸取马钱苷、莫诺苷对照品储备液 0.1、0.2、0.4、0.6、0.8、1 mL 分别置于10 mL量瓶中,加80%甲醇至刻度,摇匀。取獐牙菜苷对照品储备液0.1、0.5、1、1.5、2 mL分别置于100 mL量瓶中,加80%甲醇至刻度,摇匀。取山茱萸新苷对照品储备液0.5、1、1.5、2、2.5 mL分别置于100 mL量瓶中,加80%甲醇至刻度,摇匀。各进样 10 μL测定。以质量浓度为横坐标(X
),峰面积为纵坐标(Y
),进行线性回归,得回归方程见表2。表2 各成分线性关系(=6)
Tab 2 Linear relationship of components (=6)
成分 回归方程 R2 线性范围/(μg·mL-1)马钱苷 Y=2×107X-2.19×103 0.9998 9.98~99.8莫诺苷 Y=2×107X-1.47×104 0.9998 9.97~99.7獐牙菜苷 Y=2×107X-8.86×103 0.9999 0.996~19.92山茱萸新苷 Y=1×107X-4.30×104 0.9998 4.99~24.93
2.3.6 除杂率(Q
)与皂苷回收率(P
)的计算Q
=(Q
-Q
)/Q
×100%,式中Q
为山茱萸水溶液固形物含量,Q
为透过液固形物含量。P
=(P
/P
)×100%,式中P
为透过液皂苷含量,P
为原液皂苷含量。Q
值越大,说明该除杂方式去除杂质效果越好;P
值越大,说明透过液中的皂苷含量越高。2.3.7 指标成分转移率(T
)的计算T
=C
/C
×100%,式中C
为渗透液中马钱苷、莫诺苷、獐牙菜苷、山茱萸新苷含量,C
为原液中马钱苷、莫诺苷、獐牙菜苷、山茱萸新苷含量。T
值越大,说明山茱萸皂苷中单成分转移率越高。2.3.8 膜污染程度的测定 使用通量下降率(M
)表示膜污染程度:M
=(J
-J
)/J
×100%,J
为初始纯水通量,J
为污染膜的纯水稳定通量。M
越大,表示透过量衰减越大,污染越严重。2.4 微滤膜技术的精制处理[28]
山茱萸水溶液分别经膜孔径为0.1、0.22、0.45 μm的聚偏氟乙烯微滤膜(MF)处理,得微滤渗透液。以过膜前后除杂率、皂苷回收率、指标成分转移率及膜污染程度为评价标准,考察不同孔径的聚偏氟乙烯微滤膜对该体系的适用性。膜微滤操作条件:过膜温度 25℃,过膜压差值 0.3 MPa,结果见表3、4。皂苷含量、回收率与指标成分转移率随膜孔径的增大而增大;膜污染程度与除杂率随膜孔径的增大而减小。可能由于乙醇提取得到的山茱萸水溶液中低极性成分和皂苷形成不溶于水的复合物被微滤膜截留下来,膜孔径小,导致山茱萸水溶液中杂质拦截多,微滤膜的膜孔径构架上吸附杂质变多,在微滤膜表面形成的滤饼层较厚,导致皂苷的透过减少,从而皂苷含量、回收率与指标成分转移率下降明显。同理,膜孔径越小拦截杂质较多,除杂率越高,膜表面污染物的沉积使小孔径膜产生了更为严重的膜污染,导致膜污染速度加快,膜污染程度严重,从而造成此现象。综合考虑0.22 μm孔径的微滤膜(MF0.22)最为适用。
表3 微滤膜孔径对除杂率和皂苷回收率的影响(=3)
Tab 3 Effect of pore size of microfiltration membrane on impurity removal rate and saponin recovery rate (=3)
MF膜孔径/ μm 皂苷含量/% 除杂率/% 皂苷回收率/%0.1 47.43±2.21 35.45±2.76 80.24±2.51 0.22 53.88±3.56 28.72±1.89 93.71±3.23 0.45 75.51±3.32 10.73±3.12 96.35±1.96
表4 微滤膜孔径对皂苷成分转移率与膜污染程度的影响(=3)
Tab 4 Effect of pore size of microfiltration membrane on saponin transfer rate and membrane pollution degree (=3)
MF膜孔径/ μm 指标成分转移率/% 膜污染程度/%马钱苷 莫诺苷 獐芽菜苷 山茱萸新苷0.1 68.16±2.76 75.44±1.21 72.34±1.78 63.41±2.65 56.67±1.88 0.22 83.34±1.86 84.39±1.54 80.15±2.31 78.29±1.87 45.52±2.15 0.45 89.45±3.11 88.57±2.16 85.65±1.44 83.15±1.63 32.77±1.64
2.5 超滤膜技术的精制处理
山茱萸水溶液分别经膜孔径为截留相对分子质量分别为5、10、30、50、100 kDa的聚醚砜超滤膜(UF)处理,得超滤膜渗透液。以过膜前后除杂率、皂苷回收率、指标成分转移率及膜污染程度为评价标准,考察不同孔径的聚醚砜超滤膜对该体系的适用性。膜微滤操作条件:过膜温度25℃,过膜压差值 0.3 MPa,结果见表5、6。从表5、6可知,皂苷含量、回收率与指标成分转移率随膜孔径的增大而增大;膜污染程度与除杂率随膜孔径的增大而减小。综合考虑各项因素,选择50 kDa孔径的超滤膜(UF50)来纯化山茱萸皂苷较为适宜。
表5 超滤膜孔径对除杂率和皂苷回收率的影响(=5)
Tab 5 Effect of ultrafiltration membrane pore size on impurity removal rate and saponin recovery (=5)
UF膜孔径/kDa 皂苷含量/% 除杂率/% 皂苷回收率/%5 10.12±1.81 51.60±2.67 52.68±2.39 10 15.64±1.37 48.41±1.03 60.43±1.56 30 32.28±2.05 43.74±1.12 83.45±0.97 50 35.53±1.32 40.31±2.78 86.33±1.09 100 43.86±2.15 22.98±2.14 95.25±2.34
表6 超滤膜孔径对皂苷成分转移率与膜污染程度的影响 (=5)
Tab 6 Effect of ultrafiltration membrane pore size on saponin transfer rate and membrane pollution degree (=5)
UF膜孔径/ kDa 指标成分转移率/% 膜污染程度/%马钱苷 莫诺苷 獐芽菜苷 山茱萸新苷5 28.64±1.34 31.09±1.52 25.27±1.66 34.68±1.84 58.60±2.67 10 33.41±2.15 36.59±2.08 32.19±1.45 47.38±1.65 46.41±1.03 30 51.37±1.76 57.72±1.79 51.39±1.81 65.34±2.08 37.74±1.12 50 54.86±1.53 60.81±1.52 53.61±2.17 68.93±1.89 34.31±2.78 100 65.32±2.37 71.23±2.13 68.33±1.95 80.16±2.01 22.98±2.14
2.6 大孔树脂技术的精制处理
2.6.1 大孔树脂种类筛选 试验选取6种适合分离山茱萸皂苷的大孔吸附树脂(见表7),从中选出最优树脂用于分离纯化山茱萸皂苷。
表7 大孔树脂种类与性质(=6)
Tab 7 Types and properties of macroporous resin (=6)
树脂型号 平均孔径/μm 比表面积/(m2·g-1)HPD-600 80~90 550~600 HPD-300 90~110 500~550 D-101 90~100 500~550 H-103 85~95 1000~1100 AB-8 130~140 480~520 NKA-9 100~120 500~550
① 大孔树脂预处理:将大孔树脂用95%乙醇于室温下浸泡24 h,倾去上层乙醇,湿法装柱,用95%乙醇冲洗树脂柱,至流出液加水不产生白色浑浊为止;再用纯化水冲洗树脂柱至流出液无醇味;然后,用2 BV体积5%HCl溶液冲洗树脂柱,再用纯化水冲洗至流出液呈中性;再用2 BV体积5%NaOH溶液冲洗树脂柱,最后用纯化水冲洗至流出液呈中性,备用。
② 静态吸附:精密称取已预处理好的大孔树脂HPD-600、HPD-300、D-101、H-103、AB-8、NKA-9各10 g,置于150 mL锥形瓶中,加入山茱萸水溶液40 mL,置于25℃恒温水浴摇床上,以110 r·min的速度震荡4 h,静置12 h,使其达到饱和吸附,吸取上层药液检测。
③ 静态解吸:取上述达到静态饱和吸附药液的大孔树脂,滤过,水洗净,吸干表面水分,加入55%乙醇40 mL,置于25℃恒温水浴摇床上,以110 r·min的速度震荡2 h,静置8 h,使其解吸完全,以大孔树脂吸附洗脱前后除杂率、皂苷回收率、指标成分转移率为评价标准,考察不同种类的大孔树脂对该体系的适用性。结果见表8。
表8 大孔树脂种类对除杂率和皂苷回收率及皂苷成分转移率的影响(=6)
Tab 8 Effect of macroporous resin types on impurity removal rate, saponin recovery rate and saponin component transfer rate (=6)
树脂类型 皂苷含量/% 除杂率/% 皂苷回收率/% 指标成分转移率/%马钱苷 莫诺苷 獐芽菜苷 山茱萸新苷AB-8 44.73±2.05 30.19±1.68 62.44±1.66 70.15±1.66 75.07±1.57 65.16±1.35 59.23±1.58 HPD-300 65.59±1.87 42.33±1.93 88.16±2.03 87.61±2.33 93.72±1.69 85.33±1.89 83.17±1.77 D-101 58.34±2.13 35.82±2.07 77.45±1.84 80.13±1.89 86.39±1.74 76.47±1.76 72.32±1.59 H-103 48.67±1.94 31.94±1.57 68.58±2.18 74.76±2.15 78.51±2.02 68.94±1.54 63.67±1.62 HPD-600 61.56±2.23 38.61±2.18 82.92±1.73 83.49±2.19 90.18±1.58 81.69±2.11 78.34±1.88 NKA-9 55.34±1.85 33.74±1.86 73.66±1.84 77.42±1.38 82.43±1.69 72.17±1.23 67.23±1.97
由表8可知,HPD-300型大孔树脂的皂苷含量达到(65.59±1.87)%,除杂率为(42.33±1.93)%,皂苷回收率为(88.16±2.03)%,这3个指标成分均高于其他5种大孔树脂,指标性成分转移率相较于其他5种大孔树脂也有明显的提高,HPD-300型大孔树脂对山茱萸皂苷体系的适用性较好,故选择 HPD-300 型大孔树脂来分离纯化山茱萸皂苷。
2.7 微滤膜与超滤膜联用技术的精制处理
先将山茱萸水溶液经MF0.22微滤膜滤过后,再将微滤膜渗透液经UF50超滤膜滤过,收集超滤膜渗透液。以处理前后的除杂率、皂苷回收率、指标成分转移率为评价标准,考察膜联用方式对该体系的适用性。结果见表9。
表9 不同联用方式对除杂率和皂苷回收率及皂苷成分转移率的影响(=4)
Tab 9 Effects of different combination methods on impurity removal rate, saponin recovery rate and saponin component transfer rate (=4)
联用方式 皂苷含量/%除杂率/%皂苷回收率/%指标成分转移率/%马钱苷 莫诺苷 獐芽菜苷 山茱萸新苷HPD-300(1号) 52.02±1.58 64.59±1.56 69.82±1.79 60.51±1.71 55.76±1.28 57.83±1.33 57.12±1.77 MF0.22+UF50(2号) 48.32±1.49 48.61±1.31 75.82±2.48 56.34±1.65 53.42±1.39 51.43±1.71 54.35±1.62 MF0.22+HPD-300(3号) 55.98±1.16 67.64±2.07 66.17±1.54 65.81±1.33 57.17±1.51 62.58±1.65 57.29±1.44 UF50+HPD-300(4号) 58.24±1.32 71.41±1.91 62.62±2.01 71.28±1.62 63.48±1.65 65.61±1.44 58.73±1.57 MF0.22+UF50+HPD-300(5号)65.05±1.27 75.22±2.54 57.57±1.67 75.33±1.43 68.35±1.32 70.06±1.52 60.49±1.51
2.8 膜技术与大孔树脂联用技术的精制处理
分别将“2.4”“2.5”“2.7”项下得到的微滤膜渗透液、超滤膜渗透液、微滤超滤联用渗透液,经浓缩后分别加入到HPD-300大孔树脂柱中,静置吸附2 h。先用蒸馏水冲洗至流出液无色,再用55%乙醇洗脱,收集乙醇洗脱液。以处理前后除杂率、皂苷回收率、指标成分转移率为评价标准,考察不同联用方式对该体系的适用性。结果见表9。
由表9可知,微滤超滤联用处理山茱萸水溶液(2号)与传统工艺大孔树脂吸附(1号)相比,在纯化方面确实无法达到大孔树脂纯化的效果,可能由于单纯使用膜处理纯化药液,不能去除小于膜孔径的杂质,而传统大孔树脂可以吸附较多粒径小的杂质,无法使用单纯膜技术处理替代大孔树脂分离纯化山茱萸皂苷。联用(5号)在皂苷含量、除杂率、回收率与指标性成分转移率上效果显著,明显高于传统大孔树脂吸附工艺与其他联用方式。将不同分离原理的膜分离技术与大孔树脂分离联用,去除杂质的范围较广,得到的山茱萸皂苷含量高,故选择联用技术来纯化山茱萸皂苷。
2.9 膜技术前处理对大孔树脂使用效率及次数的影响
2.9.1 饱和吸附量 将“2.2”“2.7”项下所得的山茱萸水溶液、微滤超滤联用渗透液分别作为大孔树脂的上样溶液,以2 BV·h的速度进行上样,分段收集55%乙醇洗脱液,每份收集50 mL,收集1~10份流出液,测定皂苷含量。流出液中皂苷浓度如果达到上样液浓度的10%时,称为泄漏点,当流出液中皂苷浓度达到上样液浓度的100%时,称为饱和点。计算吸附率(E
):E
(%)=(M
-M
)/M
×100%(M
为吸附前溶液皂苷质量;M
为吸附后溶液皂苷质量)。从图1、2看出,山茱萸水溶液的大孔树脂饱和吸附量为300 mL,经过微滤超滤处理的药液饱和吸附量为500 mL,饱和吸附量提高40%。经过微滤超滤前处理,可以使大孔树脂饱和吸附量明显提高,可能由于山茱萸水溶液中杂质较多,过多地占据大孔树脂孔道,或者覆盖在树脂表面直接导致吸附的药液量减少。而经由微滤超滤处理的山茱萸透过液,其中可吸附的杂质等物质减少,可以减轻树脂孔道堵塞,减少树脂表面杂质覆盖。大孔树脂的饱和吸附量增加明显,直接提高大孔树脂的最大使用效率。
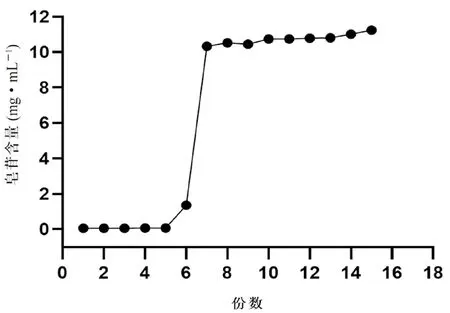
图1 山茱萸水溶液在大孔树脂上泄露曲线Fig 1 Leakage curve of Cornus saponins saponin stock solution on macroporous resin

图2 山茱萸微滤超滤渗透液在大孔树脂上泄露曲线Fig 2 Leakage curve of Cornus saponins ultrafiltration permeate on macroporous resin
2.9.2 大孔树脂使用次数静态吸附实验 称取已处理好的大孔树脂HPD-300各10 g,置于150 mL锥形瓶中,分别取“2.2”“2.7”项下所得的山茱萸水溶液、微滤超滤联用渗透液各40 mL,置于25℃恒温水浴摇床上以110 r·min的速度震荡4 h,静置2 h,使其达到饱和吸附,吸取上层药液测定皂苷的浓度。比较山茱萸水溶液、微滤超滤联用渗透液两者使用多次后吸附率的变化。再将已吸附饱和药液的HPD-300大孔树脂滤过,水洗净,吸干表面水分。各加入55%乙醇40 mL,置于25℃恒温水浴摇床上,以110 r·min的速度震荡4 h,静置2 h。使其解吸完全,测定洗脱液的皂苷浓度。比较山茱萸水溶液、微滤超滤联用渗透液两者使用多次后解吸率的变化,解吸后,适量蒸馏水洗至无醇味,大孔树脂完成一次使用。同样操作重复10次,计算出每次的吸附率与解吸率。对比相同使用次数条件下,两种药液吸附率与解吸率变化。计算解吸率(W
):W
(%)=M
/(M
-M
)×100%(M
为解吸溶液中皂苷质量;M
为吸附后溶液皂苷质量;M
为吸附前溶液皂苷质量)。由图3中可知,首次使用时大孔树脂对山茱萸水溶液、微滤超滤联用渗透液吸附率分别为93.48%与93.71%,吸附率差异较小。在使用第4次时两者溶液吸附率分别为88.73%与92.11%,山茱萸水溶液吸附率明显下降。到使用第10次时两者溶液吸附率分别为79.36%与85.31%。由于使用次数增加,树脂表面及内部都会残留许多非吸附性成分或杂质,导致树脂表面被覆盖或孔道被部分填充,待测物再次填充难度增大,吸附量下降。由图4中可知,在初次使用时两者溶液解吸率分别为98.34%与98.17%,解吸率同样差异较小。使用第10次时两者溶液解吸率分别为80.25%与87.74%,解吸率差别较大。由于使用次数增加,树脂吸附量下降,直接导致吸附的皂苷量减少,解吸出来的皂苷量降低,解吸率随之下降。经过微滤超滤前处理的山茱萸水溶液有效提高大孔树脂的吸附率与解吸率,可增加大孔树脂的使用次数,提高大孔树脂使用寿命。

图3 大孔树脂使用次数与吸附率变化趋势Fig 3 Change trend of the times of use and adsorption rate of macroporous resin

图4 大孔树脂使用次数与解吸率变化趋势Fig 4 Change trend of the times of use and desorption rate of macroporous resin
3 讨论
本试验采用MST与传统大孔树脂吸附工艺联合对山茱萸水溶液进行了精制处理。从皂苷含量、除杂率、回收率、指标成分转移率及膜污染程度等多方面综合分析了不同膜孔径及不同大孔树脂种类对山茱萸水溶液液精制效果的影响。山茱萸水溶液经联用精制处理后,除杂率分别比前期研究的传统工艺大孔树脂吸附提高11.63%,马钱苷、莫诺苷、獐芽菜苷与山茱萸新苷单成分含量较传统工艺大孔树脂洗脱有明显提高,联用技术可克服传统工艺中存在的有效成分损失严重、生产效率低等不足。且研究发现在使用 0.22 μm孔径的微滤膜与50 kDa孔径超滤膜,联用HPD-300型大孔树脂吸附工艺的条件下,能够有效去除杂质,并对指标成分有较好的保留率。
本研究优化工艺操作性与复制性强,可尝试推广到生产中,用以提高皂苷含量,降低生产成本,提高生产效率,为日后此类研究提供了新的思路和方法。本研究的不足:只考察了膜孔径,没有考察过膜条件的影响因素,包括过膜压力、膜材料以及过膜药液温度的影响。对不同纯化工艺得到的山茱萸皂苷缺少药效学方面的考察。下一步试验中需要对这些问题进行深入研究。
