活血定眩胶囊含药血清对氧糖剥夺诱导的bEnd.3细胞铁死亡的影响*
2022-03-28王凯宋敏宋志靖李金益范凯海云翔
王凯, 宋敏,2△, 宋志靖,2, 李金益, 范凯, 海云翔
活血定眩胶囊含药血清对氧糖剥夺诱导的bEnd.3细胞铁死亡的影响*
王凯1, 宋敏1,2△, 宋志靖1,2, 李金益1, 范凯1, 海云翔1
(1甘肃中医药大学,甘肃 兰州 730000;2甘肃中医药大学附属医院,甘肃 兰州 730020)
探讨活血定眩胶囊(HXDX)对氧糖剥夺(OGD)诱导小鼠脑微血管内皮细胞株bEnd.3铁死亡的影响。将bEnd.3细胞分为空白对照(control)组、OGD组、OGD+铁死亡抑制剂ferrostatin-1(Fer-1)组及OGD+HXDX组,control组细胞正常培养,其他组建立OGD模型,OGD+Fer-1组和OGD+HXDX组分别加入1 μmol/L Fer-1和10% HXDX含药血清后OGD处理6 h。FerroOrange探针测定细胞内Fe2+水平,DCFH-DA探针检测活性氧(ROS)含量,试剂盒检测超氧化物歧化酶(SOD)活性及丙二醛(MDA)和谷胱甘肽(GSH)水平,Western blot检测核因子E2相关因子2(Nrf2)、铁蛋白重链1(FTH1)、谷胱甘肽过氧化物酶4(GPX4)、长链脂酰辅酶A合成酶4(ACSL4)、环加氧酶2(COX2)和NADPH氧化酶1(NOX1)蛋白表达。与control组比较,OGD组bEnd.3细胞内Fe2+荧光强度与ROS含量显著增加;SOD活性降低,GSH表达下降,MDA含量显著增高(<0.05);FTH1和GPX4表达降低,ACSL4、COX2和NOX1表达升高(<0.05),Nrf2无显著差异。HXDX含药血清处理后,Fe2+水平和ROS含量显著降低(<0.05);SOD活性和GSH含量显著升高,MDA水平显著降低(<0.05);Nrf2、FTH1与GPX4蛋白的表达显著增高(<0.05),COX2和NOX1蛋白表达降低(<0.05),ACSL4无显著差异。活血定眩胶囊可抑制体外OGD诱导的bEnd.3细胞铁死亡,其机制与降低细胞内Fe2+和ROS含量、减轻脂质过氧化及调控铁死亡相关蛋白表达有关。
椎动脉型颈椎病;活血定眩胶囊;bEnd.3细胞;氧糖剥夺;铁死亡
椎动脉型颈椎病(cervical spondylosis of vertebral artery type, CSA)是以眩晕、头痛为主要临床表现,伴有颈部僵滞不适、恶心、呕吐、汗出异常等症状的综合征,是颈椎病中病理机制较为复杂的一类分型[1]。近些年,CSA的发病率逐年上升,高达17.3%,且呈现出低龄化趋势,严重危害患者身心健康[2]。中医药在CSA的防治中疗效确切、安全性高,彰显出了良好的应用前景。
铁死亡是一种新型的细胞死亡类型,以铁代谢紊乱、活性氧(reactive oxygen species,ROS)聚集及脂质过氧化为特征性改变[3],对缺血性脑血管疾病的发生、发展有着重要的影响,抑制铁死亡能够明显减轻脑组织和神经元的缺血损害[4]。
bEnd.3细胞是一种人工培育的、具有脑微血管内皮细胞特性的细胞株,目前多采用氧糖剥夺(oxygen-glucose deprivation, OGD)处理建立缺血缺氧损伤模型[5]。在CSA发病过程中,椎动脉缺血导致血管内皮细胞氧化应激损伤,代谢产物过度积累,会进一步加重脑部的供血不足。
活血定眩胶囊(Huoxue-Dingxuan capsule, HXDX)由黄芪、当归、丹参、白芷、葛根、赤芍、石决明、天麻、钩藤、刺蒺藜、桑寄生和甘草共12味中药组成,具有补气活血、定眩通络之效。前期研究表明,HXDX具有清除氧自由基、降低脂质过氧化、对抗bEnd.3细胞缺氧损伤、抑制细胞凋亡的作用[6];还能通过对bEnd.3细胞自噬的双向调节,减轻缺血缺氧引起的血管内皮细胞损伤,以维持血管微环境的稳定[7]。但HXDX能否通过调节铁死亡而减轻血管内皮细胞的氧化应激损伤,既往鲜有报道。基于此,本项工作建立血管内皮细胞的OGD损伤模型,观察bEnd.3细胞铁死亡的情况,揭示HXDX对OGD诱导bEnd.3细胞铁死亡的干预机制,以期为HXDX防治CSA的进一步研究提供参考资料。
材料和方法
1 实验动物与细胞
6周龄SPF级Witar雄性大鼠30只,体重200~220 g,由北京斯贝福生物技术有限公司提供,动物许可证号为SCXK(京)2019-0010,饲养于甘肃中医药大学SPF级动物实验中心,条件为温度 23~25℃,相对湿度(50±10)%。小鼠脑微血管内皮细胞株bEnd.3购自广州集拓科技生物有限公司。
2 实验试剂与设备
HXDX(甘肃中医药大学附属医院药物制剂中心);CCK8检测试剂盒(武汉伊莱瑞特生物科技股份有限公司);ROS、丙二醛(malondialdehyde, MDA)、谷胱甘肽(glutathione, GSH)和超氧化物歧化酶(superoxide dismutase, SOD)测定试剂盒(南京建成生物工程研究所);铁死亡抑制剂ferrostatin-1(Fer-1; APExBIO);FerroOrange亚铁离子荧光探针(上海懋康生物科技有限公司);抗铁蛋白重链1(ferritin heavy chain 1, FTH1)、NADPH氧化酶1(NADPH oxidase 1, NOX1)和长链脂酰辅酶A合成酶4(long-chain acyl-CoA synthase 4, ACSL4)抗体(Abcam);环加氧酶2(cyclooxygenase 2, COX2)、谷胱甘肽过氧化物酶4(glutathione peroxidase 4, GPX4)和核因子E2相关因子2(nuclear factor E2-related factor 2, Nrf2)抗体(武汉三鹰生物技术有限公司)。三气培养箱(力康生物医疗科技控股有限公司);荧光显微镜(Olympus);转印电泳仪(北京六一生物科技有限公司);连续波长酶标仪、电泳仪电源和凝胶成像分析系统(BIO-RAD)。
3 主要方法
3.1HXDX含药血清的制备将Witar大鼠随机分为空白组和含药血清组,每组15只。含药血清组按0.54 g/kg等效剂量的HXDX溶液灌胃,空白组给予同体积的生理盐水,每天2次,连续1周。末次灌胃2 h后麻醉大鼠,“三线定位法”心脏取血[8],1 917×离心15 min,移液器吸取上清液,56 ℃恒温水浴灭活30 min,0.2 µm微孔滤膜除菌,-20 ℃条件储存备用。
3.2bEnd.3细胞的体外培养及分组处理复苏原代bEnd.3细胞,培养条件为37 ℃、5% CO2、95%空气及饱和湿度,待生长密度达到80%~90%时进行传代。根据前期研究基础,OGD条件下培养6 h后bEnd.3细胞的活细胞占比大于50%,比较符合后续实验的要求,且10% HXDX含药血清的干预作用最为明显[9]。因此,将bEnd.3细胞分为空白对照(control)组、OGD组、OGD+Fer-1组和OGD+HXDX组。control组正常条件下培养;OGD组在低氧预处理的无糖培养液中加入10%空白血清,三气培养箱中OGD诱导6 h,条件为37℃、5% CO2、94% N2、1% O2及饱和湿度;OGD+Fer-1组在OGD组基础上加入1 μmol/L Fer-1;OGD+HXDX组将OGD组中的空白血清替换为10% HXDX含药血清,OGD处理6 h。
3.3FerroOrange探针测定细胞内Fe2+含量将bEnd.3细胞以2×108/L的密度接种至6孔板,每孔加入2 mL细胞悬液,放置正常培养箱中过夜,按照3.2中方法进行操作;处理好的细胞弃去旧培养液,用无血清培养液清洗3遍后加入1 μmol/L FerroOrange染色液,CO2培养箱中孵育30 min。Hoechst 33342染色,室温孵育5 min,生物型荧光显微镜下观察并采集图像。
3.4细胞内ROS含量检测细胞分组及处理方法同3.2,干预6 h后用不含EDTA的胰蛋白酶消化,收集各组细胞,352×离心5 min,去上清,加PBS重悬,将细胞润洗2次,352×再离心5 min。按照DCFH-DA荧光探针法ROS试剂盒说明上机检测。
3.5SOD、MDA和GSH水平的测定细胞处理按照3.2中的方法,用低温PBS液清洗贴壁细胞,胰蛋白酶消化后157×离心5min,收集各组细胞,并通过反复冻融使细胞破碎,将提取液1 409×离心10 min,取上清液按照试剂盒操作说明检测SOD活性及MDA和GSH含量。
3.6Western blot法检测铁死亡相关蛋白表达水平收集干预处理后的各组细胞,加入1 mL RIPA裂解液,置于冰上裂解30 min,将细胞碎片和裂解液移至离心管中,于4 ℃、12 000×离心5 min,吸取上清液进行蛋白浓度测定。将提取的蛋白与5ⅹ蛋白上样缓冲液按照4∶1体积比混合,沸水变性10 min。以40 μg的各样品总蛋白量进行电泳分离,转移至PVDF膜,5%脱脂奶粉封闭2 h。Ⅰ抗4 ℃孵育过夜后,加入Ⅱ抗孵育2 h。将ECL试剂中增强液与稳定的过氧化物酶溶液按1∶1比例混匀,滴加至PVDF膜,反应2 min后进行显影曝光,使用ImageJ软件分析条带灰度值,统计各组蛋白的相对表达量。
4 统计学处理
使用SPSS 21.0和GraphPad Prism 7.0软件进行统计分析。计量资料以均数±标准差(mean±SD)形式表示。两组间比较采用独立样本检验;多组间均数比较采用单因素方差分析,组间两两比较采用LSD法。以<0.05为差异有统计学意义。
结果
1 bEnd.3细胞的形态学观察
光学显微镜下观察bEnd.3细胞形态,可见其呈梭形、长条形或三角形贴壁生长,呈铺路石样,形态饱满、排列紧密,各组细胞肉眼观察无明显形态学改变。与control组相比,OGD组细胞排列分散、稀疏,细胞间隙扩大;HXDX含药血清和Fer-1处理后,细胞间的连接有所改变,OGD+HXDX组显得更为紧密,见图1。

Figure 1.Morpholocical observation of bEnd.3 cells in each group (inverted optical microscope, scale bar=20 μm).
2 HXDX含药血清对细胞内铁含量的影响
本研究采用FerroOrange荧光探针检测细胞内Fe2+的含量变化。结果显示,与control组相比,OGD组bEnd.3细胞内Fe2+荧光强度显著增强(<0.05);与OGD组相比,OGD+HXDX组和OGD+Fer-1组的荧光强度均显著降低(<0.05),而Fer-1抑制铁聚集的作用更为显著(<0.05),见图2。

Figure 2.The content of Fe2+ in bEnd.3 cells detected by FerroOrange probe (scale bar=50 μm). Blue: Hoechst 33342 staining, indicating the nucleus. Mean±SD. n=6. *P<0.05 vs control group; #P<0.05 vs OGD group; &P<0.05 vs OGD+Fer-1 group.
3 DCFH-DA荧光探针检测细胞内ROS含量
与control组相比,OGD组bEnd.3细胞内ROS含量显著增加(<0.05);与OGD组相比,HXDX含药血清和Fer-1均能抑制ROS的生成,OGD+HXDX组ROS水平显著低于OGD+Fer-1组(<0.05),见图3。
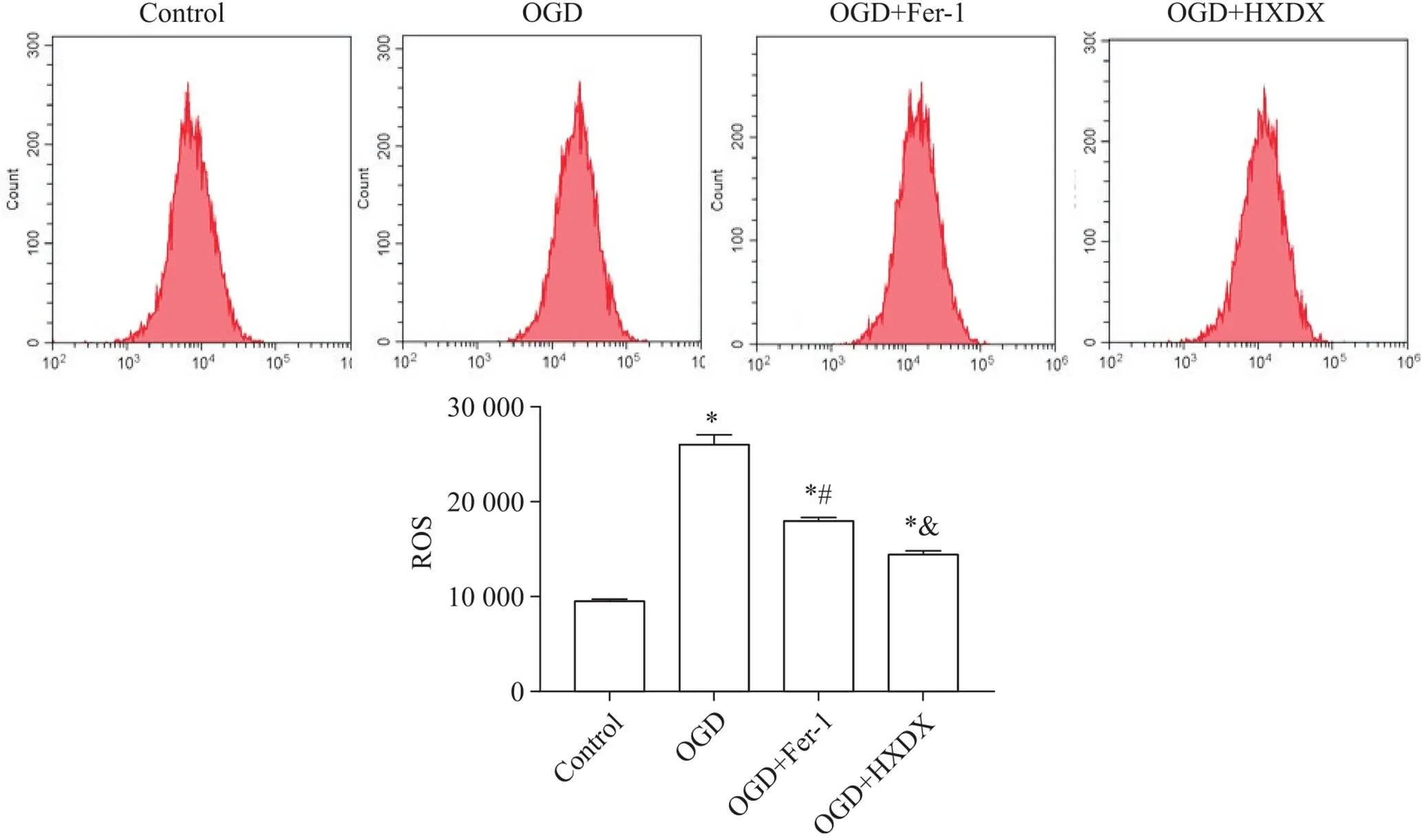
Figure 3.Flow cytometry detection of intracellular ROS content in each group. Mean±SD. n=3. *P<0.05 vs control group; #P<0.05 vs OGD group; &P<0.05 vs OGD+Fer-1 group.
4 各组细胞SOD、MDA和GSH水平
与control组比较,OGD组bEnd.3细胞内SOD活性和GSH含量显著下降,MDA含量显著增高(<0.05);与OGD组相比,OGD+HXDX组和OGD+Fer-1组SOD活性和GSH含量显著升高(<0.05),HXDX含药血清的作用最为显著(<0.05),OGD+HXDX组和OGD+Fer-1组MDA水平均显著降低(<0.05),但二者比较无显著差异,见图4。

Figure 4.Effect of Huoxue-Dingxuan capsule (HXDX) on oxidative stress indexes in each group. A: superoxide dismutase (SOD) activity; B: malondialdehyde (MDA) content; C: glutathione (GSH) content. Mean±SD. n=3. *P<0.05 vs control group; #P<0.05 vs model group; &P<0.05 vs OGD+Fer-1 group.
5 bEnd.3细胞内铁死亡相关蛋白的表达情况
与control组比较,OGD组Nrf2蛋白表达有增加趋势,但差异无统计学意义(>0.05),FTH1和GPX4蛋白表达显著降低(<0.05),ACSL4、COX2和NOX1蛋白表达显著升高(<0.05);与OGD相比,OGD+HXDX组Nrf2、FTH1和GPX4蛋白表达显著增加(<0.05),COX2和NOX1蛋白表达显著降低(<0.05);OGD+HXDX组和OGD+Fer-1组ACSL4表达降低,但无显著差异(>0.05),见图5。

Figure 5.Effect of Huoxuedingxuancapsuleson ferroptosis related proteins expression ineach group. A:protein expression of Nrf2, FTH1 and GPX4 was detected by Western blot;B:Nrf2;C:FTH1;D:GPX4;E:protein expression of ACSL4, COX2 and NOX1 was detected by Western blot;F:ACSL4;G:COX2;H:NOX1. Mean±SD. n=3. *P<0.05 vs control group;#P<0.05 vs model group.
讨论
颈椎退行性改变导致颈部动静力失衡,椎动脉及交感神经遭受机械性刺激,造成椎-基底动脉血流减少、脑组织供血不足是CSA关键的病理因素[10]。中医学认为CSA属于“眩晕”、“头痛”等范畴[10],《灵枢·口卫》曰:“上气不足,脑为之不满,耳为之苦鸣,头为之苦倾,目为之眩”,气血运行失调、血脉瘀滞不通、头目清窍失养是其主要的病因病机。HXDX是甘肃中医药大学附属医院院内制剂,针对CSA气虚血瘀的关键病机,选用具有甘肃地域特色的道地药材组方,能有效缓解CSA的不适症状、降低复发率[11]。前期研究表明,HXDX通过对血管内皮细胞自噬与凋亡的调控以及清除过度生成的氧化自由基,从而减轻血管缺血状态下的氧化应激损伤[6-7]。铁死亡是一种铁依赖性而导致细胞出现脂质过氧化的程序性细胞死亡形式,氧化应激和内源性的抗氧化失衡是导致细胞发生铁死亡的关键因素[12]。而在缺血缺氧状态下,大量Fe3+进入细胞内被还原成Fe2+,更容易触发铁死亡[13]。本研究旨在探究bEnd.3细胞在OGD处理后的铁死亡情况及HXDX的干预效应。
铁代谢紊乱和ROS大量聚集是细胞铁死亡的特征性改变,本研究通过FerroOrange和DCFH-DA荧光探针检测表明,OGD诱导后bEnd.3细胞内Fe2+和ROS水平显著升高,说明OGD诱导会造成bEnd.3细胞内铁过载和脂质过氧化产物ROS的产生。GPX4是抗氧化体系的核心调控酶,也是铁死亡发生的标志蛋白[14],经OGD处理后细胞内GPX4蛋白表达显著降低,可基本确定OGD能诱导bEnd.3细胞铁死亡。而氧化应激指标SOD、GSH及MDA测定结果显示,OGD组SOD活性和GSH含量显著下降,MDA含量显著增高,初步证实OGD容易造成bEnd.3细胞氧化应激,导致抗氧化失衡,进而造成细胞铁死亡。另外,利用Western blot技术对铁死亡关键蛋白的检测结果表明,OGD处理后FTH1表达显著降低,ACSL4、NOX1及COX2显著增高,进一步证实了bEnd.3细胞的铁死亡。值得注意的是,Nrf2作为机体重要的抗氧化因子[15],在细胞应激状态下有所增高,属于保护反应,但无显著差异。
Fer-1是一种选择性的铁死亡抑制剂,可通过阻断GSH的产生而发挥作用,在使用Fer-1和HXDX干预后,二者均可降低细胞内Fe2+、ROS与MDA含量,提高SOD活性和GSH表达,抑制OGD诱导的bEnd.3细胞铁死亡,总体而言,HXDX含药血清的作用更为明显。HXDX含药血清干预能显著增高细胞Nrf2、FTH1和GPX4蛋白表达,降低COX2和NOX1蛋白水平,而ACSL4含量虽有上升趋势,但差异无统计学意义,说明HXDX含药血清可能主要通过对Nrf2、FTH1、GPX4、COX2及NOX1蛋白表达的影响而抑制OGD诱导的bEnd.3细胞铁死亡。
综上所述,本研究从缺血缺氧条件下容易触发血管内皮细胞铁死亡的途径探讨了HXDX对这一病理损伤的调控作用,进一步揭示了HXDX可能通过对血管内皮细胞铁死亡的抑制,减轻血管的氧化应激损伤,从而纠正血管内皮功能的紊乱。
[1]刘清, 周亮. 按摩星状神经节治疗椎动脉型颈椎病的疗效观察[J]. 中华物理医学与康复杂志, 2018, 40(6):463-464.
Liu Q, Zhou L. Observation of curative effect of massage stellate ganglion in the treatment of vertebral artery type cervical spondylosis[J]. Chin J Phys Med Rehabil, 2018, 40(6):463-464.
[2]明瑞蕊, 徐腾腾, 王金霞, 等. 盘龙七片对椎动脉型颈椎病大鼠的干预作用[J]. 中国实验方剂学杂志, 2021, 27(22):51-58.
Ming RR, Xu TT, Wang JX, et al. Effect of Panlongqi tablet on cervical spondylosis of vertebral artery type in rats[J]. Chin J Exp Med Formulae, 2021, 27(22):51-58.
[3] Hirschhorn T, Stockwell BR. The development of the concept of ferroptosis[J]. Free Radic Biol Med, 2019, 133:130-143.
[4]朱蕊, 曾庆, 黄国志. 铁死亡与脑卒中[J]. 中国组织工程研究, 2021, 25(23):3734-3739.
Zhu R, Zeng Q, Huang GZ. Ferroptosis and stroke[J]. Chin J Tissue Eng Res, 2021, 25(23):3734-3739.
[5] Ku JM, Taher M, Chin KY, et al. Characterisation of a mouse cerebral microvascular endothelial cell line (bEnd.3) after oxygen glucose deprivation and reoxygenation[J]. Clin Exp Pharmacol Physiol, 2016, 43(8):777-786.
[6]刘涛, 宋敏, 巩彦龙, 等. 活血定眩胶囊含药血清减轻小鼠脑微血管内皮细胞bEnd.3缺氧损伤[J]. 中国病理生理杂志, 2017, 33(3):552-556.
Liu T, Song M, Gong YL, et al. Protective effect of Huoxue-Dingxuan capsule-medicated serum on mousebrain microvascular endothelial cell line bEnd.3 with hypoxic injury[J]. Chin J Pathophysiol, 2017, 33(3):552-556.
[7]巩彦龙, 宋敏, 董万涛, 等. 活血定眩胶囊含药血清对小鼠脑微血管内皮细胞bEnd.3自噬的影响[J]. 中华中医药杂志, 2020, 35(5):2653-2656.
Gong YL, Song M, Dong WT, et al. Effects of serum containing HuoxueDingxuan capsule on bEnd.3 autophagy inmouse brain microvascular endothelial cells[J]. Chin J Tradit Chin Med Pharm, 2020, 35(5):2653-2656.
[8]周灵通, 宋敏, 刘小钰, 等. 三线定位法在大鼠心脏采血中的应用[J]. 局解手术学杂志, 2017, 26(12):919-921.
Zhou LT, Song M, Liu XY, et al. Application of three-line positioning method in blood collection by cardiac puncture from rats[J]. J Regional Anta Oper Surg, 2017, 26(12):919-921.
[9]董平, 侯红燕, 黄凯, 等. 活血定眩胶囊含药血清对小鼠脑微血管内皮细胞bEnd.3细胞自噬的干预研究[J]. 中国临床药理学杂志, 2019, 35(23):3038-3041.
Dong P, Hou HY, Huang K, et al. Intervention study of drug-containing serum of HuoxueDingxuan Capsules on autophagy of microvascular endothelial cells of mouse brain bEnd.3 cell[J]. Chin J Clin Pharmacol, 2019, 35(23):3038-3041.
[10] 郑涵, 张建明, 吴辛甜, 等. “通脱法”理论指导浮针治疗椎动脉型颈椎病疗效观察[J]. 中国针灸, 2021, 41(12):1313-1316.
Zheng H, Zhang JM, Wu XT, et al. Therapeutic observation on Fu's acupuncture for cervical spondylosis of vertebral artery typebased on Tongtuo method[J]. Chin Acupunct Moxibustion, 2021, 41(12):1313-1316.
[11] 董万涛, 宋敏, 吕泽斌, 等. 活血定眩胶囊治疗椎动脉型颈椎病临床疗效评价[J]. 中国中医药信息杂志, 2014, 21(1):33-35.
Dong WT, Song M, Lv ZB, et al. Clinical effects evaluation of HuoxueDingxuan capsules in treatment of vertebral artery type of cervical spondylosis[J]. Chin J Inf Tradit Chin Med, 2014, 21(1):33-35.
[12] Dixon SJ, Lemberg KM, Lamprecht MR, et al. Ferroptosis: an iron-dependent form of nonapoptotic cell death[J]. Cell, 2012, 149(5):1060-1072.
[13] Tang D, Kroemer G. Ferroptosis[J]. Curr Biol, 2020, 30(21):R1292-R1297.
[14] Forcina GC, Dixon SJ. GPX4 at the crossroads of lipid homeostasis and ferroptosis[J]. Proteomics, 2019, 19(18):e1800311.
[15] Kerins MJ, OoiA. The roles of NRF2 in modulating cellular iron homeostasis[J]. Antioxid Redox Signal, 2018, 29(17):1756-1773.
Effect of Huoxue-Dingxuan capsule-containing serum on ferroptosis of bEnd.3 cells induced by oxygen-glucose deprivation
WANG Kai1, SONG Min1,2△, SONG Zhi-jing1,2, LI Jin-yi1, FAN Kai1, HAI Yun-xiang1
(1,730000,;2,730020,)
To investigate the effect of Huoxue-Dingxuan capsule (HXDX) on the ferroptosis of mouse brain microvascular endothelial cell line bEnd.3 induced by oxygen-glucose deprivation (OGD).The bEnd.3 cells were divided into control group, OGD group, OGD+ferroptosis inhibitor ferrostatin-1 (Fer-1) group and OGD+HXDX group. The cells in control group were cultured normally, while those in other groups were subjected to OGD. The cells in OGD+Fer-1 group and OGD+HXDX group were treated with 1 μmol/L Fer-1 and 10% HXDX-containing serum, respectively, and treated with OGD for 6 h. FerroOrange and DCFH-DA probes were used to measure the levels of Fe2+and reactive oxygen species (ROS), respectively, and the levels of superoxide dismutase (SOD), malondialdehyde (MDA) and glutathione (GSH) were measured by commercial kits. The protein levels of nuclear factor E2-related factor 2 (Nrf2), ferritin heavy chain 1 (FTH1), glutathione peroxidase 4 (GPX4), long-chain acyl-CoA synthase 4 (ACSL4), cyclooxygenase 2 (COX2) and NADPH oxidase 1 (NOX1) were detected by Western blot.Compared with control group, the Fe2+and ROS levels were significantly increased, SOD activity and GSH expression decreased, and MDA content increased significantly in OGD group (<0.05). The expression of FTH1 and GPX4 was decreased, while the levels of ACSL4, COX2 and NOX1 were increased (<0.05), and there was no significant difference in Nrf2. The Fe2+, ROS and MDA levels were significantly decreased, while SOD activity and GSH content were significantly increased after treatment with HXDX-containing serum (<0.05). The expression of Nrf2, FTH1 and GPX4 were significantly increased (<0.05), while COX2 and NOX1 were decreased (<0.05), and there was no significant difference in ACSL4.Huoxue-Dingxuan capsule inhibits OGD-induced ferroptosis of bEnd.3 cells, which is related to reducing Fe2+and ROS levels, attenuating lipid peroxidation and regulating ferroptosis-related protein expression.
Cervical spondylosis of vertebral artery type; Huoxue-Dingxuan capsule; bEnd.3 cells; Oxygen-glucose deprivation; Ferroptosis
R743; R363.2
A
10.3969/j.issn.1000-4718.2022.03.005
1000-4718(2022)03-0420-07
2021-12-01
2022-02-12
[基金项目]国家自然科学基金资助项目(No. 81360554; No. 81760876);甘肃省自然科学基金资助项目(No. 1610RJZA069);甘肃省教育厅优秀研究生“创新之星”项目(No. 2021CXZX-765);甘肃省高等学校科学研究项目(No. 2017A-053)
Tel: 0931-5161526; E-mail: sm@gszy.edu.cn
(责任编辑:卢萍,罗森)
