圣草酚通过激活Nrf2/HO-1通路减轻大鼠缺氧缺血性脑损伤*
2022-03-28赵斌王美玲马文彬张青青
赵斌, 王美玲, 马文彬, 张青青
圣草酚通过激活Nrf2/HO-1通路减轻大鼠缺氧缺血性脑损伤*
赵斌, 王美玲, 马文彬, 张青青△
(滨州医学院附属医院神经内科,山东 滨州 256603)
探讨圣草酚(eriodictyol)在大鼠缺氧缺血性脑损伤(HIBD)中的作用及机制。50只幼龄Wistar大鼠分为健康对照组、模型(HIBD)组、HIBD+eriodictyol 1 mg/kg组和HIBD+eriodictyol 2 mg/kg组和HIBD+eriodictyol 4 mg/kg组,每组10只。采用Rice-Vannucci法建立缺氧缺血性脑损伤大鼠模型,造模成功后,治疗组大鼠分别口服1、2和4 mg/kg的圣草酚,对照组和模型组大鼠则口服生理盐水;Y迷宫实验检测新异臂进入次数;根据TTC法计算各组大鼠脑组织含水率及脑指数;HE染色法观察脑组织损伤程度并行病理学评分;TUNEL染色法观察脑组织中细胞凋亡水平;Western blot检测cleaved caspase-3、cleaved caspase-9、Kelch样环氧氯丙烷相关蛋白1(Kelch-like epichlorohydrin-associated protein 1, Keap1)、核因子E2相关因子2(nuclear factor E2-related factor 2,Nrf2)和血红素加氧酶1(heme oxygenase-1, HO-1)的蛋白表达水平;ELISA测定外周血中肿瘤坏死因子α(tumor necrosis factor-α, TNF-α)、白细胞介素6(interleukin-6, IL-6)和诱导型一氧化氮合酶(inducible nitric oxide synthase, iNOS)的含量。与对照组相比,HIBD组大鼠脑组织损伤程度、细胞凋亡水平及TNF-α、 IL-6和iNOS表达水平均显著升高(<0.05),p-Nrf2和HO-1蛋白表达显著降低(<0.05)。与HIBD组相比,经2和4 mg/kg圣草酚给药治疗后,脑组织损伤程度显著减轻(<0.05),脑组织细胞凋亡率及cleaved caspase-3和cleaved caspase-9的蛋白表达水平显著降低(<0.05),促炎因子TNF-α、IL-6和iNOS蛋白含量显著降低(<0.05),Keap1、p-Nrf2和HO-1蛋白表达显著上调(<0.05)。圣草酚可减轻大鼠缺氧缺血性脑损伤,其作用机制可能与激活Nrf2/HO-1信号通路有关。
圣草酚;缺氧缺血性脑损伤;Nrf2/HO-1信号通路;细胞凋亡
缺氧缺血性脑损伤(hypoxic-ischemic brain damage, HIBD)是由各种围生期因素引起的脑缺氧或缺血而形成的脑损伤,是导致儿童发育迟缓、智力低下、癫痫甚至脑瘫等后遗症的主要病因[1-2]。研究表明,缺氧缺血性脑损伤的严重程度与氧化应激、细胞凋亡和炎症反应有关[3-4]。在缺氧缺血性脑损伤发病过程中,炎症因子和凋亡蛋白的异常表达会加剧脑组织缺氧缺血,产生严重的脑组织损伤等疾病。圣草酚是一种存在于大多数植物中的天然二氢类黄酮化合物,具有抗氧化、抗炎、抗凋亡和神经保护等多种药理活性,常被用于治疗气管炎、风湿和过敏性鼻炎等疾病[5]。随着国内外对圣草酚的深入研究表明,圣草酚的药理作用与核因子E2相关因子2(nuclear factor E2-related factor 2, Nrf2)/血红素加氧酶1(heme oxygenase-1, HO-1)信号通路密切相关[6-8],因此,本项工作应用缺氧缺血性脑损伤大鼠模型探索圣草酚对HIBD大鼠脑组织中凋亡蛋白和炎症因子表达水平的影响,并初步了解其作用机制。
材料和方法
1 动物
50只清洁级雄性Wsitar大鼠(1~2周龄,体重12~18 g),购自山东大学实验动物中心,生产许可证号为SCXK(鲁) 2019-0001。实验动物严格遵守3R原则,并通过医院伦理委员会批准。实验动物饲养于漯河医学高等专科学校重点实验室,每只大鼠给予24 h昼夜灯光照射控制及严格、规范的卡片登记管理,24℃条件下封闭群养。
2 主要试剂
圣草酚(纯度≥98%,购自上海源叶生物科技有限公司);2,3,5-三甲基氯化四氮唑(2,3,5-triphenyltetrazolium chloride, TTC)、苏木精-伊红(hematoxylin-eosin, HE)染色试剂盒、酶联免疫吸附实验(enzyme-linked immunosorbent assay, ELISA)试剂盒购自Sigma;末端转移酶介导的脱氧尿嘧啶核苷三磷酸缺口末端标记(terminal deoxynucleotidyltransferasemediated 2'-deoxyuridine 5'-triphosphate nick-end labeling, TUNEL)染色试剂盒购自Roche;半胱氨酸天冬氨酸蛋白酶3(caspase-3)、半胱氨酸天冬氨酸蛋白酶9(caspase-9)、肿瘤坏死因子α(tumor necrosis factor-α, TNF-α)、白细胞介素6(interleukin-6, IL-6)、Kelch样环氧氯丙烷相关蛋白1(Kelch-like epichlorohydrin-associated protein 1, Keap1)、Nrf2和HO-1兔单克隆抗体及辣根过氧化物酶(horseradish peroxidase, HRP)标记的对应Ⅱ抗均购自Abcam。
3 主要方法
3.1动物分组、建模及给药将50只Wsitar大鼠分为健康对照(healthy control)组、模型组(HIBD组)、HIBD+eriodictyol 1 mg/kg组、HIBD+eriodictyol 2 mg/kg组和HIBD+eriodictyol 4 mg/kg组共5组,每组10只;参照文献[9-10],采用Rice-Vannucci法建立缺氧缺血性脑损伤大鼠模型,新生幼龄大鼠行左侧颈总动脉结扎,其中在8% O2、35 ℃条件下缺氧40 min,幼鼠死亡率为5%,成模率为90%;造模成功2 h后,治疗组分别口服圣草酚(1,2和4 mg/kg)给药治疗[11],对照组和模型组口服生理盐水,每天1次,持续5 d。
3.2新异臂进入次数、脑含水率及脑指数检测自发性交替反应、空间识别、主动回避三步骤法检测大鼠新异臂进入次数,评估大鼠学习和记忆能力。断头法处死大鼠,取出大脑,剥去脑膜、小脑和脑干,用磷酸盐缓冲清洗,滤纸吸干称取体质量;将大脑切成小片并放入1% TTC溶液中,37℃温箱中孵育20 min染色,待孵育完成后,将脑片置于10%甲醛中固定24 h 后称取湿质量,随后将其放入烘箱(105 ℃)中12 h至恒质量后,取出并称取干质量,计算脑含水率、脑指数。脑含水率(%)=(脑片湿质量-脑片干质量)/脑片湿质量×100%;脑指数(%)=大脑质量/体质量×100%。
3.3HE染色断头法处死大鼠,取出大脑,4%多聚甲醛固定脑组织,石蜡包埋切片;经脱蜡、水化后,行HE染色;光镜下下拍照并观察记录组织形态学变化。并参照陈惠金等[12]的文献行脑组织病理损伤评分。
3.4TUNEL染色断头法处死大鼠并迅速取出大脑皮质于4%多聚甲醛溶液中充分固定,48 h后脱水、浸蜡、石蜡包埋;按照TUNEL染色试剂盒说明书进行染色;凋亡细胞即阳性细胞在光镜下呈棕黄色或棕褐色,非凋亡细胞即阴性细胞呈蓝色。
3.5ELISA检测收集外周血,并在4℃、1 509 ×条件下离心25 min,离心完成后,提取上清液,按照ELISA试剂盒说明书测定TNF-α、IL-6和iNOS含量。
3.6Western blot检测取大脑组织组织研磨均匀,用RIPA蛋白裂解液于冰上提取脑组织总蛋白,用BCA蛋白浓度测定试剂盒测定脑组织蛋白浓度,每孔上样20 μg样品蛋白,经SDS-PAGE分离、转模、脱脂奶粉封闭,加入Ⅰ抗(1∶1 000),4 ℃孵育摇床上过夜。回收Ⅰ抗,加入按比例稀释HRP标记的对应Ⅱ抗(1∶4 000),室温孵育120 min。采用ECL化学发光法于暗室下进行曝光显影(β-actin作内参照)。将胶片进行扫描存档,Photoshop整理去色,Alpha软件分析吸光度值,结果以目的蛋白和内参照蛋白条带灰度值比值表示,实验重复3次,取平均值。
4 统计学处理
使用SPSS 17.0软件分析。正态分布的计量资料表示为均数±标准差(mean±SD)。多组数据比较采用单因素方差分析,两两比较采用LSD法,以0.05为差异有统计学意义。
结果
1 圣草酚对HIBD大鼠脑功能的影响
各组大鼠新异臂进入次数分别为5.7±0.6、3.7±0.5、3.8±0.4、4.5±0.5和5.3±0.3,脑指数分别为0.32±0.08、0.68±0.09、0.65±0.05、0.47±0.07和0.36±0.06,脑含水率分别为(71±4)%、(88±6)%、(86±4)%、(80±5)%和(73±3)%。与健康对照组相比,模型组大鼠新异臂进入次数显著降低(<0.05),脑指数和脑含水率显著升高(<0.05),证明造模成功。与模型组相比,1 mg/kg圣草酚给药治疗后,新异臂进入次数、脑指数和脑含水率无显著改变(0.05),经2和4 mg/kg圣草酚治疗后,新异臂进入次数显著升高,脑指数和脑含水率显著下调(<0.05)。见图1。

Figure 1.Effects of eriodictyol on the number of new arm entry (A), brain index (B) and brain moisture content (C) of young rats in each group. Mean±SD. n=10. *P<0.05 vs healthy control group; #P<0.05 vs HIBD group.
2 圣草酚对HIBD大鼠脑组织病理学的影响
健康对照组大鼠脑组织形态正常,无组织损伤,与健康对照组相比,模型组大鼠脑组织结构紊乱,组织损伤严重,可见大量炎症细胞浸润;与模型组相比,经圣草酚给药治疗后,HIBD大鼠脑组织损伤程度有显著改善。与健康对照组相比,模型组大鼠脑组织病理评分显著升高(<0.05)。与模型组相比,1 mg/kg圣草酚给药治疗后无显著改变,经2和4 mg/kg圣草酚治疗后,大鼠脑组织病理评分显著降低(<0.05)。见图2。

Figure 2.HE staining images of young rat brain tissues in each group (scale bar=50 μm). A: healthy control group; B: HIBD group; C: HIBD+eriodictyol 1 mg/kg group; D: HIBD+eriodictyol 2 mg/kg group; E: HIBD+eriodictyol 4 mg/kg group.
3 圣草酚对HIBD大鼠脑组织细胞凋亡的影响
TUNEL染色检测圣草酚对大鼠脑组织细胞凋亡的影响,如图3A所示,阳性细胞的细胞核(凋亡细胞)被染成棕黄色或褐色,胞质不着色,正常细胞核呈淡蓝色。与健康对照组相比,模型组大鼠脑组织结构紊乱,可见大量凋亡小体(棕黄色/褐色),细胞凋亡率显著升高(<0.05);与模型组相比,2和4 mg/kg圣草酚给药治疗后,大鼠脑组织凋亡小体数显著减少(<0.05),见图3B。各组大鼠脑组织中cleaved caspase-9/caspase-9表达水平分别为0.0±0.0、0.54±0.05、0.52±0.06、0.09±0.02和0.02±0.01,cleaved caspase-3/caspase-3表达水平分别为0.01±0.01、0.38±0.04、0.35±0.07、0.05±0.03和0.01±0.01。与健康对照组相比,模型组大鼠脑组织中cleaved caspase-3/caspase-3和cleaved caspase-9/caspase-9蛋白表达水平显著升高(<0.05);与模型组相比,经1 mg/kg圣草酚治疗后,凋亡蛋白表达水平无显著改变,2和4 mg/kg圣草酚治疗则显著抑制cleaved caspase-3/caspase-3和cleaved caspase-9/caspase-9的蛋白表达(<0.05),见图3C。
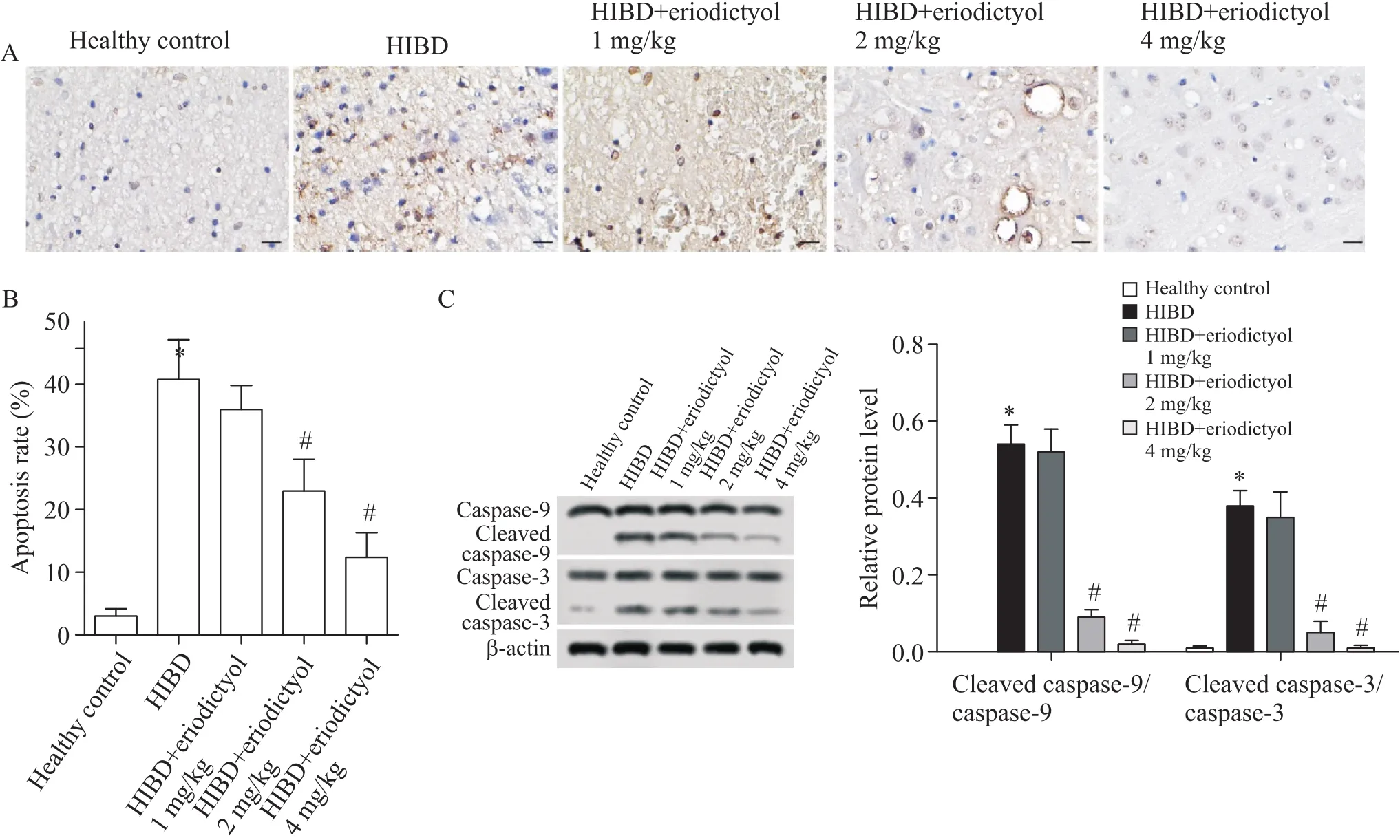
Figure 3.Effect of eriodictyol on apoptosis of brain tissue in rats with hypoxic-ischemic brain damage (HIBD). A: TUNEL staining images of young rat brain tissues in each group (scale bar=50 µm); B: the apoptosis rate of brain tissues in each group was semi-quantitatively analyzed; C: Western blot was used to detect the expression levels of apoptotic proteins in brain tissues of young rats in each group. Mean±SD. n=10. *P<0.05 vs healthy control group; #P<0.05 vs HIBD group.
4 圣草酚对HIBD大鼠促炎因子表达水平的影响
与健康对照组相比,模型组大鼠脑组织中TNF-α、IL-6和iNOS蛋白含量显著升高(<0.05);与模型组相比,经1 mg/kg圣草酚给药治疗后,促炎因子表达水平无显著差异(>0.05),2和4 mg/kg圣草酚治疗组TNF-α、IL-6和iNOS蛋白含量显著降低(<0.05)。见图4。

Figure 4.ELISA determination of TNF-α (A), IL-6 (B) and iNOS (C) levels in peripheral blood of young rats in each group. Mean±SD. n=10. *P<0.05 vs healthy control group; #P<0.05 vs HIBD group.
5 圣草酚对HIBD大鼠Nrf2磷酸化及Keap1和HO-1蛋白表达的影响
与健康对照组相比,模型组大鼠Keap1、p-Nrf2/Nrf2和HO-1蛋白表达水平显著下降<0.05);与模型组相比,1 mg/kg圣草酚给药治疗后,Keap1、p-Nrf2/Nrf2和HO-1蛋白表达水平无显著差异(>0.05),经2和4 mg/kg圣草酚治疗后,Keap1、p-Nrf2/Nrf2和HO-1蛋白表达水平显著上调(<0.05)。见图5。

Figure 5.Western blot detection of Keap1, p-Nrf2 and HO-1 protein expression levels in the brain tissue of young rats in each group. Mean±SD. n=10. *P<0.05 vs healthy control group; #P<0.05 vs HIBD group.
讨论
缺氧缺血性脑损伤常见于新生儿,其他年龄段也有发生,虽然发病率不高,但是会诱发一系列后遗症。缺氧缺血性脑损伤会导致水肿、炎症反应、自由基产生、小胶质细胞活化等病理生理过程,大量炎症因子的释放会加重脑组织损伤[13]。本研究结果显示,缺氧缺血性脑损伤大鼠脑组织功能下降,新异臂进入次数减少,脑含水率和脑指数升高,组织损伤严重,大量脑组织细胞凋亡,炎症因子异常表达加剧缺氧缺血性脑损伤。经2和4 mg/kg圣草酚给药治疗后,新异臂进入次数增加,脑含水率和脑指数下降,组织损伤程度好转,结果提示,圣草酚能够改善缺氧缺血性脑损伤大鼠脑组织功能,缓解脑组织损伤。
研究表明,细胞凋亡也参与缺氧缺血性脑损伤发生过程,缺氧缺血性脑损伤发生时,上游细胞凋亡起始蛋白caspase-9诱导并活化下游细胞凋亡执行蛋白caspase-3,凋亡蛋白caspase-3和caspase-9被异常激活,使得大脑组织产生大量的cleaved caspase-3和cleaved caspase-9,并进一步执行DNA裂解及细胞凋亡过程,加重脑组织损伤[3,14]。本研究通过TUNEL和Western blot检测脑组织中细胞凋亡程度、cleaved caspase-3和cleaved caspase-9蛋白表达水平,结果显示,模型组大鼠脑组织中细胞凋亡程度显著升高,cleaved caspase-3和cleaved caspase-9蛋白表达增加;经2和4 mg/kg圣草酚治疗后,cleaved caspase-3和cleaved caspase-9蛋白表达显著降低,细胞凋亡数显著减少。结果提示,圣草酚抑制缺氧缺血性脑损伤大鼠脑组织中凋亡蛋白的表达,缓解脑组织细胞凋亡引起的脑组织损伤。
缺氧缺血脑损伤引起脑组织主要的生理病理改变是能量代谢紊乱,促使氧自由基积累和细胞内钙超载,机体内部氧化与抗氧化作用失去平衡,导致细胞炎性浸润,蛋白酶分泌增加,产生大量的炎症因子和氧化中间产物。研究表明,缺氧缺血性脑损伤与氧化应激和炎症反应密切相关[15]。TNF-α、IL-6和iNOS是重要的炎症调节因子,参与多种生理和细胞免疫过程,诱导机体发生炎症反应,在缺氧缺血性脑损伤中起负调控作用。本实验结果显示,模型组大鼠外周血中TNF-α、IL-6和iNOS蛋白含量升高,经圣草酚治疗后,TNF-α、IL-6和iNOS蛋白含量降低。结合HE染色结果可知,圣草酚抑制缺氧缺血性脑损伤大鼠脑组织炎症因子蛋白表达,减少炎症细胞浸润,缓解炎症因子高表达引起的脑组织损伤。
为进一步明确圣草酚缓解缺氧缺血性脑损伤大鼠脑组织功能的作用机制,本实验利用Western blot检测Keap1、Nrf2和HO-1蛋白表达水平。Nrf2是抗氧化剂的关键转录调节因子,当细胞处于氧化应激状态时,Nrf2与其负性调节因子Keap1发生解离转入细胞核内与小Maf蛋白结合形成异二聚体,异二聚体与抗氧化反应元件结合,促使基因的表达,从而发挥抗氧化和抗炎作用[16-18]。Nrf2磷酸化(p-Nrf2)可促进Nrf2核蓄积和抗氧化反应元件受体转基因的激活,增强Nrf2与核内相关蛋白的结合,上调抗氧化酶基因表达,研究显示,Nrf2/HO-1信号通路负调控TNF-α、IL-6、IL-1β和cleaved caspase-3表达,从而减轻氧化应激、炎症反应、细胞凋亡对机体的损伤[19-20]。本研究结果显示,模型组大鼠高表达TNF-α、IL-6和iNOS,低表达Keap1、p-Nrf2/Nrf2和HO-1,经2和4 mg/kg圣草酚治疗后,TNF-α、IL-6和iNOS蛋白表达量降低,Keap1、p-Nrf2/Nrf2和HO-1蛋白表达升高,结果提示,圣草酚通过激活Nrf2/HO-1信号通路,抑制凋亡蛋白和促炎因子表达,缓解缺氧缺血性脑损伤大鼠因凋亡蛋白和炎症因子高表达引起的脑组织损伤。
综上所述,圣草酚可抑制缺氧缺血性脑损伤大鼠脑组织凋亡蛋白和炎症因子表达,减轻大鼠脑组织损伤,作用机制与Nrf2/HO-1信号通路有关。本实验通过动物模型初步探讨了圣草酚在缺氧缺血性脑损伤中的作用及机制,为圣草酚在缺氧缺血性脑损伤中的临床应用提供了实验基础。
[1]闵颖俊, 赵俊雄, 彭行, 等. 小胶质细胞参与新生儿缺氧缺血性脑损伤所致突触异常的研究[J]. 中国病理生理杂志, 2021, 37(3):385-392.
Ming YJ, Zhao JX, Peng X, et al.Microglia cells are involved in synaptic abnormalities caused by hypoxic-ischemic brain damage in neonates[J]. Chin J Pathophysiol, 2021, 37(3):385-392.
[2]薛磊, 沈冰冰, 王丽娜, 等. 黄芩苷对新生大鼠缺氧缺血性脑损伤保护作用的实验研究[J]. 解放军医药杂志, 2019, 31(10):6-9.
Xue L, Shen BB, Wang LN, et al. An experiment study of baicalin in protection of neonate rats with hypoxic ischemic brain damage[J]. Med Pharm J Chin People's Liber Army, 2019, 31(10):6-9.
[3] Lv Y, Sun B, Lu XX, et al. The role of microglia-mediated pyroptosis in neonatal hypoxic-ischemic brain damage[J]. Biochem Biophys Res Commun, 2020, 521(4):933-938.
[4] Wei W, Lan XB, Liu N, et al. Echinacoside alleviates hypoxic-ischemic brain injury in neonatal rat by enhancing antioxidant capacity and inhibiting apoptosis[J]. Neurochem Res, 2019, 44(7):1582-1592.
[5] Islam A, Islam MS, Rahman MK, et al. The pharmacological and biological roles of eriodictyol[J]. Arch Pharm Res, 2020, 43(6):582-592.
[6] Lv P, Yu J, Xu X, et al. Eriodictyol inhibits high glucose-induced oxidative stress and inflammation in retinal ganglialcells[J]. J Cell Biochem, 2019, 120(4):5644-5651.
[7] Habtemariam S. The Nrf2/HO-1 axis as targets for flavanones: neuroprotection by pinocembrin, naringenin, and eriodictyol[J]. Oxid Med Cell Longev, 2019, 2019:4724920.
[8]王茹, 沈磊. 圣草酚对实验性结肠炎小鼠Nrf2/HO-1通路的影响[J]. 中国免疫学杂志, 2020, 36(8):928-932.
Wang R, Shen L. Effect of eriodictyol on Nrf2/HO-1 pathway in experimental colitis mice[J]. Chin J Immunol, 2020, 36(8):928-932.
[9] Yang W, Zhang X, Wang N, et al. Effects of acute systemic hypoxia and hypercapnia on brain damage in a rat model of hypoxia-ischemia[J]. PLoS One, 2016, 11(12):e0167359.
[10] Li X, Hong M. Aqueous extract of Dendrobium officinale confers neuroprotection against hypoxic-ischemic brain damage in neonatal rats[J]. Kaohsiung J Med Sci, 2020, 36(1):43-53.
[11] Ferreira Ede O, Fernandes MY, Lima NM, et al. Neuroinflammatory response to experimental stroke is inhibited by eriodictyol[J]. Behav Brain Res, 2016, 321:321-332.
[12] 陈惠金, 张忠德, 周建德, 等. 脑缺氧缺血损伤新生大鼠的脑形态学研究及病理量化评分[J]. 上海医学, 2000, 23(11):682-684.
Chen HJ, Zhang ZD, Zhou JD, et al. Cerebral morphologic study and pathological quantitative score of neonatal rats with cerebral hypoxic ischemia injury[J]. Shanghai Med J, 2000, 23(11):682-684.
[13] 张英英, 单海军, 郭鑫. 针刺对缺氧缺血性脑损伤新生大鼠的神经保护作用及对小胶质细胞和炎症反应的影响[J]. 中国免疫学杂志, 2020, 36(2):169-173.
Zhang YY, Shan HJ, Guo X. Neuroprotective effects of acupuncture on neonatal rats with hypoxic-ischemic brain damage and their effects on microglia and inflammatory response[J]. Chin J Immunol, 2020, 36(2):169-173.
[14] Claire T, Bryan L, Carina M, et al. Cell death in the developing brain after hypoxia-ischemia[J]. Front Cell Neurosci, 2017, 11:248.
[15] Bai X, Liu S, Yuan L, et al. Hydrogen-rich saline mediates neuroprotection through the regulation of endoplasmic reticulum stress and autophagy under hypoxia-ischemia neonatal brain injury in mice[J]. Brain Res, 2016, 1646:410-417.
[16] Zhang W, Dong X, Dou S, et al.Neuroprotective role of Nrf2 on hypoxic‐ischemic brain injury in neonatal mice[J]. Synapse, 2020, 74(11):e22174.
[17] 高雅萱, 宋顺晨, 盛奕, 等. Nrf2在脑铁代谢中作用的研究进展[J]. 中国病理生理杂志, 2021, 37(8):1499-1504.
Gao YX, Song SC, Sheng Y, et al. Role of Nrf2 in brain iron metabolism[J]. Chin J Pathophysiol, 2021, 37(8):1499-1504.
[18] 王波, 于景翠, 周虹. 血红素加氧酶-Ⅰ与实体肿瘤[J]. 医学分子生物学杂志, 2008, 5(4):336-339.
Wang B, Yu JC, Zhou H. HO-1 and solid tumor[J]. J Med Mol Biol, 2008, 5(4):336-339.
[19] Li H, Lv L, Wu C, et al. Methyl jasmonate protects microglial cells against β-amyloid-induced oxidative stress and inflammation via Nrf2-dependent HO-1 pathway[J]. Neuropsychiatr Dis Treat, 2020, 16:1399-1410.
[20] Park C, Lee H, Noh JS, et al. Hemistepsin A protects human keratinocytes against hydrogen peroxide-induced oxidative stress through activation of the Nrf2/HO-1 signaling pathway[J]. Arch Biochem Biophys, 2020, 691:108512.
Eriodictyol attenuates hypoxic-ischemic brain damage in rats by activating Nrf2/HO-1 signaling pathway
ZHAO Bin, WANG Mei-Ling, Ma Wen-bing, ZHANG Qing-qing△
(,,256603,)
To investigate the effect and mechanism of eriodictyol on hypoxic-ischemic brain damage (HIBD) in rats.Fifty young Wistar rats were divided into healthy control group, model group (HIBD group), HIBD+eriodictyol 1 mg/kg group, HIBD+eriodictyol 2 mg/kg group and HIBD+eriodictyol 4 mg/kg group, with 10 rats in each group. Rice-Vannucci method was used to establish the rat model of hypoxic-ischemic brain injury. Eriodictyolat the does of 1, 2 and 4 mg/kg was orally administered in rats, normal saline was serve as control. The number of new heteroarm entry was tested by Y maze test. Brain water content and brain index were calculated by 2,3, 5-triphenyltetrazolium chloride (TTC) method. Hematoxylin-eosin (HE) staining was used to observe the degree of brain tissue damage and pathological score. TUNEL staining was used to observe the apoptotic rate of brain cells. Cleaved caspase-3, cleaved caspase-9, Kelch-like epichlorohydrin-associated protein 1 (Keap1), nuclear factor E2-related factor 2 (p-Nrf2/Nrf2), and heme oxygenase-1 (HO-1) protein expression levels were detected by Western blot. The protein levels of tumor necrosis factor-α (TNF-α), interleukin-6 (IL-6) and inducible nitric oxide synthase (iNOS) in peripheral blood were determined by enzyme linked immunosorbent assay (ELISA).Compared with healthy control group, the level of brain injury, apoptosis and expression of inflammatory factors (TNF-α, IL-6 and iNOS) in model group were significantly increased (<0.05), while the expression of p-Nrf2 and HO-1 protein was significantly decreased (<0.05). Compared with model group, 2 and 4 mg/kg eriodictyol significantly improved the degree of brain injury (<0.05), it is also significantly reduced the apoptotic rate of brain cells and cleaved caspase-3 and cleaved caspase-9 protein expression levels (<0.05). The protein levels of pro-inflammatory factors such as TNF-α, IL-6 and iNOS were significantly decreased (<0.05), and the protein expressions of Keap1, p-Nrf2 and HO-1 were significantly up-regulated after treated with eriodictyol (<0.05).Eriodictyol alleviates hypoxic-ischemicbrain injury in rats through Nrf2/HO-1 signaling pathway.
Eriodictyol; Hypoxic-ischemic brain damage; Nrf2/HO-1 signaling pathway; Apoptosis
R722; R363.2
A
10.3969/j.issn.1000-4718.2022.03.014
1000-4718(2022)03-0495-07
2021-11-17
2022-02-22
[基金项目]山东省医药卫生科技发展计划项目(No. 2018WS539)
Tel: 0543-3156444; E-mail: zhangqingsos@aliyun.com
(责任编辑:林白霜,余小慧)
