基于CRISPR/Cas9技术创制木薯MeSTP7和MeSTP15双基因突变体
2022-03-25耿沙张建禹王晓彤任思杨毋志浩姚远李瑞梅
耿沙 张建禹 王晓彤 任思杨 毋志浩 姚远 李瑞梅





,
郭建春,刘 姣,罗丽娟
1. 海南大学热带作物学院,海南海口 570228;2. 中国热带农业科学院热带生物技术研究所/海南熱带农业资源研究院,海南海口 571101
摘 要:木薯( Crantz)是一种热带、亚热带重要的粮食与能源作物,提高木薯的产量对木薯产业发展至关重要。木薯块根的发育直接影响其产量情况,而不同逆境胁迫会影响木薯块根的发育情况。因此解析木薯块根的发育机制有助于通过分子育种手段实现木薯高产,以及获得具备一定抗逆品质的优良种质,增强木薯的适应性,从而扩大木薯种植的推广面积。己糖转运蛋白(STPs)是一类MSTs亚家族蛋白,通过转运糖类物质调节植物生长发育及非生物胁迫。本实验室前期鉴定出和基因在块根发育时期的糖分累积、应对非生物胁迫过程中起到重要作用,因此获得木薯和双突变体将有助于解析木薯块根发育机制及创制抗逆新种质。为了得到和木薯双突变体,利用在线软件CRISPR-P v2.0同时设计靶标基因和的sgRNA,成功构建了和的CRISPR/Cas9双基因编辑载体。将编辑载体转化农杆菌LBA4404后,侵染‘华南8号’(SC8)木薯脆性胚性愈伤组织,经过Sanger测序分析和成功发生编辑,而潜在的脱靶位点未发生编辑,说明双编辑载体可对和基因进行编辑,且不造成脱靶现象,然后将侵染后的脆性胚性愈伤组织诱导出子叶,经过15 mmol/L的潮霉素B筛选出生根植株,生根植株再经过分子检测,成功获得带有双编辑载体表达框的转基因阳性植株。以阳性植株的基因组作为模板,分别用PCR扩增2个基因的靶位点前后各100 bp核苷酸序列,经过Hi-TOM测序后,结果显示有26个株系发生突变,其中双基因突变体有23个,单基因突变体2个,单基因突变体1个,编辑类型多为单碱基缺失或插入,大片段碱基的缺失所占比率小。初步在组培瓶中观察突变体的变型,发现单突变体和双突变体的根系生长均受抑制,植株矮小,且和双突变体受损更严重。该研究结果不仅为进一步解析木薯块根发育机制奠定基础,还为获得木薯抗病、抗逆新种质提供材料。
关键词:木薯;己糖转运蛋白;CRISPR/Cas9;双基因编辑
中图分类号:S330 文献标识码:A
Construction of and Double Mutants in Cassava Based on CRISPR/Cas9 Technology
GENG Sha, ZHANG Jianyu, WANG Xiaotong, REN Siyang, WU Zhihao, YAO Yuan, LI Ruimei, GUO Jianchun, LIU Jiao, LUO Lijuan
1. College of Tropical Crops, Hainan University, Haikou, Hainan 570228, China; 2. Institute of Tropical Bioscience and Biotechnology, Chinese Academy of Tropical Agricultural Sciences / Hainan Institute for Tropical Agricultural Resources, Haikou, Hainan 571101, China
Cassava ( Crantz) is an important food and energy crop in the tropics and subtropics, and improving cassava production is essential for the development of the cassava industry. The development of cassava storage root directly affects its yield, and different adversity stresses can affect the development of cassava storage root. Therefore, the analysis of cassava storage root development mechanism can help to achieve high cassava yield through molecular breeding, as well as to obtain excellent germplasm with certain resistance quality and enhance the adaptability of cassava, so as to expand the extension of cassava cultivation. Hexose transport proteins (STPs) are a subfamily of MSTs that regulate plant growth and development as well as abiotic stresses by transporting sugars. The and genes have been identified to play an important role in sugar accumulation during tuber development and in response to abiotic stresses. To obtain cassava double mutants, CRISPR/Cas9 double gene editing vectors for and were successfully constructed by designing the sgRNAs of both target genes, and 5, using the online software CRISPR-P v2.0. After transformation of the editing vector into LBA4404, ‘SC8’ cassava brittle embryonic healing tissues were infiltrated, and and were successfully edited by Sanger sequencing analysis, while the potential off-target sites were not edited, indicating that the dual editing vector could edit both and genes without causing off-target phenomenon. The rooted seedlings were then screened with 15 mmol/L Hygromycin B to produce rooted seedlings, which were then characterized detection to obtain positive transgenic cassavaplantswith the expression frame of the double-edited vector. The genomes of positive plants were used as the templates for PCR amplification of 100 bp nucleotide sequences before and after each target site of the two genes, and after Hi-TOM sequencing, the results showed that there were 26 strains with mutations, including 23 double mutants, 2 single mutants and 1 single mutant, and the editing types were mostly single. The types of editing were mostly single base deletions or insertions, with a small percentage of deletions of large segments of bases. Our preliminary observations of the mutant variants in histoponic flasks revealed that root growth was inhibited and plants were dwarfed in both the single and double mutants, and that the and double mutants were more severely damaged. These results not only lay the foundation for further analysis of the mechanism of cassava tuber development, but also provide material for obtaining new germplasm for cassava disease and stress resistance.
cassava; hexose transport proteins; CRISPR/Cas9; double gene editing
10.3969/j.issn.1000-2561.2022.03.004
木薯( Crantz)是一种热带、亚热带重要的粮食与能源作物。木薯产量与其块根发育和逆境适应密切相关。在植物中,单糖可作为植物生命活动的能量供给,还可作为信号分子与激素协同作用、渗透保护剂、抗氧化剂等影响植物的生长发育。而糖类物质的运输由糖外排转运蛋白(SWEETs)、蔗糖转运蛋白(SUTs)、单糖转运蛋白(MSTs)三类蛋白负责运输。己糖转运蛋白(STPs)属于MSTs亚家族,具有典型的12次跨膜结构域,是质膜上H/糖共转体,不同的己糖转运蛋白STPs具有的氨基端和羧基端跨膜蛋白序列有很高的同源性,但在一些结构域有保守的氨基酸序列,其功能并不一致。研究表明STPs主要参与植物库器官的发育和库强的构建,还参与植物的开花结果、信号传导、生物和非生物胁迫等多种生理过程。为研究在木薯块根发育和非生物胁迫中的作用,本实验室前期在木薯中成功鉴定出20个己糖转运蛋白基因。对其组织特异性和木薯块根发育过程中的表达模式分析,发现其中(Manes.03G180400)和(Manes. 15G027300)在早期贮藏根的根尖中高表达,且受干旱胁迫和低温胁迫诱导表达上调最高,推测和基因参与块根发育时期的糖分累积和应对非生物胁迫过程中起到重要作用。此外,和有相似的糖转运功能,对葡萄糖、戊糖、木糖、核糖、半乳糖、果糖和甘露糖这7种己糖都有转运特性。
和的蛋白序列相近,功能可能存在冗余,為更好地解析这2个基因功能,对其同时进行基因编辑,创制和MeSTP15双突变体。CRISPR/Cas9基因编辑技术不仅编辑效率高、稳定和特异性强,还能同时编辑多个基因,被广泛地应用到医学研究和生命科学领域,目前用于提高作物的抗性及营养价值,已在玉米、水稻、木薯等植物中应用。在木薯中,利用CRISPR/Cas9双基因编辑技术同时介导编辑木薯eIF4E异构体nCBP-1和nCBP-2,可降低木薯褐条病症状严重程度和发病率,为本研究提供了设计提供了思路。本研究利用CRISPR/Cas9技术构建木薯和双基因编辑载体,转化‘华南8号’(SC8)木薯脆性胚性愈伤,验证载体的编辑效果,获得了和双基因突变体,有助于后续深入解析在木薯块根发育过程中的作用。
材料与方法
材料
本研究选用具有适应性强、抗风性强、出苗率高的木薯品种‘华南8号’(SC8),种植于中国热带农业科学院木薯种质资源圃。菌株LBA4404根癌农杆菌菌株、DH5α大肠杆菌菌株购于上海唯地生物技术有限公司,载体质粒pCAMBIA1301-Cas9-sgRNA为本实验室所保存。
方法
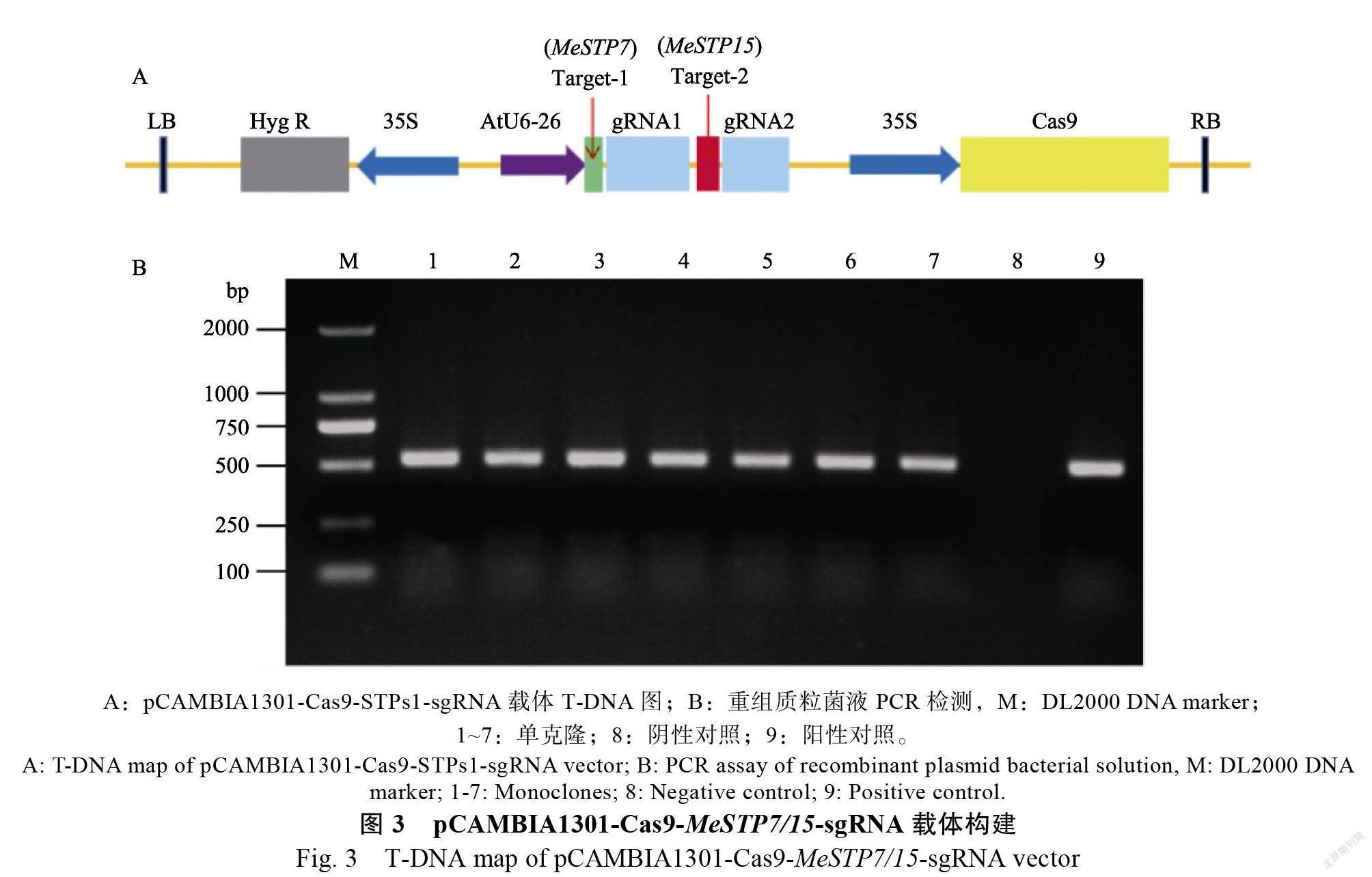
1.2.1 靶点引物的设计及基因编辑载体构建根据(Manes.03G180400)和(Manes.15G027300)基因的CDS序列,利用CRISPR-P v2.0在线软件(http://crispr.hzau.edu. cn/cgi-bin/CRISPR2/CRISPR)分析CDS区靶点及潜在脱靶位点,选择满足以下条件的靶点:靶点得分高于0.6,相对应脱靶位点得分低;靶点GC含量为50%~70%;sgRNA中至少含有完整的茎环RAR、茎环2、茎环3。合成靶点退火引物(表1),参照李崭等的方法构建和双基因编辑载体。根据载体序列,在AtU6-26启动子前设计阳性克隆F,在gRNA2后设计阳性克隆R,通过菌液PCR扩增目的片段(538 bp),将测序正确的质粒命名为pCAMBIAP1301-Cas9- -sgRNA,并将该质粒转化LBA4404农杆菌,菌液PCR验证正确后备用。
1.2.2木薯脆性胚性愈伤组织的诱导及侵染转化 将鉴定正确的pCAMBIAP1301-Cas9-- sgRNA质粒的LBA4404农杆菌侵染木薯的脆性愈伤组织,将农杆菌摇菌至对数,调整侵染浓度为为0.65,乙酰丁香酮浓度为250 mmol/L,侵染时间为40 min。侵染后的脆性胚性愈伤组织转移至GD固体培养基上,在22℃黑暗条件培养3 d后洗菌。然后移至GD固体培养基上,第1周不加潮霉素筛选,从第2周开始每周更换一次潮霉素筛选压(5、8、15 mg/L潮霉素),培养4周后,移至培养基(MS+1 mg/L NAA)诱导子叶,子叶在生根(MS+15 mg/L潮霉素)筛选后再经过DNA鉴定,确定阳性植株。
1.2.3 编辑效果检测及脱靶分析 根据张彤等的方法,设计和 CDS区编辑靶点和4个潜在脱靶位点区域的PCR扩增引物(表1)。提取未侵染的木薯脆性胚性愈伤组织DNA和含有pCAMBIAP1301-Cas9--sgRNA质粒农杆菌侵染后的木薯脆性胚性愈伤组织DNA,用靶点引物(target-1)和靶点引物(target-2)PCR扩增获得目的片段并测序。基于Sanger测序峰值图,分析编辑效果及验证是否存在脱靶情况。
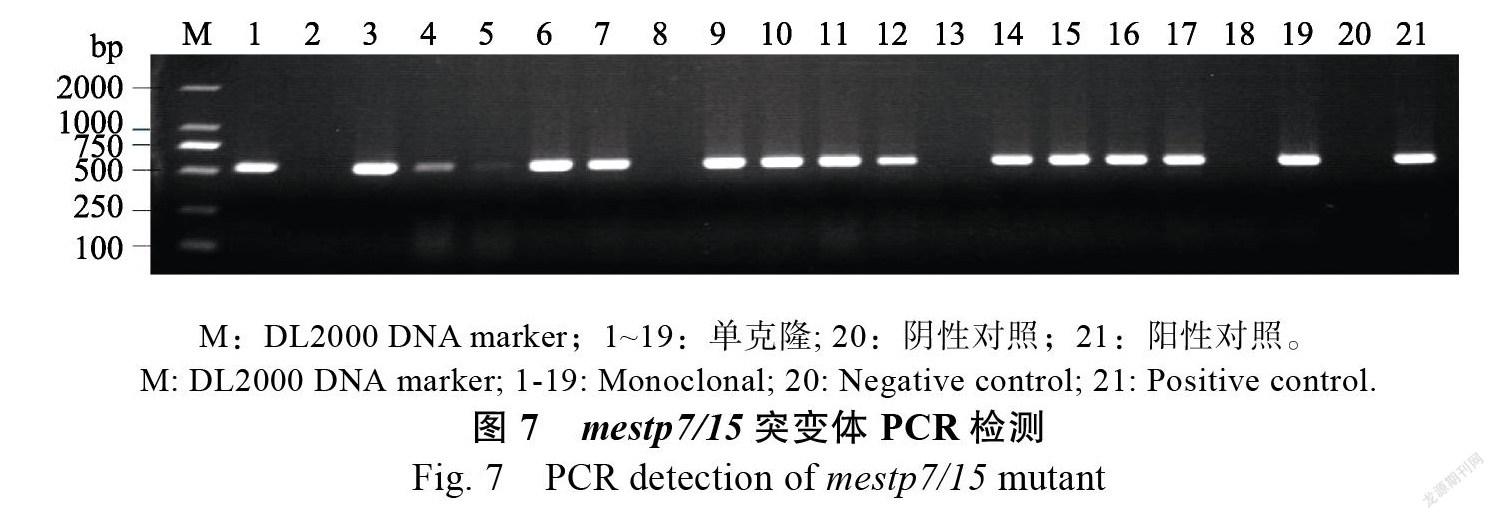
1.2.4 阳性苗的鉴定及突变体的鉴定 提取经过潮霉素生根筛选的再生植株叶片的DNA,用阳性克隆筛选引物,PCR扩增包含AtU6-26、靶点1、gRNA1、靶点2、gRNA2载体片段,凝胶电泳片段大小为538 bp的则为转基因苗。提取阳性苗的DNA,用靶点引物(target-1)和 靶点引物(target-2)PCR扩增基因靶点前后100 bp,送高通量测序(Hi-TOM测序),检测靶点是否发生插入或缺失,分析是否导致基因突变。
结果与分析
2.1 双基因编辑靶点的设计及潜在脱靶位点分析
利用木薯基因和的DNA序列,通过在线设计软件CRISPR-P2.0,获得,基因编辑靶点位于该基因的第3个外显子,命名靶点1(图1),GC含量为60%,有1个潜在脱靶位点,位于10号染色体Manes. 10G030300基因的CDS区,脱靶分值为0.106,命名为Off-target-1;基因编辑靶点位于该基因的第2个外显子,命名靶点2(图1),GC含量为48%,有3个潜在脱靶位点,Off-target-2位于10号染色体Manes.10G105000基因的内含子,脱靶分值为0.312,Off-target-3位于号染色体Manes.08G047800基因的内含子,脱靶分值为0.115,Off-target-4位于1号染色体Manes. 01G204800基因的内含子,脱靶分值为0.092。潜在脱靶位点只有Off-target-1位于CDS区且得分较低,其余脱靶位点位于内含子,表明即使脱靶也不会造成基因功能的缺失(表2)。对靶点1和靶点2的sgRNA的二级结构预测分析结果显示,靶点序列二级结构较为松散,含有完整的茎环RAR、茎环2、茎环3,利于结合靶位点(图2)。
基因编辑载体构建
本研究所采用的基因编辑载体为pCAMBIA1301-Cas9-sgRNA。利用限制性内切酶Ⅰ酶切将载体线性化,再将线性化的质粒与退火后的靶点引物连接,得到AtU6-26--sgRNA表达盒(图3)。通过菌液PCR扩增目的条带,经测序分析,长约538 bp,进一步证明载体pCAMBIA1301-Cas9--sgRNA已构建成功。最后提取阳性质粒转LBA4404农杆菌,备用。
木薯脆性胚性愈伤组织的诱导及转化
将培养2个月的‘SC8’无菌苗切茎段,诱导侧芽膨大,挑取侧芽诱导体细胞胚,体细胞胚诱导得到脆性胚性愈伤组织(图4A、图4B、图4C)。将携带编辑质粒pCAMBIA1301-Cas9- -sgRNA的LBA4404农杆菌转化木薯脆性胚性愈伤组织,转化后培养脆性胚性愈伤组织4周,再诱导出子叶,诱导子叶分化形成植株,在MS+15 mg/L潮霉素的培养基中筛选再生根苗(图4D、图4E、图4F)。
<!--[if gte vml 1]>
编辑效果检测及脱靶分析
以未转化和转化4周后的脆性胚性愈伤组织
DNA为模板,通过PCR扩增和基因的编辑靶点上下100 bp左右的基因组片段,并测序分析该区域的序列变化情况。结果显示,在转化后的样品中,靶点(Target-1)的PAM区附近开始出现多峰,靶点(Target-2)的PAM区及后续片段都发生了移码,峰值错乱,然而未转化样品中并无杂锋出现(图5),表明携带编辑质粒的农杆菌成功转化进入脆性胚性愈伤组织,在2个靶点处发生编辑。再以未转化和转化4周后的木薯脆性胚性愈伤组织DNA为模板,通过PCR扩增和基因编辑靶点的4个潜在脱靶位点区域片段,利用Sanger测序分析该靶点是否存在脱靶现象。结果表明,潜在脱靶位点的序列在已转化和未转化的样品中未发生改变(图6)。说明本研究构建的双基因编辑载体pCAMBIA1301-Cas9-- sgRNA可对和基因同时进行编辑,均无脱靶现象。
阳性苗筛选及突变体编辑分析
将鉴定发生编辑的木薯脆性胚性愈伤组织诱导产生子叶,子叶诱导成苗,经过15 mg/L的潮霉素生根筛选,提取生根苗的DNA进行PCR检测,成功得到带有编辑表达框的阳性植株(图7)。阳性苗Hi-TOM测序检测是否发生编辑,于‘SC8’比对分析,2个靶点的编辑类型主要是单个碱基的缺失或插入,大片段的编辑类型较少;突变类型有纯和突变、杂合突变及双等位突变的多种突变形式,编辑率比对发现,靶点Target-1<!--[if gte vml 1]>
突变体表型分析
突变体茎段培养一个月后,与野生型(SC8)相比,所有株系均表现出生长缓慢,植株矮小,根系生长受抑制。单突变体与的单基因突变体相比,株高稍高但根系发育相对缓慢;推测主要在根中发挥作用;而双突变体、株系相比于野生型和单突变体,根系发育严重受损,植株低矮,叶片窄小。同时观察到的根系受损比严重推测由于突变比率高于(图8)。初步证明功能存在冗余,影响木薯根的发育。
<!--[if gte vml 1]>
讨论
植物进行光合作用,在叶片中合成糖类物质,这些糖类物质从源叶组织经过糖转运体运输、转运到下沉库组织利用和储存。这一过程对植物应对非生物胁迫和生物胁迫至关重要。因此,了解糖分配及其遗传调控对于实现突破以提高作物产量和非生物胁迫耐受性至关重要。KOMAITIS等在蒺藜苜蓿中研究發现MSTs家族通过调控糖分的运输,进而影响苜蓿根瘤菌对氮的固定。董元花在苹果中发现过表达后,促进植株根的生长发育,同时抗逆性降低。拟南芥中,利用RNAi干扰沉默和后,切断对保卫细胞的能量供应,抑制光合作用。定位于拟南芥侧根结点处,和侧根生长相关。过表达后增加拟南芥叶片光合作用,从而提高氮的利用率,并且能抑制灰霉病。在水稻中,、、、和在盐、渗透性和干旱胁迫下高表达。在小麦中,小麦条锈病可刺激宿主细胞中的ABA生物合成,从而上调、和的表达,从而增加真菌己糖的供应,促进感染,在大麦中发现突变体(自然突变的),削弱了己糖转运活性,对锈病和白粉病有一定的抗性,反义沉默也能抑制条锈病的感染。
CRISPR/Cas9是一项特异识别编辑技术,仅需gRNA引导序列和Cas9核酸酶即可对靶基因DN序列进行剪切编辑,CRISPR/Cas9双基因编辑已经使用于多个物种。为研究和的生物学功能,利用CRISPR/Cas9技术分别设计和的靶位点,将2个靶位点串联,构建双基因编辑载体,转化木薯胚性脆性愈伤组织,一个月后检测靶点的编辑效率,证明本研究构建的双基因编辑载体pCAMBIA<!--[if gte vml 1]>
本研究通过构建CRISPR/Cas9介导的双基因编辑载体,对和基因同时进行编辑。初步确定和对木薯根系发育的影响。为后续研究块根发育机制提供了丰富的材料,而STPs家族在植物应对非生物胁迫和抗击病原菌中也起到关键作用,推测突变体在应对非生物胁迫和抵抗病原菌起到作用。本研究对其功能分析尚浅,后续我们将在大田里筛选可稳定遗传的株系作为研究材料,分析不同阶段的木薯根系形态及地上部分的生长情况,检测块根淀粉和糖类物质含量,分析和基因其对植物生长发育的影响;对其突变体进行干旱、盐和低温胁迫并分析其抗逆性,解析和基因在非生物脅迫中的作用;接种木薯的主要病原菌:细菌性枯萎病、花叶病、褐斑病、锈病和白粉病,分析突变体对这些病害是否有抗病性。
参考文献
[1] 严华兵, 叶剑秋, 李开绵. 中国木薯育种研究进展[J]. 中国农学通报, 2015, 31(15): 63-70.
YAN H B, YE J Q, LI K M. Progress of cassava breeding in China[J]. Chinese Agricultural Science Bulletin, 2015, 31(15): 63-70. (in Chinese)
[2] WAISUNDARA V. Cassava[M/OL]. IntechOpen: 2018. https://www.intechopen.com/books/6308.
[3] SMEEKENS S, HELLMANN H A. Sugar sensing and signaling in plants[J]. Front Plant Science, 2014, 5: 113.
[4] RUAN Y L, JIN Y, YANG Y J, LI G J, BOYER J S. Sugar input, metabolism, and signaling mediated by invertase: roles in development, yield potential, and response to drought and heat[J]. Molecular Plant, 2010, 3(6): 942-955.
[5] JULIUS B T, LEACH K A, TRAN T M, MERTZ R A, BRAUN D M. Sugar transporters in plants: new insights and discoveries[J]. Plant and Cell Physiology, 2017, 58(9): 1442-1460.
[6] BÜTTNER M, SAUER N. Monosaccharide transporters in plants: structure, function and physiology[J]. Biochimica et Biophysica Acta, 2000, 1465(1/2): 263-274.
[7] SHERSON S M, ALFORD H L, FORBES S M, WALLACE G, SMITH S M. Roles of cell-wall invertases and monosaccharide transporters in the growth and development of [J]. Journal of Experimental Botany, 2003, 54(382): 525-531.
[8] BÜTTNER M. The monosaccharide transporter (-like) gene family in [J]. FEBS Letters, 2007, 581(12): 2318-2324.
[9] BÜTTNER M. The sugar transporter (AtSTP) family: an update[J]. Plant Biology, 2010, 12: 35-41.
[10] QIN L, HUIJIE D, ZHIJIAN C, DANG H J, CHEN Z J, WU J Z, CHEN Y H, CHEN S B, LUO L J. Genome-wide identification, expression, and functional analysis of the sugar transporter gene family in cassava ( Crantz)[J]. International Journal of Molecular Sciences, 2018, 19(4): 2-18.
[11] 黨会杰. 木薯单糖转运蛋白基因、的克隆与功能初步分析[D]. 海口: 海南大学, 2018.
DANG H J. Cloning and functional analysis of , sugar transporter gene in cassana (Crantz)[D]. Haikou: Hainan University, 2018. (in Chinese)
[12] 武军政. 木薯己糖转运蛋白基因的克隆与功能初步分析[D]. 海口: 海南大学, 2017.
WU J Z. Cloning and primary functional identification of sugar transporter gene in cassava ( Crantz)[D]. Haikou: Hainan University, 2017. (in Chinese)
[13] WANG J, CHEN H. A novel CRISPR/Cas9 system for efficiently generating Cas9-free multiplex mutants in [J]. aBIOTECH, 2019, 1(1): 6-14.
[14] XIE K, MINKENBERG B, YANG Y. Boosting CRISPR/ Cas9 multiplex editing capability with the endogenous tRNA-processing system[J]. Proceedings of the National Academy of Sciences of the United States of America, 2015, 112(11): 3570-3575.
[15] ODIPIO J, ALICAI T, INGELBRECHT I, NUSINOW D A, BART R, TAYLOR N J. Efficient CRISPR/Cas9 genome editing of in cassava[J]. Frontiers in Plant Science, 2017, 8(18): 1780-1791.
[16] GOMEZ M A, LIN Z D, MOLL T, CHAUHAN R D, HAYDEN L, RENNINGER K, BEYENE G, TAYLOR N J, CARRINGTON J C, STASKAWICZ B J, BART R S. Simultaneous CRISPR/Cas9-mediated editing of cassava eIF 4E isoforms nCBP-1 and nCBP-2 reduces cassava brown streak disease symptom severity and incidence[J]. Plant Biotechnology Journal, 2019, 17(2): 421-434.
[17] 李 嶄, 王亚杰, 陆小花, 李瑞梅, 刘 姣, 符少萍, 胡新文, 郭建春, 姚 远. 木薯基因的CRISPR/ Cas9基因编辑载体构建及验证[J]. 分子植物育种, 2020, 18(16): 5367-5372.
LI Z, WANG Y J, LU X H, LI R M, LIU J, FU S P, HU X W, GUO J C, YAO Y. Construction and verification of CRISPR/ Cas9 gene editing vector for cassava gene[J]. Molecular Plant Breeding, 2020, 18(16): 5367-5372. (in Chinese)
[18] 张 彤, 王亚杰, 郭文雅, 李瑞梅, 刘 姣, 郭建春, 胡新文, 姚 远, 耿梦婷. 木薯基因启动子EBE区编辑载体的构建及验证[J]. 热带作物学报, 2021, 42(11): 3120-3125.
ZHANG T, WANG Y J, GUO W Y, LI R M, LIU J, GUO J C, HU X W, YAO Y, GENG M T. Construction and verification of editing vector for EBE region of gene promoter in cassava[J]. Chinese Journal of Tropical Crops, 2021, 42(11): 3120-3125. (in Chinese)
[19] KAUR H, MANNA M, THAKUR T, GAUTAM V, SALVI P. Imperative role of sugar signaling and transport during drought stress responses in plants[J]. Physiologia Plantarum, 2021, 171(4): 833-848.
[20] KOMAITIS F, KALLIAMPAKOU K, BOTOU M, NIKOLAIDIS M, KALLONIATI C, SKLIROS D, DU B, RENNENBERG H, AMOUTZIAS G D, FRILLINGOS S, FLEMETAKIS E. Molecular and physiological characterization of the monosaccharide transporters gene family in [J]. Journal of Experimental Botany, 2020, 71(10): 3110-3125.
[21] 董元花. 苹果单糖转运蛋白MdSTP1参与植物生长与非生物胁迫响应的研究[D]. 泰安: 山东农业大学, 2020.
DONG Y H. Study on apple sugar transporter MDSTP1 in mediating plant growth and stress response[D]. Taian: Shandong Agricultural University, 2020. (in Chinese)
[22] FLÜTSCH S, NIGRO A, CONCI F, FAJKUS J, THALMANN M, TRTÍLEK M, PANZAROVÁ K, SANTELIA D. Glucose uptake to guard cells via STP transporters provides carbon sources for stomatal opening and plant growth[J]. EMBO Reports, 2020, 21(8): e49719-e49721.
[23] LEMONNIER P, GAILLARD C, VEILLET F, VERBEKE J, LEMOINE R, COUTOS-THÉVENOT P, LA CAMERA S. Expression of sugar transport protein STP13 differentially affects glucose transport activity and basal resistance to [J]. Plant Molecular Biology, 2014, 85(4/5): 473-484.
[24] SCHOFIELD R A, BI Y M, KANT S, ROTHSTEIN S J. Over-expression of STP13, a hexose transporter, improves plant growth and nitrogen use in seedlings[J]. Plant Cell and Environment, 2009, 32(3): 271-285.
[25] ROTTMANN T, KLEBL F, SCHNEIDER S, KISCHKA D, RÜSCHER D, SAUER N, STADLER R. Sugar transporter STP7 specificity for l-Arabinose and d-Xylose contrasts with the typical hexose transporters STP8 and STP12[J]. Plant Physiology, 2018, 176(3): 2330-2350.
[26] KONG W, AN B, ZHANG Y, YANG J, LI S, SUN T, LI Y. Sugar transporter proteins (STPs) in gramineae crops: comparative analysis, phylogeny, evolution, and expression profiling[J]. Cells, 2019, 8(6): 560-573.
[27] HUAI B, YANG Q, QIAN Y, QIAN W, KANG Z, LIU J. ABA-induced sugar transporter TaSTP6 promotes wheat susceptibility to stripe rust[J]. Plant Physiology, 2019, 181(3): 1328-1343.
[28] MILNE R J, DIBLEY K E, SCHNIPPENKOETTER W, MASCHER M, LUI A C W, WANG L, LO C, ASHTON A R, RYAN P R, LAGUDAH E S. The wheat gene from the sugar transport protein 13 family confers multipathogen resistance in barley[J]. Plant Physiology, 2019, 179(4): 1285-1297.
[29] CAI Y, WANG L, CHEN L, WU T, LIU L, SUN S, WU C, YAO W, JIANG B, YUAN S, HAN T, HOU W. Mutagenesis of GmFT2a and GmFT5a mediated by CRISPR/Cas9 contributes for expanding the regional adaptability of soybean[J]. Plant Biotechnology Journal, 2020, 18(1): 298-309.
[30] 毛興学, 柳武革, 郑晓钰, 范芝兰, 陈文丰, 潘大建, 李 晨, 王 丰. CRISPR/Cas9技术编辑和基因创制抗穗发芽水稻新种质[J]. 植物遗传资源学报, 2022, 23(1): 281-289.
MAO X X, LIU W G, ZHENG X Y, FAN Z L, CHEN W F, PAN D J, LI C, WANG F. Generating pre-harvest sprouting resistant germplasms by editing and via CRISPR/Cas9 technology[J]. Journal of Plant Genetic Resources, 2022, 23(1): 281-289. (in Chinese)
[31] 李兆伟, 孙聪颖, 零东兰, 曾慧玲, 张晓妹, 范 凯, 林文雄. 基于CRISPR/Cas9技术的osarf7突变体创建及其农艺性状调查[J/OL]. 中国水稻科学: 1-17. http://kns. cnki.net/kcms/detail/33.1146.S.20210708.1347.010.
LI Z W, SUN C Y, LING D L, ZEN H L, ZHANG X M, FAN K, LIN W X. Construction of osarf7 mutants in rice based on CRISPR/Cas9 technology and investigation on the corresponding agronomic traits[J/OL]. Chinese Journal of Rice Science: 1-17. http://kns.cnki.net/kcms/detail/33.1146. S. 20210708.1347.010. (in Chinese)
