植物天然产物的葡萄糖醛酸苷生物合成的研究进展
2022-03-21陈秉松王昭昕杨雨帆颜晓晖
陈秉松,周 迎,王昭昕,杨雨帆,邱 峰,颜晓晖*
植物天然产物的葡萄糖醛酸苷生物合成的研究进展
陈秉松1, 2,周 迎3,王昭昕2,杨雨帆2,邱 峰1*,颜晓晖2*
1. 天津中医药大学中药学院,天津 301617 2. 天津中医药大学 组分中药国家重点实验室,天津 301617 3. 天津中医药大学国际学院,天津 301617
葡萄糖醛酸化是一类重要的由葡萄糖醛酸转移酶(UDP-glucuronosyltransferase,UGT)催化的Ⅱ相代谢反应,负责多种体内内源性和外源性物质的清除。葡萄糖醛酸化影响内源或外源性物质在组织中的分布水平,对药物的药效和不良反应有巨大的影响。UGTs广泛分布于机体的各种组织中,不同亚型之间存在组织差异性和底物特异性。葡萄糖醛酸苷的制备为植物天然产物的药理活性、药动学性质、药物间相互作用等研究提供了基础。综述了植物天然产物酚类、香豆素类、木脂素类、生物碱类、萜类等葡萄糖醛酸苷生物合成的研究进展,为这类化合物的制备和药理活性研究提供参考。
植物天然产物;葡萄糖醛酸苷;葡萄糖醛酸转移酶;生物合成;多酚类;香豆素类;木脂素类;生物碱类;萜类
葡萄糖醛酸化是生物体内通过葡萄糖醛酸转移酶(UDP-glucuronosyltransferase,UGT)催化进行的II相代谢反应,在这类反应中,UGT催化葡萄糖醛酸从尿苷二磷酸葡萄糖醛酸(uridine 5′-diphosphoglucuronic acid,UDPGA)转移到内源性物质(如胆红素、类固醇激素和脂溶性维生素等)和外源性物质(药物、食物、环境毒物等)上生成相应的葡萄糖醛酸苷产物[1]。葡萄糖醛酸化通常导致产物水溶性增强,活性降低,可加快底物分子通过肾脏、胆汁或肠道清除。据统计,葡萄糖醛酸化代谢约占所有药物Ⅱ相代谢的35%[2]。因此,葡萄糖醛酸化在维系内源性物质平衡和体内外源性物质的清除中发挥关键调控作用,影响药物在组织中的分布和水平,对药物的药效和不良反应有巨大的影响,UGT也是机体发育[3-4]和疾病发生[5-7]的重要指标。在葡萄糖醛酸化反应过程中,UGT催化底物分子的亲核基团进攻葡萄糖醛酸,发生双分子亲核取代反应反应,葡萄糖醛酸中C1位羟基的构象发生翻转,生成β--葡萄糖醛酸苷和尿苷二磷酸,通常按照底物中亲核基团的不同,把葡萄糖醛酸化反应分为-、-、-和-葡萄糖醛酸化[8](图1)。大多数底物分子结合葡萄糖醛酸基团后水溶性增加,药理活性降低,清除率增加,但是一些葡萄糖醛酸代谢产物与底物相比具有更强的活性[9]。如阿片类药物吗啡在UGT2B7的催化下可产生吗啡6--葡萄糖醛酸苷(morphine-6-glucuronide,M6G)和吗啡3--葡萄糖醛酸苷(morphine-3-glucuronide,M3G),研究发现M6G的麻醉效果是吗啡的100倍,M3G具有明显的中枢兴奋作用[10]。化合物methyl 1-(3,4-dimethoxyphenyl)-3-(3-ethylvaleryl)-4-hydroxy-6,7,8-trimethoxy-2-naphthoate(S-8921)是一种肠道顶端钠依赖性胆汁转运蛋白(apical sodium-dependent bile acid transporter,ASBT)抑制剂,体外抑制实验表明其葡萄糖醛酸化代谢物S-8921G对人ASBT的抑制作用比原型药物强6000倍[11]。
UGT广泛分布在机体的各种组织器官如肝、肾、肠、胃、皮肤、胸腺、脑中,不同UGT的表达具有不同的组织特异性,对于内源性和外源性物质也具有不同的底物选择性和位点选择性,导致了体内葡萄糖醛酸化反应的高度复杂性(图2)。目前研究较为广泛的、以UDPGA为糖基供体的人源UGT可分为3个家族(UGT1A、UGT2A和UGT2B),包括19个亚型(UGT1A1、UGT1A3、UGT1A4、UGT1A5、UGT1A6、UGT1A7、UGT1A8、UGT1A9、UGT1A10、UGT2A1、UGT2A2、UGT2A3、UGT2B4、UGT2B7、UGT2B10、UGT2B11、UGT2B15、UGT2B17和UGT2B28)[9]。参与药物代谢的主要是UGT1A和UGT2B 2个家族,对这2个家族酶的表达和底物特异性研究也最多。近年来随着对UGT在内源和外源物质代谢、生长发育和疾病发生方面的深入研究,特别是因UGT基因多态性,相同药物在不同的人群中会产生不同的有效性和毒性[12],药物研发人员越来越重视药物葡萄糖醛酸化产物的药理活性、成药性和安全性等问题。伍明江等[13]采用超高效液相色谱与四级杆飞行时间质谱联用(UPLC-Q-TOF/MS)技术,从口服桑叶黄酮提取物的大鼠血浆、尿液、粪便、胆汁中分析鉴定了包括葡萄糖醛酸化代谢产物在内的41个代谢产物。Zhao等[14]通过收集给药大鼠的尿液,分离获得4--β--葡萄糖醛酸化根皮素和6-甲氧基-2--β--葡萄糖醛酸化根皮素,但从生物样品中直接提取生物体内的代谢产物,所需生物样品量大,成本高,不利于后续的药理活性研究。虽然可以通过Koenigs-Knorr反应利用卤代糖作为葡萄糖醛酸的供体来化学合成葡萄糖醛酸衍生物,但这一反应需要经过多个保护和脱保护步骤,合成效率普遍不高[15-16]。相比之下,利用UGT制备葡萄糖醛酸化产物具有反应条件温和、选择性好、合成步骤少、产物后处理容易等优势,越来越受到青睐。本文对植物天然产物葡萄糖醛酸化的催化酶、作用位点、化合物结构及近年来利用UGT制备植物天然产物的葡萄糖醛酸化衍生物的研究进展进行综述。
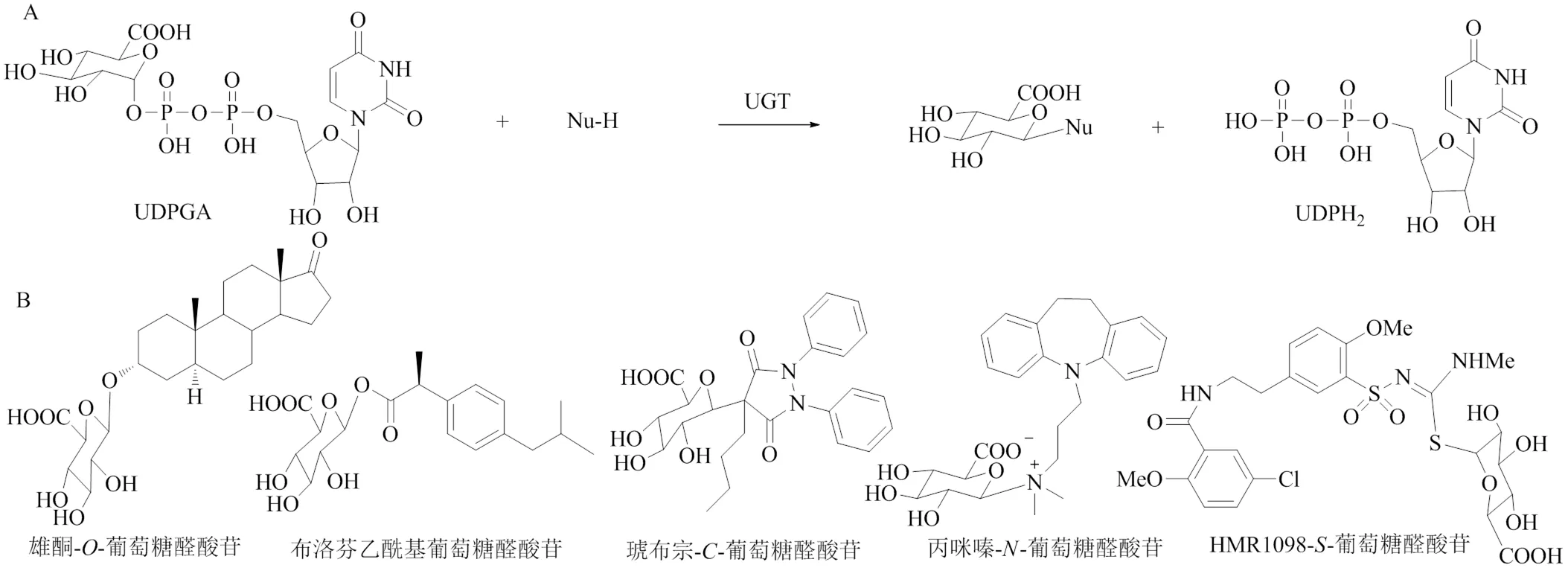
图1 UGT介导的葡萄糖醛酸化反应(A)及不同类型的葡萄糖醛酸化产物(B)

图2 葡萄糖醛酸转移酶进化树分析、组织分布和代表性底物
1 葡萄糖醛酸化代谢研究的体外模型
当前常用的研究葡萄糖醛酸化代谢的体外模型主要有原代肝细胞、微粒体和重组UGT等[17]。原代肝细胞是与人体肝脏最接近的模型,但其代谢活性在培养过程中会明显减弱,不同批次代谢活性差异大,且因为肝细胞来源短缺、操作复杂,难以广泛应用。微粒体是细胞内膜系统(主要为内质网)的膜结构破碎后形成的囊泡,一般通过组织匀浆、差速离心法制备,制备的微粒体包含了大量的UGT。因为肝脏、肾脏和肠道是动物代谢外源物质的主要组织,所以肝微粒体、肾微粒体和肠微粒体是最常用的微粒体模型。相对于原代肝细胞,微粒体具有易制备、易操作等优点,但其需要消耗动物资源,而且种属及个体差异会导致批次间的稳定性差,难以实现葡萄糖醛酸化代谢物的规模化制备。重组UGT酶是利用DNA重组技术将编码UGT的基因转入哺乳动物细胞(COS、V79和HEK293)、昆虫细胞(Sf9)中,实现其高效、专一表达。目前UGT1A1、UGT1A3、UGT1A4、UGT1A6、UGT1A7、UGT1A8、UGT1A9、UGT1A10、UGT2B4、UGT2B7、UGT2B15、UGT2B10、UGT2B17等人源UGT已经实现了以哺乳动物细胞为宿主的商业化重组表达[8]。利用重组UGT,可以研究不同酶的底物特异性,制备目标化合物的葡萄糖醛酸化衍生物,比较原型药物和衍生物在吸收、分布、代谢、外排等方面的性质差异。重组UGT也为研究基因多态性与药物代谢差异性提供了模型[18]。
2 利用体外模型制备植物天然产物的葡萄糖醛酸苷
2.1 酚类化合物的葡萄糖醛酸苷
2.1.1 类黄酮化合物的葡萄糖醛酸苷 类黄酮化合物具有抗氧化、抗炎、抗病毒等多种活性,在植物中主要以糖苷、酯等结合物形式存在,不易被机体吸收。类黄酮摄入后通常先被肠道中的酶及微生物水解成游离形式的苷元,被吸收后在UGT的作用下生成葡萄糖醛酸化衍生物,经由胆汁、粪便、尿液等途径排出体外,呈现明显的首关效应。类黄酮化合物的葡萄糖醛酸化反应主要由UGT1A家族中的6种酶UGT1A1、UGT1A3、UGT1A7、UGT1A8、UGT1A9、UGT1A10催化,UGT2B7和UGT2B15也可参与部分类黄酮化合物的代谢[1]。这些UGT酶在各个组织中的表达水平不同,对于不同类黄酮底物的选择性也有较大差异,导致体内类黄酮化合物的代谢具有组织特异性。如山柰酚(kaempferol)在大鼠体内存在山柰酚-7-葡萄糖醛酸苷(K-7-G)和山柰酚-3-葡萄糖醛酸苷(K-3-G)2种代谢产物,在小肠中更多生成K-3-G,而用大鼠肝微粒体催化山柰酚,主要的代谢产物是K-7-G[19]。此外,UGT针对不同类黄酮化合物中酚羟基的葡萄糖醛酸化也存在位点选择性。以木犀草素(luteolin)为例,人源重组UGT代谢研究表明其葡萄糖醛酸化代谢主要由UGT1A9、UGT1A6和UGT1A1催化,其中UGT1A9的代谢能力最强,介导其C7-OH和C3′-OH的葡萄糖醛酸化反应,UGT1A6介导C7-OH的葡萄糖醛酸结合,而UGT1A1可催化木犀草素C3′--葡萄糖醛酸苷中C7-OH与葡萄糖醛酸的结合,生成C7-OH和C3′-OH的双葡萄糖醛酸化产物[20]。由于类黄酮化合物的生物活性主要取决于羟基,特别是游离羟基的数目和位置,因此不同UGT对于这类化合物在体内的活性有重要影响。
2.1.2 白藜芦醇及其类似物的葡萄糖醛酸苷 白藜芦醇(resveratrol)及其类似物包括白皮杉醇(piceatannol)、氧化白藜芦醇(oxyresveratrol)、二芳基乙烯(combretastatin)、紫檀茋(pterostilbene)等,具有抗肿瘤、抗氧化和抗心血管疾病等多种活性,但口服后被肝细胞和肠上皮细胞中的UGT1A1、UGT1A3、UGT1A6、UGT1A7、UGT1A8、UGT1A9、UGT1A10以及磺基转移酶代谢,经由胆汁、尿液等途径清除,导致进入血液循环的白藜芦醇类化合物的原型浓度极低,其生物利用度几乎为零[21]。姜黄素(curcumin)可用于治疗肿瘤、糖尿病、炎症、神经退行性疾病、代谢综合征等,但因极低的口服生物利用度和在生理条件下降解快等缺点,限制了姜黄素的临床开发[22]。UGT1A1、UGT1A8和UGT1A10是主要的姜黄素及去甲氧基姜黄素的酚羟基葡萄糖醛酸化酶,而双去甲氧基姜黄素不易被葡萄糖醛酸化;UGT1A9可以同时催化姜黄素酚羟基和碳链上醇羟基的葡萄糖醛酸化[23]。大麻酚(cannabinol)是从大麻中分离的一种活性物质,可与免疫细胞表面抑制性G蛋白偶联受体CB1和CB2结合,大麻酚与CB2受体的结合与激活能力更强,因此可以发挥CB2受体治疗神经病理性疼痛的作用,而不产生CB1受体相关的中枢性不良反应,因此受到了广泛的关注[24]。四氢大麻酚(tetrahydrocannabinol,THC)是从大麻中分离的另一种活性物质,与大麻酚相比,它在C6a-C10a和C7-C8间的双键被还原,因此C环失去芳香性;利用重组UGT对大麻酚和THC进行体外催化发现THC只有在被转化成大麻酚后才能被UGT1A9葡萄糖醛酸化,提示C环可能与UGT1A9中的芳香氨基酸通过π-π重叠效应参与酶与底物的识别。除了UGT1A9之外,UGT1A7、UGT1A8、UGT1A10也能催化大麻酚的葡萄糖醛酸化[25]。THC的Ⅰ相代谢产物THC-OH和THC-COOH能分别被UGT1A9、UGT1A10和UGT1A1、UGT1A3催化生成葡萄糖醛酸苷,说明Ⅰ相代谢引入的游离羟基、羧基能影响化合物经由葡萄糖醛酸化途径代谢的能力[25]。辣椒素(capsaicin)是辣椒产生辛辣感的主要成分,具有很好的镇痛和抗炎作用,常用于治疗关节炎、牛皮癣和外周神经炎等,此外辣椒素还能抑制肿瘤细胞增殖、转移及诱导肿瘤细胞凋亡。通过对不同UGT亚型与辣椒素的共孵育发现UGT1A1、UGT1A8、UGT1A9、UGT2B7、UGT2B15和UGT2B17均参与辣椒素的葡萄糖醛酸化,而UGT1A1和UGT2B7是主要的亚型酶[26]。表1总结了部分已进行表征的植物来源的酚类化合物的葡萄糖醛酸化位点和相关UGTs,葡萄糖醛酸化酚类化合物的化学结构见图3。
2.2 香豆素类化合物的葡萄糖醛酸苷
香豆素类化合物主要存在于茄科、伞形科、菊科、豆科等植物中,也是许多中药材如白芷、蛇床子、补骨脂、秦皮、前胡、独活等的重要药效成分。除了具有抗炎、抗病毒、抗氧化等活性外,近年来发现许多香豆素类化合物可通过调控细胞周期、诱导细胞凋亡等机制抑制肿瘤细胞的增殖。大部分香豆素类化合物在C7位上连有酚羟基,其他位点如C6、C8位因为电负性较高,也容易产生含氧取代基或异戊烯基等。葡萄糖醛酸化代谢是香豆素类化合物在体内代谢的主要途径,C7位上的羟基是发生葡萄糖醛酸化的主要位点。UGT1A9是主要催化香豆素类化合物葡萄糖结合反应的酶,此外UGT1A6、UGT1A1、UGT1A10等也能催化部分这类化合物的葡萄糖醛酸化,而UGT2B家族中各种同工酶均未表现出对香豆素类化合物的催化活性。伞形酮(umbelliferone)和4-甲基伞形酮(4-methylumbelliferone)常被用作非特异性底物来考察各种UGT同工酶的活性[56]。
除了简单结构的香豆素类化合物外,UGT1A家族的亚型酶也参与如补骨脂定(psoralidin)和蟛蜞菊内酯(wedelolactone)等较为复杂的香豆素类化合物的代谢。补骨脂定经过肝微粒体代谢产生2个代谢物补骨脂定-9--葡萄糖醛酸苷(psoralidin-9--glucuronide,9--G)和补骨脂定-3--葡萄糖醛酸苷(psoralidin-3--glucuronide,3--G),UGT1A1、UGT1A7、UGT1A8和UGT1A9负责参与这一代谢过程,而3--G的生成只由UGT1A9介导,因此补骨脂定可作为检测UGT1A9活性的特异性底物[57]。蟛蜞菊内酯中有3个酚羟基,但其C5位羟基是主要的葡萄糖醛酸化位点,这一反应主要由UGT1A9和UGT1A1介导[58]。香豆素类化合物的葡萄糖醛酸化位点和相关UGTs见表2,葡萄糖醛酸化香豆素类化合物的化学结构见图4。
表1 酚类化合物的葡萄糖醛酸化位点和相关UGTs
Table 1 Glucuronidation sites of phenols and related UGTs
编号化合物名称UGTs葡萄糖醛酸化位点文献 1木犀草素(luteolin)1A1, 1A6, 1A9C7-OH, C3′-OH20 2白杨素(chrysin)1A6C7-OH27 3芹菜(apigenin)1A3, 1A9, 1A6, 2B7C5-OH, C7-OH, C4′-OH28 4千层纸素A(oroxylin A)1A9, 1A10C7-OH29 5黄芩素(baicalein)1A8, 1A9C7-OH30 6汉黄芩素(wogonin)1A3, 1A9, 1A8C7-OH31 7野黄芩素(scutellarein)1A9, 1A8, 1A10C7-OH32 8香叶木素(diosmetin)1A1, 1A6, 1A8, 1A9, 1A10C7-OH, C3′-OH33 9金圣草黄素(chrysoeriol)1A1, 1A3, 1A6, 1A8, 1A9, 1A10C7-OH, C4′-OH33 10刺槐素(acacetin)1A8, 1A9, 1A10C5-OH, C7-OH34 11异鼠李素(isorhamnetin)1A3, 1A9C3-OH, C5-OH, C7-OH35 12山柰酚(kaempferol)1A3, 1A9C3-OH, C7-OH19 13槲皮素(quercetin)1A3, 1A9C3-OH, C7-OH, C3′-OH, C4′-OH36 14漆黄素(fisetin)1A1, 1A3, 1A7, 1A8, 1A9C4′-OH37 15橙皮素(hesperetin)1A1, 1A3, 1A7, 1A8, 1A9C7-OH, C3′-OH38 16大豆苷元(daidzein)1A1, 1A3, 1A8, 1A9C7-OH, C4′-OH39 17染料木素(genistein)1A8, 1A9, 1A10C7-OH, C4′-OH40 18大豆黄素(glycitein)1A1, 1A8, 1A9C7-OH41 19芒柄花黄素(formononetin)1A1, 1A8, 1A9C7-OH42 20鹰嘴豆芽素A(biochanin A)1A1, 1A8, 1A9C7-OH43 21樱黄素(prunetin)1A1, 1A8, 1A9C5-OH, C4′-OH, C8-C44 22毛蕊异黄酮(calycosin)1A1, 1A9C7-OH, C3′-OH45 23甘草黄酮(glabridin)1A1, 1A3, 1A8, 1A10, 2B7, 2B15C2-OH, C4-OH46 24儿茶[(+)-catechin]1A9C5-OH, C7-OH47 25表没食子儿茶[(−)-epigallocatechin]1A1, 1A8, 1A9C7-OH, C3′-OH48 26表没食子儿茶素没食子酸酯[(−)-epigallocatechin gallate]1A1, 1A3, 1A8, 1A9C7-OH, C3′-OH, C3′′-OH, C4′′-OH48 27水飞蓟宾(silybin)1A3, 1A9C20-OH, C7-OH35 28异新狼毒素A(iso-neochamaejasmin A)1A1, 1A3, 1A9C7-OH, C7′′-OH, C4′-OH, C4′′-OH49 29反式白藜芦醇(trans-resveratrol)1A1, 1A7, 1A9, 1A10C3-OH, C4′-OH50 30白皮杉醇(piceatannol)1A1, 1A8, 1A10C3-OH, C3′-OH, C4′-OH51 31氧化白藜芦醇(oxyresveratrol)1A1, 1A3, 1A6, 1A7, 1A10, 2B7C2′-OH52 32顺式白藜芦醇(cis-resveratrol)1A1, 1A6, 1A9, 1A10C3-OH, C4′-OH50 33combretastatin A41A9C3′-OH53 34姜黄素(curcumin)1A1, 1A8, 1A10C4-OH23 35没食子酸甲酯(methyl gallate)1A1, 1A9C3-OH, C4-OH54 36大麻酚(cannabinol)1A8, 1A10C1-OH25 37辣椒素(capsaicin)1A1, 2B7, 1A3, 1A7, 1A8, 1A9, 2B7, 2B15 C4′-OH26 382,6-二羟蒽醌(anthraflavic acid)1A1, 1A3, 1A9, 1A10, 2B17C2-OH55 39大黄素(emodin)1A1, 1A8, 1A10C3-OH55 40芦荟大黄素(aloe-emodin)1A7, 1A9C1-OH, C8-OH55 41丹蒽醌(danthron)1A1, 1A9, 2B7C1-OH55

图3 葡萄糖醛酸化酚类化合物的化学结构
表2 香豆素类化合物的葡萄糖醛酸化位点和相关UGTs
Table 2 Glucuronidation sites of coumarins and related UGTs
编号化合物名称UGTs葡萄糖醛酸化位点文献 42秦皮素(fraxetin)1A1, 1A3, 1A6, 1A7, 1A9, 1A10C7-OH, C8-OH59 43秦皮乙素(esculetin)1A6, 1A9C7-OH60 44异秦皮啶(isofraxidin)1A1, 1A7, 1A8, 1A9, 1A10C7-OH61 45瑞香素(daphnetin)1A6, 1A9C7-OH, C8-OH59 46东莨菪素(scopoletin)1A9C7-OH62 474-甲基伞形酮(4-methylumbelliferone)1A1, 1A3, 1A6, 1A7, 1A8, 1A9, 1A10, 2B7, 2B15, 2B17C7-OH63 48欧前胡素酚(osthenol)1A3, 1A9C7-OH64 49补骨脂定(psoralidin)1A9, 1A1, 1A7, 1A8C3-OH, C9-OH57 50蟛蜞菊内酯(wedelolactone)1A1, 1A9C5-OH58

图4 葡萄糖醛酸化香豆素类化合物的化学结构
2.3 木脂素类化合物的葡萄糖醛酸苷
木脂素类化合物具有多种重要的生物活性,如抗病毒、抗菌、抗氧化、抗癌、抗焦虑、抗糖尿病并发症等,大部分植物木脂素类化合物在肠道菌群的作用下发生去甲基化、去羟基化、还原和水解等反应,同时也被体内的细胞色素P450和UGT等酶代谢,生成具有不同药理活性的代谢产物[65]。
芝麻素(sesamin)具有清除自由基、保肝、抗癌等药理作用,受到了广泛关注,其在体内的代谢主要经由肝脏中的细胞色素P450转化为单儿茶酚芝麻素,然后由UGT进行葡萄糖醛酸化,单儿茶酚芝麻素及其葡萄糖醛酸化代谢物可通过抑制巨噬细胞介导的解偶联来抑制β干扰素/诱导型一氧化氮合成酶信号,发挥抗炎作用[66]。单儿茶酚芝麻素的葡萄糖醛酸化具有物种差异性,在人微粒体中孵育只有单一产物3--葡萄糖醛酸化单儿茶酚芝麻素生成,而在大鼠微粒体孵育体系中,单儿茶酚芝麻素可以在C3-OH或C4-OH发生葡萄糖醛酸化。重组人UGT孵育实验显示,UGT2B7在单儿茶酚芝麻素葡萄糖醛酸化中发挥重要作用[67]。
厚朴酚(magnolol)是传统中药厚朴的主要活性成分,具有抗氧化、抗微生物、抗肿瘤等多种药理作用[68],也是一种常用的食品添加剂。UGT1A1、UGT1A3、UGT1A7、UGT1A8、UGT1A9和UGT2B7能够催化厚朴酚的葡萄糖醛酸结合代谢,其中UGT2B7在催化过程中起最主要的作用[69]。肉豆蔻木酚素(macelignan)是一种从肉豆蔻中分离出的木脂素类化合物,对神经退行性疾病具有潜在治疗作用。利用商业化重组人UGT孵育肉豆蔻木酚素,发现多数重组UGT均能催化肉豆蔻木酚素的葡萄糖醛酸化,其中UGT1A1和UGT2B7活性最高[70]。狼毒乙素(ebracteolata compound B)是月腺大戟和狼毒大戟中主要的活性物质,具有显著的抗结核杆菌活性,是上市药物结核灵片中的药效物质。通过使用选择性化学抑制和重组人UGT来鉴定催化狼毒乙素葡萄糖醛酸化的UGT,发现UGT1A6和UGT1A9对狼毒乙素具有较好的催化活性,其中UGT1A6的亲和力更强。虽然狼毒乙素结构中存在C2-OH、C4-OH 2个潜在的葡萄糖醛酸化结合位点,但仅分离鉴定出4--葡萄糖醛酸化狼毒乙素,说明UGT对狼毒乙素的催化具有立体选择性[71]。张涵庆等[72]在月腺大戟的根中曾分离得到该葡萄糖醛酸苷,说明在植物中也存在相应的UGT。部分已表征的木脂素类化合物的葡萄糖醛酸化位点和相关UGTs见表3,葡萄糖醛酸化木脂素类化合物的化学结构见图5。
2.4 生物碱类化合物的葡萄糖醛酸苷
大多含有亲核性氮原子的生物碱,包括初级芳香胺、羟胺、酰胺和芳香-杂环化合物等,均可以发生-葡萄糖醛酸化代谢;在服用一些生物碱药物后,可在尿液中检测到大量的-葡萄糖醛酸化代谢产物,表明葡萄糖醛酸化代谢是生物碱在人体中重要的代谢和清除途径[8]。
表3 木脂素类化合物的葡萄糖醛酸化位点和相关UGTs
Table 3 Glucuronidation sites of lignans and related UGTs
编号化合物名称UGTs葡萄糖醛酸化位点文献 51单儿茶酚芝麻素(sesamin monocatechol)2B7C3-OH67 52厚朴酚(magnolol)2B7, 1A1, 1A3, 1A7, 1A8, 1A9C2-OH69 53肉豆蔻木酚素(macelignan)1A1, 1A3, 1A7, 1A8, 1A9, 1A10, 2B4, 2B7, 2B15, 2B17C1-OH70 54狼毒乙素(ebracteolata compound B)1A6, 1A9C4-OH71
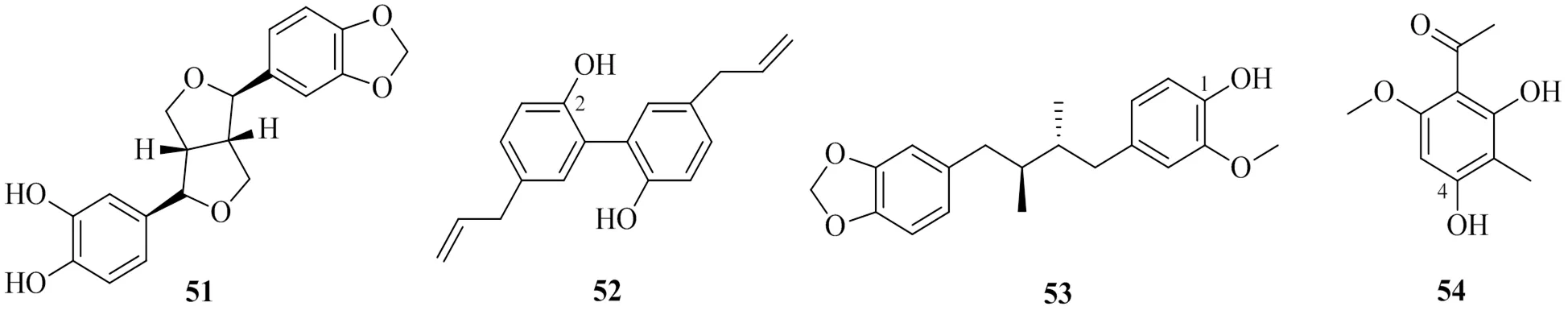
图5 葡萄糖醛酸化木脂素类化合物的化学结构
小檗碱(berberine)是从黄连中分离得到的一种生物碱,作为黄连的重要药效物质,因其良好的抗炎、调脂、抗肿瘤、抗糖尿病等作用而受到广泛关注。小檗红碱(berberrubine)是小檗碱的代谢产物之一,药动学研究显示小檗红碱比小檗碱具有更好的肠道吸收和生物利用度;葡萄糖醛酸化小檗红碱(berberrubine-9--β--glucuronide,BRBG)是小檗红碱的主要代谢产物,口服给药后小檗红碱被迅速代谢为BRBG。虽然小檗红碱和BRBG都具有良好的降血糖效果,但因为BRBG在体内的暴露量远高于小檗红碱,因此BRBG可能在小檗红碱降血糖过程中发挥更为重要的作用[73-74]。药根碱(jatrorrhizine)也是一种小檗碱的体内代谢产物,采用化学抑制剂法及重组人CYP和UGT酶鉴定药根碱代谢酶,发现CYP1A2、UGT1A1、UGT1A3、UGT1A7、UGT1A8、UGT1A9和UGT1A10可参与人肝微粒体中药根碱的代谢[75]。Shi等[76]给大鼠iv药根碱后发现其血浆中的代谢产物多为去甲基化和葡萄糖醛酸化产物,大鼠肝微粒体代谢研究显示UGT1A1和UGT1A3催化药根碱葡萄糖醛酸化生成药根碱-3-葡萄糖醛酸苷(jatrorrhizine-3--glucuronide)。大鼠iv小檗碱后,部分药物被代谢为去甲基小檗碱,随后UGT1A1催化其C2-OH、C3-OH的葡萄糖醛酸化[74,77]。
吗啡(morphine)经葡萄糖醛酸化代谢形成M3G和M6G;M3G是吗啡的主要代谢产物(占吗啡总量的45%~55%),但无镇痛活性。M6G有极佳的镇痛活性,经由鞘内注射的麻醉作用比原型吗啡强600倍,且无吗啡原型药物具有的恶心、呕吐和呼吸抑制等不良反应[78]。研究表明M6G可通过与有机阴离子转运蛋白2和葡萄糖转运蛋白-1相结合从而透过血脑屏障,还可以形成电子中性两性离子二聚体,通过被动扩散透过血脑屏障,在脑组织中发挥作用[79]。尼古丁(nicotine)被认为是烟草中的主要成瘾剂,在体内被代谢成可替宁(cotinine),Kuehl等[80]通过异源表达蛋白体外代谢研究,发现UGT1A3、UGT1A4和UGT1A9均能催化尼古丁的-葡萄糖醛酸化,但可替宁的-葡萄糖醛酸化仅能由UGT1A4催化。生物碱类化合物的葡萄糖醛酸化位点和相关UGTs见表4,葡萄糖醛酸化生物碱类化合物的化学结构见图6。
2.5 萜类化合物的葡萄糖醛酸苷
萜类广泛存在于自然界中,是构成某些植物的香精、树脂、色素等的主要成分,根据化合物分子中异戊二烯单位的数量,可分为半萜、单萜、倍半萜、二萜、二倍半萜、三萜、四萜等。
薄荷醇(menthol)是从薄荷中提取的一种饱和环萜醇,具有抗炎镇痛、清凉止痒、抗真菌、胃肠道保护等多种药理活性[85]。薄荷醇是一种手性脂肪醇,以-或-薄荷醇的形式存在,研究显示UGT酶对2种薄荷醇异构体的葡萄糖醛酸化转化具有立体选择性,UGT2A1和UGT2B7对-薄荷醇的催化活性最高,UGT2B7和UGT2B17对-薄荷醇的催化活性最高。相比于UGT2A1和UGT2B17,UGT2B7催化- 和-薄荷醇均具有最小的米氏常数(m)且数值接近,说明UGT2B7对2种薄荷醇异构体同时表现出最高的催化活性且活性相似,而UGT1A7仅检测到对-薄荷醇具有催化活性[86]。香芹酚(carvacrol)是唇形科植物精油中的主要成分之一,广泛应用于食品、香料、医药等行业,其在肝脏和肠道中的葡萄糖醛酸化主要由UGT1A9和UGT1A7催化[87]。链状倍半萜化合物金合欢醇(又称法尼醇,farnesol)存在于许多芳香植物中具有较好的抗癌活性。微粒体孵育和化学抑制实验显示,金合欢醇在人肝微粒体中被UGT1A1催化形成葡萄糖醛酸化金合欢醇,而在肠微粒体中的葡萄糖醛酸化主要由UGT2B7催化,同时人肝微粒体也可将金合欢醇代谢为羟基金合欢醇,并进一步代谢为其葡萄糖醛酸化衍生物[88]。
表4 生物碱类化合物的葡萄糖醛酸化位点和相关UGTs
Table 4 Glucuronidation sites of alkaloids and related UGTs
编号化合物名称UGTs葡萄糖醛酸化位点文献 55小檗红碱(berberrubine)1A1, 2B1C9-OH74 56药根碱(jatrorrhizine)1A1, 1A3, 1A7, 1A8, 1A9, 1A10C3-OH75 57去亚甲基小檗碱(demethyleneberberine)1A1C2-OH, C3-OH74 58吗啡(morphine)2B7, 1A1C3-OH, C6-OH79 59尼古丁(nicotine)1A3, 1A4, 1A9N80 60可替宁(cotinine)1A4N80 61千里光碱(senecionine)1A4N81 62倒千里光碱(retrorsine)1A4N81 63荷叶碱(nuciferine)1A4N82 64士的宁(strychnine)1A4, 2B10N83 65马钱子碱(brucine)1A4, 2B10N84

图6 葡萄糖醛酸化生物碱类化合物的化学结构
天然甜味剂甜菊糖苷是一类从菊科植物甜叶菊中提取的四环二萜类糖苷,它们以甜菊醇(steviol)为苷元,口服后甜菊糖苷在结肠中被拟杆菌产生的β-葡萄糖苷酶催化水解成甜菊醇[89]。在甜菊醇的体内代谢产物中,仅检测到C19位羧基的葡萄糖醛酸化产物[90],表明UGT只能介导甜菊醇的C19位羧基的葡萄糖醛酸化。双氢青蒿素(dihydroartemisinin,DHA)是青蒿素衍生物青蒿琥酯(artesunate)的活性代谢物,与青蒿素相比水溶性更高,活性更强,同时还具有抗疟、抗炎、抗肿瘤、抗肺纤维化等作用[91]。在人尿液样品和人肝微粒体催化体系中均检测出葡萄糖醛酸化双氢青蒿素(α-DHA-β-glucuronide),UGT1A9和UGT2B7是这一过程中主要的代谢酶[92]。polyandric acid A(PAA)是从澳大利亚药用植物Merr. & L. M. Perry中分离获得的活性成分,在人肝微粒体催化体系中,PAA首先发生酯键水解,生成hydrolysed polyandric acid A(PAAH),再通过UGT2B7和UGT1A1进行葡萄糖醛酸化反应。PAAH具有C2-OH、C17-OH、C18-COOH 3个可进行葡萄糖醛酸化的位点,其与人肝微粒体、重组UGT1A1或UGT2B7孵育可检测出3种单葡萄糖醛酸化代谢物,显示该催化反应缺乏区域选择性[93]。
20()-原人参二醇(protopanaxadiol,PPD)是人参皂苷的代表苷元之一,具有广泛的药理活性。在人肝微粒体和大鼠肝微粒体中孵育的PPD葡萄糖醛酸化代谢产物,均为PPD-3-β--葡萄糖醛酸酯,未发现在C12-OH和C20-OH位点的葡萄糖醛酸化代谢产物,表明UGT酶对PPD有较好的立体选择性。化学抑制和重组人UGT亚型分析表明,在人肝微粒体中,PPD的葡萄糖醛酸化反应主要由UGT1A4催化,UGT1A3虽然也可以催化这一反应,但活性较弱[94]。
熊果酸(ursolic acid)是一种天然的五环三萜类羧酸化合物,是一些传统中药如山楂、女贞、栀子等的主要药理活性成分。将熊果酸与人肝微粒体、肠微粒体分别孵育,均发现同种单葡萄糖醛酸化产物生成。在轻度碱性水解作用下,葡萄糖醛酸化代谢产物的峰几乎没有降低,推测葡萄糖醛酸化在羟基而不是在羧酸部分发生。与不同亚型的UGTs共孵育,鉴定发现UGT1A3和UGT1A4对熊果酸葡萄糖醛酸化反应显示出最显著的催化活性。鹅去氧胆酸(chenodeoxycholic acid,UGT1A3抑制剂)和合欢素(hecogenin,UGT1A4抑制剂)联用时,肝微粒体催化的熊果酸葡萄糖醛酸化产物产量明显降低[59]。萜类化合物的葡萄糖醛酸化位点和相关UGTs见表5,葡萄糖醛酸化萜类化合物的化学结构见图7。
表5 萜类化合物的葡萄糖醛酸化作用位点和相关UGTs
Table 5 Glucuronidation sites of terpenoids and related UGTs
编号化合物名称UGTs葡萄糖醛酸化位点文献 66D-薄荷醇(D-menthol)2A1, 2B7C1-OH86 67L-薄荷醇(L-menthol)2B7, 2B17C1-OH86 68香芹酚(carvacrol)1A7, 1A9C1-OH87 69金合欢醇(farnesol)2B4, 2B7, 1A1, 1A9C1-OH88 70甜菊醇(steviol)2B7C19-COOH90 71双氢青蒿素(dihydroartemisinin)1A9, 2B7C10-OH92 72hydrolysed polyandric acid A 1A1, 2B7C2-OH, C17-OH, C18-COOH93 7320(S)-原人参二醇[20(S)-protopanaxadiol]1A4, 1A3C3-OH94 74熊果酸(ursolic acid)1A3, 1A4C3-OH59
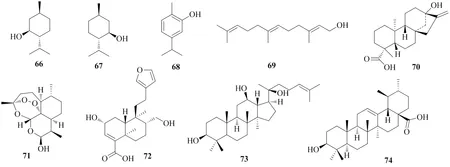
图7 葡萄糖醛酸化萜类化合物的化学结构
3 利用微生物制备植物天然产物的葡萄糖醛酸苷
部分天然产物的葡萄糖醛酸化代谢产物比原型药物具有更好的药理活性、稳定性或水溶性,利用化学合成方法制备葡萄糖醛酸苷因技术、成本等因素限制,难以实现工业化生产。在大肠杆菌、酿酒酵母等宿主中高效、专一表达动物或植物来源的UGT,并利用宿主内源或外源的UDP-葡萄糖6-脱氢酶(UDP-glucose 6-dehydrogenase,UGDH)提供UDPGA,可以构建中药活性成分的葡萄糖醛酸化工程菌。利用葡萄糖为碳源,以目标活性成分为底物,可以规模化制备其葡萄糖醛酸化衍生物,为研究目标化合物的吸收、代谢和药效物质奠定基础。
Pandey等[95]在大肠杆菌BL21(DE3)中过表达UDP-葡萄糖醛酸生物合成基因(、、、),并异源表达来源于葡萄的VvGT5蛋白和阿拉伯婆婆纳的UGT88D8蛋白,分别催化芹菜素和槲皮素的葡萄糖醛酸化,制备芹菜素-7--葡萄糖醛酸(apigenin 7--glucuronide)和槲皮素-3--葡萄糖醛酸(quercetin 3--glucuronide)。Kim等[96]敲除了大肠杆菌BL21(DE3)中代谢UDP-葡萄糖醛酸的基因,以增加UDPGA的供应,使木犀草素-7--葡萄糖醛酸的产量从14 mg/L上升到30 mg/L;进一步过表达大肠杆菌基因后,木犀草素的葡萄糖醛酸苷的产量进一步上升至300 mg/L。Ikushiro等[97]在酿酒酵母和裂殖酵母的基因组中,整合了人源的编码UGT1以及鼠源的编码UGDH的基因,构建其共表达体系;通过静息酵母细胞进行全细胞催化,获得了4-甲基伞形酮、双氯芬酸、萘普生、洛索洛芬等具有酚羟基或羧酸基团化合物的葡萄糖醛酸化产物。人参皂苷Rh1(ginsenoside Rh1)具有较强的药理活性,包括细胞毒性作用、抗炎作用、神经保护作用和抗过敏作用,但其水溶性较低[98-99];糖基的结合可以增加母体化合物的稳定性和水溶性,而通过化学合成方法制备人参皂苷的葡萄糖醛酸化衍生物难以进行[100]。Luo等[101]在大肠杆菌BL21(DE3)中分别异源表达枯草芽孢杆菌来源的编码UGT酶的、和基因,其中表达和的工程菌株可催化人参皂苷Rh1生成3--β--吡喃葡萄糖基-6--β--吡喃葡萄糖基-20()-原托那沙三醇。Yue等[102]在大肠杆菌BL21(DE3)中表达了来源于紫苏的UGT88D7,通过全细胞催化获得了包括白杨素、香叶木素、山柰酚、漆黄素、桑色素、二氢槲皮素、橙皮素、鹰嘴豆芽素A在内的多种植物天然产物的葡萄糖醛酸苷。Marvalin等[103]利用链霉菌sp. M52104转化柚皮素、槲皮素、反式白藜芦醇等酚类植物天然产物,获得了他们的葡萄糖醛酸苷产物。利用微生物转化制备的植物天然产物的葡萄糖醛酸苷的相关信息见表6,化合物75~78的化学结构见图8。
表6 利用微生物转化制备的植物天然产物的葡萄糖醛酸苷
Table 6 Biosynthesis of glucuronidated plant natural products using microbial biotransformation
编号化合物名称表达宿主UGT葡萄糖醛酸化位点文献 1木犀草素(luteolin)大肠杆菌BL21(DE3)UGT1A1, UGT1A7, UGT1A9C3-OH, C7-OH 20 2白杨素(chrysin)大肠杆菌BL21(DE3)UGT88D7(紫苏)C7-OH102 3芹菜素(apigenin)大肠杆菌BL21(DE3)UGT88D8(葡萄)C7-OH 99 8香叶木素(diosmetin)大肠杆菌BL21(DE3)UGT88D7C7-OH102 12山柰酚(kaempferol)大肠杆菌BL21(DE3)UGT88D7C7-OH102 13槲皮素(quercetin)大肠杆菌BL21(DE3)VvGT5(阿拉伯婆婆纳)C3-OH 99 13槲皮素(quercetin)链霉菌Streptomyces sp. M52104未表征C3-OH, C7-OH, C3′-OH, C4′-OH103 14漆黄素(fisetin)大肠杆菌BL21(DE3)UGT88D7C7-OH102 15橙皮素(hesperetin)大肠杆菌BL21(DE3)UGT88D7C7-OH102 20鹰嘴豆芽素A(biochanin A)大肠杆菌BL21(DE3)UGT88D7C7-OH102 29反式白藜芦醇(trans-resveratrol)链霉菌未表征C3-OH, C4′-OH103 474-甲基伞形酮(4-methylumbelliferone)酿酒酵母AH22UGT1A1, UGT1A6C7-OH 97 75人参皂苷Rh1(ginsenoside Rh1)大肠杆菌BL21(DE3)yojK1, yjiC1(枯草芽孢杆菌)C3-OH101 76桑色素(morin)大肠杆菌BL21(DE3)UGT88D7C7-OH102 77二氢槲皮素(dihydroquercetin)大肠杆菌BL21(DE3)UGT88D7C7-OH102 78(2S)-柚皮[(2S)-naringenin]链霉菌未表征C7-OH, C4′-OH103

图8 化合物75~78的化学结构
4 结语与展望
葡萄糖醛酸化代谢在药物的体内代谢过程中发挥着不可或缺的作用,通过UGT的作用,细胞内源的葡萄糖醛酸被转移到药物分子上,显著提高药物分子的水溶性和极性,一方面加速药物经由胆汁和尿液排出体外,降低了药物分子的生物利用度,另一方面也降低了药物对其靶标的亲和性和药理活性。此外,葡萄糖醛酸化反应在药物-药物相互作用中也发挥重要作用。研究葡萄糖醛酸化反应对药物相互作用影响,不仅可以了解药物的药效和代谢特性,也对分析预测多种药物相互作用导致的药效改变、不良反应等有重要意义。中药具有成分复杂、作用靶点多等特点,深入研究葡萄糖醛酸化反应对中药药效物质的转化、代谢、清除及药理活性的影响,特别是由于UGTs的基因多态性、表达水平差异、联合用药等因素对中药活性成分发挥药效的影响[102],对于中药的个性化、精准化用药有非常重要的意义。
虽然大部分药物在葡萄糖醛酸化代谢后活性降低,但部分药物的葡萄糖醛酸化代谢物,如M6G、表儿茶素-3--葡萄糖醛酸、橙皮素-7--葡萄糖醛酸、槲皮素-3--葡萄糖醛酸等具有比原型化合物更优的药理活性[1]。开发有效制备植物天然产物的葡萄糖醛酸化代谢物的方法,规模化制备葡萄糖醛酸化代谢产物,是比较研究原型药物和葡萄糖醛酸化代谢物的代谢性质和药理活性、监测不同药物的葡萄糖醛酸化代谢物之间的相互作用、开发基于植物天然产物的新药的基础。由于UGTs主要存在于真核细胞的内质网膜上,在体外表达,蛋白质正确折叠存在较大困难,大部分UGTs只能通过哺乳动物细胞、昆虫细胞等进行表达,成本高、难以放大,不适合进行葡萄糖醛酸化产物的规模化制备。利用合成生物学技术,在大肠杆菌、酿酒酵母等底盘细胞中表达动物源或植物源的UGTs,可以利用葡萄糖等廉价碳源,对植物天然产物进行葡萄糖醛酸化转化,为植物天然产物的药效学研究和新药开发奠定物质基础。
利益冲突 所有作者均声明不存在利益冲突
[1] 王梅玲, 夏杨柳, 杨梦丽, 等.-葡萄糖醛酸苷的生物合成研究进展 [J]. 中草药, 2015, 46(7): 1065-1073.
[2] Evans W E, Relling M V. Pharmacogenomics: Translating functional genomics into rational therapeutics [J]., 1999, 286(5439): 487-491.
[3] Miners J O, Rowland A, Novak J J,. Evidence-based strategies for the characterisation of human drug and chemical glucuronidationand UDP-glucuronosyltransferase reaction phenotyping [J]., 2021, 218: 107689.
[4] 陈虹, 钟丹妮, 高宗燕, 等. 胆红素尿苷二磷酸葡萄糖醛酸转移酶1A1基因突变与新生儿黄疸易感性的关系 [J]. 山东医药, 2017, 57(1): 22-25.
[5] Oda S, Fukami T, Yokoi T,. A comprehensive review of UDP-glucuronosyltransferase and esterases for drug development [J]., 2015, 30(1): 30-51.
[6] Meech R, Hu D G, McKinnon R A,. The UDP-glycosyltransferase (UGT) superfamily: New members, new functions, and novel paradigms [J]., 2019, 99(2): 1153-1222.
[7] Yang N, Sun R, Liao X,. UDP-glucuronosyltransferases (UGTs) and their related metabolic cross-talk with internal homeostasis: A systematic review of UGT isoforms for precision medicine [J]., 2017, 121: 169-183.
[8] Stachulski A V, Meng X L. Glucuronides from metabolites to medicines: A survey of thegeneration, chemical synthesis and properties of glucuronides [J]., 2013, 30(6): 806-848.
[9] Hu D G, Hulin J U A, Nair P C,. The UGTome: The expanding diversity of UDP glycosyltransferases and its impact on small molecule metabolism [J]., 2019, 204: 107414.
[10] Kilpatrick G J, Smith T W. Morphine-6-glucuronide: Actions and mechanisms [J]., 2005, 25(5): 521-544.
[11] Sakamoto S, Kusuhara H, Horie K,. Identification of the transporters involved in the hepatobiliary transport and intestinal efflux of methyl 1-(3,4-dimethoxyphenyl)-3-(3-ethylvaleryl)-4-hydroxy-6,7,8-trimethoxy-2-naphthoate (S-8921) glucuronide, a pharmacologically active metabolite of S-8921 [J]., 2008, 36(8): 1553-1561.
[12] Hu D G, Mackenzie P I, McKinnon R A,. Genetic polymorphisms of human UDP-glucuronosyltransferase (UGT) genes and cancer risk [J]., 2016, 48(1): 47-69.
[13] 伍明江, 吴晓磊, 张德芹, 等. UPLC-Q-TOF/MS鉴定大鼠口服桑叶黄酮后的体内物质 [J]. 中草药, 2017, 48(14): 2832-2838.
[14] Zhao Y, Liu C P, Lai X P,. Immunomodulatory activities of phlorizin metabolites in lipopolysaccharide-stimulated RAW264.7 cells [J]., 2017, 91: 49-53.
[15] 朱向明, 俞飙, 惠永正. 葡萄糖醛酸苷的合成研究进展 [J]. 有机化学, 2000, 20(2): 146-154.
[16] Singh Y, Demchenko A V. Koenigs-knorr glycosylation reaction catalyzed by trimethylsilyl trifluoromethanesulfonate [J]., 2019, 25(6): 1461-1465.
[17] Burchell B, Coughtrie M W. UDP-glucuronosyltransferases [J]., 1989, 43(2): 261-289.
[18] Radominska-Pandya A, Bratton S, Little J M. A historical overview of the heterologous expression of mammalian UDP-glucuronosyltransferase isoforms over the past twenty years [J]., 2005, 6(2): 141-160.
[19] Zheng L, Zhu L, Zhao M,.exposure of kaempferol is driven by phase II metabolic enzymes and efflux transporters [J]., 2016, 18(5): 1289-1299.
[20] Wu L, Liu J, Han W,. Time-dependent metabolism of luteolin by human UDP-glucuronosyltransferases and its intestinal first-pass glucuronidation in mice [J]., 2015, 63(39): 8722-8733.
[21] Cottart C H, Nivet-Antoine V, Laguillier-Morizot C,. Resveratrol bioavailability and toxicity in humans [J]., 2010, 54(1): 7-16.
[22] 李玉倩, 李学军. 姜黄素抗肿瘤作用基础与临床研究进展 [J]. 中国药理学与毒理学杂志, 2020, 34(5): 321-335.
[23] Hoehle S I, Pfeiffer E, Metzler M. Glucuronidation of curcuminoids by human microsomal and recombinant UDP-glucuronosyltransferases [J]., 2007, 51(8): 932-938.
[24] Salo O M, Raitio K H, Savinainen J R,. Virtual screening of novel CB2 ligands using a comparative model of the human cannabinoid CB2 receptor [J]., 2005, 48(23): 7166-7171.
[25] Mazur A, Lichti C F, Prather P L,. Characterization of human hepatic and extrahepatic UDP-glucuronosyltransferase enzymes involved in the metabolism of classic cannabinoids [J]., 2009, 37(7): 1496-1504.
[26] Sun H, Wang H, Liu H,. Glucuronidation of capsaicin by liver microsomes and expressed UGT enzymes: Reaction kinetics, contribution of individual enzymes and marked species differences [J]., 2014, 10(10): 1325-1336.
[27] Walsky R L, Bauman J N, Bourcier K,. Optimized assays for human UDP-glucuronosyltransferase (UGT) activities: Altered alamethicin concentration and utility to screen for UGT inhibitors [J]., 2012, 40(5): 1051-1065.
[28] Li Q, Wang L, Dai P,. A combined strategy of mass fragmentation, post-column cobalt complexation and shift in ultraviolet absorption spectra to determine the uridine 5′-diphospho-glucuronosyltransferase metabolism profiling of flavones after oral administration of a flavone mixture in rats [J]., 2015, 1395: 116-128.
[29] Zhou Q, Zheng Z, Xia B,. Use of isoform-specific UGT metabolism to determine and describe rates and profiles of glucuronidation of wogonin and oroxylin A by human liver and intestinal microsomes [J]., 2010, 27(8): 1568-1583.
[30] Zhang L, Lin G, Zuo Z. Involvement of UDP-glucuronosyltransferases in the extensive liver and intestinal first-pass metabolism of flavonoid baicalein [J]., 2007, 24(1): 81-89.
[31] Hanioka N, Isobe T, Tanaka-Kagawa T,. Wogonin glucuronidation in liver and intestinal microsomes of humans, monkeys, dogs, rats, and mice [J]., 2020, 50(8): 906-912.
[32] Wang Y Z, Ao H, Qian Z M,. Intestinal transport of scutellarein and scutellarin and first-pass metabolism by UDP-glucuronosyltransferase-mediated glucuronidation of scutellarein and hydrolysis of scutellarin [J]., 2011, 41(7): 538-548.
[33] Zeng X, Shi J, Zhao M,. Regioselective glucuronidation of diosmetin and chrysoeriol by the interplay of glucuronidation and transport in UGT1A9-overexpressing HeLa cells [J]., 2016, 11(11): e0166239.
[34] Dai P, Luo F, Wang Y,. Species-and gender-dependent differences in the glucuronidation of a flavonoid glucoside and its aglycone determined using expressed UGT enzymes and microsomes [J]., 2015, 36(9): 622-635.
[35] Chen Y, Xie S, Chen S,. Glucuronidation of flavonoids by recombinant UGT1A3 and UGT1A9 [J]., 2008, 76(3): 416-425.
[36] Chen Y K, Chen S Q, Li X,. Quantitative regioselectivity of glucuronidation of quercetin by recombinant UDP-glucuronosyltransferases 1A9 and 1A3 using enzymatic kinetic parameters [J]., 2005, 35(10/11): 943-954.
[37] Wong Y C, Zhang L, Lin G,. Structure-activity relationships of the glucuronidation of flavonoids by human glucuronosyltransferases [J]., 2009, 5(11): 1399-1419.
[38] Brand W, Boersma M G, Bik H,. Phase II metabolism of hesperetin by individual UDP-glucuronosyltransferases and sulfotransferases and rat and human tissue samples [J]., 2010, 38(4): 617-625.
[39] Hanioka N, Ohkawara S, Isobe T,. Regioselective glucuronidation of daidzein in liver and intestinal microsomes of humans, monkeys, rats, and mice [J]., 2018, 92(9): 2809-2817.
[40] Pritchett L E, Atherton K M, Mutch E,. Glucuronidation of the soyabean isoflavones genistein and daidzein by human liver is related to levels of UGT1A1 and UGT1A9 activity and alters isoflavone response in the MCF-7 human breast cancer cell line [J]., 2008, 19(11): 739-745.
[41] Tang L, Singh R, Liu Z,. Structure and concentration changes affect characterization of UGT isoform-specific metabolism of isoflavones [J]., 2009, 6(5): 1466-1482.
[42] Shi J, Zheng L, Lin Z F,. Study of pharmacokinetic profiles and characteristics of active components and their metabolites in rat plasma following oral administration of the water extract ofusing UPLC-MS/MS [J]., 2015, 169: 183-194.
[43] Kosaka K, Sakai N, Endo Y,. Impact of intestinal glucuronidation on the pharmacokinetics of raloxifene [J]., 2011, 39(9): 1495-1502.
[44] Joseph T B, Wang S W, Liu X,. Disposition of flavonoids via enteric recycling: Enzyme stability affects characterization of prunetin glucuronidation across species, organs, and UGT isoforms [J]., 2007, 4(6): 883-894.
[45] Ruan J Q, Yan R. Regioselective glucuronidation of the isoflavone calycosin by human liver microsomes and recombinant human UDP-glucuronosyltransferases [J]., 2014, 220: 231-240.
[46] Guo B, Fang Z, Yang L,. Tissue and species differences in the glucuronidation of glabridin with UDP-glucuronosyltransferases [J]., 2015, 231: 90-97.
[47] Blount J W, Redan B W, Ferruzzi M G,. Synthesis and quantitative analysis of plasma-targeted metabolites of catechin and epicatechin [J]., 2015, 63(8): 2233-2240.
[48] Lu H, Meng X, Li C,. Glucuronides of tea catechins: Enzymology of biosynthesis and biological activities [J]., 2003, 31(4): 452-461.
[49] Yu L S, Pu J B, Zuo M J,. Hepatic glucuronidation of isoneochamaejasmin A from the traditional Chinese medicineL. root [J]., 2014, 42(4): 735-743.
[50] Aumont V, Krisa S, Battaglia E,. Regioselective and stereospecific glucuronidation of-and-resveratrol in human [J]., 2001, 393(2): 281-289.
[51] Miksits M, Maier-Salamon A, Vo T P,. Glucuronidation of piceatannol by human liver microsomes: Major role of UGT1A1, UGT1A8 and UGT1A10 [J]., 2010, 62(1): 47-54.
[52] Hu N, Mei M, Ruan J,. Regioselective glucuronidation of oxyresveratrol, a natural hydroxystilbene, by human liver and intestinal microsomes and recombinant UGTs [J]., 2014, 29(3): 229-236.
[53] Aprile S, del Grosso E, Grosa G. Identification of the human UDP-glucuronosyltransferases involved in the glucuronidation of combretastatin A-4 [J]., 2010, 38(7): 1141-1146.
[54] Jiamboonsri P, Pithayanukul P, Bavovada R,.glucuronidation of methyl gallate and pentagalloyl glucopyranose by liver microsomes [J]., 2016, 31(4): 292-303.
[55] Wu W, Hu N, Zhang Q,.glucuronidation of five rhubarb anthraquinones by intestinal and liver microsomes from humans and rats [J]., 2014, 219: 18-27.
[56] Lu H, Fang Z Z, Cao Y F,. Isoliquiritigenin showed strong inhibitory effects towards multiple UDP-glucuronosyltransferase (UGT) isoform-catalyzed 4-methylumbelliferone (4-MU) glucuronidation [J]., 2013, 84: 208-212.
[57] Sun H, Ma Z, Lu D,. Regio-and isoform-specific glucuronidation of psoralidin: Evaluation of 3--glucuronidation as a functional marker for UGT1A9 [J]., 2015, 104(7): 2369-2377.
[58] Li L, Huang X J, Peng J L,. Wedelolactone metabolism in rats through regioselective glucuronidation catalyzed by uridine diphosphate-glucuronosyltransferases 1As (UGT1As) [J]., 2016, 23(4): 340-349.
[59] Liang S C, Ge G B, Liu H X,. Identification and characterization of human UDP-glucuronosyltransferases responsible for theglucuronidation of daphnetin [J]., 2010, 38(6): 973-980.
[60] Zhu L, Lu L, Zeng S,. UDP-glucuronosyltransferases 1A6 and 1A9 are the major isozymes responsible for the 7--glucuronidation of esculetin and 4-methylesculetin in human liver microsomes [J]., 2015, 43(7): 977-983.
[61] Meng F, Li Y, He G,. Identification of human UDP-glucuronosyltransferase isoforms involved in the isofraxidin glucuronidation and assessment of the species differences of the reaction [J]., 2017, 117: 118-125.
[62] Fujiwara R, Yokoi T, Nakajima M. Structure and protein-protein interactions of human UDP-glucuronosyltransferases [J]., 2016, 7: 388.
[63] Uchaipichat V, MacKenzie P I, Guo X H,. Human udp-glucuronosyltransferases: Isoform selectivity and kinetics of 4-methylumbelliferone and 1-naphthol glucuronidation, effects of organic solvents, and inhibition by diclofenac and probenecid [J]., 2004, 32(4): 413-423.
[64] Cho P, Paudel S, Lee D,. Characterization of CYPs and UGTs involved in human liver microsomal metabolism of osthenol [J]., 2018, 10(3): 141.
[65] 陶凯奇, 王红, 周宗宝, 等. 木脂素类化合物的结构及生物活性研究进展 [J]. 中南药学, 2017, 15(1): 70-74.
[66] Abe-Kanoh N, Kunimoto Y, Takemoto D,. Sesamin catechol glucuronides exert anti-inflammatory effects by suppressing interferon β and inducible nitric oxide synthase expression through deconjugation in macrophage- like J774.1 cells [J]., 2019, 67(27): 7640-7649.
[67] Yasuda K, Ikushiro S, Kamakura M,. Sequential metabolism of sesamin by cytochrome P450 and UDP-glucuronosyltransferase in human liver [J].2011, 39(9): 1538-1545.
[68] 张勇, 唐方. 厚朴酚药理作用的最新研究进展 [J]. 中国中药杂志, 2012, 37(23): 3526-3530.
[69] Zhu L L, Ge G B, Zhang H B,. Characterization of hepatic and intestinal glucuronidation of magnolol: Application of the relative activity factor approach to decipher the contributions of multiple UDP-glucuronosyltransferase isoforms [J]., 2012, 40(3): 529-538.
[70] Liu H, Wu Z, Ma Z,. Glucuronidation of macelignan by human liver microsomes and expressed UGT enzymes: Identification of UGT1A1 and 2B7 as the main contributing enzymes [J]., 2014, 35(9): 513-524.
[71] Zhang X, Yao Y, Lou Y,. Metabolism of ebracteolata compound B studiedwith human liver microsomes, HepG2 cells, and recombinant human enzymes [J]., 2010, 38(12): 2157-2165.
[72] 张涵庆, 丁云梅. 月腺大戟根中有效成分乙素和丙素的结构研究 [J]. 植物资源与环境, 1992, 1(3): 6-9.
[73] Yang N, Sun R B, Chen X L,.assessment of the glucose-lowering effects of berberrubine-9--β--glucuronide, an active metabolite of berberrubine [J]., 2017, 38(3): 351-361.
[74] Liu Y, Hao H, Xie H,. Oxidative demethylenation and subsequent glucuronidation are the major metabolic pathways of berberine in rats [J]., 2009, 98(11): 4391-4401.
[75] Zhou H, Shi R, Ma B,. CYP450 1A2 and multiple UGT1A isoforms are responsible for jatrorrhizine metabolism in human liver microsomes [J]., 2013, 34(3): 176-185.
[76] Shi R, Zhou H, Ma B L,. Pharmacokinetics and metabolism of jatrorrhizine, a gastric prokinetic drug candidate [J]., 2012, 33(3): 135-145.
[77] Wang K, Feng X, Chai L,. The metabolism of berberine and its contribution to the pharmacological effects [J]., 2017, 49(2): 139-157.
[78] Klimas R, Mikus G. Morphine-6-glucuronide is responsible for the analgesic effect after morphine administration: A quantitative review of morphine, morphine-6-glucuronide, and morphine-3-glucuronide [J]., 2014, 113(6): 935-944.
[79] De Gregori S, De Gregori M, Ranzani G N,. Morphine metabolism, transport and brain disposition [J]., 2012, 27(1): 1-5.
[80] Kuehl G E, Murphy S E.-glucuronidation of nicotine and cotinine by human liver microsomes and heterologously expressed UDP-glucuronosyltransferases [J]., 2003, 31(11): 1361-1368.
[81] He Y Q, Liu Y, Zhang B F,. Identification of the UDP-glucuronosyltransferase isozyme involved in senecionine glucuronidation in human liver microsomes [J]., 2010, 38(4): 626-634.
[82] Lu Y L, He Y Q, Wang M,. Characterization of nuciferine metabolism by P450 enzymes and uridine diphosphate glucuronosyltransferases in liver microsomes from humans and animals [J]., 2010, 31(12): 1635-1642.
[83] Tian J X, Peng C, Xu L,.metabolism study of strychnos alkaloids using high-performance liquid chromatography combined with hybrid ion trap/time-of-flight mass spectrometry [J]., 2013, 27(6): 775-783.
[84] Chen X G, Lai Y Q, Cai Z W. Simultaneous analysis of strychnine and brucine and their major metabolites by liquid chromatography-electrospray ion trap mass spectrometry [J]., 2012, 36(3): 171-176.
[85] 陈晨, 刘兆国, 汪思亮, 等. 薄荷醇及其受体TRPM8与肿瘤关系研究进展 [J]. 中国药理学通报, 2015, 31(3): 312-314.
[86] Kozlovich S, Chen G, Watson C J W,. Role of l- and d-menthol in the glucuronidation and detoxification of the major lung carcinogen, NNAL [J]., 2019, 47(12): 1388-1396.
[87] Dong R H, Fang Z Z, Zhu L L,. Identification of UDP-glucuronosyltransferase isoforms involved in hepatic and intestinal glucuronidation of phytochemical carvacrol [J]., 2012, 42(10): 1009-1016.
[88] Staines A G, Sindelar P, Coughtrie M W H,. Farnesol is glucuronidated in human liver, kidney and intestine, and is a novel substrate for UGT2B7 and UGT1A1 [J]., 2004, 384(3): 637-645.
[89] 陈俊名. 甜菊糖苷的体外代谢及生物活性研究 [D]. 无锡: 江南大学, 2019.
[90] Geuns J M, Buyse J, Vankeirsbilck A,. Identification of steviol glucuronide in human urine [J]., 2006, 54(7): 2794-2798.
[91] 王岚, 李纯, 董雨瑞, 等. 双氢青蒿素抗肝癌作用机制研究进展 [J]. 现代中西医结合杂志, 2020, 29(15): 1703-1706.
[92] Ilett K F, Ethell B T, Maggs J L,. Glucuronidation of dihydroartemisininand by human liver microsomes and expressed UDP-glucuronosyltransferases [J]., 2002, 30(9): 1005-1012.
[93] Bendikov M Y, Miners J O, Simpson B S,.metabolism of the anti-inflammatory clerodane diterpenoid polyandric acid A and its hydrolysis product by human liver microsomes and recombinant cytochrome P450 and UDP-glucuronosyltransferase enzymes [J]., 2017, 47(6): 461-469.
[94] Li J, He C, Fang L,. Identification of human UDP-glucuronosyltransferase 1A4 as the major isozyme responsible for the glucuronidation of 20()-protopanaxadiol in human liver microsomes [J]., 2016, 17(3): 205.
[95] Pandey R P, Jung H Y, Parajuli P,. A synthetic approach for biosynthesis of miquelianin and scutellarin A in[J]., 2019, 9(2): 215.
[96] Kim S Y, Lee H R, Park K S,. Metabolic engineering offor the biosynthesis of flavonoid--glucuronides and flavonoid--galactoside [J]., 2015, 99(5): 2233-2242.
[97] Ikushiro S, Nishikawa M, Masuyama Y,. Biosynthesis of drug glucuronide metabolites in the budding yeast saccharomyces cerevisiae [J]., 2016, 13(7): 2274-2282.
[98] Lee Y, Jin Y, Lim W,. A ginsenoside-Rh1, a component of ginseng saponin, activates estrogen receptor in human breast carcinoma MCF-7 cells [J]., 2003, 84(4): 463-468.
[99] Jung J S, Shin J A, Park E M,. Anti-inflammatory mechanism of ginsenoside Rh1in lipopolysaccharide-stimulated microglia: Critical role of the protein kinase A pathway and hemeoxygenase-1 expression [J]., 2010, 115(6): 1668-1680.
[100] Lairson L L, Henrissat B, Davies G J,. Glycosyltransferases: Structures, functions, and mechanisms [J]., 2008, 77: 521-555.
[101] Luo S L, Dang L Z, Zhang K Q,. Cloning and heterologous expression of UDP-glycosyltransferase genes fromand its application in the glycosylation of ginsenoside Rh1[J]., 2015, 60(1): 72-78.
[102] Yue T, Chen R, Chen D,. Enzymatic synthesis of bioactive-glucuronides using plant glucuronosyltransferases [J]., 2019, 67(22): 6275-6284.
[103] Marvalin C, Azerad R. Microbial glucuronidation of polyphenols [J]., 2011, 73(1/2/3/4): 43-52.
Research progress on biosynthesis of glucuronides of plant natural products
CHEN Bing-song1, 2, ZHOU Ying3, WANG Zhao-xin2, YANG Yu-fan2, QIU Feng1, YAN Xiao-hui2
1. School of Traditional Chinese Medicine, Tianjin University of Traditional Chinese Medicine, Tianjin 301617, China 2. State Key Laboratory of Component-based Traditional Chinese Medicine, Tianjin University of Traditional Chinese Medicine, Tianjin 301617, China 3. College of International Education, Tianjin University of Traditional Chinese Medicine, Tianjin 301617, China
Glucuronidation is an important phase Ⅱ metabolism catalyzed by UDP-glucuronosyltransferases (UGT), which is involved in the clearance of many endogenous and exogenous substances. Glucuronidation influences the tissue distribution of endogenous and exogenous compounds, and has a great impact on the efficacy, toxicity, and side effects of drugs. UGTs are widely distributed in various tissues of the body, featured by various tissue-abundance and substrate-specificity among different isoforms. Preparation of glucuronides for plant natural products provides foundation to evaluate their pharmacological activities, pharmacokinetic properties, and drug interactions. Research progress on biosynthesis of glucuronides of plant natural products such as polyphenols, coumarins, lignans, alkaloids, and terpenoids were summarized in this paper, in order to provide reference for their preparation and pharmacological studies.
plant natural products; glucuronides; UDP-glucuronosyltransferase; biosynthesis; polyphenols; coumarins; lignans; alkaloids; terpenoids
R282.1
A
0253 - 2670(2022)06 - 1875 - 16
10.7501/j.issn.0253-2670.2022.06.032
2021-05-25
国家重点研发计划“合成生物学”重点专项(2020YFA0907900);天津中医药大学研究生科研创新项目(YJSKC-20191021)
陈秉松(1995—),男,硕士研究生,研究方向为合成生物学。E-mail: bingsongchen@163.com
颜晓晖(1979—),男,研究员,博士生导师,研究方向为天然产物的合成生物学。E-mail: yanxh@tjutcm.edu.cn
邱 峰(1967—),男,教授,博士生导师,研究方向为中药及天然药物药效物质。E-mail: fengqiu20070118@163.com
[责任编辑 崔艳丽]
