膳食胆酸对大鼠糖脂代谢及肠道菌群的影响
2022-03-20吴佩娴范艳飞彭卫群洪小瑜
陈 说,张 帆,吴佩娴,范艳飞,彭卫群,洪小瑜
(北京大学深圳医院内分泌科,广东 深圳 518036)
近年来,肠道菌群被视为一种内分泌器官,其结构和功能的改变在肥胖发生中占据重要作用[1],逐渐成为研究热点。胆汁酸由肝脏合成经胆总管分泌入肠道可以促进脂类消化吸收;作为信号分子,调节机体的糖脂代谢;参与维持肠道正常功能[2]。胆汁酸膳食是否引起体内胆汁酸水平的变化及其对机体代谢及肠道菌群的影响尚未明确。本研究通过建立高脂大鼠模型和普通饲料添加胆汁酸喂养的大鼠模型,检测血液中胆汁酸、白细胞介素(IL)-18、瘦素以及粪便中拟杆菌门和厚壁菌门的比例,通过与正常对照组比较,初步探讨胆汁酸膳食可能通过激活炎性反应和改变肠道诱导大鼠的代谢指标及肠道菌群结构的影响,进而为脂肪肝及肥胖的防治提供新的方向。
1 材料与方法
1.1动物与试剂:8周龄的SD雄性大鼠(斯莱克公司),高脂饲料(斯莱克公司),去氧胆酸(Sigma-aldrich公司),生化指标检测试剂盒(中生北控生物公司),大鼠瘦素酶联免疫吸附试验(ELISA)试剂盒、大鼠IL-18 ELISA试剂盒、粪便基因组提取试剂盒(DP328-02) (天根生化科技有限公司),SYBRGreen Realtime PCR Master Mix(QPK-201) (TOYOBO公司)Premix Taq Version 2.0(TAKARA公司),10*TBE(Promega公司)。本次研究经过本院医学伦理委员会同意。
1.2方法
1.2.1动物模型的建立:健康8周龄的SD雄性大鼠30只,动物等级SPF,体重160~180 g。先统一喂养正常饲料7 d,第7天进行体重的称量并采集每只动物的粪便样品,为零时刻样品。此后随机将实验动物分成三组,第一组对照组10只大鼠喂食正常饲料;第二组高脂饮食组10只大鼠喂食高脂饲料;第三组胆酸组10只大鼠喂养正常饲料+胆酸(100 mg/kg);以上三组均1次/d,共8周。
1.2.2样本收集:实验期间大鼠自由摄食和饮水,共喂养56 d,每10天收集上述三组共30只大鼠新鲜粪便样本(采用逼迫法收集)用于检测肠道菌群结构的变化,一共收集5次;从分组时的零时刻开始每周对三组大鼠进行体重的称量,每天观察大鼠的皮毛色泽、饮食变化、活动状态及粪便形态,以评价大鼠的表象特征。实验分组期末,各组禁食12 h,用戊巴比妥将大鼠麻醉,注射器采血后立即离心分离血清、血浆。测定血清空腹血糖(FBG)、丙氨酶氨基转移酶(ALT)、三酰甘油(TG)、总胆固醇(TC)、游离脂肪酸(FFA)、总胆汁酸(TBA)。放免法测定空腹胰岛素(FINS)。计算胰岛素抵抗指数(HOMA-IR):FBS×FINS/22.5。
1.2.3ELISA样本准备,收集血清100 μl/孔;按试剂盒说明书稀释标准品;每孔加100 μl标准品或样本,37℃孵育1 h每孔加100 μl检测试剂A,37℃孵育1 h缓冲液洗涤3次;每孔加100 μl检测试剂A,37℃孵育30 min;缓冲液洗涤3次;每孔加入90 μl基质溶液,室温孵育30 min,50 μl终止溶液终止;450 nm读取OD值。
1.2.4肠道菌群RT-PCR:粪便基因组提取试剂盒提取各样品基因组DNA,并检测DNA浓度,调整各样品DNA浓度至10 ng/μl;利用实时定量PCR技术检测各样品中厚壁菌群,拟杆菌群基因的相对含量。计算如下:对应样品中目标基因Xn的相对含量=2-ΔΔCT,ΔΔCT=ΔCTxn-ΔCTA1;其中ΔCTxn为对照组目的基因减去内参基因β-actin的循环数,ΔCTA1为干预组目的基因减去内参基因β-actin的循环数;通过以上计算方法计算各样品厚壁菌群、拟杆菌群基因相对含量。
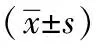
2 结果
2.1高脂饲料和胆汁酸喂养对大鼠血清生化指标的影响:与对照组相比,高脂饮食组及胆酸组血清中FBG、TC、TG、TBA、ALT和FFA均明显升高,差异有统计学意义(P<0.01);胆酸组的升高不如高脂饮食组,差异有统计学意义(P<0.01)。见表1。表明高脂饮食组和胆酸组均可诱导大鼠出现糖、脂代谢紊乱、肝功能异常,但胆酸组的影响小于高脂饮食组。
2.2高脂饲料和胆汁酸喂养对大鼠体重及血清IL-18和瘦素的影响:三组大鼠在干预前体重无明显差异,喂养期间体重均稳定增加,干预结束时高脂饮食组及胆酸组大鼠的体重增量较正常组高但无显著差异,而血清HOMA-IR、 IL-18和瘦素明显升高,差异有统计学意义(P<0.01);其中高脂饮食组血清中IL-18和瘦素较胆酸组升高更明显,差异有统计学意义(P<0.01),相关分析显示,HOMA-IR与血清FFA、IL-18、瘦素水平呈正相关,差异有统计学意义(r分别为0.85,0.72,0.87,均P<0.01),血清瘦素及IL-18之间呈正相关,差异有统计学意义(r=0.89,P<0.01)。见表2。提示胆酸干预与高脂喂养均可以诱导大鼠产生胰岛素抵抗及炎性反应并导致体重增加,而胆酸组的影响小于高脂饮食组。

表1 各组大鼠血清中生化指标

表2 各组大鼠体重增量及血清中IL-18和瘦素水平
2.3高脂饲料和胆汁酸喂养对大鼠肠道菌群基因表达的影响:与对照组相比,高脂饮食组和胆酸组大鼠粪便中的厚壁菌群基因表达均增加,差异有统计学意义(P<0.01),而且在高脂饮食组更为明显,差异有统计学意义(P<0.01)。见图1;拟杆菌群基因则表达减少,差异有统计学意义(P<0.01)。见图2;拟杆菌群与厚壁菌群比例呈下降,差异有统计学意义(P<0.01)。见图3。后两者在高脂饮食组和胆酸组之间比较差异无统计学意义(P>0.05)。

注:与对照组比较,①P<0.01;与高脂饮食组比较,②P<0.01图1 各组大鼠粪便中厚壁菌群的基因表达量

注:与对照组比较,①P<0.01图2 各组大鼠粪便中拟杆菌群的基因表达量

注:与对照组比较,①P<0.01图3 各组大鼠粪便中拟杆菌群与厚壁菌群表达的比例
3 讨论
不同的膳食结构对糖脂代谢存在明显影响,本研究中高脂模型组大鼠TG、TC、TBA、ALT水平高于正常对照组,体重有增加趋势但差异不明显考虑可能与喂养周期较短及喂养末期大鼠产生厌食相关。这与既往在高脂喂养大鼠模型中观察到的结果类似[3]。高脂饮食对糖脂代谢产生影响机制主要在于肝内胆汁酸淤积、干扰肝脏处理血脂能力,导致多余的脂肪在肝脏及体内脏器累积,血浆中脂肪酸升高,最终引起血脂代谢紊乱、肥胖等疾病的发生[4]。本研究中观察到8周的去氧胆酸膳食在大鼠体内可代谢为脱氧胆酸(属于疏水性胆汁酸),形成血浆中胆汁酸堆积,FFA增加及血脂代谢紊乱。可能的机制在于疏水性胆汁酸可溶解细胞膜膜脂,从而引起细胞坏死[5-6],诱导细胞毒性作用及体内血清胆固醇的水平增高[7]。胆酸组大鼠转氨酶异常并伴随胆固醇升高,也间接证实了胆汁酸喂养可能通过肝细胞毒性作用进而引起血脂异常。
高脂饮食能够诱导大鼠出现胰岛素抵抗,其机制主要涉及瘦素、细胞炎性因子的分泌增加。高胰岛素血症可增加脂肪细胞瘦素的表达,由此形成高瘦素与胰岛素抵抗间的恶性循环。IL-18是肿瘤坏死因子(TNF)-α的诱导因子,通过其信号转导通路中激酶如c-Jun氨基末端激酶(JNK)、NF-κB、IKB激酶(IKK)等和细胞因子信号抑制物(SOCS)的激活,阻碍正常的酪氨酸磷酸化而导致IR和肥胖[8]。本研究结果显示,胆酸喂养大鼠血清中瘦素及IL-18、HOMA-IR升高,其可能机制为胆汁酸摄入后在体内代谢为脱氧胆汁酸,可诱导产生一系列慢性炎性反应表现为瘦素及IL-18的升高。正常情况下瘦素增加可抑制胰岛素分泌,但本研究中发现大鼠胰岛素水平并未下降,提示可能发生了瘦素抵抗。李静芳等[9]也发现在脂代谢紊乱的早期,机体发生瘦素抵抗,使得瘦素作用减弱,发生脂肪肝,血清瘦素浓度的代偿增加,可反映出肝内胆汁沉积的程度[10]。结合本研究的结果,推断胆汁酸可诱导大鼠增加瘦素分泌及炎性反应从而引起胰岛素抵抗。
有研究在人体和动物中发现,肥胖个体肠道中拟杆菌门细菌的含量下降,而厚壁菌门细菌的比例相对升高[11-12]。高脂饮食引起的肝细胞脂肪堆积和胰岛素抵抗可导致胆汁酸淤积和胆汁酸成分改变,从而导致肠道菌群失衡,进一步加重胆汁酸代谢紊乱和肝脏炎性反应[13-14]。Janssen等[15]研究发现,给小鼠喂食牛磺胆酸(TCA)引起肠道菌群结构改变,加剧肝脏炎性反应和肝纤维化。将胆汁酸加入正常小鼠饮食出现体质指数升高,且其肠道菌群结构近似肥胖小鼠;而将胆汁酸受体激动剂加入高脂小鼠饮食,胆汁酸合成受到抑制,小鼠体质指数、肠道菌群结构均趋向正常[16]。本研究中胆酸喂养后大鼠粪便内的厚壁菌群数量上升,拟杆菌群数量下降,拟杆菌群/厚壁菌群比例下降,证明胆汁酸膳食可以诱导大鼠产生类似高脂模型的肠道菌群改变进而参与了胰岛素抵抗的发生,但胆汁酸调控肠道菌群参与肥胖、糖尿病的具体机制比较复杂,仍需要进一步深入研究。展望未来,干预胆汁酸代谢的膳食结构有望成为改善高脂血症、糖尿病、肥胖等代谢性疾病的新方向。
