基于网络药理学研究白术-黄芪药对抗胃癌作用机制
2022-03-19魏思媛方海明李学军
魏思媛,刘 云,孙 琴,方海明,李学军*
(1.安徽中医药大学 第一临床医学院,安徽 合肥 230012;2.安徽中医药大学第二附属医院 脾胃科,安徽 合肥 230061;3.安徽医科大学第二附属医院 消化内科,安徽 合肥 230601)
胃癌在我国的发病率、死亡率均居前列,且起病不易察觉,发展迅速,部分患者确诊时,已处于中晚期,早期检出率小于10%,其防治形势十分严峻。手术切除、化疗、放疗以及靶向性治疗等作为治疗胃癌的常见方法,复发率高、生存率低,影响患者生活质量。近年来,中医药的作用在癌症防治中被愈发重视,与西医治疗方法比,具有一定的优势,二者结合也可起到互补的作用。胃癌归属于中医学“痞满”“胃痛”“噎膈”“癥瘕”等病范畴。《脾胃论》指出:“百病皆由脾胃衰而生”。有研究发现,消化道恶性肿瘤患者常有脾虚,并由此认为“有瘤体必虚,有虚首健脾”[1]。《金匮要略·脏腑经络先后病脉证并治》提及:“脾旺则四季不受邪”,脾虚是免疫功能减弱之根本的学术观点也得到了较广泛的认同。同时,“脾胃为气血生化之源”,脾虚正衰则气血生化不足、气血不行、瘀血阻滞,致使肿瘤局部微循环障碍,使肿瘤微环境的缺血缺氧状态加重。中医药辨证论治是中医治疗胃癌的特色,临床疗效显著,但其作用机制尚待进一步研究。
脾胃培源方是在首届全国名中医,全国第二、三、四、五、六批名老中医药专家马骏教授指导下,形成的我院脾胃科治疗胃癌及癌前病变之经验方,临床应用多年,疗效显著。该方依据《内经》以脾为“中央土,以灌四傍”,以胃为“水谷之海,六腑之大原也”为核心,结合《灵枢》指出的“胃者,五脏之本也”“人受气于谷,谷入于胃,以传于肺,五脏六腑皆以受气”,认为胃气是生命活动的物质基础。本方的创新点在于对胃癌及癌前病变病因病机的独特认识,认为脾虚与肿瘤互为因果,提出病机多以脾虚正衰为本。白术-黄芪为本方君药药对,白术有健脾益气、燥湿利水之功,有“健脾补气第一要药”的美誉;黄芪有健脾补中、升阳举陷、益卫固表之效,为补中益气圣药;作为治疗脾虚的基础药对,二者补脾益气,合而为君,正中本病病机。已有现代药理学研究表明,白术有效成分——白术内酯Ⅱ可以通过减少巨噬细胞内 p-PI3K 的表达,诱导巨噬细胞向M1 型极化,从而抑制胃癌增殖和迁移[2];黄芪可用于治疗胃癌前病变[3],黄芪多糖、黄芪甲苷均有抗肿瘤的作用[4-5],特别是黄芪多糖,可改善胃癌术后化疗患者的免疫状态[6];本药对也被用于其它肿瘤疾病治疗[7]。多年临床研究表明,脾胃培源方治疗胃癌前病变慢性萎缩性胃炎疗效甚佳[8-9],且本方联合化疗治疗进展期胃癌患者疗效显著[10],但其作用机制欠清,现从本方治疗脾虚的君药药对白术-黄芪入手,探究其治疗胃癌的作用机制。
1 材料与方法
1.1 白术-黄芪药对药物有效成分化合物及药物靶点筛选与提取
白术-黄芪药对有效成分与作用靶点均基于中药系统药理学分析平台TCMSP(https://tcmspw.com/tcmsp.php)进行检索。筛选条件设置为口服生物利用度(OB ≥ 30%)与类药性指数(DL ≥0.18),并进行去重等处理。基于数据库Uniprot(https://www.uniprot.org/),将作用靶点基因进行人类基因的名称转换,最后将结果录入至Excel 表格中。
1.2 胃癌疾病靶点的检索与筛选
疾病靶点检索用到的数据库包括以下:GeneCards(https://www.genecards.org)、OMIM (https://omim.org)、Drugbank(https://go.drugbank.com)、PharmGK(https://www.pharmgkb.org)、TTD(http://db.idrblab.net/ttd),检索胃癌疾病靶基因以“gastric cancer”为关键词进行,将以上结果合并去重后,对得到的疾病靶点,与药对作用靶点取交集,绘制韦恩图。
1.3 “药物-化合物-靶点”可视化网络构建
将交集基因与药对有效成分化合物运用Cytoscape 3.7.2 软件进行“药物-活性成分-靶点”网络图搭建,将得到药物靶点与疾病靶点整合,获得白术-黄芪药对治疗胃癌的潜在作用靶点。
1.4 蛋白互作网络(PPI)构建
基于String11.0(https://string-db.org/cgi/input.pl)中,将交集基因导入后,以人类作为限定物种条件,搭建蛋白互作网络,并设置Degree ≥40 为条件进行过滤,保证过滤后得到的结果在数据库、实验、基因预测等方面都已被证实。将得到的后缀为.tsv 的文件导入至Cytoscape 3.7.2 软件中,绘制网络图。
1.5 GO 生物过程与KEGG 富集分析
通过Metascape 数据库对白术-黄芪药对治疗CAG 的潜在作用靶点进行GO 生物过程、KEGG 通路富集分析,挖掘关键靶点参与的主要分子生物过程、信号通路,据此探讨该药对治疗胃癌可能的作用机制,将KEGG 分析所获得的通路与药对疾病交集基因导入至Cytoscape 3.7.2 软件,构建“靶点-通路”可视化网络。
2 结果
2.1 药对有效成分筛选结果
经过TCMSP 数据库检索后,以OB ≥30%、DL ≥0.18 为条件筛选后去重,共得到白术有效成分4 个,黄芪有效成分17 个,重合成分1 个,具体见表1。

表1 白术-黄芪活性成分信息Tab.1 Atractylodes-Astragalus active ingredient information
2.2 药对靶点基因与胃癌疾病基因筛选结果
分析共得到189 个靶点基因,其中,白术20 个,黄芪169 个。9 152 个胃癌疾病基因,其中,GeneCards 8 611 个,OMIM 169 个,DrugBank 30 个,PharmGKB 315 个,TTD 27 个,进行去重操作后共得到8 805 个疾病基因。将药对靶点基因与胃癌疾病基因取交集后,共得到168 个交集基因,Venn 图见图1。依据以上得到的药物有效成分化合物与交集基因,应用Cytoscape 3.7.2 构建“药物-化合物-靶点”网络图,见图2。

图1 “药物-疾病”交集基因韦恩图Fig.1 “Drug-Disease” intersection gene Venn diagram
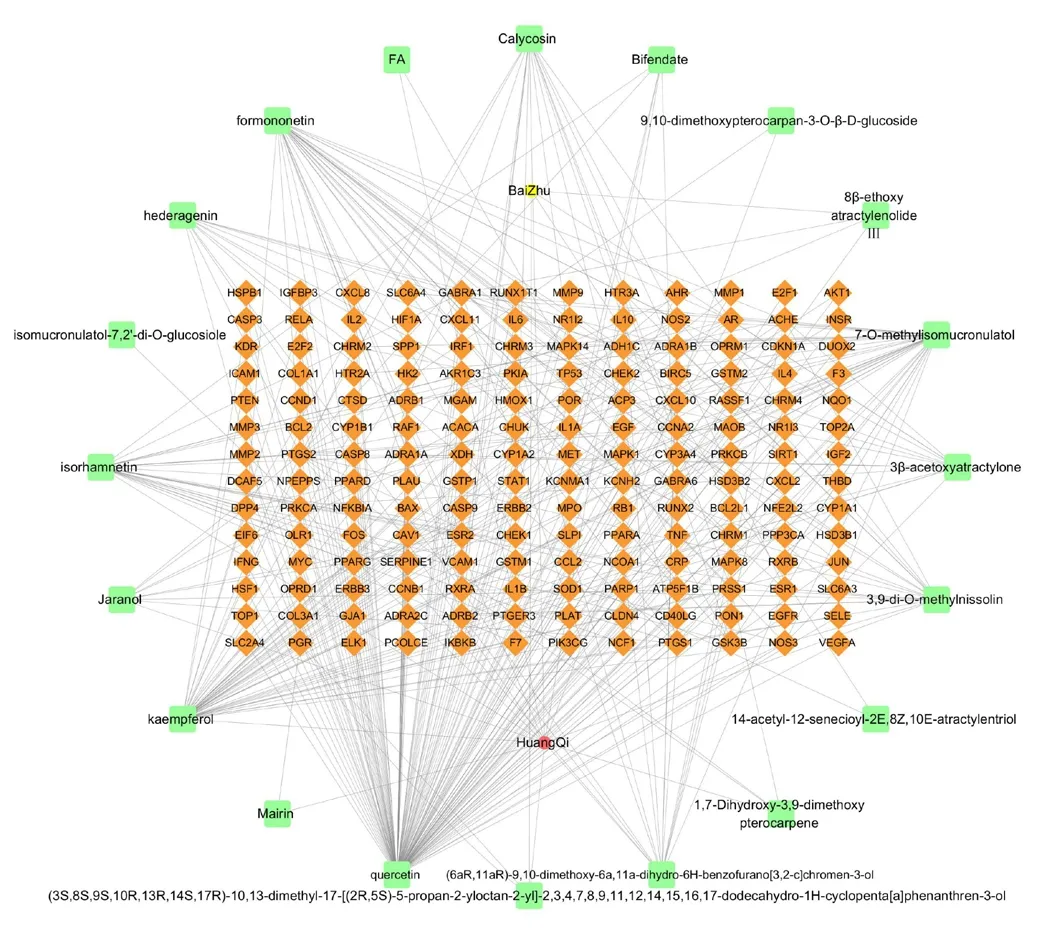
图2 “药物-化合物-靶点”网络图Fig.2 “Drug-Compound-Target” network diagram
2.3 蛋白互作网络构建
将获得的168 个交集基因导入至String 数据库,共获得168 个节点,2 970 条边,使用Cytoscape 获得可视化网络图,见图3。据此,可知靶基因之间的互作关系十分密切,Degree ≥40 的靶基因共59 个,其中,前20 位为:AKT1、IL-6、TP53、VEGFA、TNF、JUN、CASP3、MAPK1、MYC、MAPK8、PTGS2、MMP9、EGFR、EGF、CXCL8、ESR1、FOS、IL-1B、CCND1、CCL2。

图3 PPI 网络图Fig.3 PPI network diagram
2.4 GO 生物过程富集分析
通过对白术-黄芪药对治疗胃癌的潜在作用靶点进行GO 生物过程分析进一步揭示其中重要靶点参与的主要生物过程,包括对有毒物质的反应、无机物的反应、脂多糖的反应、损伤的反应、活性氧代谢的过程、凋亡信号通路、调控细胞死亡等生物学过程,依据P值选取前20 条,并根据所得结果绘制GO 富集分析水平条形图,具体结果见图4。

图4 GO 功能富集图Fig.4 GO functional enrichment diagram
2.5 KEGG 通路富集分析
将168 个靶蛋白进行 KEGG 通路富集分析。以P值、基因频率排序条件,排除与胃癌无关通路,例如糖尿病并发症中的AGE-RAGE 信号通路、疟疾、急性粒细胞白血病等,最终筛选出12 条通路,包括癌症信号通路、PI3K-Akt 信号通路、IL-17 信号通路等,具体结果见表2。并根据通路与靶点关系,绘制 KEGG 通路富集分析气泡图,见图5。依据靶点与信号通路之间的联系,绘制“靶点-通路”网络图,见图6。
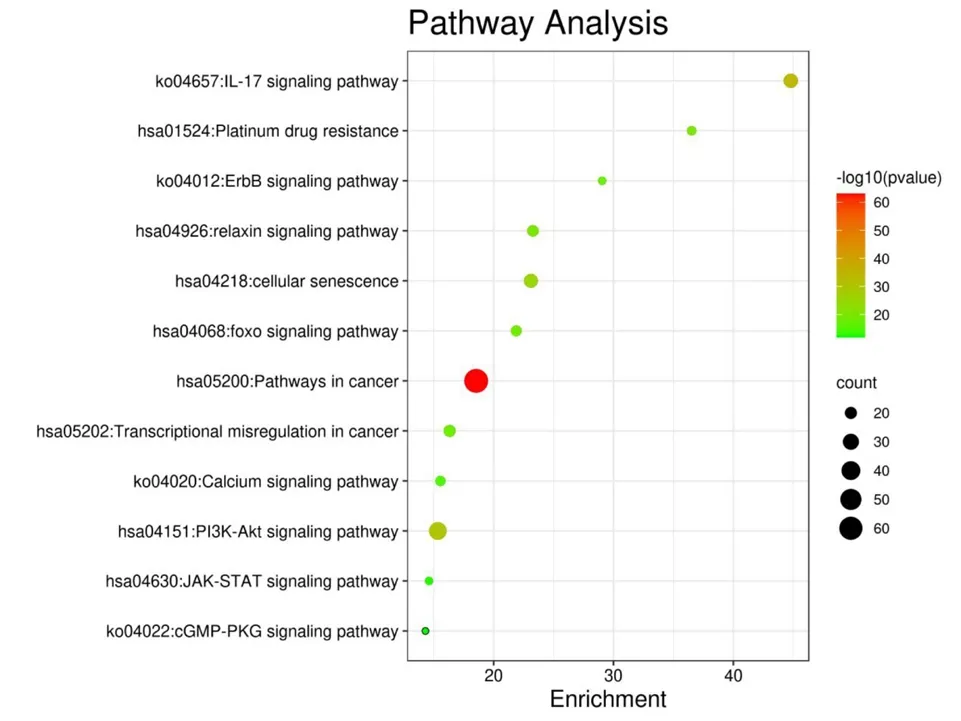
图5 KEGG 通路富集图Fig.5 KEGG pathway enrichment diagram

图6 “靶点-通路”网络图Fig.6 “Target-Path” network diagram

表2 靶基因的KEGG 富集分析Tab.2 KEGG enrichment analysis of target genes
3 讨论
通过蛋白互作网络分析得出,白术-黄芪治疗胃癌的关键靶点有AKT1、IL-6、TP53、VEGFA、TNF、JUN 等。丝氨酸/苏氨酸蛋白激酶(AKT1)涉及癌细胞增殖、肿瘤血管生成、抑制凋亡和能量代谢;AKT 是PI3K/AKT 信号通路的核心因子,在胃癌进程中起重要作用[11]。白细胞介素6(IL-6)与胃癌前病变、胃黏膜萎缩、肠上皮化生程度等密切相关[12],还可通过AKT信号通路使金属基质蛋白酶-9 (MMP-9)与c-Myc 在胃癌细胞内的蛋白表达增高,促进胃癌细胞侵袭和增殖[13];还有研究表明,抑制NF-κB或IL-6 可能成为未来胃癌临床治疗的潜在靶点[14]。TP53 为肿瘤蛋白P53,是著名的肿瘤抑制基因,参与细胞凋亡或细胞周期调控过程,与胃癌组织分化、淋巴结转移、浸润深度关系紧密[15]。血管内皮生长因子A(VEGFA)在各种胃癌组织中表达增加,促进胃癌发生发展、侵袭转移,可作为判断胃癌预后的生物学标志物[16],也可作为治疗胃癌腹膜转移的潜在靶点[17]。肿瘤坏死因子(TNF)也是促炎因子之一,TNF-α 可通过caspase 介导的信号通路、NF-κB激活的信号通路、JNK 信号通路来诱导细胞凋亡;参与免疫系统的调节,来控制肿瘤细胞的增殖和凋亡;TNF-α 还可通过促进VEGF 的表达来提高肿瘤细胞生长,VEGF 还可以加速淋巴管的形成导致肿瘤病灶向淋巴发生转移[18];TNF-α 还可以抑制肿瘤新血管生成[19];当TNF-α 作为治疗胃癌的药物靶点时可起到抗癌作用,通过激活TNF-α/TNFR1 信号通路,使下游发生caspase 级联反应[20]。氨基末端激酶(c-Jun),主要涉及肿瘤细胞增殖、凋亡抑制等方面,基因编码的c-JUN 蛋白是丝裂原活化蛋白激酶(MAPK),参与多条信号通路在肿瘤进展中起协同作用[21-23],参与调控细胞增殖、分化、侵袭和凋亡,已有研究表明,c-JUN 高表达与胃癌的发生发展联系紧密,作为胃癌预后指标[24]。
经KEGG 富集分析可知,白术-黄芪药对通过多条信号通路干预胃癌病程进展,如:癌症通路、IL-17 信号通路、PI3K-Akt 信号通路、细胞衰老等,其中,癌症通路富集最为显著。当前,有许多证据强调IL-17 细胞因子家族在恶性疾病中的作用,IL-17可通过NF-κB 信号通路刺激IL-6 参与胃癌的免疫调控,从而促进胃癌疾病进程,IL-17 可能作为胃癌的临床治疗潜在靶点,这给研究胃癌发病机制提供新方向[25];还有研究表明,除了IL-17A 以外,IL-17B 信号通过促进肿瘤进展的趋化因子和细胞因子的分泌,从而改善肿瘤微环境,且在胃癌中,IL-17B的升高与预后不良有关[26]。有研究表明分子可通过PI3K-Akt 信号通路促使胃癌细胞自噬、细胞周期阻滞并抑制上皮间质转化[27],中药复方健脾化瘀解毒方通过可抑制该通路阻断胃癌前病变恶性进展[28];此外PI3K-PKB/Akt 信号通路可对抑癌基因p53 进行调控[29]。细胞衰老经验证与胃癌关系十分密切[30],研究发现发现4,5-二苯基-2-甲基吡啶甲酸酯(DMP)可通过靶向DNA 损伤及相关信号通路在胃癌中通过诱导细胞衰老发挥抗癌作用[31]。还有例如铂耐药、松弛素信号通路、foxo 信号通路、癌症中的转录失调、ErbB 信号通路、钙信号通路、JAKSTAT 信号通路、cGMP-PKG 信号通路,均在癌症进程中起到重要作用。GO 生物过程分析结果中的脂多糖(LPS)在肿瘤微环境中起核心作用,有研究表明,Brusatol 可通过PI3K/AKT/NF-κB 通路逆转脂多糖诱导的人胃癌SGC7901 细胞上皮-间充质转化,诱导细胞凋亡[32]。将KEGG 与GO 生物过程分析结果相结合,预测白术-黄芪药对治疗胃癌的作用机制主要为:通过介导癌症通路、IL-17、PI3K-Akt 等信号通路,肿瘤细胞对有毒物、无机物、脂多糖的反应,以及肿瘤细胞的损伤、氧代谢、增殖、凋亡等生物过程进而起到治疗胃癌的作用。
4 结论
脾胃培源方君药药对白术-黄芪可能是通过介导癌症通路、IL-17、PI3K-Akt 等信号通路,肿瘤细胞对有毒物、无机物、脂多糖的反应,以及调控肿瘤细胞的损伤、氧代谢、增殖、凋亡等生物过程进而起到治疗胃癌的作用。本研究为后续进一步实验研究提供了方向。
