丹皮酚异丁酸酯类衍生物的合成及体外降血脂活性研究
2022-03-19徐淼焱李光耀常皓云
刘 鹏,徐淼焱,李光耀,常皓云,黄 鹏,2*
(1.安徽中医药大学 药学院,安徽 合肥 230012; 2.安徽中医药大学 中药研究与开发安徽省重点实验室,安徽 合肥 230012)
近年来随着生活水平的提高,中老年人群中高血脂发病率不断升高,严重影响患者身体健康和生活质量。研究发现高血脂症可导致动脉粥样硬化(AS)进而引发其它心脑血管疾病[1]。目前,临床常用降血脂药是他汀类,但是此类药物长期服用易造成轻度肝损伤,如何研发更加安全有效的新型降血脂药是药物研究的热点。大量研究发现一些天然酚类和黄酮类化合物均具有较好的降血脂作用[2]。因此,以天然活性酚类化合物作为先导化合物进行新型降血脂药物研发符合现代中医药发展的趋势。
天然酚类化合物丹皮酚(Paeonol)是中药丹皮的主要活性成分,具有多种生物功能,如抗炎、抗菌、抗氧化、抗病毒、抗肿瘤、抗动脉硬化、预防心血管系统疾病[3-9]等。但由于水溶性差、口服生物利用度低等缺点[10],阻碍了其在临床上的应用与开发。氯贝丁酯是临床常用的降血脂药物,通过对苯氧乙酸类降脂药物氯贝丁酯的结构分析,发现丹皮酚与其芳环结构类似。鉴于此,基于生物电子等排原理,以丹皮酚取代氯贝丁酯的芳环部分,设计、合成了6个苯氧乙酸类结构的丹皮酚类衍生物[11-12],通过建立高血脂HepG2 细胞模型、脂肪酶活性抑制和胆酸盐结合能力实验对6 个不同结构的目标化合物进行体外降血脂活性评价研究,以期获得具有降血脂效果好、生物利用度高的丹皮酚类衍生物。
1 材料
1.1 细胞株
人肝癌细胞HepG2(上海弘顺生物科技有限公司)。
1.2 仪器与试剂
Nicolet-6700 型傅立叶变换红外光谱仪(美国尼高力科学仪器有限公司);AV300 型核磁共振仪(德国Bruker 公司);LCQ Advantage MAX 型液质联用质谱仪(美国Finnigan 公司)。iMark 型酶标分析仪(美国BioRad 公司)。丹皮酚(分析纯,广州美懿生物科技有限公司);α-溴代异丁酸(分析纯,山东西亚化学股份有限公司);无水甲醇、无水乙醇、异丙醇、正丁醇、正戊醇、环己醇(分析纯,江苏强盛功能化学股份有限公司);EDCI-HCl、TBAB、DMAP(分析纯,山东西亚化学工业有限公司);PBS 粉末(武汉赛维尔生物科技有限公司);油酸(国药集团化学试剂有限公司);胎牛血清(双洳生物科技有限公司);BSA、Western 及IP 细胞裂解液(江苏省凯基生物技术股份有限公司);DMEM 高糖培养基(赛默飞世尔生物化学制品有限公司);胰蛋白酶、胆固醇、脂肪酶、甘氨胆酸钠、牛黄胆酸钠(上海麦克林生物科技有限公司);非诺贝特(Merck Sharp& Dohme Limited U.K.);BCA 法蛋白试剂盒、TC、TG、LDL-C、HDL-C 试剂盒(南京建成生物科技有限公司)。
2 方法
2.1 合成实验研究
以丹皮酚为先导化合物,碱性条件下与α-溴代异丁酸反应,得到2-(2-乙酰基-5-甲氧基苯氧基)-2-甲基丙酸(丹皮酚异丁酸)(1);利用丹皮酚异丁酸的羧基与不同的醇发生酯化反应得到目标化合物(2)。合成线路见图1。
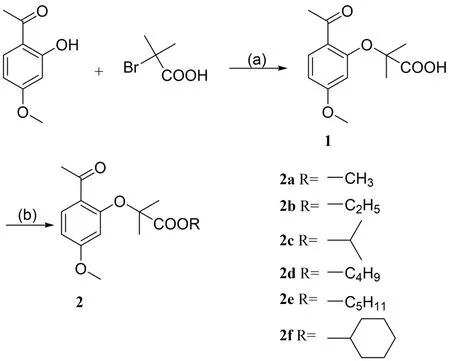
图1 目标化合物2a-2f 的合成路线Fig.1 The Synthesis route for compound 2a-2f
2.1.1 2-(2-乙酰基-5-甲氧基苯氧基)-2-甲基丙酸(丹皮酚异丁酸)的制备 参考文献[13]并略作改动:分别称取1.0 g(6.1 mmol)丹皮酚、3.0 g(18 mmol)α-溴代异丁酸、5.0 g(125 mmol)NaOH加入50 mL 圆底烧瓶中,加入11 mL DMF 溶解,室温搅拌,薄层色谱法(TLC)监测反应结束后,加入110 mL 水,再 加HCl 溶 液 调 节pH = 2,EA 萃 取(40 mL × 3), 饱 和NaHCO3洗(60 mL×3), 无 水Na2SO4干燥,浓缩,柱层析[V(乙酸乙酯)∶V(石油醚)= 1 ∶5]得橘红色油状物640 mg,收率42.0%。
2.1.2 2-(2-乙酰基-5-甲氧基苯氧基)-2-甲基丙酸甲酯(2a)的制备 分别称取253 mg(1 mmol)丹皮酚异丁酸、328 mg(1 mmol)TBAB、123 mg(1 mmol)DMAP、330 mg(1.5 mmol)EDCI-HCl置于50 mL 圆底烧瓶中,加入5 mL 无水甲醇溶解,30℃搅拌,TLC 监测反应结束后,加入100 mL 水,DCM 萃取(20 mL×3),饱和NaHCO3洗(30 mL × 3),无水Na2SO4干燥,浓缩,柱层析[V(乙酸乙酯)∶V(石油醚)=1 ∶4]得淡黄色油状物133 mg,收率50.0%。1H-NMR(600 MHz,CDCl3) δ:7.76(d,J= 8.8 Hz,1H),6.53(d,J= 8.8,2.0 Hz,1H),6.17(d,J= 2.0 Hz,1H),3.78(s,3H),3.76(s,3H),2.60(s,3H),1.70(s,6H)。IR(KBr),ν,cm-1: 1 500,1 606,1 657,1 263,1 733。ESI-MS(m/z):267.125 5[M+H]+(理论值:267.115 4)。
化合物2b-2e 按照化合物2a 的方法合成。
2b:淡黄色油状物,145 mg,收率51.8%。1H-NMR(600 MHz,CDCl3) δ:7.77(d,J= 8.7 Hz,1H),6.53(d,J= 8.8,2.1 Hz,1H),6.21(d,J= 2.2 Hz,1H),4.23(q,J= 7.1 Hz,2H),3.77(s,3H),2.60(s,3H),1.70(s,6H),1.22(t,J= 7.1Hz,3H)。IR (KBr),ν,cm-1: 1 737,1 667,1 602,1 573,1 267,1 204,1 173,1 136,1 070,1 035。ESI-MS(m/z):281.143 3[M+H]+(理论值:281.131 1)。
2c:黄色油状物,138 mg,收率46.9%。1H-NMR(600 MHz,CDCl3) δ:7.75(d,J= 8.8 Hz,1H),6.51(d,J= 8.8,2.2 Hz,1H),6.22(d,J= 2.2 Hz,1H),5.06(m,J= 6.3 Hz,1H) ,3.76(s,3H),2.59(s,3H),1.68(s,6H),1.18(s,6H)。IR(KBr),ν,cm-1: 1 735,1 667,1 602,1 496,1 267,1 177,1 137,1 103,1 071,1 035。ESI-MS(m/z):295.157 5[M+H]+(理论值:295.146 7)。
2d:黄色油状物,145 mg,收率45.5%。1H-NMR(600 MHz,CDCl3) δ:7.76(d,J= 8.8,1.0 Hz,1H),6.51(dd,J= 8.7,2.3,0.9 Hz,1H),6.20(d,J= 2.3,1.1 Hz,1H),4.15(t,2H),3.76(s,3H),2.59(s,3H),1.69(d,J= 1.1 Hz,6H),1.55(p,2H),1.24(h,J= 7.4 Hz,2H),0.84(t,J= 7.4,1.0 Hz,3H)。IR(KBr),ν,cm-1:1 737,1 669,1 601,1 573,1 267,1 204,1 176,1 137,1 070,1 037。ESI-MS(m/z):309.168 0[M+H]+(理论值:309.374 0)。
2e:黄色油状物,141 mg,收率43.8%。1H-NMR(600 MHz,CDCl3) δ:7.76(d,J= 8.8,1.3 Hz,1H),6.51(dd,J= 8.7,2.3,1.2 Hz,1H),6.20(d,J= 1.8 Hz,1H),4.15(t,J= 6.6,1.3 Hz,2H),3.76(s,3H),2.60(s,3H),1.70(s,6H),1.55(tt,2H),1.27 - 1.22(m,2H),1.20 - 1.14(m,2H),0.85 - 0.79(m,3H)。IR(KBr),ν,cm-1:1 737,1 669,1 601,1 573,1 267,1 205,1 175,1 137,1 070,1 038。ESI-MS(m/z):323.183 9[M+H]+(理论值:323.401 0)。
2f:淡黄色油状物,148 mg,收率44.3%。1H-NMR(600 MHz,CDCl3) δ:7.75(d,J= 8.8,1.2 Hz,1H),6.50(dd,1H),6.23(d,1H),4.85(p,J= 8.4,3.7 Hz,1H),3.76(s,3H),2.60(s,3H),1.71 -1.67(m,6H),1.51(s,4H),1.46-1.32(m,4H),1.32-1.20(m,2H)。IR(KBr),ν,cm-1:1 735,1 669,1 601,1 573,1 267,1 204,1 176,1 137,1 070,1 037。ESI-MS (m/z):335.183 9[M+H]+(理论值:335.412 0)。
2.2 体外降血脂实验
2.2.1 高血脂HepG2 细胞实验 将HepG2 细胞(1×105个/mL)接种于24 孔板内,孵育24 h 后取出,设空白组、模型组、非诺贝特组、丹皮酚组和目标化合物2a-2f 组,各组均设置3 个平行孔。各给药组浓度为25 μmol/L 条件下,空白组加入2% BSA、1%FBS 高糖DMEM 培养基,模型组加入含1 mmol/L油酸、1% FBS 高糖DMEM 培养基,各给药组加入1 mmol/L 油酸、1% FBS 高糖DMEM 培养基,然后将24 孔板放置于恒温培养箱,孵育24 h 后移除培养液,PBS 轻洗3 遍,Western Blot、IP 细胞裂解液冰浴30 min 后,收集裂解液,将裂解液置于离心机离心10 min(4℃、12 000 r/min)后,取上清液,参照试剂盒操作说明分别测定TC、TG、LDL-C、HDL-C含量,每组均设3 个平行孔,结果以mmol/gprot 表示[14]。
2.2.2 脂肪酶活性抑制实验 在试管中分别加入4 mL PBS 缓冲液(pH 7.4)、4 mL 聚乙烯醇、橄榄油(0.330 g/mL),同时加入2 mL(1 ~5 mg/mL)的2c、2f 溶液进行混合,37℃水浴孵育10 min,再加入1 mL 浓度为2 mg/mL 胰脂肪酶液,反应15 min后,加入15 mL 95%乙醇终止酶反应。滴加酚酞,用标准氢氧化钠溶液滴定至略带红色。空白实验中,停止反应后加入胰脂肪酶液[15]。实验平行处理3 次。计算公式:胰脂肪酶活性抑制率(%)=(不加目标化合物酶活性-加入目标化合物酶活性)/不加目标化合物酶活性×100%。
2.2.3 结合胆酸盐能力实验 以甘氨胆酸钠和牛磺胆酸钠作为标准物质,分别取甘氨胆酸钠(0.05、0.10、0.15、0.20、0.30 mmol/L),牛磺胆酸钠(0.05、0.10、0.15、0.20、0.30 mmol/L)2 mL 于试管中,加入4 mL 60% H2SO4,70℃条件下,先水浴20 min,再冰浴5 min,于387 nm 波长处测定吸光度,绘图得胆酸盐含量标准曲线,得到回归方程,分别为Y=1.99X+ 0.049 和Y= 2.725 7X+ 0.003 9,相关系数分别为R2= 0.998 9 和R2= 0.999 3。
另外分别取2.0 mL 目标化合物2c、2f 溶液于具塞烧瓶中,模拟胃消化过程:加入 2 mL 10 mg/mL胃蛋白酶(溶于0.1 mol/L 磷酸盐缓冲液中,pH = 6.3)和0.5 mL 0.01 mol/L HCl,在37℃下消化1 h。然后,用0.1 mol/L 的NaOH 溶液通过调节控制溶液pH 至6.3,加入2 mL 10 mg/mL 胰蛋白酶,在37℃条件下,恒温系统振荡消化1 h,模拟体内肠道生态环境。各样品中平行四组加入2 mL 0.20 mmol/L 甘氨胆酸钠、牛磺胆酸钠,37℃条件下,振荡1 h,然后将溶液转至离心管中离心30 min(2 000 r/min),收集上清液,使用比色法测定甘氨胆酸钠和牛磺胆酸钠含量[16]。每个样品平行3 次。分别制备1.6 μmol/mL 和2.0 μmol/mL的甘氨胆酸钠和牛磺胆酸钠溶液作为检测2c、2f 对胆酸盐结合率的标准溶液。计算公式:胆酸盐结合率(%)=(胆酸盐加入量-胆酸盐剩余量)/胆酸盐加入量×100%。
2.3 统计学方法
用SPSS 23.0 软件进行数据分析,计量资料用均数±标准差(±s)表示,两组间比较采用独立样本t检验,多组间比较采用单因素方差分析。以P<0.05为差异具有统计学意义。
3 结果
3.1 高血脂HepG2 细胞实验
与空白组相比,模型组TC、TG、LDL-C 水平升高(P< 0.05),HDL-C 水平降低(P< 0.05),表明造模成功;与模型组相比,2c、2f 组TC、TG、LDL-C 水平降低(P< 0.05),HDL-C 水平升高(P<0.05),其它4 个化合物与模型组相比,差异无统计学意义(P> 0.05);与丹皮酚组相比,2c、2f 组中TC、TG、LDL-C 水平降低(P< 0.05),HDL-C 水平升高(P< 0.05);其它4 个化合物与丹皮酚组相比,TC、TG、LDL-C 水平均升高(P< 0.05),HDL-C水平均降低(P< 0.05)。实验结果表明,合成的6 个丹皮酚异丁酸酯类衍生物中,化合物2c、2f 降血脂活性比先导化合物丹皮酚更佳,见表1。
表1 各组浓度为25 μmol/L 对HepG2 细胞TC、TG、LDL-C 和HDL-C的影响(±s,n = 3)Tab.1 Effects of 25 μmol/L on TC,TG,LDL-C and HDL-C in HepG2 cells(±s,n = 3)
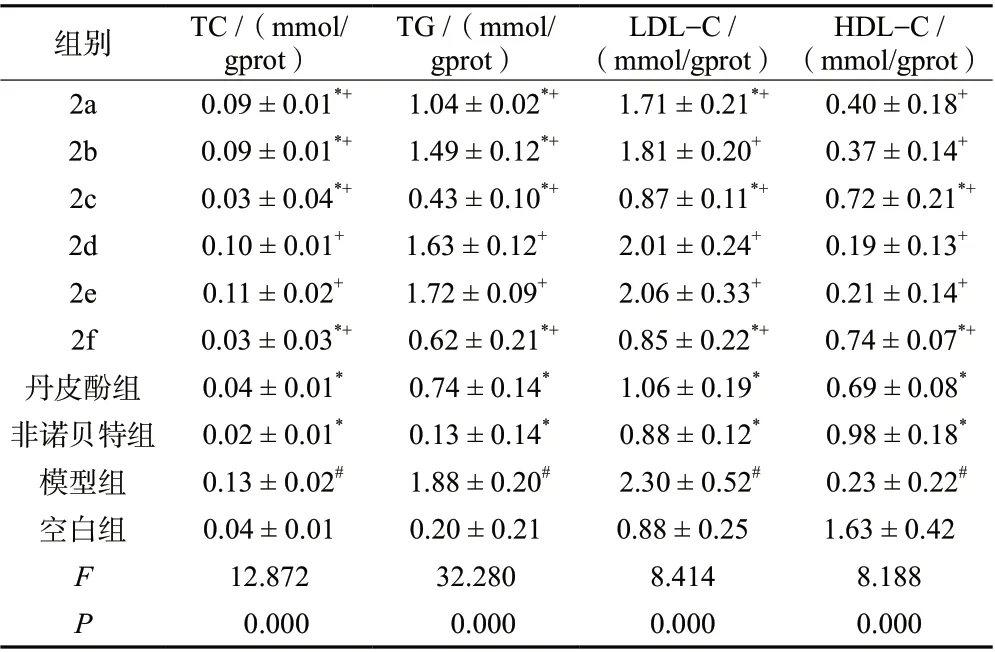
表1 各组浓度为25 μmol/L 对HepG2 细胞TC、TG、LDL-C 和HDL-C的影响(±s,n = 3)Tab.1 Effects of 25 μmol/L on TC,TG,LDL-C and HDL-C in HepG2 cells(±s,n = 3)
注:模型组与空白组相比,#P < 0.05;各给药组与模型组相比,*P < 0.05;各目标化合物组与丹皮酚组相比,+P < 0.05。
HDL-C /(mmol/gprot)2a 0.09 ± 0.01*+ 1.04 ± 0.02*+ 1.71 ± 0.21*+ 0.40 ± 0.18+2b 0.09 ± 0.01*+ 1.49 ± 0.12*+ 1.81 ± 0.20+ 0.37 ± 0.14+2c 0.03 ± 0.04*+ 0.43 ± 0.10*+ 0.87 ± 0.11*+ 0.72 ± 0.21*+2d 0.10 ± 0.01+ 1.63 ± 0.12+ 2.01 ± 0.24+ 0.19 ± 0.13+2e 0.11 ± 0.02+ 1.72 ± 0.09+ 2.06 ± 0.33+ 0.21 ± 0.14+2f 0.03 ± 0.03*+ 0.62 ± 0.21*+ 0.85 ± 0.22*+ 0.74 ± 0.07*+丹皮酚组 0.04 ± 0.01* 0.74 ± 0.14* 1.06 ± 0.19* 0.69 ± 0.08*非诺贝特组 0.02 ± 0.01* 0.13 ± 0.14* 0.88 ± 0.12* 0.98 ± 0.18*模型组 0.13 ± 0.02# 1.88 ± 0.20# 2.30 ± 0.52# 0.23 ± 0.22#空白组 0.04 ± 0.01 0.20 ± 0.21 0.88 ± 0.25 1.63 ± 0.42 F 12.872 32.280 8.414 8.188 P 0.000 0.000 0.000 0.000组别 TC /(mmol/gprot)TG /(mmol/gprot)LDL-C /(mmol/gprot)
3.2 脂肪酶活性抑制实验
在浓度为1 ~5 mg/mL 范围内,随着浓度增加,2c、2f 对脂肪酶的抑制作用也逐渐增强,当浓度达到5 mg/mL 时,其对脂肪酶的抑制率均可达到60%左右,浓度与抑制率之间呈现量效关系,见图2。

图2 化合物2c、2f 对脂肪酶的抑制率(±s,n = 3)Fig.2 Inhibition rate of 2c,2f to lipase(±s,n = 3)
3.3 结合胆酸盐能力实验
化合物2c、2f 对两种胆酸盐均有较强的结合能力,当浓度为5 mg/mL 时,化合物2c、2f 对甘氨胆酸钠、牛黄胆酸钠的结合率分别达到了80%和90%左右,并呈现计量依赖效应,见图3、图4。
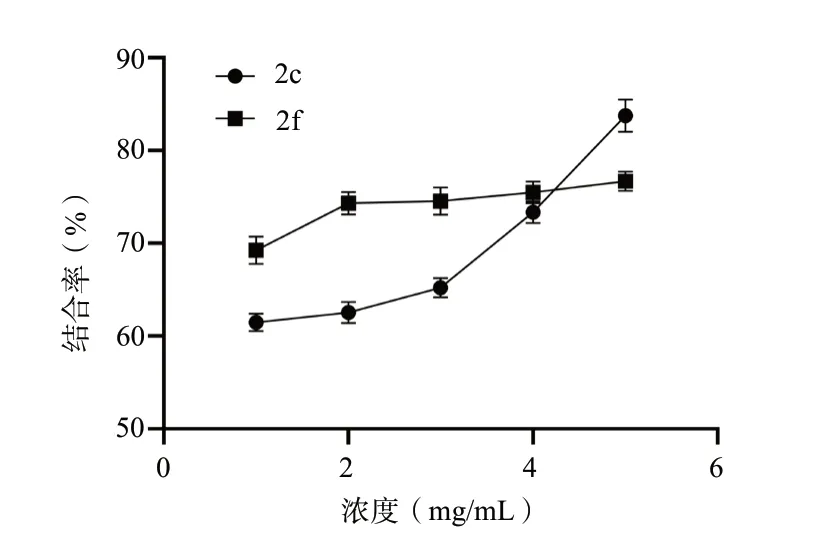
图3 化合物2c、2f 与甘氨胆酸钠的结合率(±s,n = 3)Fig.3 Binding rate of 2c,2f with sodium glycocholate (SG)(±s,n = 3)
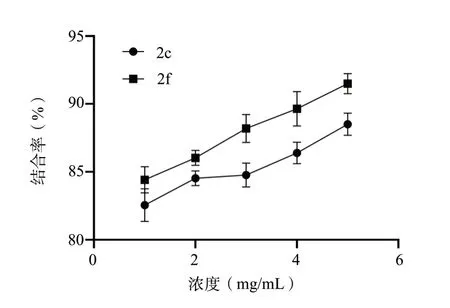
图4 化合物2c、2f 与牛黄胆酸钠的结合率(±s,n = 3)Fig.4 Binding rate of 2c,2f with sodium taurocholate(ST)(±s,n = 3)
4 讨论
丹皮酚作为天然酚类化合物,具有一定的降血脂作用,但由于生物利用度低,常被修饰为成磷酸酯类、醚类、糖苷化类[17]等来增强生物利用度。本课题组采用生物电子等排原理将其酚羟基醚化后再制成酯类化合物,以提高稳定性和降血脂活性。
油酸诱导HepG2高血脂细胞是体外降血脂活性研究最佳模型,为快速筛选降血脂活性化合物提供便捷平台。前期实验中所有给药组在浓度5 ~ 250 μmol/L范围内对油酸诱导HepG2 高血脂细胞进行研究,结果均无细胞毒活性。综合考虑筛选出25 μmol/L 为给药浓度,并以TC、TG、LDL-C、HDL-C 为指标考察目标化合物降血脂活性,结果发现与丹皮酚相比,合成的6 个目标化合物中2c、2f 降血脂活性尤为突出,这两个化合物能降低HepG2 高血脂模型细胞内TC、TG、LDL-C 水平、升高HDL-C 水平。其作用机制一方面可能与提高了Akt 通路的磷酸化水平以及GCK 和LDLR 的蛋白质水平有关[18];另一方面可能与通过激活过氧化物酶体增殖物激活受体-α,刺激脂蛋白酶、载脂蛋白基因表达,增强脂蛋白酶的脂解活性有关。基于上述细胞实验结果,选择化合物2c、2f 进行脂肪酶活性抑制和结合胆酸盐能力实验,结果发现化合物2c、2f 不仅能有效抑制脂肪酶活性,还与两种胆酸盐有着较强的结合能力。究其原因,其一,化合物2c、2f 可能是有效的脂肪酶活性抑制剂,能够阻止脂肪酶将脂肪水解为甘油和游离脂肪酸;其二,可能是通过对先导化合物丹皮酚的化学结构修饰增加了化合物2c、2f 脂溶性,促进了与两种胆酸盐的偶联能力,提高了胆酸盐肝肠循环,进而减少胆固醇含量,达到降血脂目的[19]。
此外,对体外降血脂活性研究结果综合分析,化合物2c、2f 降血脂活性最为突出,这主要归因于其具有与氯贝丁酯类似的苯氧异丁酸药效基团。化合物2c 降血脂活性稍优于2f,可能是化合物2c 上酯基为异丙酯基团,而2f 为环己烷酯,异丙酯基更容易促进药物吸收,增强降血脂活性。当然,其具体降血脂机制还有待进一步实验研究。
5 结论
设计合成了6 个丹皮酚异丁酸酯类衍生物,高血脂HepG2 细胞降血脂实验发现,其中,化合物2c、2f 比先导化合物丹皮酚降脂活性更突出。体外脂肪酶活性抑制和胆酸盐结合能力实验研究发现,化合物2c、2f 对脂肪酶的抑制作用呈量效关系;化合物2c、2f 对两种胆酸盐均显现出较强的结合能力。这些研究为丹皮酚的开发利用提供了新的研究思路,亦为丹皮酚类衍生物在体外降血脂活性研究方面提供参考。
