结直肠癌TP53相关外泌体的差异蛋白分析*
2022-03-18周茜宁
朱 琳,张 泽,贾 坤,周茜宁,周 光△
1.解放军总医院第一医学中心检验科,北京 100853;2.解放军总医院第六医学中心检验科,n北京 100037;3.首都医科大学附属北京友谊医院临床检验中心,北京 100050
在全球,结直肠癌(CRC)的发病率和死亡率仅次于肺癌及乳腺癌,居所有肿瘤的第三位[1]。抑癌基因的失活和癌基因的激活是CRC发生、发展的关键。在已发现的人类肿瘤细胞中,TP53基因突变率从10%(造血干细胞恶性肿瘤)到50%~70%(卵巢癌、大肠癌、头颈癌)[2]。一旦TP53基因发生突变,就会丧失野生型TP53基因所具有的抑癌功能,同时获得许多癌基因的特殊功能[3]。外泌体是细胞内多泡体与细胞膜融后释放到细胞外的纳米级膜性囊泡,直径30~100 nm,内部包含有微小RNA(miRNA)、信使RNA(mRNA)和细胞质蛋白,由多种细胞分泌,介导细胞间物质与信息传递[4-5]。肿瘤来源的外泌体存在于肿瘤细胞培养上清液、肿瘤患者血浆或者恶性渗出液中,通过改变肿瘤微环境,促进肿瘤血管新生和肿瘤转移,以及直接作用于肿瘤细胞等途径,影响肿瘤的进展[6]。确定肿瘤相关的外泌体蛋白和RNA,能使这些囊泡成为新的生物标记来源并用来监测健康状态。因此,本文比较分析了TP53基因突变、敲除及野生的肿瘤细胞分泌外泌体的蛋白质组差异,探讨突变的TP53基因对肿瘤微环境中的分泌蛋白质的影响。
1 材料与方法
1.1细胞系来源 人类CRC TP53野生型[HCT116-p53(WT)]细胞株购自美国标准生物品收藏中心(ATCC);TP53敲除型[HCT116-p53(-/-)]细胞株由约翰霍普金斯大学Bert VOGLESTEIN教授馈赠。
1.2临床样本 用于验证的CRC患者均依据《结直肠癌诊疗指南(2019年版)》并经病理确诊,其血清均来自中国医学科学院肿瘤医院腹部外科的住院患者,共62例,其中男32例,女30例,年龄27~81岁,中位年龄64岁。采取外周血前经患者本人知情同意,并且术前未经任何放化疗。健康对照组血清取自解放军总医院的体检健康人群,血液生化指标检测正常,腹部B超结果正常,并排除人类免疫缺陷病毒、乙型肝炎病毒和梅毒感染者,共61例,其中男35例,女26例,年龄25~73岁,中位年龄50岁。
1.3主要仪器与试剂 飞利浦CM120型透射电子显微镜(荷兰); AB SCIEX 5600质谱仪(美国);Agilent technologies超高效液相色谱(美国)。Santa Cruz Biotech兔抗人p53、HSP70多克隆抗体(美国);Sigma-Aldrich鼠抗人β-actin单克隆抗体(美国)。Qrigene的 TP53 MUTANT (R273H)重组质粒(pCMV6-Myc-DDK-AC)(美国);天根生物DH5α大肠埃希菌感受态细菌(北京)。SBI ExoQuick外泌体提取液(美国),优尔生RB1的酶联免疫吸附试验(ELISA)试剂盒(武汉);AB SCIEX iTRAQ 4重标记试剂盒(美国)。
1.4外泌体的提取 将HCT116-p53(WT)、HCT116-p53(-/-)和HCT116-p53(R273H)细胞培养上清液进行浓缩后,加入等体积的ExoQuick上下颠倒混匀,冷藏静置过夜;混合物于4℃条件下,1 500×g离心30 min,弃上清,沉淀即为富集的外泌体,少部分沉淀重悬在1 mL的1×PBS中用作电镜观察,剩余的沉淀用含有蛋白酶抑制剂的蛋白裂解液提取蛋白,-80 ℃冰箱保存备用。
1.5外泌体的电镜观察 取重悬在1×PBS中的外泌体溶液1滴,载于直径2 mm的铜网上。滴加2%磷钨酸溶液,室温负染10 min,滤纸吸干负染液后白炽灯下烤干约2 min,将此铜网置于透射电镜下,于80 kV下观察外泌体形态,在镜下用标尺量取外泌体的直径并拍摄照片。
1.6外泌体蛋白的提取和定量 在富集的外泌体沉淀中,加入100 μL的蛋白裂解液混匀,冰上放置30 min以充分裂解外泌体,12 000×g,4 ℃离心15 min后取上清,分装-80 ℃冰箱保存备用。Bradford法测定样品蛋白的浓度,具体方法参照Coomassie Plus Protein Assay说明书。
1.7质谱分析 采用iTRAQ标记和高精度质谱鉴定相结合的同位素标记相对和绝对定量联合液相色谱串联质谱(iTRAQ-LC-MS/MS)策略。
1.7.1多肽浓度的检测 酶切后的多肽样品溶于1‰ FA后采用BCA法测定多肽浓度。标准品采用血管紧张素Ⅱ配成1.00、0.50、0.25、0.10、0.05及0.00 g/L的不同浓度梯度,取不同浓度的标准品10 μL和多肽样品分别加入96孔板中,再加入200 μL配好的工作液,室温放置10 min,显色后在酶标仪的波长562 nm处测其吸光度,根据标准品的浓度及其相应的吸光度值制作标准曲线,计算出样品浓度。
1.7.2iTRAQ标记 iTRAQ 4重标记试剂盒室温平衡半小时后,加入70 μL乙醇混匀。在样品中加入36 μL TEAB缓冲液,室温下14 800 r/min离心5 min,弃去沉淀,将样品溶液转入新的离心管中,测pH值大于8时进行iTRAQ标记。将iTRAQ试剂加入含样品的离心管中,振荡混匀后离心,室温避光反应2 h标记多肽。之后加入等体积的灭菌水终止反应,充分振荡,高速离心后放入旋转蒸发仪,真空干燥,标记的多肽可避光于-80 ℃冰箱保存。
1.7.3质谱鉴定 质谱条件设定为:扫描质荷比为400~1 800的离子;离子电荷数大于2;喷雾电压设定为2 000 V;真空规温度设定为250 ℃;一级质谱自动增益设定为1 000 000,分辨率设定为30 000;二级质谱自动增益设定为30 000,分辨率设定为7 500;母离子分离窗口设定为3;离子注射时间设定为150 ms。所得质谱图用MASCOT软件检索,所用数据库为人类的蛋白质数据库(ftp.ncbi.nihIgov/)。
1.7.4蛋白定量结果校正与差异蛋白选取 将原始的蛋白定量结果进行log2转换,然后分析定量结果的分布。如果定量结果为典型正态分布时,分别计算该正态分布的均值和标准差值;如果均值不为0,说明蛋白的上样量有差异,需要通过校正的方法校正上样量差异,将每个蛋白的定量结果均减去均值,新的值作为蛋白定量值,校正后的蛋白比值仍为正态分布,而其均值应为0。
差异蛋白的选取采用重复的方法进行显著蛋白选取。计算每个蛋白在两次重复之间定量结果之间的变化值,取95%的蛋白的变化值均小于设定值时的卡值作为显著性蛋白选取的依据,蛋白比值大于该卡值的蛋白作为显著性差异蛋白。
1.8生物信息学通路分析 KEGG通路分析工具采用DAVID数据分析软件。将差异蛋白的基因名称上传至DAVID网站后,选择Pathways选项进行通路富集分析,通路富集的参数为默认参数。采用PANTHER网络分析软件对差异蛋白进行细胞定位、分子功能、生物学过程的分析,将差异蛋白号上传至PANTHER网站,种属选择人类,选择对应的biological process、molecular function、cellular component选项进行分析。网络富集分析采用IPA软件进行,差异蛋白号及比值上传至IPA网站后,选择canonical pathways选项分析显著性变化蛋白的经典通路富集。
1.9统计学处理 采用SPSS17.0统计学软件进行统计学处理。ELISA数据结果根据适用情况选择Mann-Whitney 检验。以P<0.05 为差异有统计学意义。
2 结 果
2.13种细胞系来源的外泌体的鉴定 采用ExoQuick试剂盒提取HCT116-p53(WT)、HCT116-p53(-/-)和HCT116-p53(R273H)细胞培养上清中的外泌体,在透射电镜下观察,如图1A显示3种细胞系来源的外泌体均呈大小不一的圆盘状,由脂质双分子层包裹的小囊泡,直径在30~100 nm。图1B展示的是用免疫印迹检测3种细胞系分泌的外泌体标志性分子热休克70(HSP70),均在70×103处显示出条带信号。

注:A为3种细胞系来源的外泌体经负染后在透射电镜下的形态,呈大小不一的圆盘状,标尺为100 nm,放大倍数为120 000;B为免疫印迹检测3种细胞系来源的外泌体的标志性蛋白HSP70,1代表细胞全蛋白,2代表外泌体蛋白。
2.23种细胞系分泌外泌体的差异表达蛋白质谱 将HCT116-p53(WT)-外泌体的蛋白设为reference 后,最终鉴定到3 437个蛋白,其中3 173个蛋白具有精确的定量信息;对这些蛋白进行整理,去除技术重复和生物重复各自的CV>0.5的数据后得到可信的蛋白数是3 003个。以P-value<0.05,卡值1.6,以及生物学重复ratio>0.625且<1.6为判断标准,得到最终每组间的差异蛋白:HCT116-p53(WT)-外泌体和HCT116-p53(R273H)-外泌体有144个差异蛋白,HCT116-p53(WT)-外泌体和HCT116-p53(-/-)-外泌体有480个差异蛋白。其中有34个差异蛋白在HCT116-p53(WT)和HCT116-p53(R273H)组和HCT116-p53(WT)和HCT116-p53(-/-)组中共同存在,见图2,主要富集了细胞周期相关的分子,包括E2F4、CCNB1、HSP90AA1、PCM1、PSMD12,这与TP53基因的主要功能是一致的。
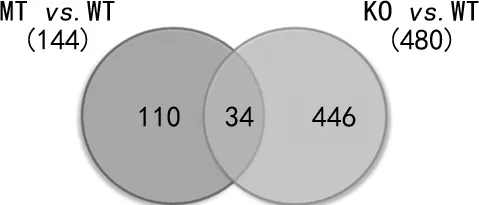
图2 HCT116-p53(WT)比HCT116-p53(R273H)与HCT116-p53(WT)比HCT116-p53(-/-)组的蛋白比较
2.3差异蛋白质的生物信息学分析 利用GO注释分别分析了HCT116-p53(WT)比HCT116-p53(R273H)组和HCT116-p53(WT)比HCT116-p53(-/-)组差异蛋白的亚细胞定位、参与的生物学过程及其分子功能,显示在图3中,可以看出大部分差异蛋白定位于细胞质、细胞骨架、细胞外基质。主要参与代谢过程、细胞的生物学过程、免疫系统过程、细胞组分的组织、凋亡、应激、增殖、细胞黏附等生物学过程,在功能上主要分为催化活性、结合功能、转录翻译调控、细胞骨架组装、受体活性、物质转运。
IPA分析显示,HCT116-p53(WT)和HCT116-p53(R273H)组的差异蛋白主要富集在泛素化、mTOR信号通路、DNA损伤修复通路中,选择性地富集了损伤修复因子、信号转导分子等,HCT116-p53(WT)和HCT116-p53(-/-)组的差异蛋白主要集中在泛素化、EIF2信号通路、糖酵解通路中,如图4。
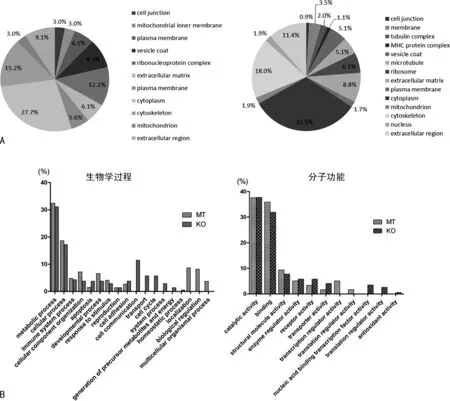
注:A为两组差异蛋白的亚细胞定位分析,左图是HCT116-p53(WT)比HCT116-p53(R273H)组,右图是HCT116-p53(WT)比HCT116-p53(-/-)组;B为左侧为两组差异蛋白参与的生物学过程,Y轴的百分比为相应蛋白质占全部具有生物学进程注释蛋白质的比例;右侧为两组差异蛋白的功能分类,Y轴的百分比为相应的蛋白质占全部具有分子功能注释蛋白质的比例;MT代表HCT116-p53(WT)比 HCT116-p53(R273H)组的差异蛋白,KO代表HCT116-p53(WT)比 HCT116-p53(-/-)组的差异蛋白。
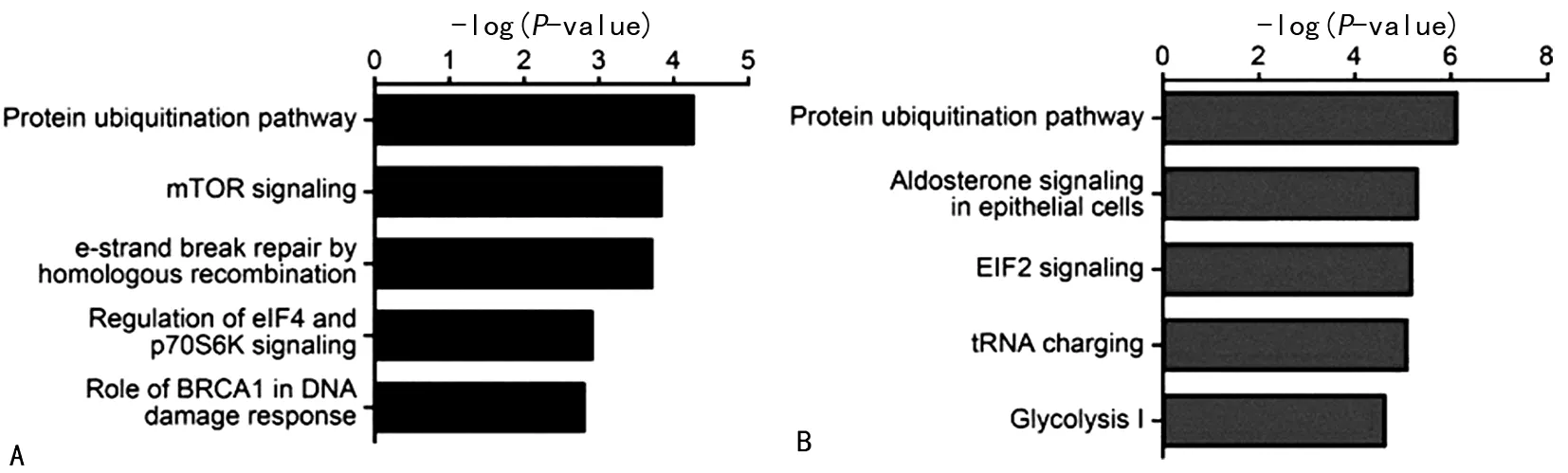
注:A为是HCT116-p53(WT)比HCT116-p53(R273H)组的差异蛋白富集通路;B为HCT116-p53(WT)比HCT116-p53(-/-)组差异蛋白富集通路。
2.4差异蛋白RB1的血清学验证 用ELISA试剂盒检测了年龄、性别相匹配的61例健康对照者和62例CRC患者的血清RB1水平,性别组、年龄组和疾病组的RB1指标经K-S检验均为非正态分布,结果用M(P25~P75)表示,结果见表1。健康对照组血清RB1浓度中位数是0.512 3 ng/mL,检测区间为0.081 5~2.469 0 ng/mL,而CRC患者的血清RB1浓度中位数是1.085 2 ng/mL,检测区间为0.153 2~5.096 0 ng/mL。经过Mann-Whitney秩和检验,二者差异具有统计学意义(P<0.05)。同时,健康对照组中的血清RB1浓度与其年龄、性别之间差异无统计学意义(P>0.05)。

表1 血清RB1表达水平及其临床参数相关性[M(P25~P75)]
3 讨 论
外泌体是由细胞内多泡体与细胞膜融后释放到细胞外的纳米级膜性小囊泡,直径在30~100 nm之间,表面含有大量与其来源和功能密切相关的蛋白质和脂质成分,内部包含有miRNA、mRNA和蛋白,因为内部成分在脂质膜的保护下具有充分的生物学活性,可以有效发挥对受体细胞的调节作用[7]。作为一种新的信息传递载体,外泌体和靶细胞之间的相互作用可以凭借其表面的生物活性脂、膜受体的转移、蛋白质的交付对靶细胞进行直接作用[8-9],通过改变靶细胞的蛋白表达、基因调控网络或者表观遗传编程等来发挥重要生物学功能[10]。
近年来针对结直肠癌细胞分泌的外泌体的研究屡有报道,比如研究发现CRC细胞的外泌体含有27种和细胞周期相关的mRNA,可有效促进内皮细胞的生长及血管形成[11-12]。用流式细胞术对CRC患者血浆中的外泌体进行定量,发现肿瘤患者的外泌体量显著高于健康对照组,并且CRC患者血浆中外泌体的含量和CEA值的水平相一致,和肿瘤的分化程度及患者生存期相反[13]。有文献证实,273位点是CRC TP53基因突变热点,与肿瘤的发生密切相关[14-16],因此TP53基因的273位点成为目前研究肿瘤发生、发展的热点。肿瘤的发展离不开肿瘤微环境,所以确定突变的TP53对肿瘤微环境的影响是十分必要的。虽然目前已知突变的TP53是如何影响肿瘤细胞生物学行为,但突变的TP53对肿瘤细胞分泌到肿瘤微环境中的分泌蛋白质的影响却知之甚少。为了检测是否TP53的状态影响外泌体的组成和行为,本文从TP53野生型、TP53突变型、TP53敲除型的HCT116结直肠癌细胞系培养上清中纯化出外泌体进行研究。利用iTRAQ-LC-MS/MS对外泌体进行蛋白质组学分析,结果显示TP53状态可以改变外泌体的成分。本研究的结果提示突变的TP53可以通过外泌体改变细胞的信号释放,为周围的肿瘤细胞提供生长条件。尽管还并不清楚TP53突变是如何分选外泌体中蛋白的,但是结果显示TP53突变型和TP53野生型的CRC细胞系分泌的外泌体差异蛋白主要富集在泛素化通路,而泛素化涉及外泌体内容物的分选[17],所以推测突变的TP53通过影响外泌体中的泛素化蛋白来进一步调节分选其他内容物进入外泌体,从而为肿瘤的发展创造有利条件。
此外,本文从HCT116-p53(R273H)和HCT116-p53(WT)与HCT116-p53(-/-)和HCT116-p53(WT)这两组差异蛋白中选择及和CRC有关,并且与TP53(WT)相比均上调的视网膜母细胞瘤蛋白(RB1)进行后续的血清学验证分析。RB1是一种细胞周期调控蛋白,可以通过抑制细胞周期进程防止细胞过度生长,被CDK3/cyclin-C磷酸化后促进细胞周期从G0至G1转变。RB1还是一种染色体改造酶(甲基化酶和乙酰化酶)的招募蛋白。这个基因缺陷可以引起儿童视网膜母细胞瘤、膀胱癌、骨肉瘤,在多种肿瘤中为一种抑癌蛋白。研究显示,RB1功能的丢失能充分诱导干细胞不受控的增殖[18]。然而,与它作为抑癌蛋白经典的角色相矛盾,CRC细胞保留抑癌蛋白RB1的表达,CRC组织较癌旁组织表达的RB1水平更高,并且较少发生RB1基因的丢失或者突变[19]。RB1基因在CRC中的mRNA和蛋白表达水平都比正常肠黏膜要高,RB1在人类多种肿瘤中都是灭活的,目前公认CRC中RB1蛋白的活性通常是存在甚至是放大的[20]。此外,研究发现RB1蛋白和通常在CRC高表达的抗凋亡Bcl-2相关的永生基因蛋白(BAG-1)相互作用,CRC中RB1的表达受到BAG-1抗凋亡活性的严格控制。与之前的报道一致,核内的BAG-1通过提高NF-κB的活性来促进细胞生存,研究人员证实了BAG-1提高NF-κB活性的能力可以被RB1表达抑制而抑制。因此,RB1可能有个新的功能,即通过调节BAG-1的功能促进细胞生存[21]。本文在年龄、性别相匹配的61例健康成人和62例CRC患者的血清中利用ELISA检测了RB1水平。结果表明,CRC患者的血清RB1水平明显高于健康对照组,差异有统计学意义(P=0.001 2),与本文的iTRAQ定量结果相吻合。
综上所述,可以推测表达高水平RB1的外泌体作为肿瘤细胞间信号交流的介质,可以抑制肿瘤细胞的凋亡,从而促进肿瘤的进展。
