例析离子晶体中重点与考点
2022-03-15宁夏固原市第一中学苟晓村
■宁夏固原市第一中学 苟晓村
在近年的高考试题中,对四大晶体内容主要从两方面考查:①有关晶胞的计算;②晶体微粒间的相互作用力以及物理性质的比较。问题主要涉及常见晶体的构型及对常见晶体的构型的类推迁移,晶胞中粒子数、晶体密度、NA、M、晶体体积、微粒间距离、微粒半径等的计算,这里就离子晶体方面的重点与考点进行归纳总结。
一、离子晶体概念、类别判断及特性的考查
1.离子晶体:阴离子和阳离子通过离子键结合,在空间呈现有规律的排列所形成的晶体。
(1)构成晶体的粒子:阴离子、阳离子。
(2)粒子间的作用力:离子键。
注意:①上述(1)(2)可作为判断晶体的理论依据;②离子晶体中并无单个分子存在;如NaCl不表示分子式,而表示化学式或最简式;③离子晶体中同时存在阴离子和阳离子。
2.常见的离子晶体:强碱(NaOH、KOH等)、大部分的盐类、活泼金属氧化物(如K2O、Na2O2等)。
3.离子晶体的物理性质。
(1)熔沸点较高(常在数百至一千摄氏度以上),硬度较大(或略硬而脆)。
(2)水溶性: 离子晶体一般易溶于水,难溶于非极性溶剂。
(3)导电性:固态不导电,水溶液或者熔融状态下能导电。
注意:(1)离子晶体熔化时,破坏离子键,离子电荷越多,离子半径越小,则离子键就越强,离子晶体的熔沸点就越高。
(2)离子晶体内无自由移动的离子,当熔融或溶于水后,离子键断裂,阴、阳离子能自由移动,所以固态不导电,水溶液或者熔融状态下可导电。
(3)注意水溶液或者熔融状态下导电与金属导电的本质区别。电解质导电:导电时的状态为水溶液或熔融状态,导电粒子为自由移动的离子,变化实质为化学变化(电解)。金属导电:导电时的状态为晶体,导电粒子为自由移动的电子,变化实质为物理变化。
例1试根据已学的知识,判断KCl、NaCl、CaO、BaO四种晶体熔点的高低顺序可能是( )。
A.KCl>NaCl>BaO>CaO
B.NaCl>KCl>CaO>BaO
C.CaO>BaO>NaCl>KCl
D.CaO>BaO>KCl>NaCl
解析:KCl、NaCl、CaO、BaO均为离子晶体,KCl、NaCl阴离子相同,电荷数相同,阳离子的半径越小,晶格能越大,熔点越高,因阳离子半径K+>Na+,所以熔点NaCl>KCl,而BaO、CaO阴离子相同,电荷数相同,而阳离子半径Ba2+>Ca2+,则熔点CaO>BaO;又因阴、阳离子所带电荷越多,晶体的熔点越高,一般来说电荷的影响大于半径的影响,所以四种化合物熔点的高低顺序为CaO>BaO>NaCl>KCl。
答案:C
4.晶体的晶格能。
(1)定义:气态离子形成1 mol离子晶体释放的能量,通常取正值,单位:kJ·mol-1。
(2)影响因素:①离子所带电荷数:离子所带电荷数越多,晶格能越大。②离子的半径:离子的半径越小,晶格能越大。
(3)与离子晶体性质的关系:晶格能越大,形成的离子晶体越稳定,则熔点越高,硬度越大。
例2根据表1中的相关数据,下列说法正确的是( )。
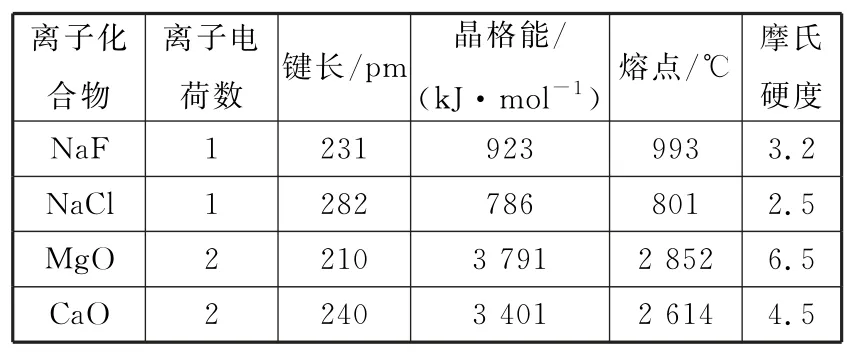
表1
A.晶格能的大小与正负离子电荷数和距离成正比
B.晶格能越大,即正负离子间的静电引力越强,晶体的熔点就越高,硬度就越大
C.表中物质CaO的晶体最稳定
D.NaF晶体比NaCl晶体稳定
解析:根据表中的数据可知:①晶格能的大小与正负离子之间的距离成反比;②离子键本质是阴、阳离子间的静电作用,不只是引力,还有斥力等,晶格能越大,即正负离子间的静电作用力越强,晶体的熔点就越高,硬度就越大;③晶格能越大,晶体越稳定,表中所列物质中MgO的晶体最稳定。④晶格能NaF>NaCl,故NaF晶体比NaCl晶体稳定。
答案:D
二、常见典型离子晶体结构及特点的考查
1.NaCl型晶体结构(如图1)。

图1
结构特点:
(1)两离子在晶胞中的位置:一种占顶点、面心,另一种占棱边、体心。
(2) 每个Na+(Cl-)周围紧邻的Cl-(Na+)有6个,即配位数为6,构成正八面体;其距离为(a为晶胞边长)。
(3)每个Na+(Cl-)周围紧邻的Na+(Cl-)有12个,其距离为面对角线的一半,即(a为晶胞边长)。
(4)每个晶胞中含4个Na+和4个Cl-,相当于4 个NaCl。
(5)晶胞的棱长与两离子的半径有关,晶胞边长a与阴阳离子半径r的关系为a=2r(Na+)+2r(Cl-)。
例3MgO具有NaCl型结构(如图2),其中阴离子采用面心立方最密堆积方式,X射线衍射实验测得MgO的晶胞参数为a=0.420 nm,则r(O2-)为_____nm。MnO也属于NaCl型结构,晶胞参数为a′=0.448 nm,则r(Mn2+)为____nm。
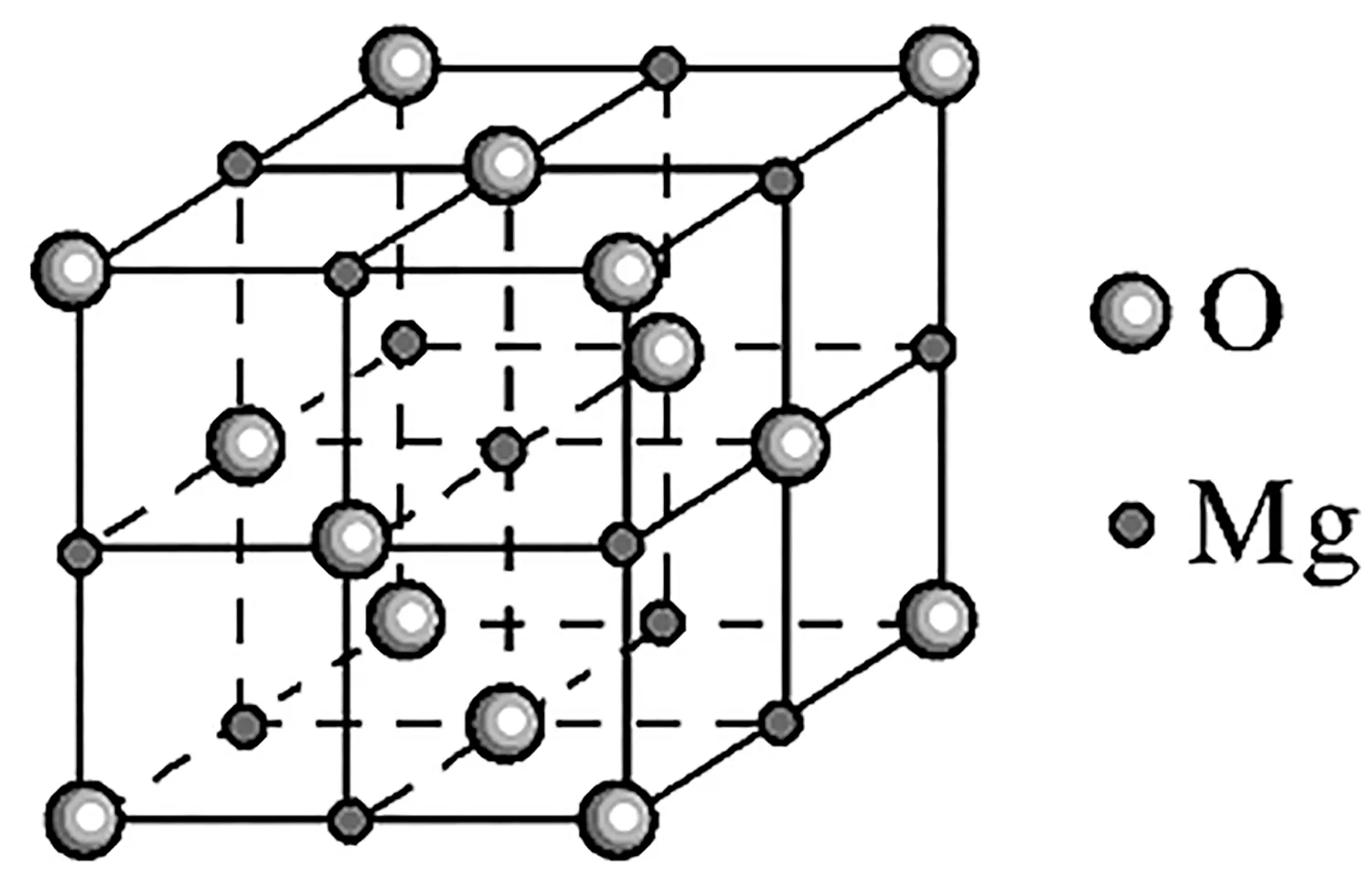
图2
解析:依晶胞结构图及题意知,在MgO中,阴离子O2-作面心立方堆积,O2-沿晶胞的面对角线方向接触,则有a=2r(O2-),r(O2-)≈0.148 nm;MnO的晶胞参数比MgO更大,推及阴离子之间并不再接触,而阴、阳离子沿坐标轴方向接触,则2[r(Mn2+)+r(O2-)]=a′,由前面计算得知r(O2-)≈0.148 nm,则r(Mn2+)=0.076 nm。
答案:0.148 0.076
2.CsCl型晶体结构(如图3)。
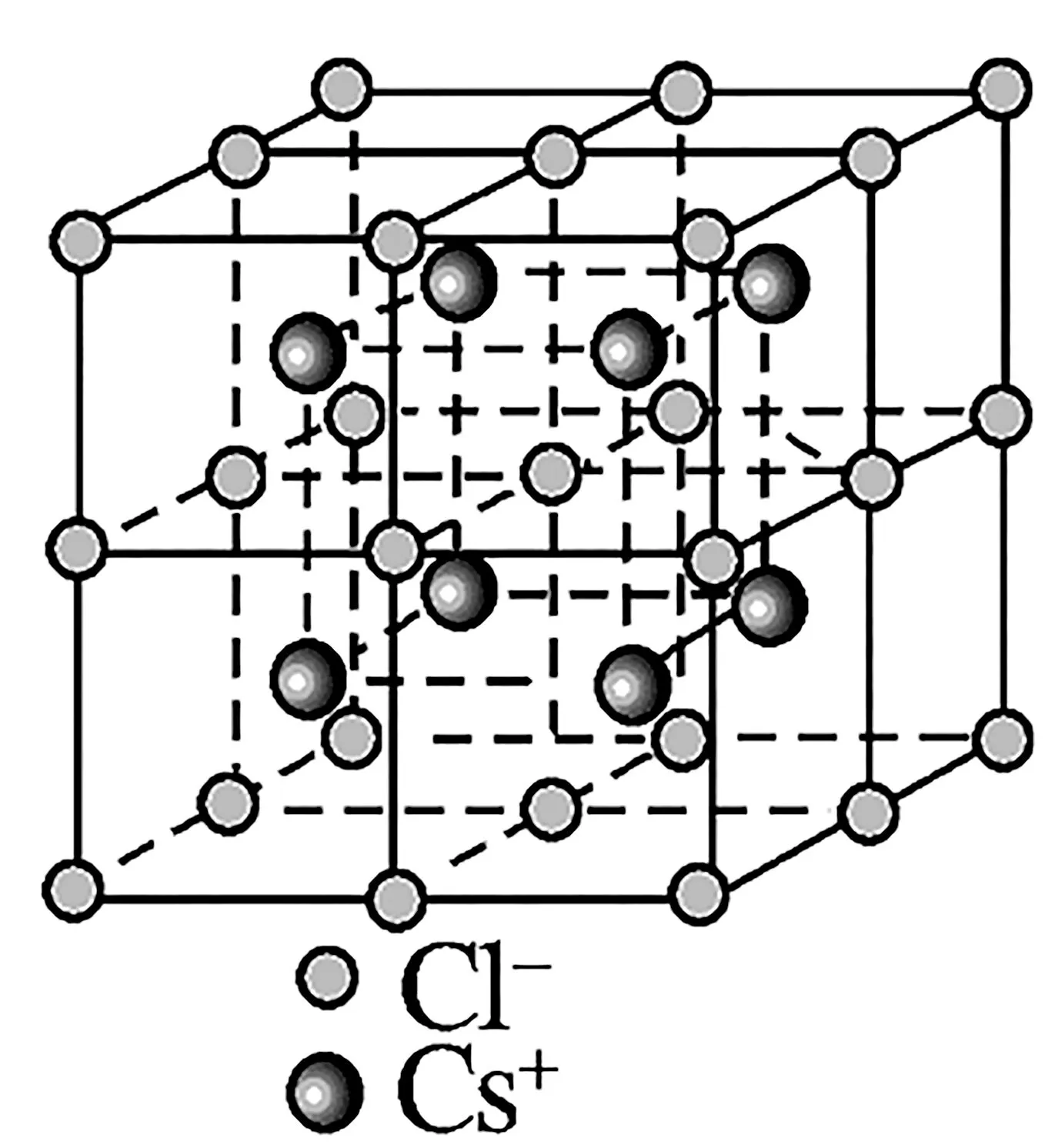
图3
结构特点:
(1)两种离子在晶胞中的位置:一种占8个顶点,另一种占体心。
(2)每个Cs+(Cl-)周围紧邻的Cl-(Cs+)有8个,即配位数为8。
(3)每个Cs+(Cl-)周围紧邻的Cs+(Cl-)有6个,构成正八面体。
(4)每个晶胞中含1个Cs+和1个Cl-,相当于1个CsCl。
(5)晶胞的体对角线与两离子半径有关,晶胞边长a与阴阳离子半径r的关系为=2r(Cs+)+2r(Cl-)。
3.CaF2型晶体结构(如图4)。
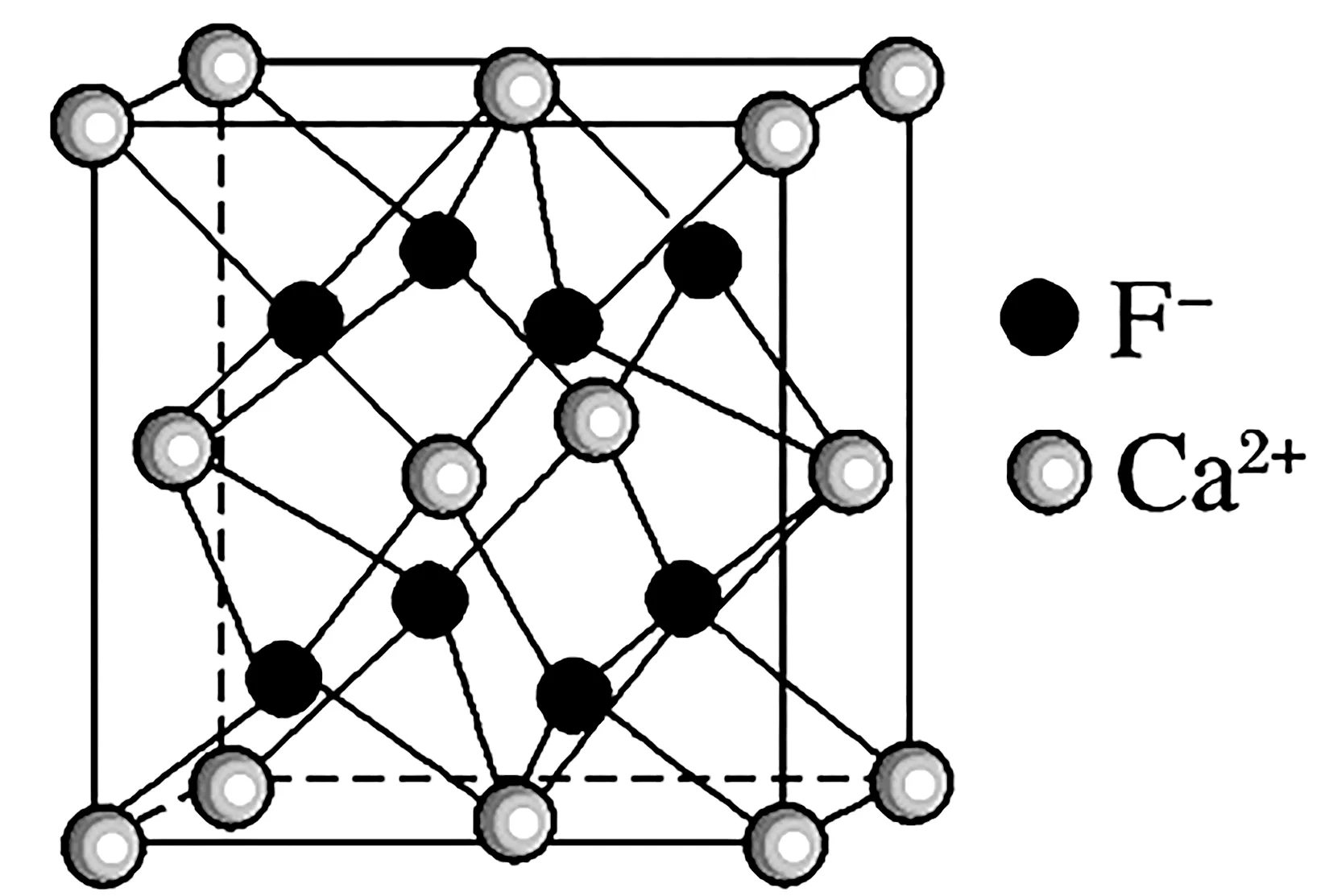
图4
结构特点:
(1)两离子在晶胞中的位置:Ca2+占顶点、面心,F-体内。
(2)每个Ca2+周围紧邻的F-有8个,即配位数为8。
(3)每个F-周围紧邻的Ca2+有4个,即配位数为4。
(4)每个晶胞中含8个F-和4个Ca2+,相当于2 个CaF2。
(5)晶胞的体对角线与两离子半径有关,晶胞边长a与阴阳离子半径r的关系为a=2{[2r(Ca2+)+2r(F-}。
例4(1)从NaCl或CsCl晶体结构中分割出来的部分结构如图5所示,其中属于从NaCl晶体中分割出来的结构图为____。

图5
A.图a和图c B.图b和图c
C.图a和图d D.只有图图d
(2)在冰晶石(Na3[AlF6])晶胞中,[AlF6]3-占据的位置相当于NaCl晶胞中Cl-占据的位置,则冰晶石晶胞中含Na+个数为_____。
A.12 B.4 C.8 D.3
解析:(1)本题考查了离子晶体的代表物质NaCl、CsCl晶体结构,由于NaCl晶体是简单立方体结构,每个Na+周围有6个Cl-,每个Cl-周围有6个Na+;与每个Na+紧邻的Cl-有6个,且构成正八面体,同理,与每个Cl-紧邻的6个Na+也构成正八面体,即配位数为6,从配位数上去分析,可知图a和图d是属于NaCl晶体的。
(2)一个NaCl晶胞中所含Cl-个数为4,由题意知,冰晶石晶胞中[AlF6]3-也应为4,又因为化学式Na3[AlF6]中Na+和[AlF6]3-的个数比为3∶1,所以冰晶石晶胞中含Na+个数为4×3=12。
答案:B A
三、晶体结构计算的考查
晶胞计算是考查晶体的重要知识点之一,也是考查考生分析问题、解决问题的能力。晶体结构的计算中常涉及如下数据:晶体密度、NA、M、晶体体积、微粒间距离、微粒半径等。解决这类题,既要熟悉常见晶体的结构特征,又要有扎实的立体几何知识,同时还要掌握晶体“均摊法”的原理,常见晶胞模型的均摊法归纳如下:
1.晶体化学式的求法——均摊法。
(1)平行六面体或立方体晶胞中:①处于顶点上的粒子被8个晶胞共用,晶胞占有该粒子的;②处于棱上的粒子被4个晶胞共用,晶胞占有该粒子的;③处于面心上的粒子被2个晶胞共用,晶胞占有该粒子的;④处于晶胞内部的粒子,晶胞完全占有该粒子。(2)直六棱柱晶胞中:①处于顶点上的粒子被6个晶胞共用,晶胞占有该粒子的;②处于水平棱上的粒子被4个晶胞共用,晶胞占有该粒子的;③处于竖直棱上的粒子被3个晶胞共用,晶胞占有该粒子的;④处于面心上的粒子被2个晶胞共用,晶胞占有该粒子的;⑤处于晶胞内部的粒子,晶胞完全占有该粒子。
(3)直三棱柱晶胞中:①处于顶点上的粒子被12个晶胞共用,晶胞占有该粒子的;②处于水平棱上的粒子被4个晶胞共用,晶胞占有该粒子的;③处于竖直棱上的粒子被6个晶胞共用,晶胞占有该粒子的;④处于面心上的粒子被2个晶胞共用,晶胞占有该粒子的;⑤处于晶胞内部的粒子,晶胞完全占有该粒子。
2.寻找有关晶胞各物理量的关系并计算。
对于立方晶胞,晶体密度、NA、M、晶体体积、微粒间距离、微粒半径等,通常可用下面的公式进行各物理量的计算:a3×ρ×NA=n×M,a表示晶胞的棱长 ,ρ表示密度,NA表示阿伏加德罗常数,n表示1 mol晶胞中所 含晶体的物质的量,M表示相对分子质量,a3×ρ×NA表示1 mol晶胞的质量,其相互转化关系如下:
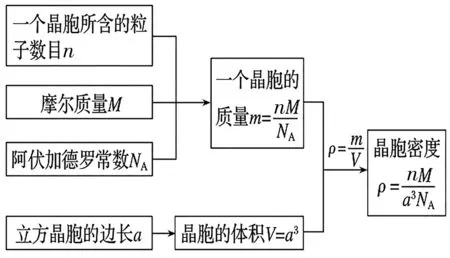
例5图6是氯化铯晶体的晶胞,已知晶体中两个最近的Cs+离子核间距离为a cm,氯化铯的相对分子质量为M,NA为阿伏加德罗常数,则氯化铯晶体密度是( )。
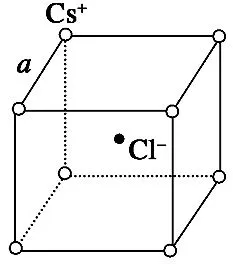
图6

解析:处于顶角的离子同时为8个晶胞所共有,每个离子有属于该晶胞,处于晶胞体内的离子,全部属于晶胞,可知1个氯化铯晶胞拥有1个Cs+和1个Cl-。则1 mol 氯化铯的体积为NAa3cm3,故氯化铯晶体的密度为g·cm-3。
答案:A
3.确定原子坐标参数。
确定原子坐标参数,即表示晶胞内部各原子的相对位置。
例6钴的一种化合物的晶胞结构如图7所示,已知A点的原子坐标参数为(0,0,0),B点为下列说法中错误的是( )。
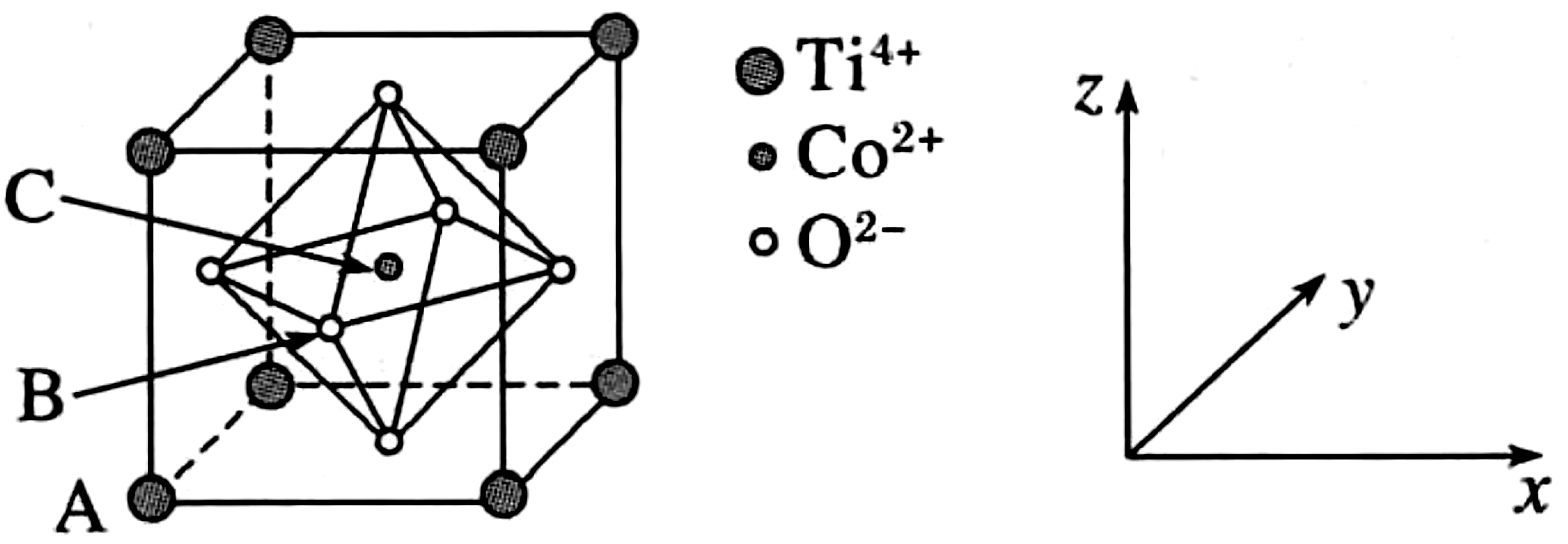
图7
A.配合物中Co2+价电子排布式为3d7
B.距离Co2+最近且等距的O2-的数目为6
D.该物质的化学式为TiCoO3
解析:由于钴原子的价电子排布式为3d74s2,所以Co2+离子的价电子排布式为3d7,A项正确。由晶胞结构知,Co2+紧邻的O2构成正八面体,其数目为6,B项正确。由于A点的原子坐标参数为(0,0,0),B点为可知,晶胞的边长为1,C点则位于体心,其原子坐标参数为,C项错误。由晶胞结构可知,晶胞中顶点的Ti4+离子的个数为=1,体心上的Co2+离子的个数为1,面心上的O2-离子的个数为3,则该物质的化学式为TiCoO3,D项正确。
答案:C
