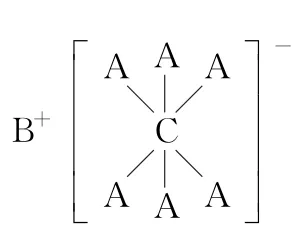
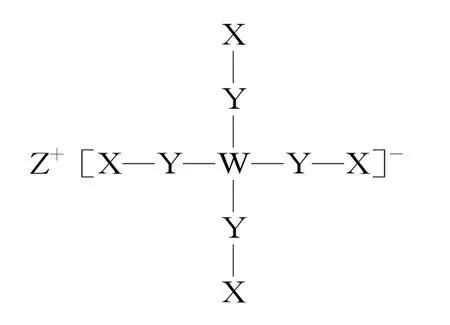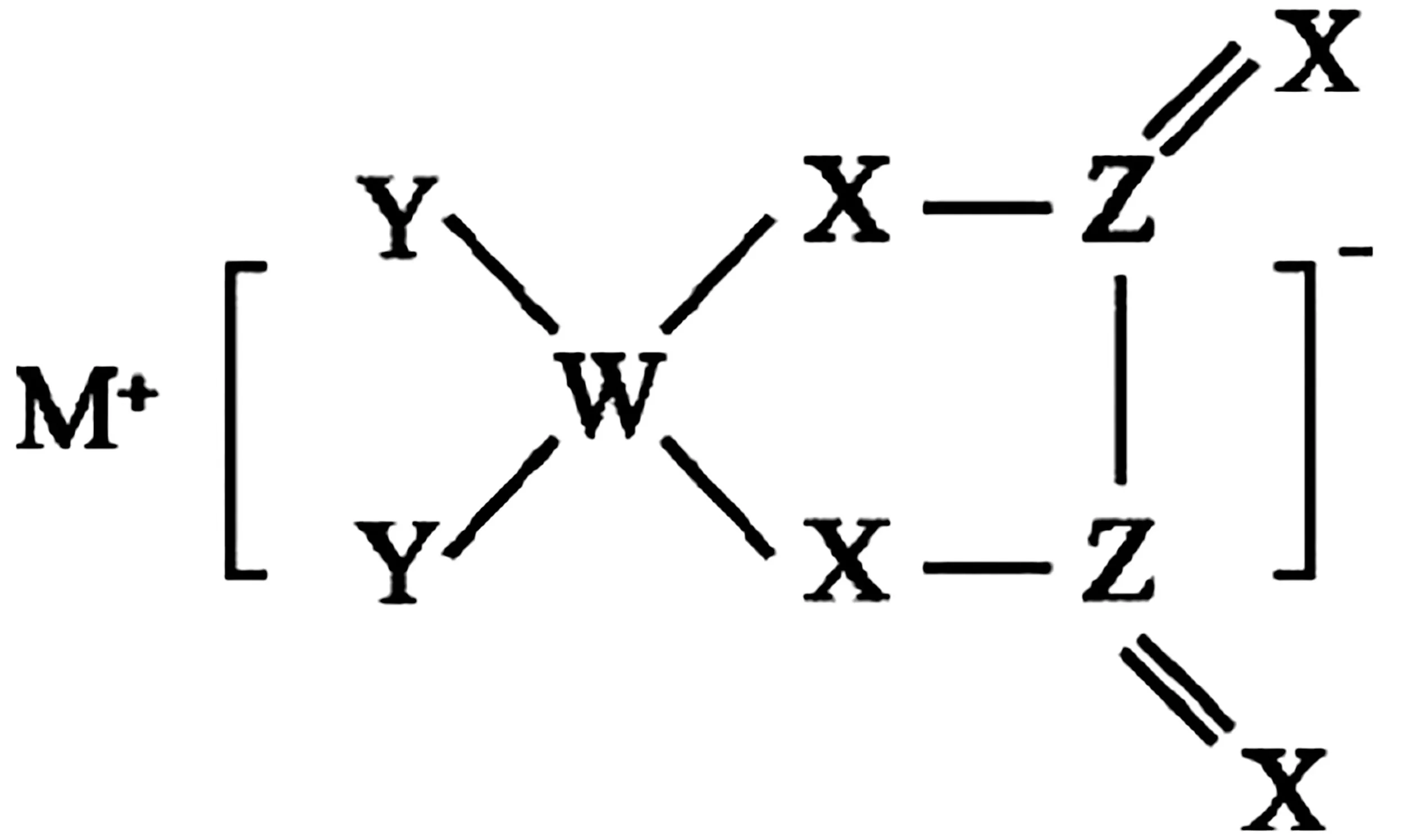追本溯源,构建结构式到元素推断的桥梁
2022-03-15山西省忻州市第一中学校赵锦花
■山西省忻州市第一中学校 赵锦花
元素推断类题目是高考选择题的必考题型,考查形式灵活多变,常考常新。近几年来高考此类题目常以结构式为载体考查元素推断及元素周期律,题目新颖,要求考生对元素的成键方式有深入理解。要解决此类题目,必须通过典型物质来了解元素成键方式的多样性和规律性,追本溯源,挖掘本质。只要推断出元素,考生一般可顺利解答。这就要求考生对前20号元素的电子排布及相关物质的物理、化学性质了然于心,真正建立元素周期表中位、构、性之间的关系。
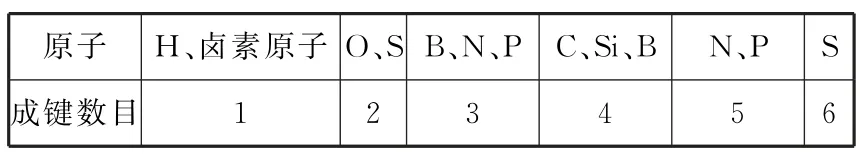
表1 常见元素的成键规律
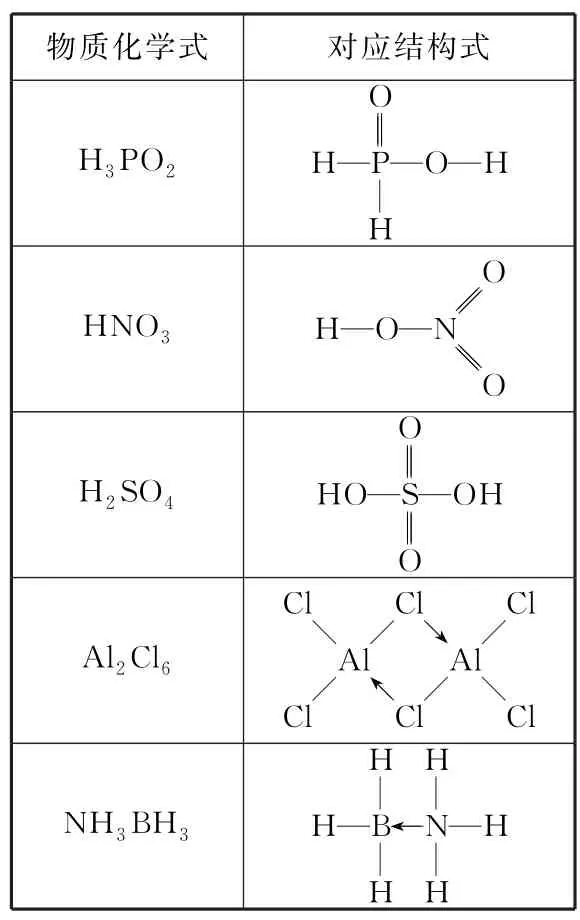
表2 常见物质的结构式举例
值得一提的是,无机化合物成键方式复杂多样,以上只是高中化学中常见的情况,并不能囊括全部成键类型。若要全面解析,还要在大学的无机化学、结构化学部分或者在化学竞赛中进一步学习。现将高考中此类题目常见的两种类型归纳如下。
一、共价化合物
对于共价化合物,只需根据元素成键规律,结合题目信息推断即可。
例1如图1所示的两种化合物可用于阻燃材料和生物材料的合成。其中 W、X、Y、Z为原子序数依次增大的短周期元素,X和 Z 同主族,Y 原子序数为 W 原子价电子数的 3倍。下列说法正确的是( )。
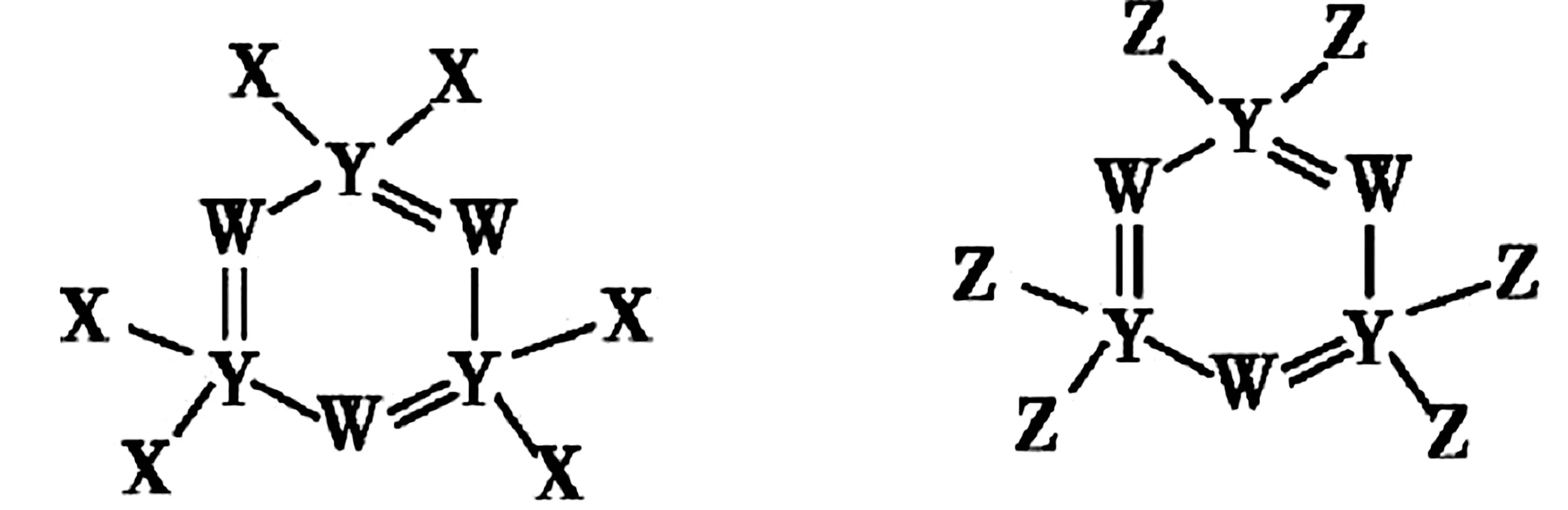
图1
A.X和Z的最高化合价均为+7价
B.HX和HZ在水中均为强酸
C.四种元素中,Y原子半径最小,X原子半径最大
D.Z、W和氢三种元素可形成同时含有离子键和共价键的化合物
解析:由图可知,W均形成3根共价键,X、Z均形成一根共价键,且同主族,结合W、X、Z原子序数依次增大,可知W、X、Z分别为N、F、Cl。Y 原子序数是 W 价电子数的 3倍,故Y为P。F没有正化合价,A项错误。HF是弱酸,B项错误。原子半径P>Cl>N>F,C项错误。Z、W和氢可组成氯化铵,氯化铵同时含共价键和离子键,D项正确。
答案:D
积累:P在此化合物中形成五个共价键。
基础必备:(1)F、O没有最高正价。
(2)常见的六大强酸:硝酸、盐酸、硫酸、高氯酸(HClO4)、氢溴酸(HBr)、HI。
(3)比较微粒半径时,先看层数:一般,层数越多,半径越大,例如r(Na)>r(Li)、r(S2-)>r(O2-)(特例见下页表3,Li位于第二周期,但原子半径大于第三周期的Al、Si、P、S、Cl。高中范围的考题一般不会考查特殊情况微粒半径的比较;稀有气体元素的原子半径测定与相邻非金属元素的测定依据不同,没有可比性,也不做比较)。层数相同时,再看核电荷数:核电荷数越大,微粒半径越小。以上方法适用于各种微粒间的比较。如r(O2-)>r(F-)>r(Na+)>r(Mg2+)。
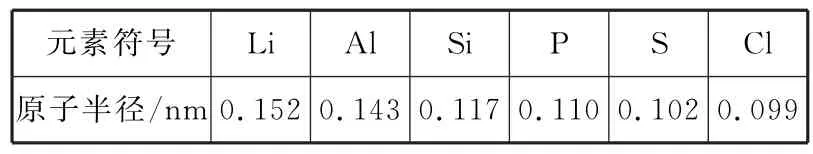
表3 元素原子半径特殊情况举例
(4)化学键类型判断方法:一般,活泼金属(ⅠA、ⅡA族元素)与活泼非金属(Ⅵ、Ⅶ族元素)形成的化合物含离子键,是离子化合物(注意:AlCl3、BeCl2是共价化合物);非金属元素间形成的化合物一般是共价化合物,含共价键(注意:铵盐如NH4Cl、NH4NO3等由非金属组成,但是是离子化合物)。
例2一种测乳制品中脂肪酸含量的试剂结构如图2所示。W、X、Y、Z、M为原子序数依次增大的短周期主族非金属元素,其中原子的核电荷数存在关系:Y+Z=X+M=14。下列说法正确的是( )。
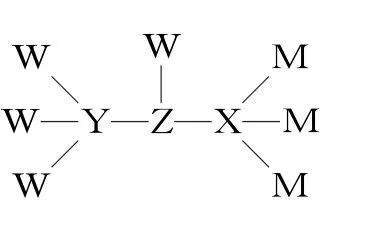
图2
A.最高价氧化物对应水化物的酸性:X>Y
B.该化合物中所有原子均满足最外层8e-稳定结构
C.常温下,M的单质能够从Z的简单氢化物中置换出Z的单质
D.Y2W6和W2Z2均能使酸性高锰酸钾溶液褪色
解析:由W、X、Y、Z、M为原子序数依次增大的短周期主族非金属元素,核电荷数X+M=14,结合图中X、M分别形成4个、1个共价键,可知M为F,则X为硼。由Y形成四个共价键,可知Y为C,结合核电荷数Y+Z=14可知Z为O。W原子序数最小且形成一个共价键,则W为氢。由元素周期律可知非金属性硼<碳,则酸性H3BO3 答案:C 点评:该题中多数考生结合成键规律能判断出W是H,M是F。定式思维在于:发现X、Y均形成四个共价键,则认为二者分别是C、Si;Z形成三个共价键则认为Z是N;但发现结论与题目所给信息“核电荷数为Y+Z=X+M=14”存在矛盾后,从而陷入了自我怀疑,进而无法准确推断。因此要特别注意B、Al元素形成配位键的情况。 基础必备:(1)H3BO3是一元弱酸,水溶液中存在:H3BO3+H2OB(OH)-4+H+。 (2)2F2+2H2O4HF+O2,2Na+2H2O2NaOH+H2。 离子化合物中阳离子一般考虑是活泼金属形成的,阴离子需要考虑是哪个元素得电子,再结合题目信息推断。 例3某化合物的结构如图3,其中X、Y、Z、W四种元素分布在三个短周期,原子序数依次增大,且Y、Z、W的简单离子具有相同的电子层结构。下列叙述不正确的是( )。 图3 A.简单离子半径:Y>Z>W B.最高价氧化物对应水化物的碱性:Z>W C.该化合物的水溶液呈中性 D.X与Y形成的化合物可与X与Z形成的化合物发生反应 解析:由X、Y、Z、W分别在三个短周期,原子序数依次增大,可知X为H,Z形成Z+故Z为Na。Y形成两个共价键,是O。由图可知W得了一个电子形成四个键,结合Y、Z、W的简单离子具有相同的电子层结构,可知W是Al。X、Y、Z、W分别是H、O、Na、Al。离子半径大小顺序为O2->Na+>Al3+,故A项正确。金属性Na强于Al,所以碱性NaOH>Al(OH)3,故B项正确。该化合物是Na[Al(OH)4],水溶液呈碱性,故C项错误。H2O+NaHNaOH+H2,故D项正确。 答案:C 积累:该题中的化合物是Na[Al(OH)4],W是Al,形成四个共价键。 点评:该题考查了盐类的水解,将水溶液中的离子平衡和元素推断有机结合在了一起。还考查了NaH与水的反应。 基础必备:金属性判断依据:单质与水或酸反应置换出H2的难易程度;最高价氧化物对应水化物的碱性强弱;置换反应(注意:Na能与水剧烈反应,不能从水溶液中置换出其他金属);对应阳离子的氧化性。 例4M、W、X、Y、Z是同周期主族元素,X原子的最外层电子数是W原子次外层电子数的3倍。它们形成的化合物可用作新型电池的电极材料,结构如图4所示。下列说法正确的是( )。 图4 A.M的单质通常保存在煤油中 B.图中阴离子中所有原子均满足8电子稳定结构 C.Z的氢化物的沸点一定低于X氢化物的沸点 D.Y是其同周期元素中第一电离能最大的元素 解析:X原子的最外层电子数是W原子次外层电子数的3倍,说明W原子次外层电子数为2,则M、W、X、Y、Z都是第二周期主族元素且X为O。由M形成M+,可知M为Li。Y、Z分别形成一根、四根共价键,则分别为F、C。据此判断是一个W得到一个电子,则W为B。则M、W、X、Y、Z分别为Li、B、O、F、C。Li密度比煤油小,应保存在石蜡油中,A项错误。阴离子中,F、B、O、C均满足8电子稳定结构,B项正确。碳的氢化物即烃,随碳数的增加可能为气态、液态、固态,沸点不一定低于H2O或H2O2,C项错误。第二周期电离能最大的是Ne,D项错误。 答案:B 积累:该化合物中W是硼,形成四根共价键。 基础必备:(1)熟记常见物质的保存方法,如碱金属中Li密度小,保存在石蜡油中,其余碱金属可保存在煤油中;液溴保存时要用水封,防止挥发;白磷放置在冷水中保存。 (2)注意碳的氢化物是烃,不要固定思维认为是CH4。 (3)同一周期中,稀有气体元素电离能最大;F是周期表中电负性最大的元素(高中课本未列出稀有气体电负性数值,无特殊信息时无须考虑)。 (4)共价化合物8电子稳定结构的判断:H元素肯定不满足8电子;其他原子若最外层电子数+共价键数=8,则满足8电子。 例5短周期元素A、B、C、D原子序数依次增大,A、D同主族,且其中三种元素组成的某种离子液体的结构式如图5,下列说法正确的是( )。 图5 A.C元素位于ⅥA族 B.D的单质具有漂白性 C.含氧酸的酸性:D>C D.A、B、C与氧元素形成的化合物中,氧元素的化合价可能均不相同 解析:由A、B、C、D原子序数依次增大且A都形成一根共价键可知,A可能是H或F,B可能是Li或Na。因此是C得到一个电子形成六根键,是N或者P。D原子序数最大,且与A同主族,可能是Na或Cl,整体推断可知A、B、C、D分别是F、Na、P、Cl,该结构代表NaPF6。氟位于ⅦA族,A项错误。Cl2本身没有漂白性,氯水中是含有HClO而有漂白性,B项错误。非金属性D>C,最高价氧化物对应水化物的酸性HClO4>H3PO4,但是该题未指明是最高价含氧酸,而Cl、P均有多种含氧酸, 无法比较, C项错误。OF2中O为+2价,P2O5中O为-2价,Na2O2中O为-1价,均不相同,D项正确。 答案:D 积累:该化合物中P得到一个电子形成六根键。 基础必备:(1)常见的漂白性物质:氯水、Na2O2、H2O2、O3(氧化性漂白)、SO2(化合漂白)、活性炭(吸附漂白)。 (2)非金属性强弱判断依据:最高价氧化物对应水化物的酸性强弱(如Cl、S元素分别对应HClO4、H2SO4,由HClO4是最强的含氧酸可知非金属性Cl>S);单质与H2化合的剧烈程度以及对应气态氢化物的稳定性(如非金属性按F、Cl、Br、I的顺序依次减小,则稳定性也是按HF、HCl、HBr、HI依次减小);对应阴离子的还原性;置换反应(注意:F2能与水剧烈反应,不能置换更弱的非金属性单质如Cl2、Br2等)。二、离子化合物