禽干扰素在免疫应答中的研究进展
2022-03-14范文辉赵启祖刘文军
王 萌,范文辉,李 翠,赵启祖,刘文军,李 晶
(1.中国科学院微生物研究所 病原微生物与免疫学重点实验室,北京 100101;2.中国科学院大学,北京 100049;3.中国兽医药品监察所,北京 100081)
干扰素(interferon,IFN)是1957年由Isasc和Linderman发现并于1978年纯化出来的一类抗病毒细胞因子[1]。当禽类受到病毒刺激时,禽干扰素由体细胞、巨噬细胞、淋巴细胞产生,具有免疫调节、抗病毒、抗肿瘤等多种生物学功能。黏膜是外界与机体内环境的分界屏障,多数病原微生物通过黏膜进入宿主。当病原体侵染黏膜细胞时,细胞上模式识别受体(pattern recognition receptors,PRRs)识别病原,诱导干扰素的产生。干扰素介导干扰素刺激基因(interferon stimulated gene,ISGs)的活化、调控一系列细胞因子的表达并且诱导接收干扰素信号的细胞呈抗病毒状态,形成一个有效的天然防御机制[2]。越来越多的研究证明,禽干扰素对由病毒引起的流行性疾病有良好的抑制作用,但由于研究数据不充足等原因并没有广泛的应用于市场。
禽类传染病每年给我国养殖业造成巨大的经济损失,目前禽类传染病预防疫苗种类繁多,但是并不能高效的预防禽类传染病的暴发,因此,亟需研发高效且安全的预防禽类传染病的免疫用药。相对于传统免疫方式,黏膜免疫由于其经济性及便于操作性越来越受到人们的重视,黏膜抗原的接种不仅可以增强局部免疫还可以增强系统免疫[3]。有研究表明,用灭活毒疫苗通过鼻内途径给药,其免疫原性较差[4],需要结合佐剂来增强疫苗的免疫原性,因此开发有效且经济的黏膜免疫佐剂也是禽类市场迫切需要的。
1 禽干扰素的产生及分类
根据基因、结构、功能特点及同源受体的不同,IFN分为三个型,分别为IFN Ⅰ型、IFN Ⅱ型、IFN Ⅲ型[5-6]。当病原体入侵机体黏膜细胞时,细胞的PRRs对病原核酸进行识别,活化下游信号通路,诱导IFN的产生。
1.1 禽干扰素的产生 几乎所有类型的细胞都能产生IFN,但有一种细胞可以产生大量的特异性IFN,并且是自然杀伤细胞(nature killer cell,NK)介导的清除感染细胞过程所必需,该细胞被命名为天然分泌干扰素细胞,目前常被称为浆细胞样树突状细胞(plasmacytoid DCs,pDC)。活化干扰素信号通路主要是依赖于PRRs,其中有三种核酸受体,第一种PRRs是维甲酸诱导基因样解旋酶家族(retinoic acid-inducible gene Ι-like helicase,RLH),包括视黄酸诱导基因蛋白Ⅰ(retinoic acid-inducible gene Ⅰ,RIG-Ⅰ)、肿瘤分化相关基因(melanoma differentiation associated gene 5,MDA5)等;第二种PRRs是toll样受体(toll-like receptors,TLR)家族,包括TLR3、TLR7、TLR9,可识别胞外、吞噬体及内涵体中的病原相关分子模式(pathogen-associated molecular patterns,PAMP);第三种是DNA感应器[7]。
禽干扰素(chicken interferon,ChIFN)的信号通路与哺乳动物IFN的信号通路相似,但是一些关键的信号元件在进化上仍有较大的差异,许多关键的免疫基因在鸡的细胞中缺失,如RIG-I、TLR8、TLR9、干扰素调节因子(interferon-regulated factor,IRF3)等[8-9]。这些关键基因的缺失,预示着禽类有其他基因或成分来代替这些缺失基因的功能。RLH是一种胞浆PRRs可以识别病毒RNA,从而激活天然免疫反应。在哺乳动物中RLH和MDA5/RIG-Ⅰ可以通过MAVS激活IRF3与NF-κB从而诱导干扰素与炎症因子的表达。鸡中缺少RIG-I,禽MDA5可以通过构建MDA5-干扰素基因刺激物(stimulator of interferon genes,STING)-IFN β信号通路填补RIG-I的缺失[10]。鸡中缺少IRF3,而鸡的IRF7与IRF3最为接近,即MDA5感应胞内病毒基因信号从而活化MAVs,MAVs活化STING,STING活化IRF7与NF-κB,这两个转录因子入核,诱导IFN的产生。
总之,ChIFN产生的信号通路与哺乳动物相似但仍存在差异,ChIFN产生相关的信号通路仍有很多研究留白,需要进一步研究探索。
1.2 禽干扰素的分类 与哺乳动物相似,ChIFN亦分为三种类型。三种ChIFN在进化上相差较大,彼此之间缺少序列同源性。与ChIFN Ⅱ相比,尽管ChIFN Ⅰ与ChIFN Ⅲ存在信号与功能上的同源性,但是ChIFN Ⅰ与ChIFN Ⅱ之间关系更为密切。
研究表明ChIFN与哺乳动物IFN在结构、功能以及进化上都有一定的相关性,提示ChIFN与哺乳动物IFN可能有共同的祖先,但是两者存在较大的差异。在人类中至少有13种编码功能性蛋白的IFNα基因和单一的IFN β、IFN ω、IFN κ、IFN ε基因,而ChIFN Ⅰ位于性染色体上并且鸡中只有12种编码IFN α基因和单一的IFN β、IFN κ基因[11]。
ChIFN γ由169个氨基酸组成,包括19个氨基酸信号区段,分泌蛋白有145个氨基酸,约为16.9 Da[12]。ChIFN γ存在于一号染色体上,与哺乳动物IFN γ同源性达30%以上,ChIFN γ的功能结构域与哺乳动物IFN的同源性达50%以上,说明IFN γ的功能域相对保守。
目前对ChIFN的研究,主要针对鸡和鸭两个物种。 ChIFN λ与鸭IFN λ分别于2008年与2014年被科学家发现并报道[13]。现已在人类基因组上发现至少四种IFN λ,但是在鸡上只有一种功能保守的ChIFN λ,其与哺乳动物IFN λ2序列相似性较高[14-15]。
2 禽干扰素的功能
细胞因子受体家族由12种不同的受体组成,这些受体由IFN介导发挥生物学功能。IFN被认为是免疫反应的重要调节介质,ChIFN与其特异性受体结合触发下游信号通路从而发挥相应的生物学作用。ChIFNⅠ与ChIFNⅢ有相似的信号通路,通过Janus激酶1(Janus kinase,JAK1)与蛋白质酪氨酸磷酸激酶2(tyrosine kinase 2,Tyk2)磷酸化激活Janus激酶信号转导与转录激活因子(Janus kinase-single transducer and activator of transcription,JAK-STAT)通路,招募并磷酸化STAT1与STAT2,从而形成STAT1/STAT2二聚体,该二聚体从受体上脱落并与IRF9结合形成干扰素刺激基因因子3(interferonstimulated gene factor 3,ISGF3)复合体,入核并与干扰素刺激应答元件(interferon-stimulated response elements,ISREs)结合从而活化一系列干扰素刺激基因(interferon stimulated gene,ISGs)表达。ChIFN Ⅱ主要通过JAK1与JAK2激酶,招募并磷酸化STAT1,使其形成同源二聚体,从而激活相关基因的转录。
2.1 禽Ⅰ型干扰素作用 IFNⅠ的受体为IFNAR1与IFNAR2组成的异二聚体,其受体在机体内普遍表达。ChIFN α与ChIFN β有相同的受体,并且都依赖ISGs来发挥抗病毒作用,但是ChIFN α的抗病毒作用较ChIFN β强并且ChIFN α可以激活T细胞依赖的淋巴系统[16-17]。其中一些ISGs在哺乳动物中研究较多,Mx是一种GTPase,哺乳动物有两种Mx蛋白,分别是Mx A与Mx B,两者都有抗病毒的活性。不同于哺乳动物,鸡只有一种Mx蛋白,研究发现其抗病毒活性与631位的氨基酸有关[18]。PKR其以非活性形式存在细胞内,是检测非胞内双链RNA的感应器。2′-5′-OAS是一种干扰素诱导酶,被双链RNA激活,利用ATP合成2′-5′-寡聚腺苷酸,可以导致病毒RNA转录本的断裂,从而抑制病毒的表达。在鸡中有两种编码OAS的等位基因,分别为OAS-A、OAS-B,其中OAS-A表达频率较OAS-B高,并且OAS-A合成 2′-5′-寡聚腺苷酸的活性较OAS-B高[19]。

表1 禽干扰素的产生细胞及免疫功能Table 1 Original cells and immune function of avian interferon
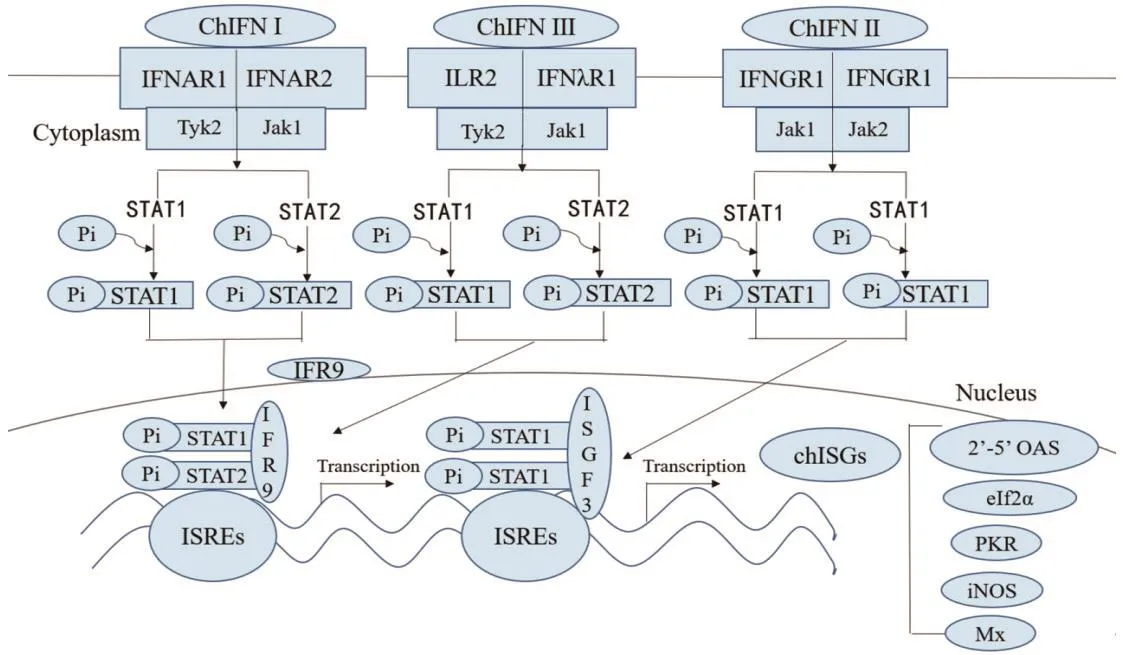
图1 禽干扰素作用机制的细胞模式图Fig.1 Cellular model of Avian inte rferon function
IFNⅠ可以促进DC的成熟及CD4+细胞分化为Th1与Th2细胞。研究表明经IFNⅠ处理的抗原呈递细胞(antigen-presenting cells,APC)可以交叉反应并且刺激天然CD8+细胞,导致T细胞克隆性扩增。IFN可以促进DC表达趋化因子,从而募集NK细胞、T细胞和B细胞到感染区,并且可以诱导IL15的表达,IL15对CD8+记忆细胞及NK细胞的维持十分重要[20]。IFNⅠ在天然免疫的抗病毒防御中发挥重要的作用,并且在黏膜免疫中通过调节细胞因子的表达,促进适应性免疫应答的活化。IFNⅠ与DC互作,使其成为连接天然免疫与适应性免疫的桥梁。
2.2 禽二型干扰素作用 IFN Ⅱ的受体为IFNG1与IFNG2形成的异二聚体,ChIFN γ与哺乳动物IFN γ有相似的作用。在鸟类中,IFN γ是巨噬细胞主要的调控器[21]。ChIFN γ可以抑制病毒的复制[22],通过抑制Th2细胞因子(IL4、IL10)的产生,促进Th1的应答[23]。ChIFN γ可以诱导主要组织复合物Ⅰ(major histocompatibility complex Ⅰ,MHC-Ⅰ)和主要组织复合物Ⅱ(major histocompatibility complex Ⅱ,MHC-Ⅱ)的表达,它增强了加工呈递抗原作用以及对细胞内病原体的破坏作用[24]。ChIFN γ可以上调许多基因的表达,其中包括诱导型一氧化氮合酶(inducible nitric oxide synthase,iNOS)。iNOS经过免疫刺激后在巨噬细胞中被激活,产生大量的一氧化氮,这是炎症反应的重要介质之一[25-26]。IFN γ可以增加巨噬细胞抗原呈递作用以及MHC-Ⅰ的表达,促进NK细胞的活化和迁移所需的白细胞的粘附与结合作用[27]。因此ChIFN γ在机体中主要起免疫调节作用。
2.3 禽三型干扰素作用 IFN Ⅲ的受体为IFN λR1与IL R2形成的异二聚体,ChIFN Ⅲ的受体IFN λR1主要表达于富含上皮细胞的组织中,如表皮、肺、胃肠道上皮细胞等,因此与IFNⅠ相比,IFNⅢ的功能范围更有局限性[28]。ChIFN λ与哺乳动物IFN λ在功能上是较为保守的,在表皮屏障抗病毒防御上起主导作用。ChIFN λ与ChIFN γ不同,其在非表皮细胞中诱导出较低水平的CO。
IFN λ可以通过上调细胞表面的MHC-Ⅰ类分子的表达水平,促进免疫系统对病毒感染的识别和破坏,并通过诱导病毒感染细胞的凋亡来抑制病毒的持续感染。有研究显示IFN Ⅲ在呼吸道中主要参与保护机体免受病毒的入侵,并且在局部抗病毒天然免疫中发挥作用[29-30]。与哺乳动物相似,ChIFN λ发挥抗病毒作用并且主要在上皮组织中发挥作用。有研究表明,ChIFN λ可以在原代的胚胎气管,以及鸡肺细胞系上抑制流感病毒的复制[31]。早期数据显示,虽然IFN λ激活的信号通路与IFN α相似,但是他们的瞬时激活与诱导的抗病毒反应是有差异的[32]。有报道称,在人源细胞上IFN可以持续激活STAT1与STAT2,从而持续增加ISGs的表达,与人IFN相似,ChIFN加对信号转导因子的活化时间也较ChIFN Ⅰ长,提示ChIFN N抗病毒作用可能较ChIFN能更为长效[33]。
ChIFN Ⅲ在上皮组织上发挥着抗病毒作用,因此ChIFN Ⅲ可能对抵御病毒入侵呼吸道、消化道等组织有一定的作用,并且与黏膜免疫关系更加密切。
3 禽干扰素的应用
3.1 禽Ⅰ型干扰素的应用 IFN α是连接天然免疫与适应性免疫的重要细胞因子,在临床上已应用较长时间,是一种有效的抗病毒与抗肿瘤的免疫佐剂,现在应用于肿瘤患者与抗感染病药物中。ChIFNⅠ家族中ChIFN α与ChIFN β均有一定的抗病毒作用,我们前期研究了细胞水平上两者抗病毒作用的差异,发现ChIFN α可以更好地促进与抗病毒相关的ISG表达。同时,在不同细胞系上针对不同的病毒进行抗病毒试验,试验结果均显示ChIFN α抗病毒活性较ChIFN β高[34]。随后,我们也发现短期重复口服ChIFN α可以上调免疫器官中的炎性因子表达,并且在攻毒试验中显示ChIFN α作为黏膜免疫佐剂可降低实验动物咽喉部的病毒载量,说明短期重复口服ChIFN α可以抑制低致病性流感病毒的复制[35]。另外,研究表明口服ChIFN α在7日龄与33日龄的SPF鸡体内均表现出显著的抗病毒效果,在7日龄SPF鸡试验组中对于H9N2亚型流感病毒的治疗效果好于防御效果,而33日龄SPF鸡则相反[36]。这些研究成果均为ChIFN α作为黏膜免疫佐剂防御流感病毒提供了理论依据。
在给药途径的研究中发现,ChIFN Ⅰ受体存在于消化器官上并且口服ChIFN后,消化器官中IFNR1基因表达量明显增加[37]。通过饮水的给药方式将ChIFN给予自然感染禽流感病毒的禽类,会降低流感病毒刺激适应性免疫应答的抗原阈值,以激活对低致病性禽流感病毒的适应性免疫[38],结果显示口服ChIFN是可行的免疫途径。
3.2 禽二型干扰素的应用 有研究证明IFN γ作为佐剂可以提高疫苗的效价。在给予鸡与火鸡ChIFN γ与重组鸡痘病毒后,抗体与细胞内的反应及对新城疫病毒攻击的保护作用均有所增加[39-40]。鸡球虫病是由艾美尔球虫寄生于肠上皮细胞引起的疾病,有研究表明,重组ChIFN γ的DNA疫苗较单独表达艾美尔球虫蛋白cSZ抗体的DNA疫苗对鸡球虫病有更好的保护作用[41]。
另外,ChIFN α在临床上已有初步的探索,ChIFN γ作为DNA疫苗的免疫佐剂有良好的应用前景,但是仍需研究数据的支持。ChIFN λ作为新型ChIFN,目前还没有应用于市场,但就其生物功能的多样性、受体表达的特异性、与黏膜免疫关系的密切性,ChIFN λ作为黏膜免疫佐剂有十分良好的应用前景,因此对其进行动物试验的深入研究及临床研究是十分必要的。
4 展望
目前禽类传染病的防治仍以疫苗为主,主要以白油为佐剂,通过注射的方式进行免疫。使用疫苗的同时,也随同使用抗生素。抗生素的滥用对动物自身及环境造成一定的破坏,疫苗中白油的使用影响了禽类肉质的质量,传统的注射免疫不仅对动物自身造成应激还带来了传播传染病的风险。
黏膜免疫主要是通过滴鼻、饮水等方式进行给药。在集约化养殖中,黏膜免疫可以减少注射免疫带来的副作用,并且黏膜免疫操作方便、经济、节约人力、可控性强,这些优势使得黏膜免疫有望成为新兴的免疫方式,广泛应用于市场。但是黏膜环境复杂,消化道存在许多会降解抗原的酶,呼吸道的上皮粘液与鼻腔纤毛的摆动也会影响黏膜免疫疫苗中抗原的活性,因此黏膜免疫疫苗需要合适的佐剂来抵抗这些因素。
目前黏膜免疫佐剂有减毒的细菌毒素、CpG等,细菌毒素由于其毒性过大限制了其作为黏膜免疫的佐剂应用于市场;CpG作为免疫佐剂虽然有诱导前炎性因子、趋化因子的表达及促进细胞毒性T细胞活化等[42]优点,但是由于其成本较高,并不适于市场应用。ChIFN可以产生抗病毒基因,并且通过调节细胞因子的表达对黏膜免疫起一定的调控作用,同时ChIFN是机体的天然生物分子,因此不会产生排异等副作用及药物残留等问题,ChIFN可作为黏膜免疫佐剂的优良候选物。
我们前期对不同型的ChIFN进行克隆、表达、纯化后,将ChIFN与灭活的禽流感病毒联用,通过饮水的方式免疫7日龄的SPF鸡,通过检测免疫相关细胞因子的表达水平、抗体的产生情况及攻毒后动物的排毒率来探究ChIFN与灭活的流感病毒联用对鸡黏膜免疫系统的调节及抗病毒作用。研究显示ChIFN α与ChIFN λ对禽流感病毒有一定防治作用。那么,深入分析多种ChIFN联用对黏膜免疫的刺激作用及细胞因子特征是我们日后的研究重点,并利用这些多效性细胞因子通过黏膜免疫方式来预防病毒性感染及炎性疾病的发生。通过基因工程技术生产重组的ChIFN可以使其在养殖场得到大规模的应用,然而对于其中一些关键性技术问题,如提高ChIFN的表达水平、高密度发酵工艺、干扰素活性的提高以及临床应用方法等诸多环节也是我们日后亟待研究解决的关键。
