EHP、SHIV双重TaqMan实时荧光定量PCR检测方法的构建及应用
2022-03-14侯月娥曾俊霞蓝间媛许枣珠廖秀云罗宝正
侯月娥,曾俊霞,蓝间媛,许枣珠,廖秀云,罗宝正
(1.珠海科艺普检测科技有限公司,珠海 51900;2.拱北海关技术中心,珠海 519015)
虾肝肠胞虫(Enterocytozoon hepatopenaei,EHP)是2009年于泰国养殖池塘生长迟缓的斑节对虾(Penaeus monodon)中发现的专门寄生于细胞内的原生生物[1-2]。主要感染凡纳滨对虾(Litopenaeus vannamei)、斑节对虾(Penaeusm onodon)等重要养殖虾类[3],Flegel(2012)报道,EHP在泰国和越南出现白便综合征(white feces syndrome,WFS)的斑节对虾和凡纳滨对虾中有较高的检出率,且严重感染虾肝肠胞虫。对虾血细胞虹彩病毒最早于1993年在靠近厄瓜多尔的对虾养殖场中的原糙对虾(Protrachypene precipua burkenroad)中被发现的,病虾症状活力较差,肝胰腺明显萎缩,肌肉发白,肠道发红、断裂,空肠空胃,鳃、步足及游泳足发黑。2017年,我国第一次在南美白对虾上发现虾血细胞虹彩病毒,根据虾感染该病毒后的临床症状和病理症状,命名为虾血细胞虹彩病毒(Shrimp hemocyte iridovirus,SHIV)[4]。SHIV和EHP是我国对虾养殖过程中的两种新发疫病,前者导致对虾大量的死亡,后者导致对虾生长缓慢,参差不齐,甚至生长停滞,仅偶尔伴随有白便或者在应激条件下才出现大量死亡,所以养殖投入高但收获甚微,给养殖业造成巨大的经济损失。
目前,对虾病害种类较多,诊断手段主要包括病理学和生物学方法、免疫诊断法分子杂交[2,5-6]、电镜观察及PCR技术。已建立的常规PCR技术,灵敏性较高,多为一次检测一种病原,但是其耗时较长,需要进行琼脂糖凝胶电泳,容易对环境造成污染。而双重实时荧光定量PCR不仅可以同时检测两种病原,并且耗时较少,病原核酸添加以后整个过程无需开盖操作,检测结果可以直接呈现在电脑或检测仪器上,灵敏度为普通PCR的100倍,大大提高了检测结果的敏感性和准确性。更利于对病原的早期诊断,便于及时采取有效的防治措施。
1 材料和方法
1.1 试验材料 虾肝肠胞虫(EHP)、SHIV、白斑综合征病毒(White spot syndrome virus,W S S V)、传染性皮下及造血组织坏死病毒(Infectious hypodermal and hematopoietic necrosis virus,IHHNV)、高致病性副溶血弧菌(Vibrio parahaemolyticus,VP)以及桃拉综合征病毒(Tauras syndrome virus,TSV)阳性样品均为本实验室采自珠海南美白对虾患有该病的样品,经PCR检测并测序后确认为阳性。
1.2 主要试剂 病毒DNA/RNA小量制备试剂盒购自广州吉瑞基因科技有限公司;AceQ qPCR Probe Master Mix购自Vazyme公司;琼脂糖凝胶DNA纯化回收试剂盒以及普通质粒小量提取试剂盒均购自Omega。
1.3 双重荧光定量PCR引物和探针的设计 通过对EHP和SHIV所有已知序列利用MegAlign进行同源性分析,确定其保守序列,然后根据EHP(GenBank登录号:FJ496356.1)和SHIV(GenBank登录号:KY681040.1)的保守核酸序列,利用Primer Premier 5.0和Oligo7设计软件设计特异性引物和荧光探针(表1),引物探针由上海辉睿生物科技有限公司合成。
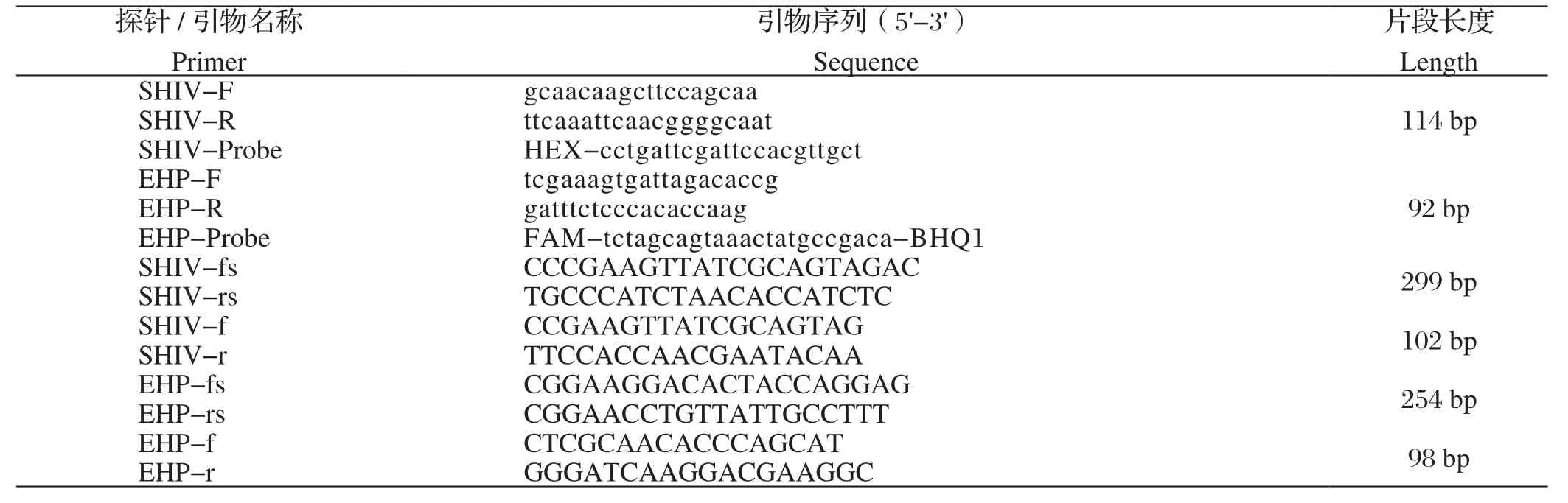
表1 本研究所用引物Table 1 Primers used in this study
1.4 总核酸的提取及模板的制备
1.4.1 组织样品的处理 先在2 mL匀浆管中加入约3粒钢珠,大钢珠1粒(直径4.5 mm),小钢珠2粒(直径2.5 mm);取发病虾组织(肝胰腺、腮、肠道、肌肉)约100 mg病料至管中,加入500 μL PBS;将匀浆管置于组织匀浆器中匀浆1 min,-40℃冻存至少30 min,再放回常温溶解,反复冻融2~3次,每次冻融均置于组织匀浆器匀浆1次;10 000×g离心5 min,取约200 μL上清液于1.5 mL离心管中,编号备用。
1.4.2 核酸提取 依据Mabio病毒DNA/RNA提取试剂盒的说明书操作,阳性对照也需要同时提取的核酸保存于-20℃备检。
1.5 标准品的制备 取1.4.2中提取的总核酸。分别进行SHIV和EHP目的基因扩增。扩增条件:94℃预变性3 min;94℃变性30 s,60℃退火30 s,72℃延伸30 s,共40个循环;72℃延伸8 min。反应结束后,取5 μL PCR反应产物进行琼脂糖凝胶电泳,扩增出SHIV(114 bp)和EHP(92 bp)目的基因。将获得的两种PCR产物琼脂糖凝胶电泳后,切胶回收纯化,分别克隆至pMD18-T载体中,转化到DH5α感受态细胞,筛选阳性克隆重组质粒,送上海辉睿生物科技有限公司测序鉴定。对于鉴定正确的重组质粒,分别命名为pMD-SHIV和pMD-EHP。对阳性质粒进行浓度测定,拷贝数计算,分装于-80℃保存备用。
1.6 实时荧光定量PCR扩增 以提取的SHIV和EHP的核酸DNA为模板,反应体系如下:AceQ qPCR Probe Master Mix 10 μL,将引物SHIV-F、SHIV-R、EHP-F、EHP-R和探针稀释至终浓度为0.1~0.6 μmol/mL,模板DNA为2 μL,无RNase的ddH2O补足20 μL。实时荧光定量PCR扩增程序:95℃预变性3 min;95℃变性10 s,55℃~65℃退火30 s,40个循环,按照不同体系,不同浓度配比,不同的退火温度进行实时荧光定量PCR反应条件优化,筛选出最好的体系、引物、探针浓度及退火温度
1.7 实时荧光定量PCR标准曲线的建立 将1.5制备的SHIV和EHP的DNA标准品做10倍系列稀释,用不同稀释梯度的RNA作为模板,每个梯度的DNA设立3个重复。使用优化的反应体系进行实时荧光定量PCR扩增。荧光定量PCR的反应条件:95℃预变性3 min,95℃变性10 s,退火温度根据1.6摸索出来的最适温度,40个循环,每个循环结束时进行荧光信号采集。
1.8 双重实时荧光定量PCR
1.8.1 敏感性试验 将测定好DNA浓度的模板进行10倍系列稀释,用本研究建立的双重实时荧光定量PCR测定其敏感性。
1.8.2 特异性试验 以提取的SHIV、EHP、IHHNV、WSSV核酸为模板,分别进行PCR扩增,验证其特异性。
1.8.3 稳定性试验 对已知浓度的质粒107copies/μL进行10倍梯度稀释,用已构建的SHIV和EHP双重荧光定量方法进行批次间的重复试验。将上述的同一样品放置1个月,用相同条件对其进行批次间的重复试验。
1.8.4 样品检测试验 选取已知的SHIV和EHP阳性、阴性的样品共37份,用本研究建立的SHIV和EHP双重荧光定量PCR检测方法进行临床检测。
2 结果
2.1 标准品的制备 重组质粒的PCR检测结果显示,SHIV和EHP的扩增产物的大小分别为114 bp和92 bp,与预期大小一致(图1、图2)。测序结果表明,克隆的虾肝肠胞虫目的基因序列、虾血细胞虹彩病毒目的基因序列分别与虾肝肠胞虫参考序列(GenBank登录号:FJ496356.1)、虾血细胞虹彩病毒参考序列(GenBank登录号:KY681040.1)的相似性达100%。证明目的基因被成功插入载体中。
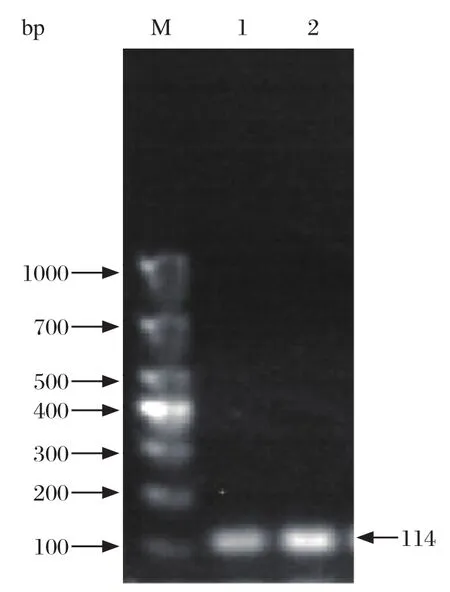
图1 pMD-EHP PCR鉴定结果Fig.1 PCR identification of pMD-SHIV
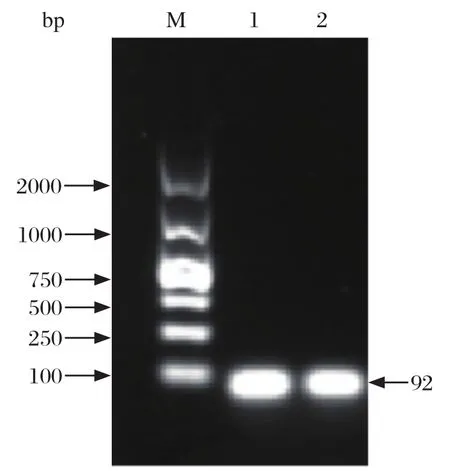
图2 pMD-EHP PCR鉴定结果Fig.2 PCR identification of pMD-EHP
2.2 双重实时荧光定量PCR扩增 通过对SHIV和EHP单项和双重实时荧光定量PCR的条件优化,SHIV-F/SHIV-R的终浓度为0.4 μmoL/mL,探针终浓度为0.2 μmol/mL,EHP-F/EHP-R的终浓度为0.35 μmoL/mL,探针终浓度为0.25 μmoL/mL,退火温度为60℃时,对同一标准品的检测信号值最强,Ct值最小。
2.3 双重实时荧光定量PCR标准曲线的建立 SHIV和EHP的荧光定量PCR反应标准品,其DNA混合液的梯度浓度从1×107copies/μL~1×101copies/μL的7个线性梯度的检测标准曲线呈等距性和平行性,具有较好的梯度性(图3)。
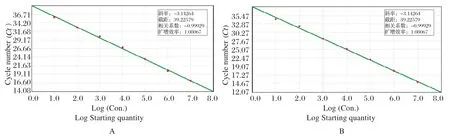
图3 SHIV(A)和EHP(B)的real-time PCR标准曲线Fig.3 Real-time PCR standard curve of SHIV(A) and EHP(B)
2.4 双重实时荧光定量PCR特异性、敏感性以及稳定性
2.4.1 特异性试验 以SHIV、EHP、IHHNV、WSSV的基因组为模板进行实时荧光定量PCR扩增,结果显示,仅有SHIV、EHP二者相应的荧光信号为阳性,其他病毒的检测均为阴性,说明此次构建的双重实时荧光定量PCR方法的特异性较强(图4)。
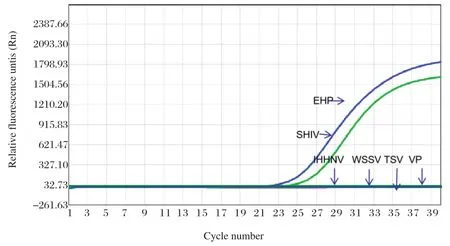
图4 双重实时荧光PCR体系的特异性检测Fig.4 Specific test of the real-time PCR system for SHIV and EHP
2.4.2 敏感性试验 将体外转录纯化后的SHIV和EHP的DNA标准品,用核酸蛋白检测仪测定其浓度,计算其拷贝数,然后10倍系列梯度稀释为1×107copies/μL~1×101copies/μL,利用本研究建立的SHIV和EHP双重实时荧光定量进行扩增,得到SHIVV和EHP探针法实时荧光定量PCR的动力学扩增曲线(图5),在Ct<40范围内可以检出的最低DNA量为10 copies/μL,因此建立的此方法敏感性可以达到10 copies/μL。与本实验室前期构建的检测SHIV和EHP普通PCR及SYBR Green real-time PCR法相比较,是SYBR green real-time PCR敏感性的10倍(图6、7)、普通PCR法敏感性的100倍(图8)
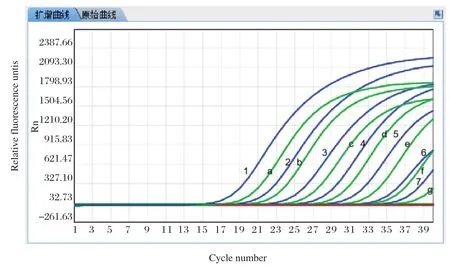
图5 荧光定量 RT-PCR体系的敏感性检测Fig.5 Sensitivity test of the real-time PCR for SHIV and EHP
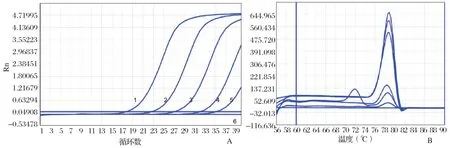
图6 SHIV SYBR Green real-time PCR敏感性检测(A)和SHIV熔解曲线(B)Fig.46 Se nsitivity test of the SYBR real-time PCR for SHIV(A) and melting curve for SHIV(B)
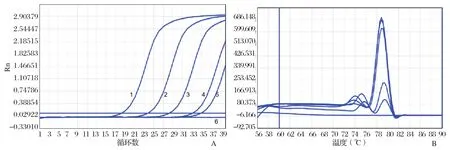
图7 EHP SYBR Green real-time PCR敏感性检测(A) 和EHP熔解曲线 (B)Fig.7 Sensitivity test of the SYBR real-time PCR for EHP (A) and melting curve for EHP (B)
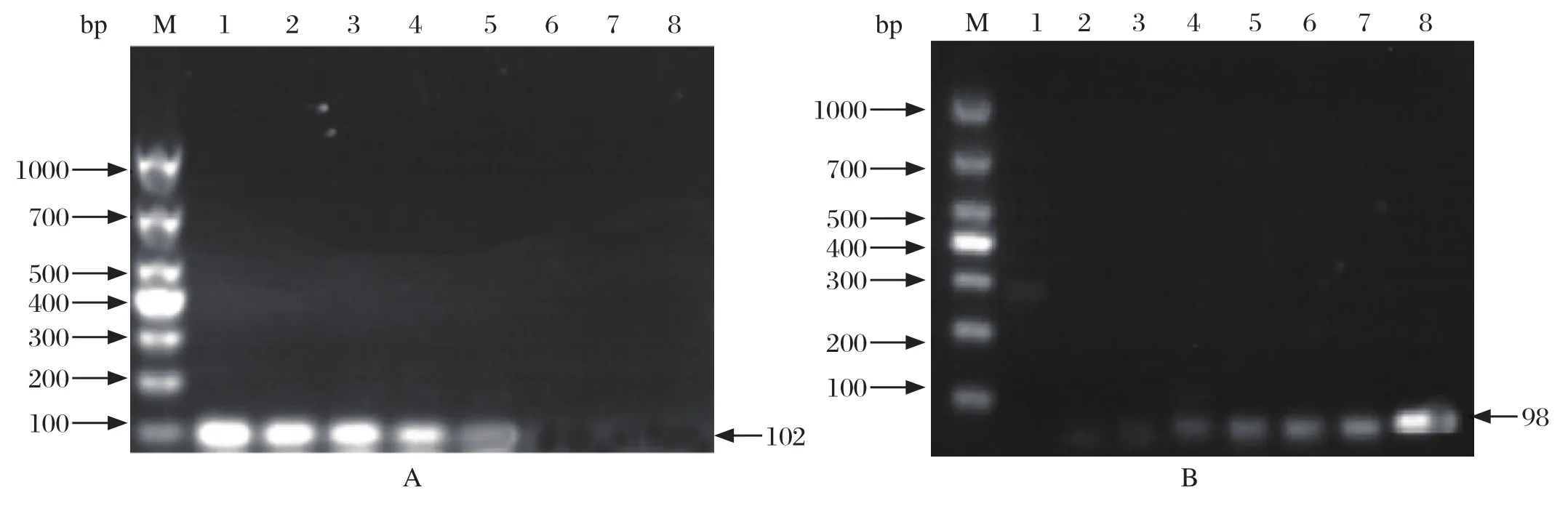
图8 SHIV (a) 和EHP (b)普通PCR敏感性检测Fig.8 Sensitivity test of the PCR for SHIV and EHP
2.4.3 稳定性试验 由实验室不同试验操作人员批内、批间的重复性试验结果显示,该方法的变异系数均小于4%(表2),具有良好的稳定性。
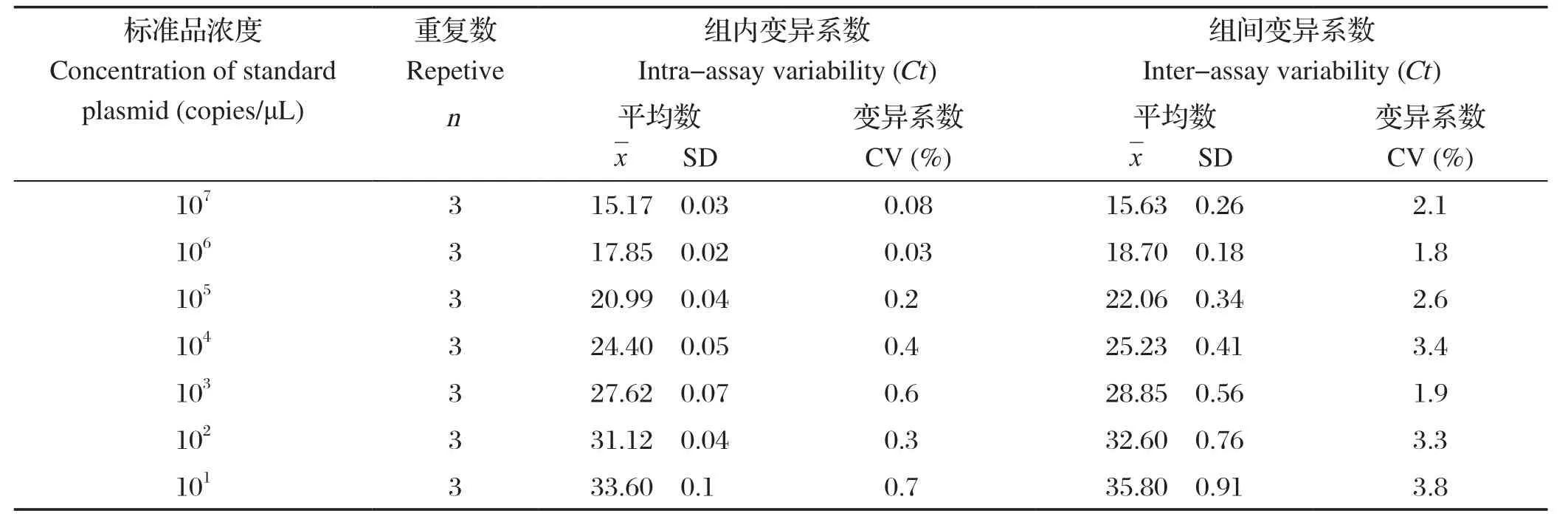
表2 EHP和SHIV双重荧光定量PCR重复性试验Table 2 Re petitive and stability verification of EHP and SHIV duplux real-time PCR
2.4.4 样品检测试验 对37份已知临床病料样品进行检测结果显示,EHP和SHIV共同阳性2份,EHP拷贝数约为3.1×103copies/μL和5.6×104copies/μL,S H I V的拷贝数约为4.1×1 04c o p i e s/μ L和6.1×105copies/μL;单EHP阳性的11份,拷贝数为5.2×102copies/μL~3.2×106copies/μL;单SHIV阳性7 份,拷贝数为1.1×102copies/μL ~ 4.4×106copies/μL;其余样品为阴性,与已知样品结果的符合率为100%。
3 讨论
EHP不会在的感染前期引起虾的大面积死亡,因此往往不会受到重视,使得EHP在南美白对虾养殖中广泛传播,造成的经济损失也越来越严重,直接或间接威胁着整个对虾养殖业的发展[7]。目前EHP已在越南、中国、印尼、马来西亚和泰国等国家流行。SHIV主要感染体长5~6 cm的虾,传染性较强,能够引起虾的大面积死亡,鱼类[8]和虾蟹类[9-10]均可携带SHIV,由于尚缺乏特效的药物和有效的控制方法,造成养殖投入高但收获甚微,给养殖业造成巨大的经济损失。
实时荧光定量PCR由于能在很宽的动态范围内特异性地准确测定核酸的含量,近年来已逐渐成为检测各种DNA或RNA病原的主流技术,SYBR GreenⅠ[11]和TaqMan探针实时定量PCR检测,其中TaqMan探针通过采用不同的荧光基团,在实时荧光定量中的应用使扩增产物特异性地发出荧光信号,该技术在畜牧兽医和水产领域的病原检测中得到了广泛应用[12-14]。
根据该两种病在南美白对虾上的发病状况,从源头对病原进行监测,本实验室研究建立了一种快速、准确的双重实时荧光定量PCR方法,该方法从引物和探针的设计上有效的避免了自身二聚体内耗以及非特异性扩增,通过调整各引物和探针的浓度实现二者扩增效率的平衡。与单项PCR技术相比,双重荧光定量PCR的方法无需进行凝胶电泳,可采集荧光信号通过电脑直接显示结果,不同的荧光信号增加了结果判断的客观性,实现了高效、低成本的快速检测。
该方法对SHIV和EHP标准质粒的检测灵敏度可以达到10个 copies/μL,比普通PCR敏感100倍,从样品核酸提取到检验完成,整个检测反应只需2 h,大大提高了SHIV和EHP检测效率,可满足高通量检测。还可以通过对DNA模板的定量,来实现对病原的检测,对分析SHIV和EHP载量和开展病原防控研究具有重要意义。对IHHNV、WSSV、VP以及TSV病毒无交叉反应,说明本方法具有很好的特异性。通过批内和批间的重复试验,变异系数均小于4%,有良好的稳定性。应用SHIV和EHP双重荧光定量方法对37个临床样品进行检测,准确率达到100%。该方法灵敏度高、成本低、操作简单,适用于亲虾、苗种和养殖环境的快速检测。筛选简单易行,可在SHIV和EHP的发病早期提供准确的诊断结果,为有效防控SHIV和EHP提供了技术支撑。
