猪流行性腹泻病毒变异株XP2018的分离及S基因序列分析
2022-03-14赵攀登冀梦瑶朱文龙卢建洲潘颂佳范宝超
赵攀登 ,冀梦瑶 ,朱文龙 ,陈 益 ,卢建洲 ,杨 霞 ,朱 芳 ,田 欣 ,程 云 ,潘颂佳,张 宁,范宝超
(1.河南牧业经济学院,郑州 450046;2.河南丰源和普农牧股份有限公司,驻马店 463900;3.江苏省农业科学院,南京 210014)
猪流行性腹泻(porcine epidemic diarrhea,PED)是由猪流行性腹泻病毒(Porcine epidemic diarrhea virus,PEDV)引起的一种以腹泻、脱水和死亡为主要症状的急性肠道传染病。各年龄段猪均易感,尤其是产房7日龄以内的仔猪,发病率和死亡率最高[1]。1971年,该病在英国被首次报道,其后在比利时、荷兰、德国、法国、加拿大等国家陆续流行起来,给全球的养猪产业造成了严重的危害[2]。自2010年的10月份以来,PEDV出现变异毒株,并在我国大面积流行和暴发,仅在我国南方10多个省份就引起了约100万头仔猪死亡。有关统计数据显示,在2011年底,我国约100万头仔猪死于PED[3]。2013年美国发生猪流行性腹泻,随后在北美地区暴发和流行[4]。猪流行性腹泻给世界养猪业造成了巨大的经济损失。
PEDV属于冠状病毒科(Coronaviridae)冠状病毒属(Coronavirus)。该病毒是单股正链有囊膜的RNA病毒,基因组大约为28 kb,编码的主要结构蛋白是纤突糖蛋白(spike glycoprotein,S)、囊膜蛋白(envelope protein,E)、膜蛋白(membrane protein,M)、核蛋白(nucleoprotein,N)[5]。S蛋白在吸附受体细胞、膜融合及中和抗体产生方面起着重要作用[6]。不同毒株的S基因差异较大,故S基因不仅可以为基因工程疫苗的设计提供参考价值,也能够作为分析不同毒株间差异的参考基因[7]。
PEDV很难在细胞上分离培养。1988年,Hofmann等[8]通过在培养基中加入胰酶的方式,利用Vero细胞成功分离PEDV。本研究旨在从临床仔猪腹泻样品中分离猪流行性腹泻病毒,并对分离毒株的S基因进行测序分析,以期为PEDV致病机理研究和疫苗的研发提供物质基础。
1 材料与方法
1.1 病料 河南省某猪场产房腹泻仔猪肠道组织。剪碎肠道组织,加入10倍体积生理盐水,研磨后反复冻融3次,4℃、10 000×g离心10 min,取上清液,加入双抗(青霉素终浓度为100 U/mL,链霉素终浓度为100 mg/L),经0.22 μm滤膜过滤,-80℃冰箱保存备用。
1.2 细胞与主要试剂 Vero细胞由本实验室保存。RNA提取试剂盒购自生工生物工程(上海)股份有限公司;HiScript Ⅱ One Step RT-PCR Kit购自南京诺维赞生物科技有限公司;DMEM、胎牛血清(FBS)和胰酶购自Gibco公司;FITC标记山羊抗鼠二抗购自Abcam公司;PEDV N蛋白单克隆抗体由江苏省农业科学院兽医研究所惠赠。
1.3 引物的设计与合成 所有引物由生工生物工程(上海)股份有限公司合成(表1)。
1.4 病原RT-PCR检测 取200 μL样品,按照RNA提取试剂盒说明书提取总RNA。利用HiScript ⅡOne Step RT-PCR Kit进行RT-PCR,相应引物鉴定猪流行性腹泻病毒(PEDV)、F/R鉴定传染性胃肠炎病毒(Transmissible gastroenteritis virus,TGEV)和轮状病毒(Rotavirus,RV)。反应程序:50℃反转录30 min;94℃预变性5 min;94℃变性45 s,55℃退火30 s,72℃延伸1 min,35个循环;72℃延伸5 min。
1.5 病毒分离 病毒分离方法参照文献[8-9],稍作修改。将Vero细胞传入6孔板,待细胞长满80%时接毒。接毒样品事先用含有10 μg/mL胰酶的DMEM在细胞培养箱孵育1 h。取出6孔板,用PBS洗涤2次,将处理过的样品接种至6孔板中,置于细胞培养箱孵育1 h,期间每隔20 min轻微晃动一次。1 h后取出6孔板,弃掉样品,加入含有10 μg/mL胰酶的维持液,37℃、5%CO2培养箱培养4~7 d,每天观察细胞病变。
1.6 间接免疫荧光鉴定 将Vero细胞铺于24孔细胞板中,接毒后置于37℃细胞培养箱中培养72 h。每孔加入500 μL 4%多聚甲醛,4℃固定1 h。PBS洗涤后,加入0.1%TritonX-100作用后经PBS洗涤,加入0.5%BSA封闭。加入PEDV N蛋白单克隆抗体(1∶1000稀释)4℃孵育过夜,PBS洗涤后加入FITC标记的羊抗鼠二抗(1∶1000稀释),37℃孵育1 h后观察。
1.7 S基因扩增及测序 将S基因分为四段,分别为Sa、Sb、Sc和Sd。用相应引物(表1)扩增分离毒株的S基因,反应程序如下:50℃反转录30 min;94℃预变性5 min;94℃变性45 s,55℃退火30 s,72℃延伸1.5 min,35个循环;72℃延伸5 min。PCR产物送生工生物(上海)股份有限公司测序。

表1 引物序列Table 1 Sequences of primers
1.8 序列分析 将测序得到的S基因和NCBI上14株国内外的参考毒株(表2)进行核苷酸、氨基酸序列同源性分析和遗传进化分析。
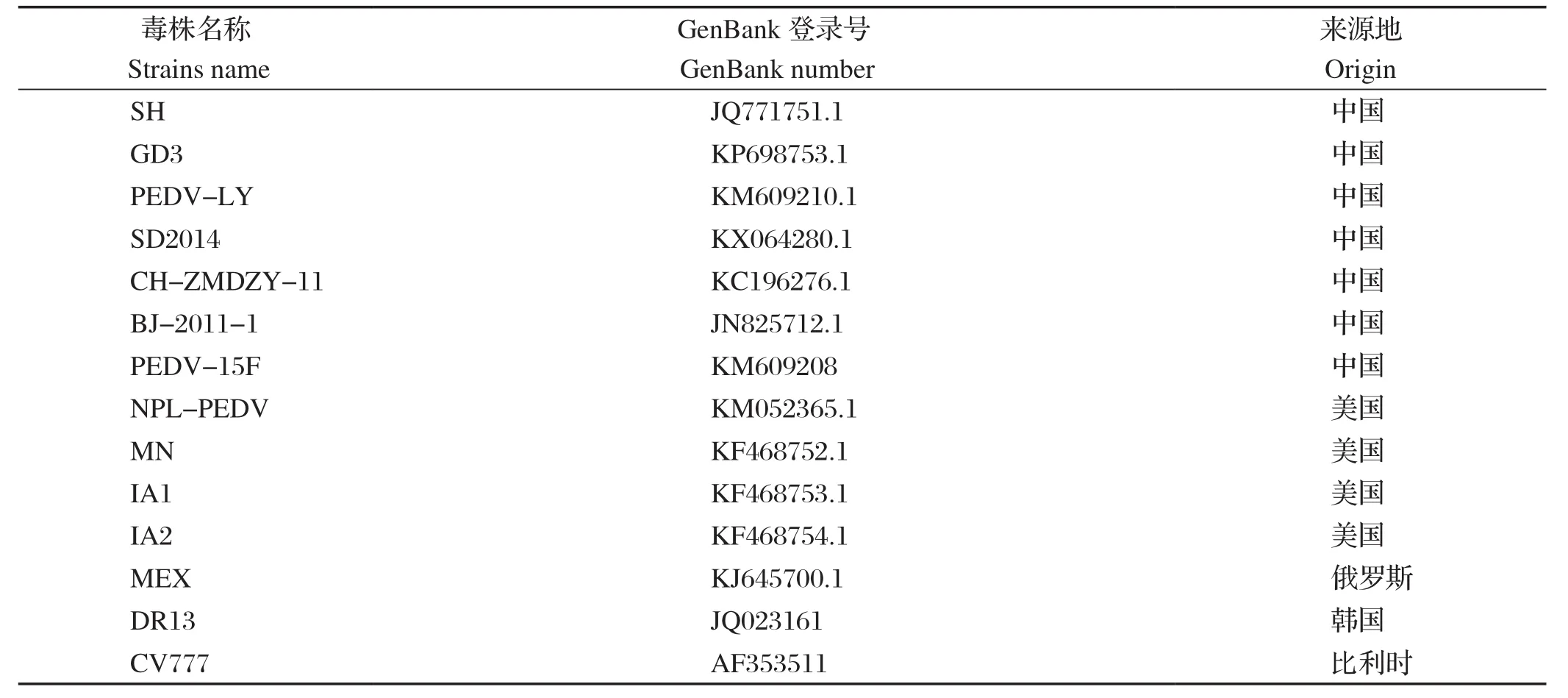
表2 PEDV参考毒株信息Table 2 Information of PEDV reference strains
2 结果
2.1 病料核酸鉴定 RT-PCR检测肠道样品中猪流行性腹泻病毒、传染性胃肠炎病毒和轮状病毒,结果如图1所示,猪流行性腹泻病毒在670 bp处出现了条带,而传染性胃肠炎病毒和轮状病毒均为阴性。
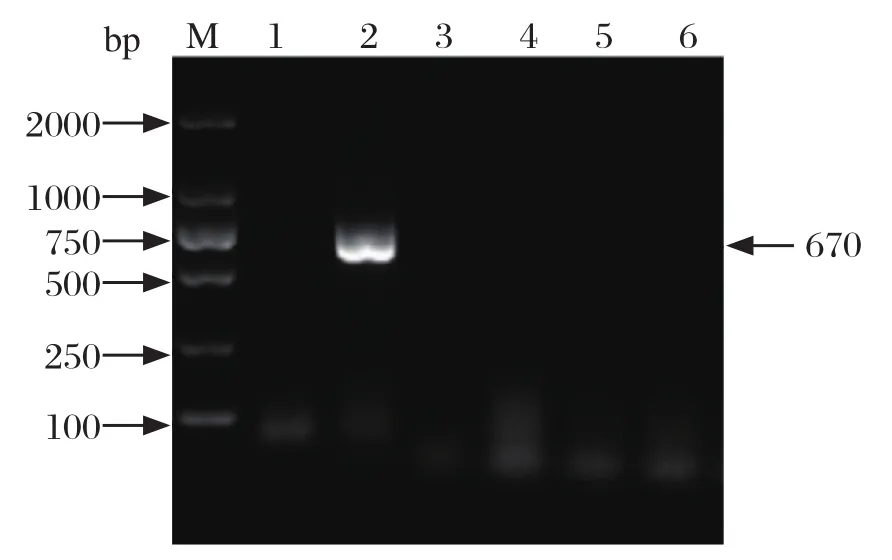
图1 RT-PCR鉴定结果Fig.1 RT-PCR identification results of PEDV
2.2 病毒的分离 将检测为阳性的病料处理后接种于单 层的Vero细胞,随着培养时间的延长,细胞的形态发生变化,细胞肿胀、变圆、融合,继而细胞脱落(图2)。将分离得到的毒株命名为XP2018株。

图2 分离毒株接种Vero细胞后的细胞病变Fig.2 Cytopathy of Vero cell inoculated with isolated strains
2.3 间接免疫荧光鉴定 将细胞置于荧光显微镜下观察,经XP2018感染的细胞出现特异性的绿色荧光,荧光集中在细胞质中,正常细胞没有荧光。如图3所示。
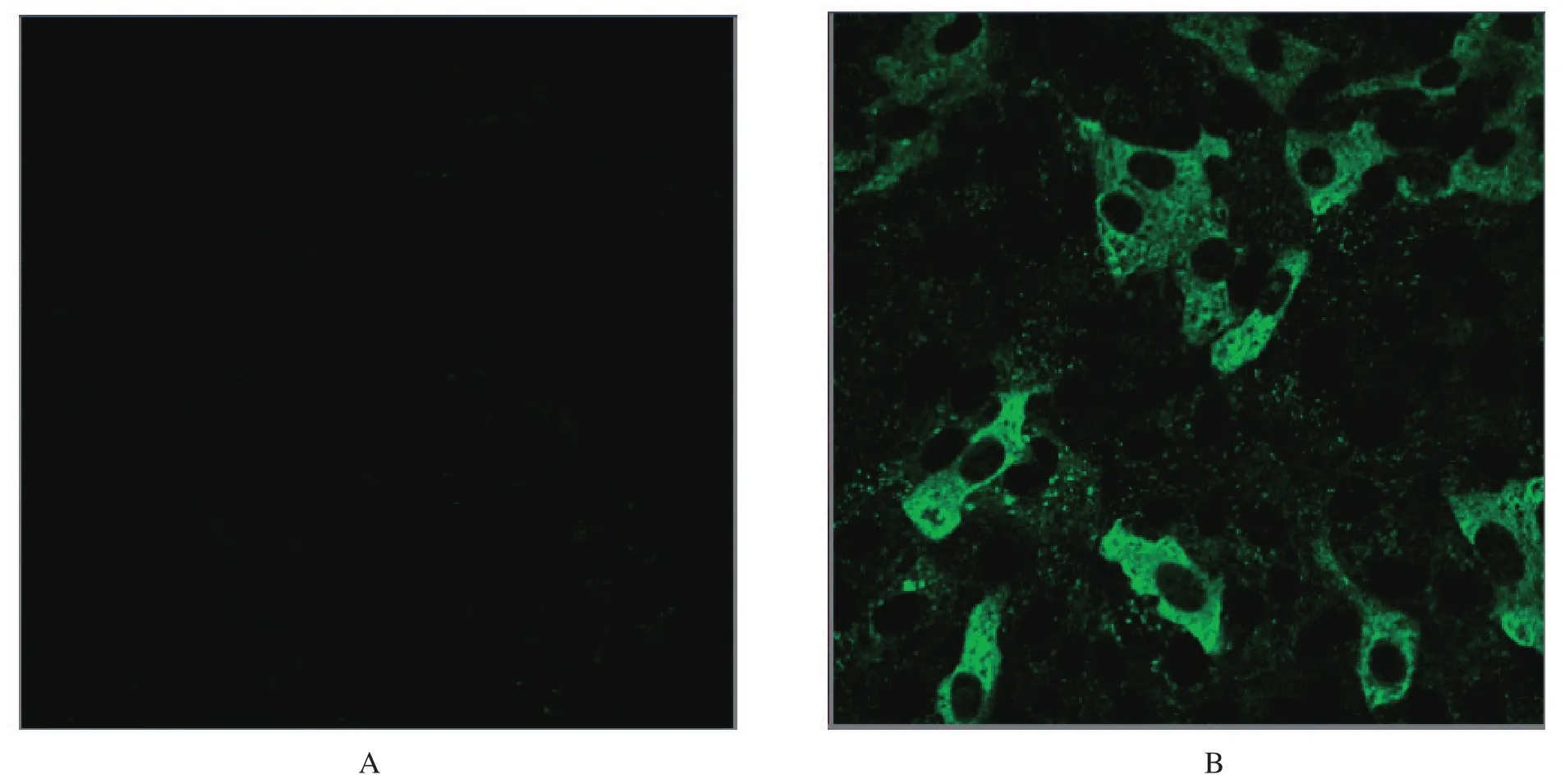
图3 PEDV XP2018接种Vero细胞间接免疫荧光鉴定Fig.3 IFA idenfication of Vero cells infected with PEDV XP2018
2.4 S基因的扩增 提取病毒液中总RNA,RT-PCR扩增S基因四个片段,大小分别为1358 bp、1380 bp、1321 bp、712 bp,均在相应位置扩增出目的片段。如图4所示。
2.5 S基因的遗传进化分析 将分离得到的XP2018毒株的S基因与NCBI上公布的国内外流行毒株进行绘制遗传进化树(图4)。结果显示XP2018毒株与MEX株、中国近年来流行毒株(SH、GD3、PEDV-LY、SD2014、CH-ZMDZY-11、BJ-2011-1、PEDV-15F)和美国毒株(NPL-PEDV、MN、IA1、IA2)在一个分支上,说明亲缘关系也较近;XP2018毒株与韩国的毒株DR13、瑞士毒株CV777不在一个分支上。
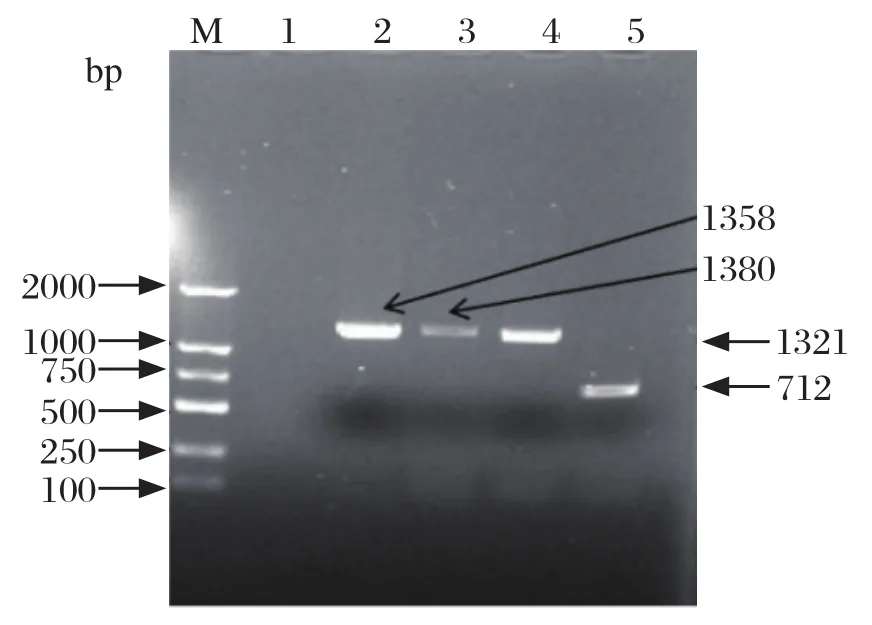
图4 分离株XP2018 S基因的RT-PCR结果Fig.4 RT-PCR results of XP2018 S gene isolated
2.6 同源性分析 对14株PEDV的S基因进行核苷酸和氨基酸同源性的分析(表6、表7),XP2018株与经典毒株CV777核苷酸的同源性为94%,氨基酸同源性为93.4%;与韩国毒株DR13的核苷酸同源性为95.2%,氨基酸同源性为94.9%;与近年来中国分离的其他毒株的核苷酸同源性为98.1%~98.8%,氨基酸同源性为97.8%~98.8%;与美国的参考毒株间的核苷酸同源性为98.8%~98.9%,氨基酸同源性为98.4%~98.8%;与莫斯科毒株的核苷酸同源性和氨基酸同源性均为98.8%。
3 讨论
自2010年以来,猪流行性腹泻给中国的养猪业造成了重大损失。疫苗免疫是防控主流行性腹泻的重要手段。尽管市面上有猪流行性腹泻疫苗,但免疫效果不甚理想。究其原因,引起猪流行性腹泻暴发的原因是变异毒株,传统的CV777疫苗毒株对该病的防控免疫效果较差,使得部分免疫PEDV疫苗的猪场仍暴发PED[10]。接种来源于变异毒株的疫苗是当前防控猪流行性腹泻的主要手段。
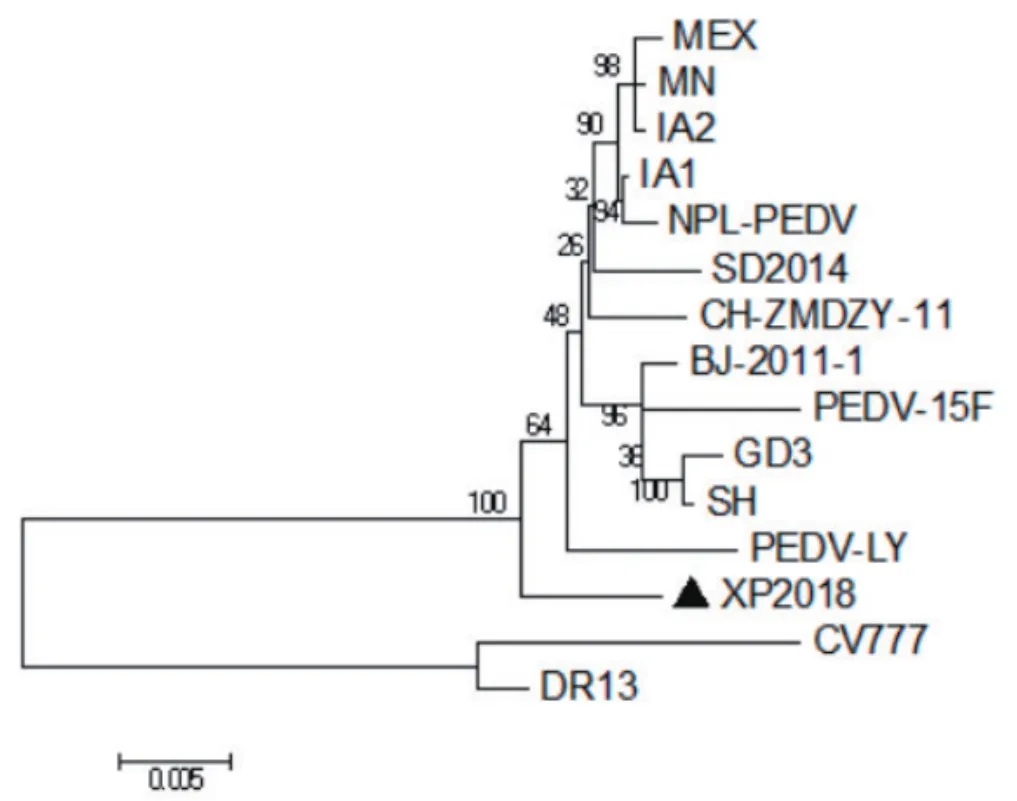
图5 PEDV S基因核苷酸序列遗传进化分析Fig.5 Phylogenetic analysis based on S gene of PEDV
猪流行性腹泻病毒的分离难度较大,受到多种因素影响,比如细胞系、样品类型、培养条件等。Vero细胞是当前猪流行性腹泻病毒分离常用细胞系。在所有的样品类型中,肠道内容物可能是分离PEDV的最佳病料,先前报道的分离毒株大部分是从自然感染或试验接种猪的肠道内容物中分离出来[11-15]。Hofmann等[8]研究认为胰酶对PEDV S蛋白切割作用能够增加病毒对Vero细胞的感染力,并利用在培养液中加入胰酶的方法成功分离PEDV。后人在此基础上,对胰酶的浓度进行了优化,提高了分离成功率[16-17]。本实验利用Vero细胞分离PEDV,前期反复优化确定胰酶浓度为10 μg/mL,样品来自临床腹泻症状明显的仔猪肠道,处理后直接用于病毒分离。病料样品接种至Vero细胞5 d出现CPE,并且多次传代后CPE明显并稳定。本实验成功分离1株PEDV,命名为XP2018株。
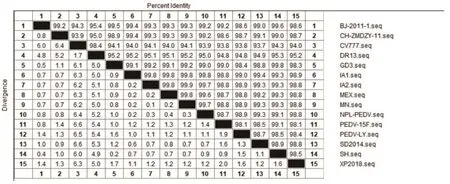
图6 PEDV S基因序列同源性比对Fig.6 Homology alignment of S gene sequence

图7 PEDV S基因序列同源性比对Fig.7 Homology alignment of S gene sequence
S蛋白是位于PEDV表面的纤突蛋白,能够介导病毒结合细胞和刺激机体产生中和抗体。编码S蛋白的S基因是病毒容易发生变异的主要基因,能够很大程度上反映PEDV不同毒株遗传变异及亲缘关系[18]。
为进一步了解XP2018毒株的特性,本研究对S基因扩增并分析。XP2018毒株S基因全长4161 bp,与经典毒株CV777相比,存在16个碱基的插入和7个碱基的缺失。同源性分析显示该毒株S基因与CV777氨基酸同源性为91.0%,与DR13氨基酸同源性为90.6%,而与中国近年来流行毒株和美国毒株的同源性高达96.6%~98.3%。遗传进化分析显示,XP2018毒株与CV777和DR13不在同一分支,与中国近年来流行毒株和美国毒株处于同一分支。说明XP2018毒株属于变异毒株。
综上所述,本研究明确了该猪场腹泻的病原、分离到1株猪流行性腹泻病毒变异毒株XP2018并分析了该毒株S基因特性。该毒株对Vero细胞具有较高的适应性,为PEDV致病机理研究和疫苗研发提供了物质基础。
