汉江下游干支流浮游植物群落特征及其对水质的指示评价
2022-03-11余业鑫向罗京柳满森赵恩民郭益铭王海军
余业鑫,李 艳,向罗京,柳满森,赵恩民,郭益铭,王海军,5
1.华中农业大学水产学院,湖北 武汉 430070
2.中国科学院水生生物研究所,淡水生态与生物技术国家重点实验室,湖北 武汉 430072
3.湖北省环境科学研究院,湖北 武汉 430073
4.中国地质大学,湖北 武汉 430074
5.云南大学生态与环境学院高原湖泊生态与治理研究院,云南 昆明 650504
浮游植物作为河流生态系统的主要初级生产者,对生态系统的物质循环和能量流动有着重要影响[1-2]。 一方面,浮游植物可吸收利用水中的营养物质,将水中的无机物转化为有机物带入食物链;另一方面,浮游植物可作为浮游动物及滤食性鱼类的食物,将能量向上一级传递[3]。 浮游植物对水环境的变化比较敏感,常被用于水质评价及预警等[4-6]。 运用浮游植物评估水质状况可以弥补物理和化学监测的局限,并且可以根据藻类的动态变化,全面、真实地反映水质的优劣,掌握污染的发展趋势[7]。 国内外许多学者利用浮游植物对河流、湖泊和海洋水质进行了评价[8-10]。BORICS 等[11]提出了应用浮游藻类对大型河流富营养化状况进行评估的思路和方法。 SABATE等[12]利用浮游藻类特征对河流生态状况进行了评价。 WU 等[6]通过调查河流浮游植物生物完整性指数,评估了人类活动对河流浮游植物群落的干扰。 孟东平等[13]通过测定汾河太原段34 个优势藻种的生态位宽度和生态位重叠,分析了该区域浮游藻类群落的稳定性。 此外,浮游植物群落特征也被应用于河流生态修复工程效果评估。
汉江是长江最长的一级支流,有着十分重要的生态和经济价值。 丹江口水库以上为汉江上游,丹江口至钟祥为中游,钟祥至汉口为下游。 汉江下游干流沿途经过6 个县市,全长382 km。 汉江生物多样性比较丰富,如汉江干流及秦岭南麓5 条支流含有底栖动物约240 种(其中水生昆虫209 种)[14],干流含有浮游动物约86 种[15],中下游含有鱼类约79 种[16-17]。 此外,汉江下游流域是我国重要的粮食生产基地,也是长江经济带重要的组成部分,2012 年湖北汉江流域GDP 总额占全省的41.51%。 因此,无论是从生物学还是经济学角度,汉江都具有十分重要的价值[18]。
随着各类水利工程的兴建和投入使用,加上营养盐的大量输入,汉江下游水生态环境发生了很大变化,浮游植物群落也发生了较大改变,主要表现为生物量的增加和物种多样性的降低[19]。近年来,汉江频繁发生硅藻水华事件,对下游的生态系统稳定和人民生命财产安全造成了极大威胁[20-21]。 因此,有必要持续开展以浮游植物等水生生物为研究对象的汉江水环境质量调查与评估。 本研究于2019 年3—12 月对汉江下游干流及主要支流(引江济汉运河和汉北河)开展了浮游植物群落特征及水环境因子状况调查,旨在分析汉江下游及主要支流浮游植物群落特征的主要影响因子,并根据浮游植物群落结构对汉江下游水质进行生物学评价,从而为汉江下游水质评估、预测及水环境安全管理提供理论参考。
1 材料与方法
1.1 研究区域及采样点
汉江下游主要指钟祥至汉口段,河道长382 km,流域面积1.7×104km2。 本研究主要针对汉江下游干流及主要支流,干流为沙洋至汉口宗关段,支流为引江济汉运河和汉北河。 在干流设置6 个采样点,包括沙洋(SY)、泽口(ZK)、仙桃(XT)、汉川(HC)、新沟交界(XGJ)、宗关(ZG);支流采样点设置在靠近汉江的一端,每条支流设置1 个采样点,即引江济汉运河(YH)和汉北河(XG)(图1)。 野外采样于2019 年3—12 月进行,每月采样1 次。 根据前期调查情况,汉江冬季藻类相对较少,所以本研究仅采集1 个月的冬季样品,即以12 月为代表。
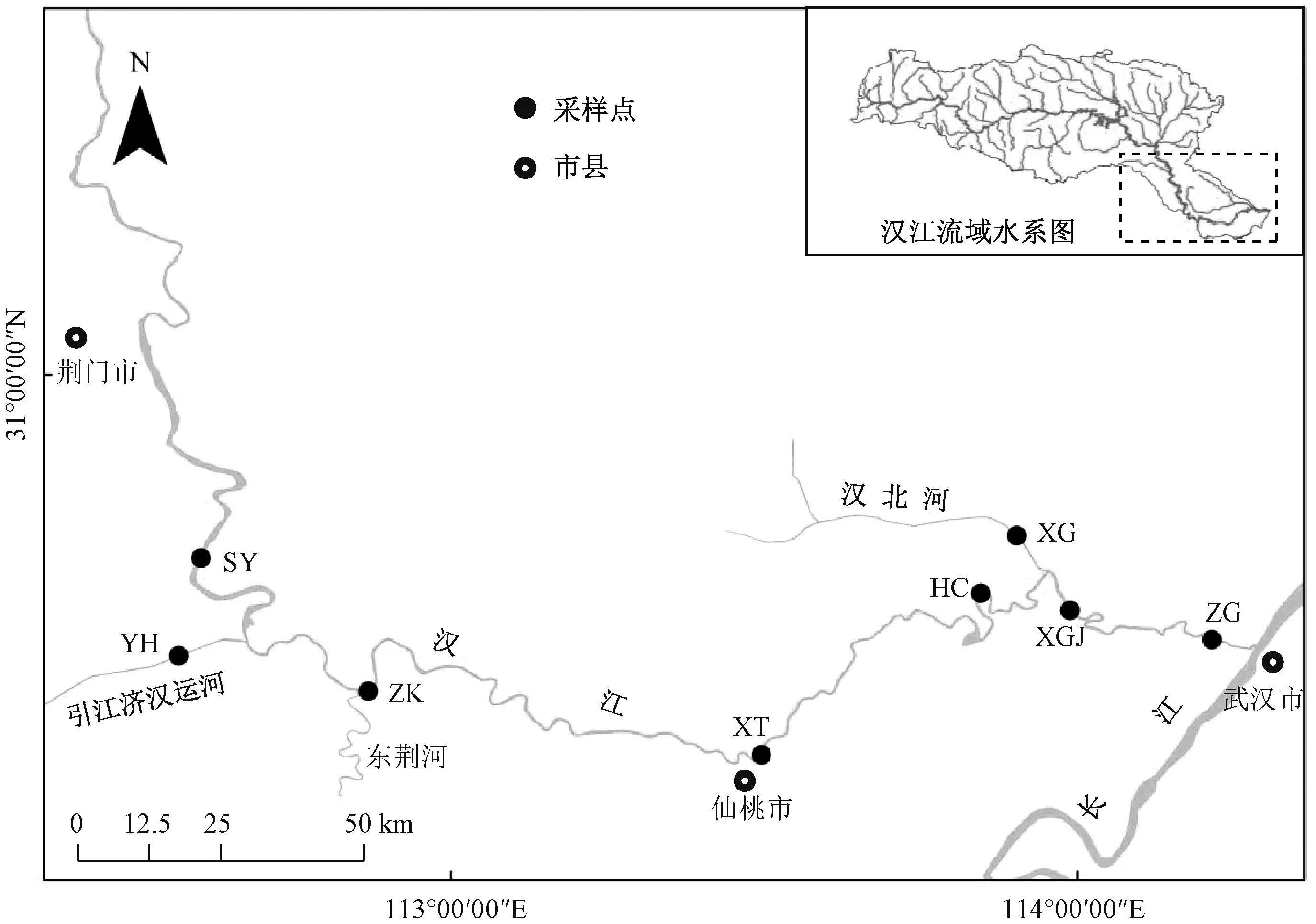
图1 汉江下游干流及主要支流采样点分布示意图Fig.1 Distribution of sampling sites in the mainstream and main tributaries of the lower reaches of Hanjiang River
1.2 浮游植物样品采集与分析
使用5 L 有机玻璃采水器在每个采样点的表层、中层和底层分别采集水样,混合均匀后取1 000 mL 置于采样瓶中,现场按照1%的体积比加入鲁哥试剂对浮游植物进行固定。 将样品带回实验室并静置48 h 后,利用虹吸法缓慢吸去上清液,将下层的浮游植物样品定容至50 mL,并加入4%的甲醛溶液保存。 取0.1 mL 浓缩液置于浮游植物计数框内,在显微镜(×400 倍)下鉴定藻类种类并计数。 浮游植物种类鉴定参照《中国淡水藻类——系统、分类及生态》[22]和《中国淡水藻志》[23]进行。 计算藻类生物量时,将藻类看作与其相似的几何体,然后测量该几何体的边长、高或直径等,计算出该几何体的体积作为该藻类的体积。 藻类生物量计算公式:

式中:BPhyt为藻类生物量,mg/L;S为藻类种类数;ρ为藻类质 量密度,10-9mg/μm3;Vi为种类i的体积,μm3;Di为种类i的数量密度,cells/L。
1.3 水体物理化学指标分析
水体温度、溶解氧、pH 和电导率使用多参数水质测量仪(美国YSI,ProPlus)在中层水深处进行原位测量。 在每个采样点的表层、中层和底层分别采集水样,取1 000 mL 混合水样带回实验室,测定水体总氮、总磷、氨氮、硝态氮和总硅酸盐等。 总氮用过硫酸钾氧化-紫外分光光度法测定,总磷使用钼锑抗分光光度法测定,氨氮用纳氏试剂分光光度法测定,硝态氮用紫外分光光度法测定,总硅酸盐用钼酸盐比色法测定[24]。
1.4 分析方法
使用浮游植物群落的Shannon-Wiener 多样性指 数(H′)[25]、 Pielous 均 匀 度 指 数(J)[26]和Margalef 物种丰富度指数(d)[27]对水质进行生物学评价。 上述评价方法计算结果指示的水质状况判别标准见表1[28]。

表1 浮游植物多样性指数及水质评判标准Table 1 Evaluation standards of phytoplankton diversity index and water quality
利用McNaughton 优势度指数(Y)来描述浮游植物种类的优势度,将Y>0.02 的浮游植物定义为优势种,计算公式如下:

式中:ni为第i种物种的个体数;N为样品中所有物种的总个体数;fi为该物种出现的频率。
数据处理在Microsoft Excel 2016 中完成,数据分析用R 4.0.5 完成,图表绘制用R 4.0.5、GraphPad Prism 8 和ArcGIS 10.2 完成。 经检验,水体营养指标和浮游植物多样性指数的数据不服从正态分布,因此,采用多个独立样本比较的Kruskal-Wallis 方法来检验不同区域间的差异性。利用R 软件中的vegan 包对浮游植物与环境因子进行排序分析。 对环境因子进行常用对数(lg)转换,并对浮游植物密度数据进行去趋势对应分析(Detrended Correspondence Analysis)。 分 析 结 果显示,排序轴梯度最大值小于3,因此,采用基于线性的冗余分析(Redundancy Analysis)对浮游动物与环境因子的关系做进一步分析[29]。 显著性标准为P<0.05。
2 结果分析
2.1 水体营养指标变化
调查显示(图2),就水体总氮含量而言,汉江下游干流略低于引江济汉运河和汉北河,但差异不显著。 总磷与总氮的变化规律类似,同样是汉江下游干流最低,但各区域之间没有显著差异。
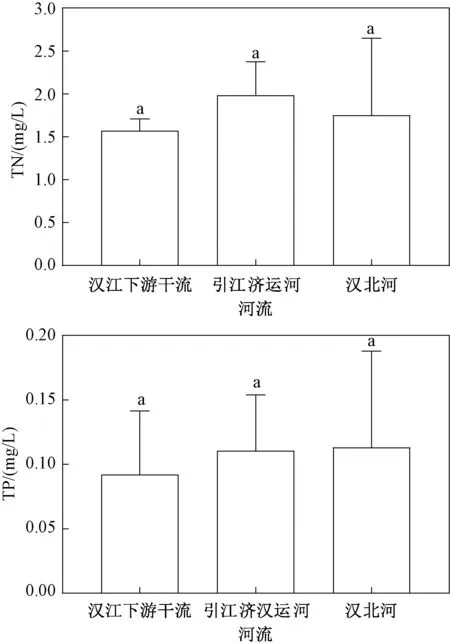
图2 2019 年3—12 月汉江下游干流及主要支流总氮和总磷平均值Fig.2 Mean values of total nitrogen and total phosphorus in the mainstream and main tributaries of the lower reaches of Hanjiang River during March-December 2019
2.2 浮游藻类种类组成
本研究共鉴定出7 门110 种浮游藻类,其中以绿藻门(49 种)和硅藻门(33 种)为主,其次为蓝藻门(11 种),隐藻门种类数最少(3 种)。 汉江下游干流浮游藻类种类数最多,共鉴定出101 种,绿藻门所占比例最大(43%),其次为硅藻门(31%)和蓝藻门(10%)[图3(a)]。 在引江济汉运河水样中,共鉴定出52 种浮游藻类,硅藻门所占比例最大(42%),其次为绿藻门(31%)和蓝藻门(13%)[图3(b)]。 在汉北河水样中,共鉴定出71 种浮游藻类,绿藻门所占比例最大(45%),其次为硅藻门 ( 24%) 和蓝藻门 ( 13%)[图3(c)]。
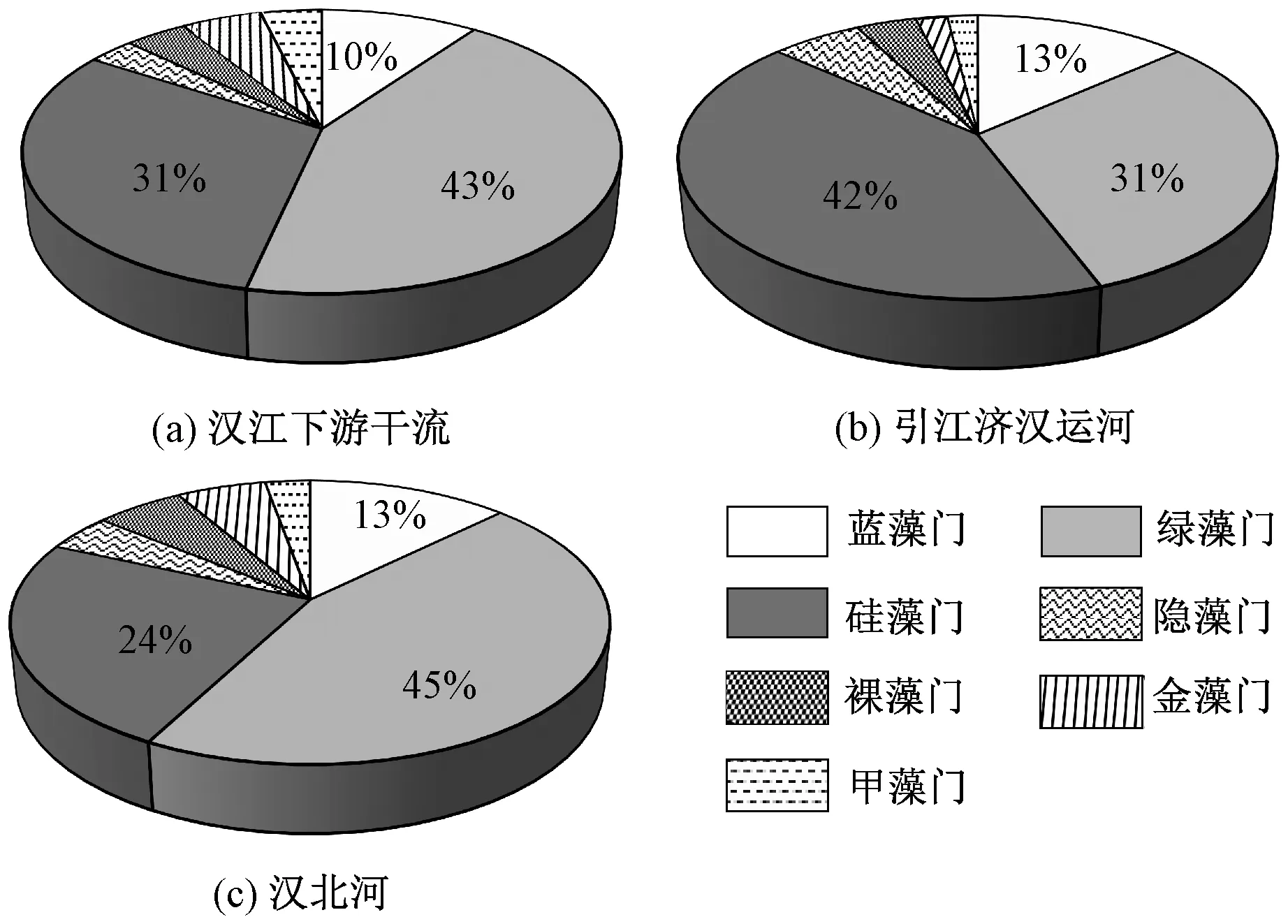
图3 2019 年3—12 月汉江下游干流及主要支流浮游植物种类数占比Fig.3 Percentage contribution of various phytoplankton phytum in species number in the mainstream and main tributaries of the lower reaches of Hanjiang River
2.3 浮游植物密度和生物量分布特征
调查显示,浮游植物密度和生物量的空间分布特征相似,均是汉北河最高,引江济汉运河最低,汉江干流介于二者之间(图4)。
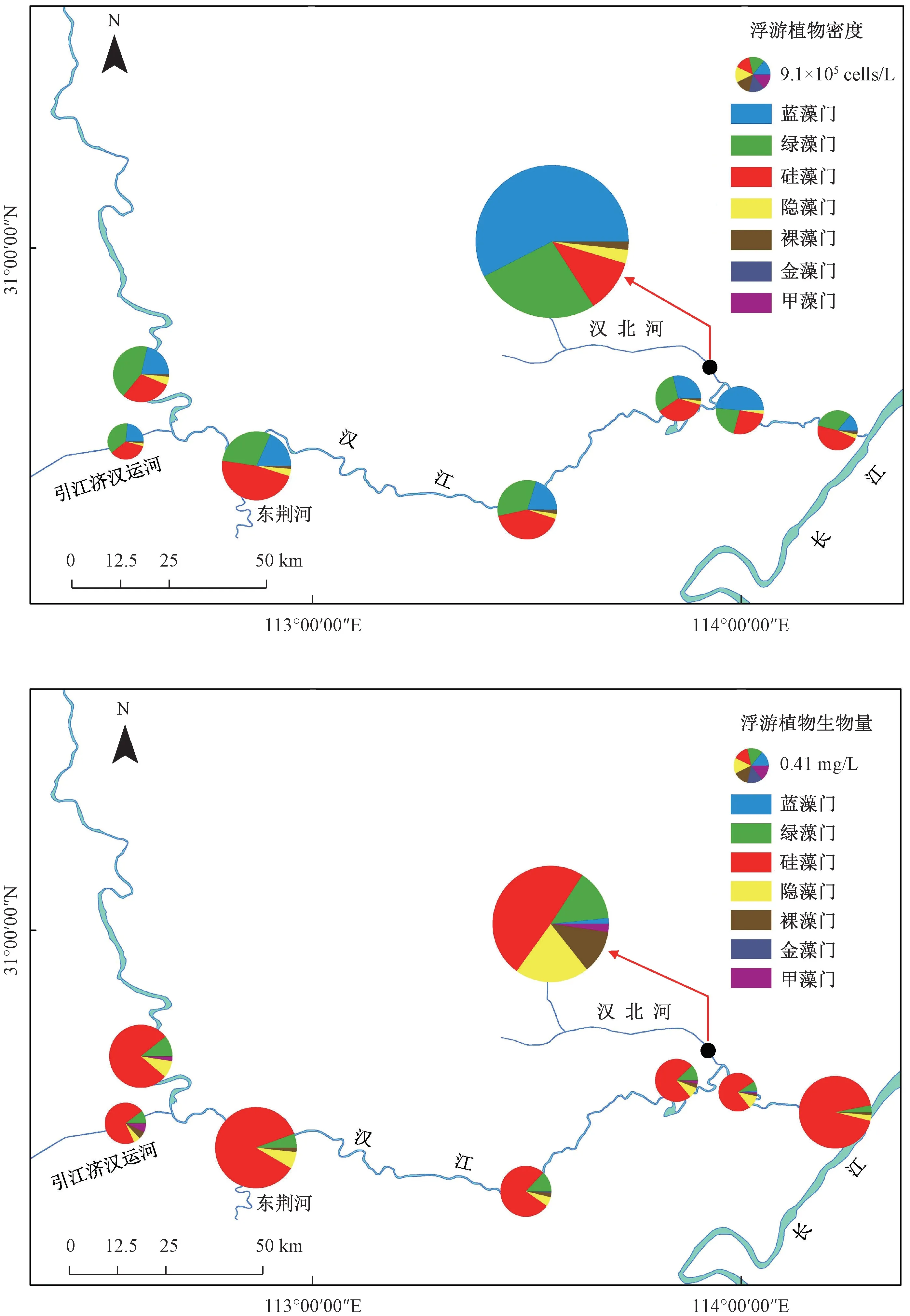
图4 2019 年3—12 月汉江下游干流及主要支流各采样点位浮游植物密度和生物量Fig.4 Distributions of phytoplankton density and biomass in the mainstream and main tributaries of the lower reaches of Hanjiang River during March-December 2019
从浮游植物密度来看,汉江下游干流以硅藻门所占比例为最大(38.77%),其次为绿藻门(31.84%)和蓝藻门(24.01%);在引江济汉运河,绿藻门所占比例最大(36.91%),其次为硅藻门(34.69%)和蓝藻门(23.35%);在汉北河,蓝藻门所占比例最大(57.44%),其次为绿藻门(26.48%)和蓝藻门(11.25%)。 从浮游植物生物量来看,汉江下游干流及主要支流均为硅藻门占比最大(49.15% ~82.59%)。 除硅藻门外,在汉江下游干流, 绿藻门(7.63%) 和隐藻门(6.39%)占比较大;在引江济汉运河,绿藻门(10.18%)和甲藻门(7.08%)占比较大;在汉北河,隐藻门(20.61%)和绿藻门(14.22%)占比较大。
2.4 浮游植物优势种分布差异
调查结果显示,汉江下游优势物种主要集中在硅藻门、蓝藻门和绿藻门,但在不同的调查区域有所差异(表2)。 在汉江下游干流,优势种集中在硅藻门、绿藻门、蓝藻门和隐藻门,其中,硅藻门的种数较多(4 种),以直链藻的优势度为最大(0.19),其次为冠盘藻(0.13)。 在引江济汉运河,优势种主要集中在绿藻门和硅藻门,优势度最大的为绿藻门的球衣藻(0.14)。 在汉北河,优势种主要集中在蓝藻门、绿藻门和硅藻门,优势度最大的为蓝藻门的伪鱼腥藻(0.24)。 相比汉江下游干流,两个支流的浮游植物优势种的数量均较少。
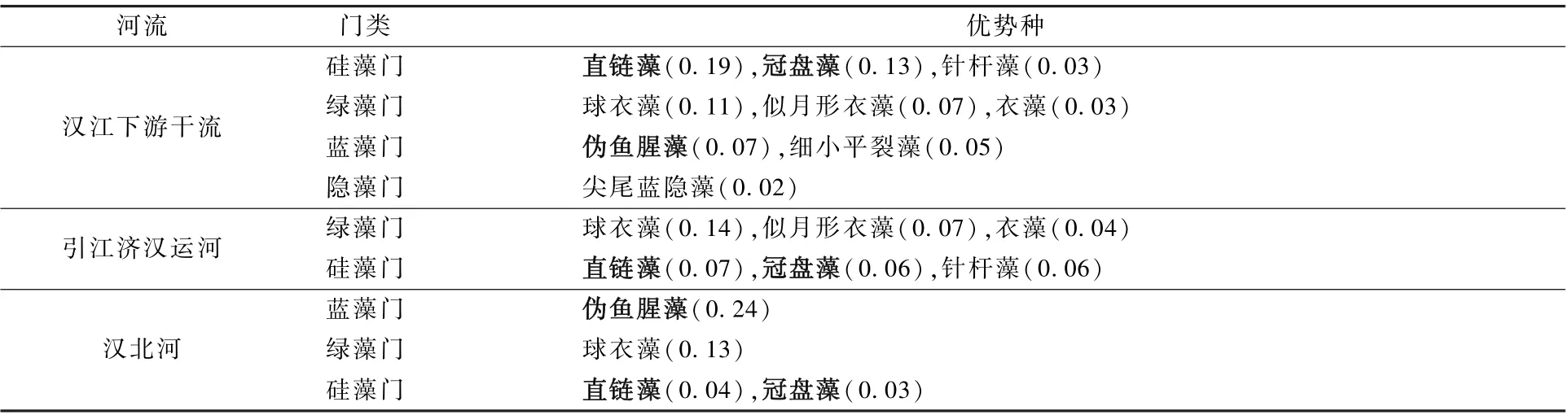
表2 2019 年3—12 月汉江下游干流及主要支流的浮游植物优势种及其优势度Table 2 The dominant species and dominance-index of phytoplankton in the mainstream andmain tributaries of the lower reaches of Hanjiang River during March-December 2019
2.5 浮游植物多样性指数分布特征及水质评价
浮游植物多样性中,汉江下游干流Shannon-Wiener 指数的年均值为2.15,引江济汉运河和汉北河分别为2.16 和2.37(图5,表3)。 根据表1可知,汉江下游干流、汉北河和引江济汉运河水质都处于β-中污染状态。 汉江下游干流Pielou 均匀度指数的年均值为0.77,引江济汉运河为0.80,汉北河为0.74,表明3 处水域的水质均处于轻度污染状态。 汉北河Margalef 物种丰富度指数的年均值最大(1.54),其次为汉江下游干流(1.24)和引江济汉运河(1.07),表明3 处水域的水质均处于α-中污染状态。
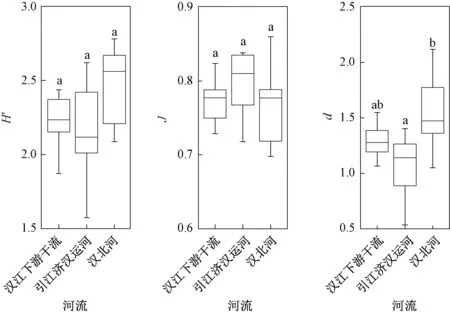
图5 2019 年3—12 月汉江下游干流及主要支流浮游植物多样性指数箱线图Fig.5 The boxplots of diversity index in the mainstream and main tributaries of the lower reaches of Hanjiang River during March-December 2019
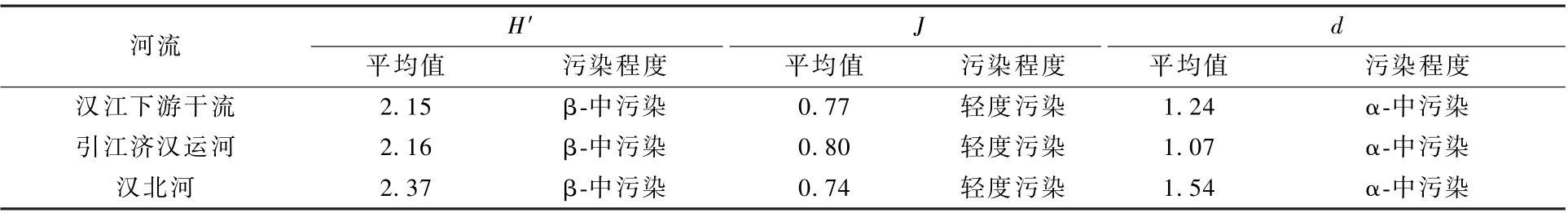
表3 2019 年3—12 月汉江下游干流及主要支流浮游植物多样性指数平均值及水质评价结果Table 3 Water quality evaluation based on the mean values of diversity index in the mainstream and main tributaries of the lower reaches of Hanjiang River during March-December 2009
2.6 浮游植物与环境因子的关系
冗余分析结果表明,影响汉江下游浮游植物群落结构的主要环境因子分别为硝态氮、硅酸盐和氨氮(P<0.05)(图6)。 同时,硅藻门密度与流速、水温、硅酸盐、总氮呈正相关,蓝藻门密度与总磷、磷酸盐、氨氮、溶解氧呈正相关,绿藻门密度与水温、氨氮呈正相关。 斯皮尔曼分析结果表明,汉江下游优势藻类硅藻门的密度主要与温度呈显著正相关(P<0.05)(图7)。
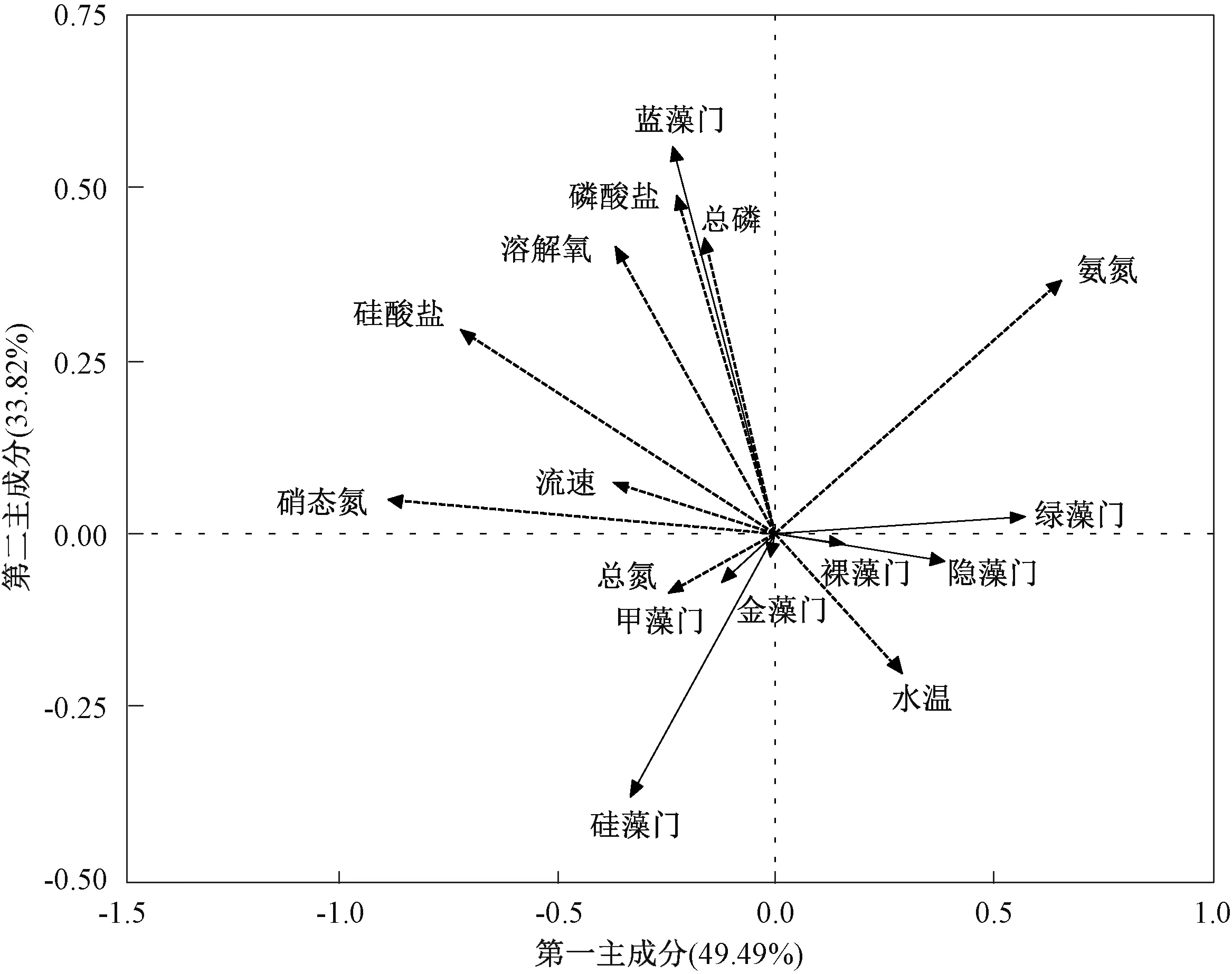
图6 2019 年3—12 月汉江下游干流及主要支流浮游植物和环境因子冗余分析结果Fig.6 Redundancy analysis for the relationships between phytoplankton composition and environmental variables in the lower reaches of Hanjiang River during March-December 2019
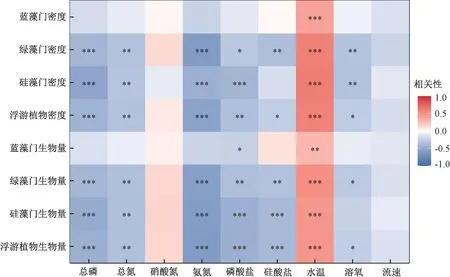
图7 2019 年3—12 月汉江下游干流及主要支流浮游植物密度、生物量和环境因子斯皮尔曼分析结果Fig.7 Spearman rank correlation analysis between density and biomass of phytoplankton and environmental variables in the lower reaches of the Hanjiang River during March-December 2019
3 讨论
3.1 汉江下游不同区域浮游植物群落特征
本研究在汉江下游干流、引江济汉运河和汉北河8 个断面共检测出浮游植物7 门105 种。 该结果与潘晓洁等[30]2010 年调查得到的64 种相比有上升趋势,与买占等[31]2017—2018 年调查得到的163 种相比有下降趋势。 总体看来,不同年份的汉江下游浮游植物种类数存在差异。 一方面,浮游植物种类数受到营养盐、气候、水文等环境条件的影响;另一方面,浮游植物种类数还受调查频次、采样点位数量等采样情况的影响。 与汉江中上游相比(173 种[32]、114 种[33]),本次调查得到的浮游藻类种类数量更少,可能是因为下游水质略差,导致浮游植物群落多样性下降。
不同调查区域的浮游植物优势类群及生物量中,硅藻门都占有很大的比例,主要为直链藻和冠盘藻,这与其他学者的调查结果相似[31-32,34]。 况琪军等[35]在1998 年对汉江下游干流的调查显示,该江段的优势种同样主要为硅藻门的直链藻和冠盘藻。 这可能是因为汉江下游干流流速较大,容易形成以硅藻为优势类群的群落。 其他区域也呈现相似的浮游植物群落特征,如珠江支流东江、湖北香溪河和云南澜沧江,其硅藻生物量所占比例均达56%以上[36-38]。 一般而言,硅藻易成为大型河流中的常见类群,其密度和生物量可达藻类总数的60%以上[39-40]。
在汉江支流汉北河和引江济汉运河,蓝藻和绿藻也是优势类群。 这可能是因为支流的流速相对较小,并且受到的污染更严重,更易出现在中富营养水体中占优势的蓝绿藻[41]。 然而,本次调查在两个支流仅各设置了一个采样点。 河流中不同区域的污染物收纳量、人为干扰程度、水动力条件等的差异,可导致浮游植物种类和数量产生较大差异,因此,后期研究中需增加采样范围,以更加准确、全面地评估汉北河和引江济汉运河的浮游植物群落特征。
就藻类总量而言,根据本研究调查结果,浮游植物密度和生物量呈现相似的变化规律,均是汉北河最高,引江济汉运河最低,汉江下游干流介于两者之间。 本次调查显示,汉江下游干流浮游植物年平均密度为9.36×106ind. /L。 根据以往调查可知,1977 年汉江下游干流的浮游植物年平均密度为3.87×105ind. /L,1996 年 为1.50×106ind. /L,2000 年为3.62×107ind. /L[16,42-43]。 对比结果表明,汉江下游干流浮游植物密度整体逐年增加,近年有所下降。 由以上研究可知,从浮游藻类总量来看,近几十年来,汉江下游干流水体受污染物输入量增加等因素的影响,水质表现出逐渐恶化的趋势,但近年来呈一定程度的转好趋势。
3.2 浮游植物群落特征主要影响因子
冗余分析结果表明,汉江下游干流及主要支流的浮游藻类群落特征受多种环境因子的影响,但只有硝态氮、硅酸盐和氨氮的影响达到了显著水平。 硅藻主要受到水温、流速和硅酸盐的影响,与总氮、总磷等营养盐的关系不明显;蓝藻主要受到总磷、磷酸盐和氨氮的影响;绿藻主要受水温和氨氮的影响。 根据斯皮尔曼分析结果可知,浮游植物的密度和生物量主要与温度呈显著正相关,而与总氮、总磷等营养盐呈负相关。 已有研究表明,汉江水华的优势藻种为硅藻,因此,探索汉江下游硅藻群落的主要环境影响因子,对于汉江下游的水质生物学评价具有重要意义[44-45]。
水温能够控制硅藻呼吸作用的强度和光合作用酶促反应的速率,从而影响硅藻的生长和繁殖[46]。 有研究表明,大部分硅藻的最适生长温度为15~25 ℃,当水温大于10 ℃时,硅藻繁殖速度较快[47]。 调查期间,汉江年平均水温为23.0 ℃。在该温度下,硅藻生长较快。 杜红春[15]、马京久等[34]对汉江的研究结果也显示,水温是影响汉江下游浮游植物群落结构和功能群分布的主要环境因子之一。
除温度外,营养盐对汉江下游干流及主要支流的浮游植物群落特征也有很重要的影响。 然而,在河流生态系统中,浮游植物与营养盐之间在很多时候并不像湖泊生态系统一样有明显的相关性[41]。 在本研究中,硅藻与营养盐呈负相关。WEHR 和THORP[48]研究发现,在密西西比河上游,适应富营养化水体的典型浮游植物的生物量很少与水体氮、磷含量相关,甚至在其最大支流俄亥俄河中还出现了浮游植物生物量与水中氮、磷浓度呈负相关的现象。 马京久等[34]在2016—2017 年对汉江的调查结果也显示,营养盐与浮游植物生物量呈负相关。 杜红春[15]在2018—2019年的调查中也发现,汉江中的部分浮游植物功能群与营养盐呈负相关。 然而,潘晓洁等[31]在2014年的调查中发现,汉江下游硅藻数量与磷酸盐、总磷等呈正相关。 FRIEDRICH 等[49]发现,莱茵河下游水体氮、磷含量的增加刺激了浮游植物种类和数量的增长。 这就表明在河流生态系统中,浮游藻类与氮、磷含量的关系相对复杂。 在本次调查中,浮游植物的密度和生物量与总氮、总磷等呈负相关。 这主要是因为在河流生态系统中,流速和温度是决定浮游植物总量的更重要的因子。 一般而言,浮游植物在静水中更容易大量繁殖。 当流速增大后,浮游植物容易进入水体下层,导致其受到的光照减少,不容易上升至较高水平[50-51]。除流速外,水温也是影响汉江浮游植物生长的主要环境因子。 水温可以直接影响浮游植物的光合作用效率,光合作用效率与水温在一定范围内呈正相关,因此,适度的高温有利于浮游植物有机质的积累[46,52]。 以上原因导致河流中的浮游植物往往与营养盐呈现负相关或不相关。
3.3 浮游植物多样性与水质评价
根据本研究浮游植物多样性指数计算结果可知,汉江下游整体处于中污染状态。 该结果与其他学者在2016—2018 年的调查结果相似[32,34]。潘晓洁等[31]在2010 年对汉江中下游浮游植物的调查结果显示,汉江中下游水体处于中污染状态。刘智峰等[53]在2009 年4—6 月的调查中发现,汉江中段水体处于β-中污染状态。 况琪军等[54]研究发现,汉江中下游所含10 种属于优势种类的浮游植物中,有6 种为α-中污染种类或β-中污染种类,汉江中下游水质状况为中污染。 有研究表明,20 世纪80 年代的汉江干流水质良好,水质综合评价等级为Ⅰ类。 然而从1992 年开始,汉江水质逐步恶化,部分年份冬春季有水华发生[21]。 这主要是因为近几十年来,随着周边城镇的快速发展,汉江水体受到了一定程度的污染。 近年来,随着国家及地方各管理部门多种控制和修复措施的实施,汉江水质已有了逐渐转好的迹象。
4 结论
根据本研究2019 年3—12 月调查结果,从浮游植物群落特征来看,汉江下游整体处于中度污染状态。 与历史调查数据相比,近几十年来,汉江下游干流水体受到了一定程度的污染,水质表现出逐渐恶化的趋势。 虽然近年来有所好转,但整体形势仍不容乐观。 汉江水质状况不仅影响着流域内的生态环境质量,而且还对区域内的饮用水安全具有重要影响,因此,有必要持续开展汉江水环境质量调查与评估。 就汉江下游水质现状而言,除加强监测外,控制周边水产养殖污水,农村生活污水、生活垃圾、人畜粪便,以及工业尾水的输入,也是恢复与维持汉江生态系统健康的重要手段之一。
