金负载多孔g-C3N4纳米片制备及可见光催化产氢性能
2022-03-11陈建军刘梓娴彭缓缓宋佳琳李永宇
陈建军,乔 岩,刘梓娴,彭缓缓,宋佳琳,高 燕,李永宇
(郑州师范学院化学化工学院,环境与催化工程研究所,河南郑州 450044)
近年来,g-C3N4由于具有稳定、无毒、廉价易得和特殊的禁带宽度等特性,在光催化降解有机污染物和分解水制氢方面有着广泛的应用[1-2]。但是和大多数催化剂一样,g-C3N4也存在着一定的缺陷,如光吸收范围有限、较低的比表面积和高载流子复合率等,极大地限制了其实际应用。为此,研究者们从形貌调控、元素掺杂、贵金属沉积和半导体复合等方面对其进行调控[3-4],以提高其光催化性能。形貌调控方面,超薄或单层g-C3N4纳米片具有更大的比表面积、更好的载流子分离效率和更丰富的表面活性位点,引起研究者的关注[5-6]。但是,超薄或单层纳米片在制备过程中会出现严重的团聚现象,导致其反应活性位点的丢失。2017年TIAN团队提出了一种克服上述超薄纳米片缺陷的新方法[7],即在块体材料上贯通孔洞,合成具有多孔结构的超薄纳米片,从而形成更多的吸附通道以及表面活性位点[8-9]。然而,单一组分的g-C3N4不能高效地将电子-空穴分离,限制了其光催化效率,因此需要对多孔结构的g-C3N4纳米片进行进一步改性。其中,贵金属[10-11]由于费米能级较低,做为助催化剂可以有效地促进光生载流子的分离,产生更多的反应活性位点。基于此,笔者以三聚氰胺为原料,利用尿素作为额外致孔剂,通过水热结合煅烧工艺制备出多孔g-C3N4纳米片,然后通过化学还原法将Au负载在多孔g-C3N4纳米片表面,同时对反应体系中的Au含量进行调控,并对复合物的光催化产氢性能进行研究,最后对催化反应机理进行了初步探讨。
1 实验部分
1.1 试剂和仪器
试剂:尿素、三聚氰胺、三乙醇胺(TEOA)、氯金酸、硼氢化钠均为分析纯;实验用水均为去离子水。
仪器:UItimaⅣ型X射线衍射仪(XRD);FTIR-650型傅里叶变换红外光谱仪(FT-IR);LabRAM HR800型激光共聚焦拉曼(Raman)光谱仪;JEOL-2100型透射电子显微镜(TEM);Cary-5000型紫外-可见分光光度计(UV-Vis);CHI-600E型电化学工作站;GC-7920型气相色谱仪(GC)。
1.2 光催化剂的制备
1.2.1 多孔g-C3N4纳米片的制备
称取4.3 g尿素和3 g三聚氰胺于烧杯中,加入50 mL去离子水,搅拌30 min使其混合均匀。将悬浊液置于90 mL水热釜中,在180℃保温24 h。自然冷却至室温,抽滤,用去离子水洗涤所得固体,在60℃干燥。将烘干后的样品转入坩埚置于马弗炉中,在空气中于520℃煅烧4 h,得到多孔g-C3N4纳米片,记为PCNS。
1.2.2 Au负载多孔g-C3N4纳米片的制备
称取100 mg多孔g-C3N4纳米片于30 mL去离子水中,在50℃搅拌分散10 min,加入105μL氯金酸(10 mg/mL),所得混合液在50℃搅拌30 min,滴加1 mLNaBH4乙醇溶液(6 mg/mL),继续搅拌30 min,抽滤,所得固体粉末用去离子水洗涤3次,置于烘箱中干燥,得到的产物记为0.5%Au/PCNS。按照相同的制备过程获得Au质量分数分别为0.3%、1.0%、2.0%的复合物。
1.2.3 Au负载g-C3N4的制备
称取3 g三聚氰胺于坩埚中,在520℃煅烧4 h,自然冷却至室温后取出,得到g-C3N4,记为CN。称取100 mg CN,按照上述方法制备0.5%Au/CN。
1.3 光催化产氢性能
采用CEL-SPH2N型光解水系统对光催化剂样品的产氢活性进行测定。在催化反应之前,开启真空泵以抽空系统中的空气。将50 mg光催化剂分散在90 mL去离子水和10 mL三乙醇胺的混合液中,将混合液抽真空25min以除去其中的空气。采用300 W氙灯(420 nm滤光片)作为光源,以高纯度Ar为载气,气相色谱仪每隔1 h自动采样。
2 结果与讨论
2.1 XRD分析
图1为光催化剂样品的XRD谱图。从图1看出,所有样品在2θ为12.9°和27.2°处均有2个衍射峰。其中,12.9°处的衍射峰对应于三嗪结构的(100)面,27.2°处的衍射峰对应的是芳香物共轭双键层间堆积形成的(002)面,表明样品中都存在石墨相C3N4[12]。另外从图1还可以看出,随着Au负载量增加,复合物在2θ为38.3°和44.3°处出现了新的衍射峰,分别对应于Au的(111)(200)面,表明复合物中金是以单质形式存在的。与0.5%Au/CN相比,0.5%Au/PCNS的衍射峰变宽、强度变弱,表明0.5%Au/PCNS具有更薄的层状结构[13]。
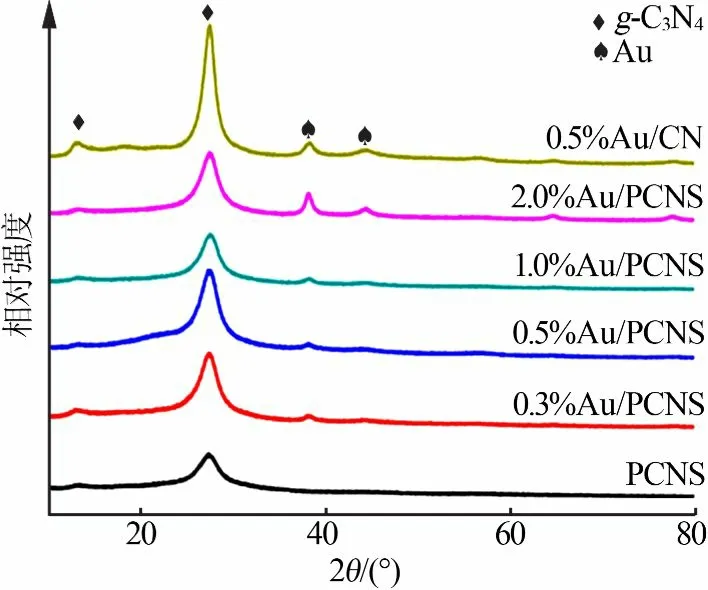
图1 光催化剂样品的XRD谱图Fig.1 XRDpatternsof photocatalyst samples
2.2 FT-IR分析
图2为光催化剂样品的FT-IR图。从图2看出,所有样品在809、1 144~1 648、3 165~3 436 cm-1处都有明显的吸收峰。其中,在3 165~3 436 cm-1处的宽吸收峰是由催化剂表面游离的氨基吸附H2O分子形成了N—H键和O—H键产生的;在1 144~1648cm-1处的吸收峰是由于杂环化合物中的C—N键拉伸振动产生的;在809 cm-1处的吸收峰是三嗪结构单元的伸缩振动产生的。另外从图2还可以看出,PCNS和Au/PCNS具有相似的吸收峰,表明Au的复合没有改变g-C3N4的键接结构。
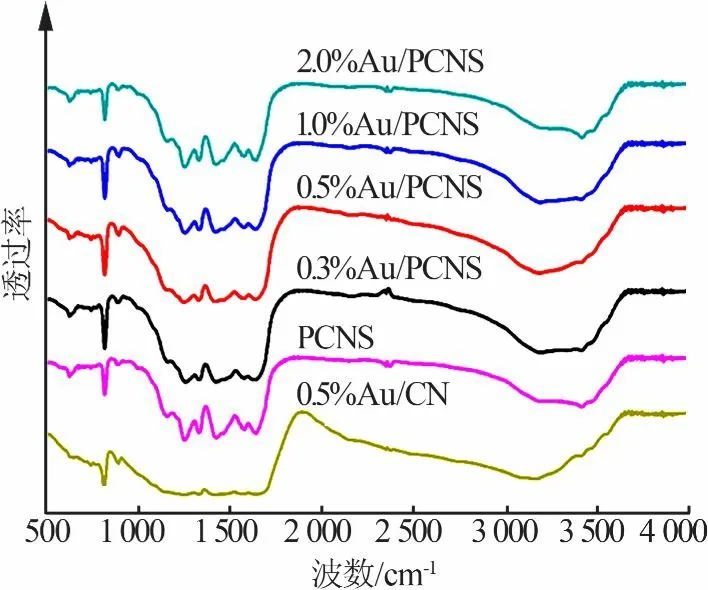
图2 光催化剂样品的FT-IR图Fig.2 FT-IRspectraof photocatalyst samples
2.3 Raman光谱分析
图3为光催化剂样品的Raman光谱图,插图为0.5%Au/CN的Raman光谱放大图。从图3看出,所有样品都出现了类石墨相氮化碳的特征峰。其特征峰分为两个区间,在400~700 cm-1的拉曼特征峰对应于三嗪环的剪式振动,1 250~1 750 cm-1的拉曼特征峰是由CN杂环化合物的典型拉伸振动引起的[14]。与PCNS相比,Au/PCNS三嗪环结构的伸缩振动和CN杂环的拉伸振动随着金含量的增加而增强,这是贵金属的表面增强拉曼效应引起的。
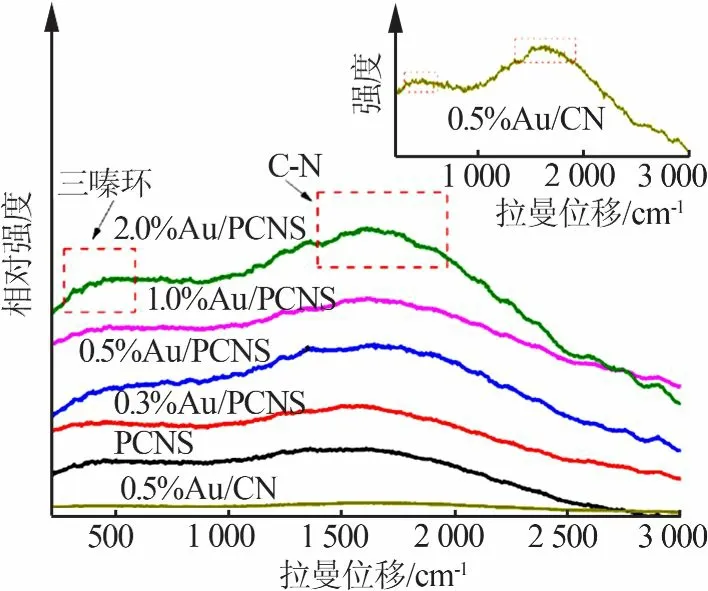
图3 光催化剂样品的Raman光谱图Fig.3 Raman spectra of photocatalyst samples
2.4 TEM分析
图4为0.5%Au/PCNS和0.5%Au/CN的TEM照片。从图4a、c看出,0.5%Au/PCNS具有多孔片状结构,0.5%Au/CN呈现层状结构。对两个复合物进一步放大(见图4b、d),可观察到纳米颗粒的存在,颗粒的晶格条纹间距为0.235 nm,对应于Au的(111)面,证明Au分别成功地负载到PCNS和CN表面。
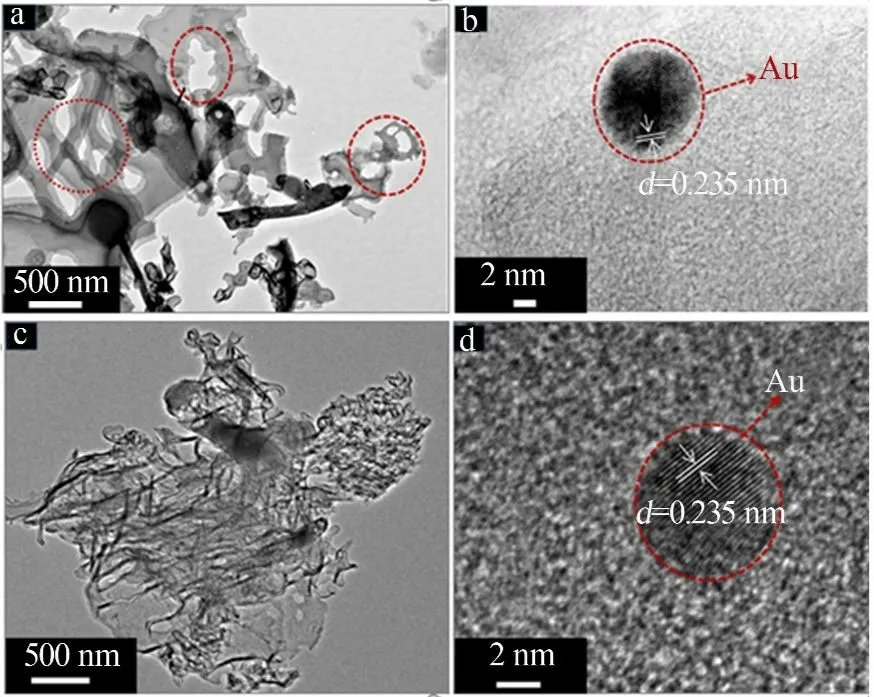
图4 0.5%Au/PCNS(a、b)和0.5%Au/CN(c、d)的TEM照片Fig.4 TEMimages of 0.5%Au/PCNS(a,b)and 0.5%Au/CN(c,d)
2.5 UV-Vis DRS分析
图5a为光催化剂样品的UV-Vis DRS图。从图5a看出,所有样品在可见光区都有吸收。与PCNS相比,Au/PCNS在480~800 nm的光吸收强度都得到了增强,并且随着Au负载量增加在530 nm处出现了吸收峰,这是Au粒子表面等离子体共振(SPR)效应引起的。图5b为样品的带隙图。由图5b可知,PCNS在负载Au粒子之后,其禁带宽度明显变窄,对可见光的吸收范围变宽,可以产生更多的载流子,进而可有助于光催化性能的提升。
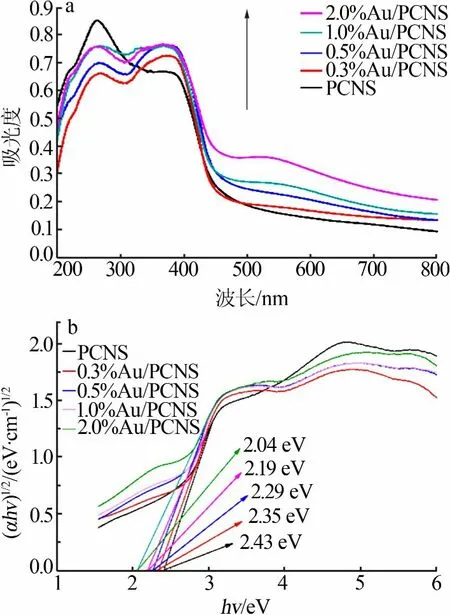
图5 光催化剂样品的UV-Vis DRS图(a)及带隙图(b)Fig.5 UV-Vis diffuse reflection spectra(a)and band-gap diagram(b)of the photocatalyst samples
2.6 光电化学分析
光电流测试可以用来评估光生电子-空穴对的复合率,光电流越大表明催化剂的电子和空穴越易分离。图6为PCNS和0.5%Au/PCNS的光电响应图。从图6看出,与PCNS相比,0.5%Au/PCNS的光电流强度明显变大,表明金的负载有助于增强光生电荷的分离效率。
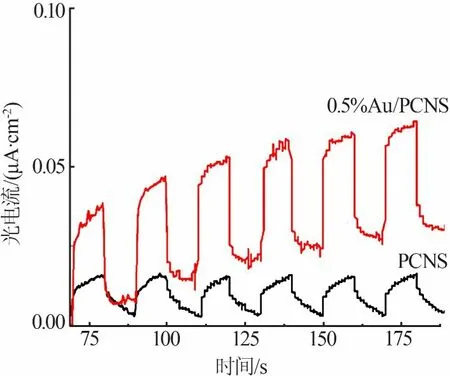
图6 PCNS和0.5%Au/PCNS的光电响应图Fig.6 Transient photocurrent responses spectra of PCNSand 0.5%Au/PCNS
为更好地评估电子-空穴的分离效果,对光催化剂样品进行了电化学阻抗测试。阻抗谱图的弧半径越大,光生电荷在转移过程中遇到阻力越大,电子-空穴的复合率越高。图7为PCNS和0.5%Au/PCNS的阻抗谱图。从图7看出,与PCNS相比,0.5%Au/PCNS的弧半径有明显缩小,表明负载Au粒子有助于提高电荷的分离度,降低电子-空穴的复合率。
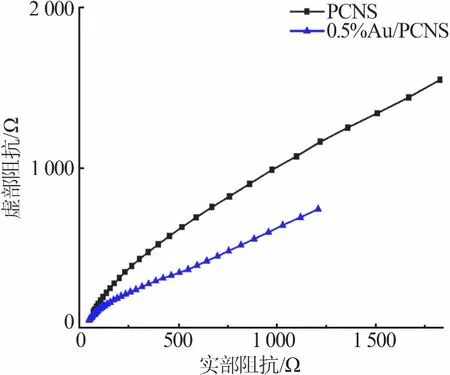
图7 PCNS和0.5%Au/PCNS的阻抗谱图Fig.7 EISspectra of PCNSand 0.5%Au/PCNS
2.7 光催化产氢性能
图8a为光催化剂样品的光催化产氢性能。从图8a看出,与PCNS[0μmol/(g·h)]相比,复合物在可见光下的光催化产氢性能均有明显的提高。其中,0.5%Au/PCNS的光催化产氢速率最高,达到了84.09μmol/(g·h)。这是因为,复合物不仅具有更好的光吸收性能,而且更利于光生载流子的分离。但是,当Au负载量过大时,样品的产氢速率反而减小。这是因为,过多的Au粒子为光生载流子提供了新的复合场所。另外从图8a还可以看出,0.5%Au/PCNS的产氢速率是0.5%Au/CN[1.88μmol/(g·h)]的44.7倍。这是因为PCNS本身具有多孔片状结构,能够提供较多的反应活性位点,进而有利于光催化产氢速率的提高。此外,对0.5%Au/PCNS的产氢稳定性进行了测试,结果见图8b。从图8b看出,0.5%Au/PCNS具有稳定的光解水产氢活性,在可见光照射12h后,其产氢活性并没有出现明显的下降。
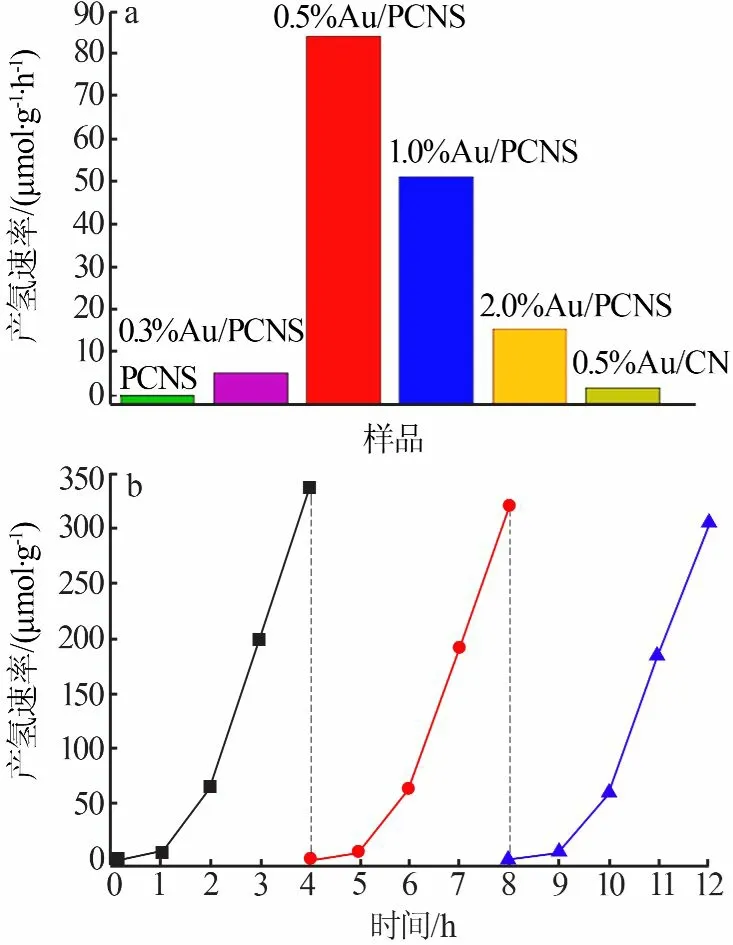
图8 光催化剂样品的光解水制氢性能(a)和0.5%Au/PCNS的产氢稳定性(b)Fig.8 Hydrogen evolution rate of the photocatalyst samples(a)and stability test of H2 evolution over 0.5%Au/PCNS(b)
2.8 光催化机理探讨
为研究PCNS的光催化产氢性能增强的机理,对其进行了莫特-肖特基测试,结果见图9。由图9得出PCNS的导带电位为-0.42 V(vs.SCE,pH=7),根据图5b得到PCNS的禁带宽度为2.43 eV,可以计算出PCNS的导带为2.01 V。依据上述结果对Au/PCNS的产氢活性提出一种可能的反应机理(见图10):在可见光照射下,PCNS因光诱导产生光生电子和空穴,空穴被三乙醇胺捕获;光生电子从PCNS的导带转移到Au粒子表面,然后与水中的氢离子发生还原反应,产生氢气。
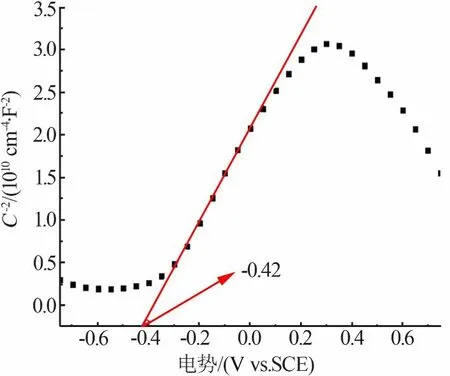
图9 PCNS的莫特-肖特基曲线Fig.9 Mott-schottky plotsof PCNS
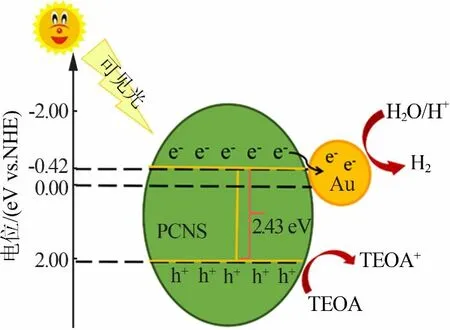
图10 Au/PCNS的光催化机理图Fig.10 Photocatalytic mechanismdiagramof Au/PCNS
3 结论
以三聚氰胺为原料、尿素作为致孔剂,通过水热结合煅烧方法制备了多孔g-C3N4纳米片,然后通过化学还原方法将多孔g-C3N4纳米片与Au进行复合。可见光分解水产氢性能结果表明,与多孔g-C3N4纳米片相比,复合物的光催化产氢速率都得到明显提高,其中0.5%Au/PCNS展现出最好的产氢活性,其产氢速率[84.09μmol/(g·h)]是0.5%Au/g-C3N4的44.7倍。这是因为,复合物不仅具有更强的光吸收性能,还能够高效地抑制光生电子和空穴的复合,为光催化反应提供更多的活性基团。
